山东省威海市2020-2022三年中考化学真题知识点分类汇编-01物质的化学变化 (含解析)
文档属性
| 名称 | 山东省威海市2020-2022三年中考化学真题知识点分类汇编-01物质的化学变化 (含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 237.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-04 08:31:14 | ||
图片预览




文档简介
山东省威海市2020-2022三年中考化学真题知识点分类汇编-01物质的化学变化
一、单选题
1.(2020·山东威海·统考中考真题)下列过程主要发生化学变化的是
A.用水银温度计测量体温
B.用消毒液对环境进行消毒
C.佩戴口罩预防疾病传染
D.教室和宿舍经常通风
2.(2020·山东威海·统考中考真题)下列对物质变化的认识不正确的是
A.在物理变化中分子的能量、间隔、相互作用均不变
B.水的天然循环只发生物理变化
C.物质能否发生化学变化是由构成物质的微粒决定的
D.研究化学变化的意义在于实现物质和能量的转化
3.(2021·山东威海·统考中考真题)下列物质的用途中,利用其物理性质的是
A.用生石灰做干燥剂 B.用75%的酒精溶液对皮肤消毒
C.用活性炭除去自来水中的异味和色素 D.用白醋除去水壶中的水垢
4.(2021·山东威海·统考中考真题)下列关于物质及变化的认识,正确的是
A.电子、光子、量子属于化学物质
B.化学变化有可能创造出世界上原来不存在的物质
C.任何变化都遵循质量守恒定律
D.只有通过化学变化才能获得物质和能量
5.(2021·山东威海·统考中考真题)下列关于物质组成和构成的认识,不正确的是
A.看似庞杂无序的化学物质均统一于种类有限的元素之中
B.“元素论”和“原子-分子论”是物质科学的基石,是科学和哲学的重要思想工具
C.核外电子特别是外层电子,是决定原子间作用方式的重要原因
D.跟卢瑟福原子模型比较,道尔顿原子模型不科学,对科学发展的贡献不大
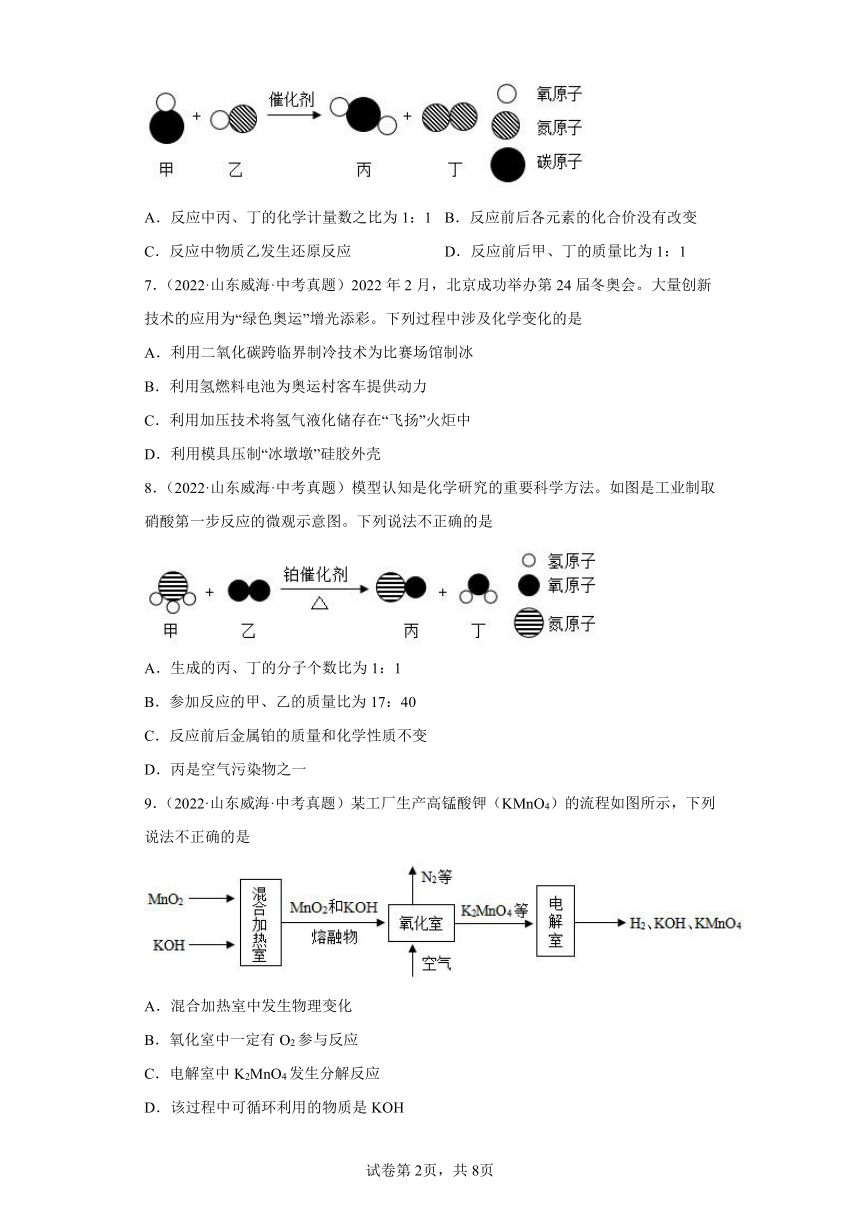
6.(2021·山东威海·统考中考真题)下图为某反应的微观示意图,有关说法正确的是
A.反应中丙、丁的化学计量数之比为1:1 B.反应前后各元素的化合价没有改变
C.反应中物质乙发生还原反应 D.反应前后甲、丁的质量比为1:1
7.(2022·山东威海·中考真题)2022年2月,北京成功举办第24届冬奥会。大量创新技术的应用为“绿色奥运”增光添彩。下列过程中涉及化学变化的是
A.利用二氧化碳跨临界制冷技术为比赛场馆制冰
B.利用氢燃料电池为奥运村客车提供动力
C.利用加压技术将氢气液化储存在“飞扬”火炬中
D.利用模具压制“冰墩墩”硅胶外壳
8.(2022·山东威海·中考真题)模型认知是化学研究的重要科学方法。如图是工业制取硝酸第一步反应的微观示意图。下列说法不正确的是
A.生成的丙、丁的分子个数比为1:1
B.参加反应的甲、乙的质量比为17:40
C.反应前后金属铂的质量和化学性质不变
D.丙是空气污染物之一
9.(2022·山东威海·中考真题)某工厂生产高锰酸钾(KMnO4)的流程如图所示,下列说法不正确的是
A.混合加热室中发生物理变化
B.氧化室中一定有O2参与反应
C.电解室中K2MnO4发生分解反应
D.该过程中可循环利用的物质是KOH
二、填空题
10.(2020·山东威海·统考中考真题)化学与航天
2019年12月27日长征五号系列运载火箭(以下简称“胖五”)发射成功。请回答下列问题:
(1)“胖五”两种发动机分别采用液氢、液氧做推进剂和煤油、液氧做推进剂,而旧的长征火箭采用的推进剂是有毒的偏二甲肼(N2H4)和液态四氧化二氮(N2O4),其燃烧时还会因泄露和不充分燃烧产生大量氮的氧化物。
①“胖五”的两种推进剂中属于可燃物的是_____________________。
②科学家发现,煤在一定条件下加氢制得煤油,称之为煤的液化,属于__________变化。
③写出煤油(以C12H16为例)完全燃烧的化学方程式_______________________。
④从环境保护的角度分析,“胖五”的两种发动机采用的推进剂优点是_________________。
(2)铝合金在火箭制造中被广泛应用。
①铝合金中的铝化学性质活泼,原因是_______________________________。
②铝在岩石圈中以化合物形式存在,工业采用电解氧化铝的方法冶炼铝,写出反应的化学方程式_______________________。
11.(2020·山东威海·统考中考真题)认识消毒剂过氧乙酸,过氧乙酸(C2H4O3)是一种高效绿色的消毒剂。请回答下列问题:
(1)下列有关过氧乙酸的说法,正确的是___________(填选项序号)。
A 是一种氧化物 B 由三种元素组成 C 分子中含有臭氧(O3)分子 D 氧元素的质量分数最大
(2)凡是含有“”结构的物质都具有杀菌消毒作用。研究发现,过氧乙酸分子结构中也含有“”结构,所以过氧乙酸也具有杀菌消毒作用。获得这一结论所运用的科学方法属于___________推理(填选项序号)。
A 归纳 B 演绎 C 类比
(3)过氧乙酸具有如下性质:
A 无色易挥发液体 B 有酸性 C 有很强的腐蚀性 D 易溶于水和乙醇 E 不稳定,易分解放出氧气 F 有毒性
其中属于化学性质的有__________________(填选项序号)。
(4)醋酸(C2H4O2)与过氧化氢在室温下混合均匀,即可反应生成过氧乙酸和水,写出该反应的化学方程式__________________________。
(5)配制1L溶质质量分数为0.5%的过氧乙酸溶液。现有以下物品:
水、溶质质量分数20%的过氧乙酸溶液、量筒(规格分别为1000mL、50mL)、塑料桶、铁桶、木棍、口罩、护目镜、橡皮手套。
①需要20%的过氧乙酸溶液____________mL(计算时,将水、20%和0.5%过氧乙酸溶液的密度都近似为1g/cm3)。
②戴好防护用品,用_____________mL量筒量取所需20%的过氧乙酸溶液倒入塑料桶中,按比例兑水,用木棍搅拌后,盖好桶盖备用。
③请你根据(3)中过氧乙酸的性质分析,进行配制时,不用铁桶的理由是_______。
12.(2021·山东威海·统考中考真题)焰火中的化学
五光十色的焰火让人叹为观止。焰火中的白光主要是由金属镁燃烧产生。下图是有关微粒的结构示意图,请回答下列问题:
(1)燃烧前
图中属于原子的有(填序号)______,属于阴离子的有(填序号)______。氧原子(填“能”或“不能”)______直接构成物质。保持金属镁化学性质的微粒是(填符号)______。
(2)燃烧中
在空气中点燃镁条,镁主要跟氧气反应,还能跟氮气反应生成少量氮化镁(氮元素显-3价)。
①镁跟氮气反应的微观实质是______。镁跟氮气反应的化学方程式为______,所属基本反应类型为______。
②焰火中燃烧金属镁是为了把______能转化为______能。
(3)燃烧后
氧化镁能跟盐酸反应生成氯化镁,要把氯化镁中的镁元素重新分配到其它物质中,从化学变化中镁元素化合价是否改变的角度,反应可分为两类,请举例说明(用化学方程式表示)______和______。但无论化学反应多么复杂,从宏观看______不会消失,从微观看______不会消失。
13.(2021·山东威海·统考中考真题)碳中和,中国在行动
人类在向大自然获取物质和能源的过程中,对物质的循环产生影响。有研究表明,大气中的碳元素只占地球碳总量的0.0000319%。通常,这部分碳是通过自然界中的碳循环(包括大气、海洋、地表生物、火山爆发等)实现平衡。由于人类过度开采使用地下碳(主要是化石燃料),导致工业革命以来碳排放量急剧增加,正是这部分碳打破了大气中二氧化碳的平衡。
为减缓温室效应,我国政府向世界庄严承诺,中国将在2060年前实现碳中和,请回答以下问题:
(1)“碳循环”与“碳中和”中的“碳”,含义是否相同?______。为什么?______。
(2)有人认为碳循环过程中碳元素的化合价始终保持不变,你认为是否正确?______,你的证据是(用化学方程式表示)______。
(3)碳循环中的关键物质一一二氧化碳
①天然气的主要成分是甲烷,若每个家庭每天平均消耗甲烷0.32kg,按三亿个家庭计算,每天向大气中排放______kg二氧化碳(假设甲烷完全燃烧)。
②沼气的主要成分也是甲烷,是利用植物秸秆等废物发酵而成。为解决能源需求跟气候变暖之间的矛盾,有学者建议:用沼气替代天然气,这样就不会额外增加二氧化碳的排放量。请你解释其中的道理______。
③某研究机构发明了转化大气中二氧化碳的技术。方法一:在一定条件下,二氧化碳和氢气反应生成甲醇(CH3OH)和水,用甲醇生产人造纤维:方法二:将二氧化碳转化为甲醇后用作燃料。这两种转化方法对大气中二氧化碳含量的影响是(填“增加”“减少”“不影响”):方法一______;方法二______。
14.(2022·山东威海·中考真题)物尽其用——金属之“铝”
社会发展离不开金属,生产生活中铁、铝及其合金制品随处可见。
(1)铝制易拉罐(如图1)
某品牌碳酸饮料的易拉罐是由铝合金制成的,内壁附着一层有机薄膜。该铝合金中铝的含量约为97%,还含有镁、锰、铁、铟(In)等。
①将易拉罐剪成条状,打磨后与纯铝片相互刻画,发现纯铝片表面有划痕,说明 _____。
②请你推测组成有机薄膜的物质具有的性质:_____、_____(写两条即可)。
③“是否应该停止使用铝制易拉罐”是当前的一个社会性科学议题。有同学认为应该停止使用铝制易拉罐,理由可能 _____(写一条即可);也有同学支持继续使用铝制易拉罐,请你结合铝的性质阐述理由 _____、_____(写两条即可)。
④生活垃圾要分类投放,可与废弃易拉罐作为同一类投放的是 _____(填字母序号)。
A.废旧电池
B.废弃口罩
C.厨余垃圾
D.废旧铁锅
(2)储氢材料
储氢材料的研发是氢能源技术的关键之一。金属铝可用作储氢材料,储氢后生成氢化铝(AlH3),其中氢元素的化合价为 _____;释氢原理为氢化铝与水反应释放氢气,同时生成氢氧化铝,其反应的化学方程式为 _____。
(3)制备铝
工业上常用电解氧化铝的方法制备金属铝,反应的化学方程式为 _____。
(4)铝合金中的铟(In)
如图2为铝、铟的原子结构示意图。某同学推测金属铟与铝的化学性质相似,理由是 _____。实验证明,铟可以与稀盐酸反应,其反应的化学方程式为 _____。
三、计算题
15.(2021·山东威海·统考中考真题)为测定某盐酸的溶质质量分数,取200g样品于烧杯中,将50g碳酸钠溶液分为5等份,分5次加入盛有样品的烧杯中、测出每次反应后溶液的总质量,实验数据如下表:
第一次 第二次 第三次 第四次 第五次
加入Na2CO3溶液的质量 10g 10g 10g 10g 10g
反应后溶液的质量 208.9g 217.8g 226.7g 235.6g 245.6g
请根据实验数据计算盐酸的溶质质量分数。
四、科普阅读题
16.(2021·山东威海·统考中考真题)探秘火星上的化学物质
2021年5月15日,我国自主研制的天问一号搭载祝融号火星车,成功登陆火星。
研究表明,火星上有大气,但总量很小,密度只有地球空气的1%左右,主要成分是二氧化碳,年平均气温-55℃,冬季最低至-133℃,夏季最高至27℃。火星地表没有发现水,但地表下发现有水冰的痕迹,并有大量干冰。土壤及岩石中含有的无机盐跟地球相似,表层土壤主要为氧化铁。到目前为止,火星上还没有发现生命迹象。
(1)下表是火星大气及土壤的部分成分。请你完善下表信息:
成分 二氧化碳 氮气 氩气 氧气 水蒸气 碳酸钙
构成微粒(写符号) ______ ______ ______ ______ ______ ______
体积分数 95.3% 2.7% 1.6% 0.15% 0.03% /
(2)已知干冰在-78.5℃升华。一年四季火星大气中二氧化碳的含量波动较大,原因是______。
(3)移居火星是人类的梦想,根据题中信息回答:跟地球相比,火星上没有或含量不足以支持人类生命活动的基本物质有哪些?______。
(4)要在太空中制取氧气、水和铁,有关物质的信息如下:
资料1、用铁酸镍(NiFe2O4)做催化剂,用舱外太阳能电池发电,通电分解二氧化碳可生成氧气和碳。
资料2、氮气的沸点-196℃:氢气的沸点-253℃。肼(分子式为N2H4,读音:jing)的沸点114℃:肼是一种无色、易挥发、有刺激性气味的油状液体,有腐蚀性,能腐蚀玻璃和橡胶,有剧毒。肼是航空器上常用的燃料。
请根据提供的信息,探究制取氧气、水和铁的方法。
①在密闭的太空舱中,用资料1中的方法制备氧气的优点是______,该反应的化学方程式为______。
②肼在氧气中燃烧是否有可能获得水?请说明理由。______,______。
③已知肼在金属铂(Pt)的催化作用下,常温即可分解产生氢气和氮气,反应的化学方程式为______。写出从氢气、氮气混合气体中分离出氢气的依据______。分离出的氢气在氧气中燃烧可制得水。
④根据资料2中肼的性质,在使用肼制取氢气时,为保障安全,需要注意的问题有______。
⑤以资料1中二氧化碳分解产生的碳、火星大气中的二氧化碳和火星土壤中的氧化铁为原料制备金属铁,反应的化学方程式为______。
17.(2022·山东威海·中考真题)神奇的转化——二氧化碳合成淀粉
2021年9月,中国科学院天津工业生物技术研究所在《科学》杂志发表论文,表示其研究团队在人工合成淀粉方面取得重大突破性进展,首次在实验室实现了二氧化碳到淀粉的人工合成。
淀粉是人体生命活动所需的重要物质。在此之前,人类通过种植玉米、小麦等农作物获取淀粉,即农作物借助光合作用先将二氧化碳转化为葡萄糖,再经过复杂的变化转化为淀粉[(C6H10O5)n]。
我国科学家人工合成淀粉的过程为:在催化剂的作用下,将二氧化碳和氢气转化为甲醇(CH3OH)和水,再经过较复杂的变化将甲醇转化为淀粉。经检测,人工合成淀粉与光合作用生成的淀粉一模一样。
(1)植物合成淀粉
光合作用中生成葡萄糖的化学方程式 _____,从能量转化角度看,绿色植物固定了太阳能,将其转化为 _____。
(2)人工合成淀粉
①从宏观角度看,人工合成淀粉的组成元素是 _____(填名称),其质量比为 _____。
②检验合成的物质是淀粉的实验方案是 _____。
③该过程中生成甲醇的化学方程式 _____。
④你认为该成果实现工业化生产后的现实意义是 _____、_____(写两条即可)。
⑤淀粉的合成实现了无机物到有机物的转化。有人认为化学变化无所不能,还能将一种元素变成另一种元素。你是否赞成这一观点?请结合你对化学变化实质和元素概念的理解,谈谈你的看法 _____。
参考答案:
1.B
【分析】物理变化和化学变化的唯一标志是有无新物质生成,有新物质生成的为化学变化,没有新物质生成的为物理变化。
【详解】A、用水银温度计测量体温,只是水银受热膨胀,没有新物质生成,属于物理变化,故A错误;
B、消毒液消毒的原理是使细菌或病毒的蛋白质变性,有新物质生成,属于化学变化,故B正确;
C、佩戴口罩预防疾病传染没有新物质生成,属于物理变化,故C错误;
D、教室和宿舍经常通风没有新物质生成,属于物理变化,故C错误;
故选B。
2.A
【详解】A、物理变化的实质是无新物质生成,但是分子的能量、间隔、相互作用可能发生改变,如水由气态变为液态,属于物理变化,但是分子间隔变小,符合题意;
B、水的天然循环,只是水的状态发生了改变,无新物质生成,属于物理变化,不符合题意;
C、化学变化的实质是由新物质生成,故发生化学变化,物质的微粒一定发生了改变,物质能否发生化学变化,要看构成物质的微粒是否改变,不符合题意;
D、研究化学变化的意义在于实现物质和能量的转化,用于我们的生活,改变我们的生活,说法正确,不符合题意。
故选A。
3.C
【详解】A、用生石灰做干燥剂,是因为氧化钙能与水反应生成氢氧化钙,利用的是其化学性质,不符合题意;
B、用75%的酒精溶液对皮肤消毒,能使蛋白质变性,需要通过化学变化表现出来,利用的是其化学性质,不符合题意;
C、用活性炭除去自来水中的异味和色素,是因为活性炭具有吸附性,利用的是其物理性质,符合题意;
D、用白醋除去水壶中的水垢,是因为醋酸能与氢氧化镁和碳酸钙反应,利用的是其化学性质,不符合题意。
故选C。
4.B
【详解】A、光子不属于化学物质,不符合题意;
B、化学变化能生成新物质,有可能创造出世界上原来不存在的物质,符合题意;
C、化学变化遵循质量守恒定律,物理变化不遵循质量守恒定律,不符合题意;
D、物理变化也能获得能量,如氢氧化钠溶于水,放出热量,不符合题意。
故选B。
5.D
【详解】A、物质是由元素组成的,有限的元素可组成种类繁多的物质,不符合题意;
B、“元素论”和“原子-分子论”是物质科学的基石,是科学和哲学的重要思想工具,说法正确,不符合题意;
C、最外层电子数决定元素的化学性质,核外电子特别是外层电子,是决定原子间作用方式的重要原因,不符合题意;
D、跟卢瑟福原子模型比较,道尔顿原子模型不科学,但是推动了科学的发展,为以后的研究奠定了基础,符合题意。
故选D。
6.C
【分析】由图可知,该反应为一氧化碳和一氧化氮在催化剂的作用下反应生成二氧化碳和氮气,该反应的化学方程式为:。
【详解】A、由化学方程式可知,反应中丙、丁的化学计量数之比为2:1,不符合题意;
B、由图可知,反应前后,氮元素由化合态转化为游离态,化合价一定发生了改变,不符合题意;
C、在该反应中,物质乙失去氧,属于氧化剂,发生还原反应,符合题意;
D、反应前后甲、丁的质量比为:2×(12+16):(14×2)=2:1,不符合题意。
故选C。
7.B
【详解】A、采用二氧化碳跨临界直冷技术制冰过程没有产生新物质,属于物理变化,故错误;
B、氢气燃烧生成水,产生新物质,属于化学变化,故正确;
C、利用加压技术将氢气液化储存在“飞扬”火炬中,只是氢气的状态发生改变,没有产生新物质,属于物理变化,故错误;
D、利用模具压制“冰墩墩”硅胶外壳,没有产生新物质,属于物理变化,故错误。
故选B。
8.A
【分析】依据图示的分子结构可知该反应的化学方程式为:4NH3+5O24NO+6H2O。
【详解】A、由4NH3+5O24NO+6H2O可知,生成的丙、丁的分子个数比为4:6=2:3,故说法错误;
B、由4NH3+5O24NO+6H2O可知,参加反应的甲、乙的质量比为(17×4):(5×32)=17:40,故说法正确;
C、铂是该反应的催化剂,反应前后金属铂的质量和化学性质不变,故说法正确;
D、丙是一氧化氮,是空气污染物之一,故说法正确。
故选A。
9.C
【详解】A、由流程图可知:混合加热室中二氧化锰和氢氧化钾由固体变为熔融物,状态改变,无新物质生成,属于物理变化,说法正确;
B、由流程图可知:氧化室中发生反应后,空气成分减少了氧气,所以氧化室中一定有O2参与反应,说法正确;
C、由流程图可知:电解室发生反应后,生成高锰酸钾、氢氧化钾和氢气,反应后含有钾、氢、锰、氧元素,依据化学反应前后,元素种类不变,反应物中也应该含有钾、氢、锰、氧元素,锰酸钾中只含有钾、锰、氧元素,可确定反应物还有其他物质含有氢元素,所以该反应的反应物不是一种物质,不属于分解反应,电解室中K2MnO4发生的不是分解反应,说法不正确;
D、由流程图可知:该过程中原料中有氢氧化钾,电解室中又生成氢氧化钾,可循环利用的物质是氢氧化钾,说法正确。
故选C。
10. 液氢、煤油 化学 原料无毒,产物无污染 铝原子核外有13个电子,最外层电子数为3,易失电子
【详解】(1)①“胖五”的两种推进剂中液氧是助燃剂,属于可燃物的是液氢、煤油;
②科学家发现,煤在一定条件下加氢制得煤油,称之为煤的液化,变化中产生了新物质煤油,属于化学变化;
③煤油(以C12H16为例)完全燃烧,反应物是煤油和氧气,生成物是二氧化碳和水,化学方程式是:;
④因为旧的长征火箭采用的燃料偏二甲肼(N2H4)有毒,燃烧时还会因泄露和不充分燃烧产生大量氮的氧化物,氮的氧化物溶于雨水会形成酸雨,而“胖五”采用的燃料液氢、煤油本身无毒,生成物是水和二氧化碳,对环境无污染,所以从环境保护的角度分析,“胖五”的两种发动机采用的推进剂优点是:原料无毒,产物无污染;
(2)①元素的化学性质主要决定于原子的最外层电子数。铝化学性质活泼,原因是铝原子核外有13个电子,最外层电子数为3,易失电子;
②电解氧化铝生成铝和氧气,反应的化学方程式为:。
11. BD B BCEF 25 50 过氧乙酸显酸性,能与铁反应
【详解】(1)A、 过氧乙酸含三种元素,不是氧化物,故A错误;
B、过氧乙酸由碳、氢、氧三种元素组成,故B正确。
C、过氧乙酸分子中不含有臭氧(O3)分子,C错误;
D、过氧乙酸中,碳氢氧元素的质量比为(12×2):(1×4):(16×3)=6:1:12,氧元素质量分数最大,故D正确。
故选:BD。
(2)凡是含有“”结构的物质都具有杀菌消毒作用。研究发现,过氧乙酸分子结构中也含有“”结构,所以过氧乙酸也具有杀菌消毒作用。获得这一结论所运用的科学方法属于演绎,故填:B。
(3)A 无色易挥发液体,物理性质;
B 有酸性,属于化学性质;
C 有很强的腐蚀性,化学性质;
D 易溶于水和乙醇,物理性质;
E 不稳定,易分解放出氧气,化学性质;
F 有毒性,化学性质。
故选:BCEF。
(4)C2H4O2与过氧化氢在室温下混合均匀,即可反应生成过氧乙酸和水,化学方程式为,故填:。
(5)①设需要过氧乙酸体积为x,则1000mL×1g/mL×0.5%=x×1g/mL×20%,x=25mL,故填:25。
②为准确量取过氧乙酸溶液,戴好防护用品,量取25mL液体,用50mL量筒量取,故填:50。
③请你根据(3)中过氧乙酸的性质分析,进行配制时,不用铁桶的理由是过氧乙酸显酸性,能与铁反应,故填:过氧乙酸显酸性,能与铁反应。
12. BCE DF 不能 Mg 镁原子失去电子变成镁离子,氮原子得到电子变成氮离子,镁离子与氮离子结合生成氮化镁 化合反应 化学 光 元素 原子
【详解】(1)A、质子数大于核外电子数,表示阳离子;B、质子数=核外电子数,表示原子;C、质子数=核外电子数,表示原子;D、质子数小于核外电子数,表示阴离子;E、质子数=核外电子数,表示原子;F、质子数小于核外电子数,表示阴离子,故表示原子的有BCE;
属于阴离子的有:DF;
氧原子不能直接构成物质;
镁由镁原子构成,保持镁化学性质的微粒为镁原子,故填:Mg;
(2)①镁跟氮气反应的微观实质是:镁原子失去电子变成镁离子,氮原子得到电子变成氮离子,镁离子与氮离子结合生成氮化镁;
镁在氮气中燃烧生成氮化镁,氮化镁中镁元素显+2价,氮元素显-3价,故氮化镁的化学式为:Mg3N2,该反应的化学方程式为:;
该反应符合“多变一”的特点,属于化合反应;
②焰火中燃烧金属镁是为了把化学能转化为光能;
(3)从化学变化中镁元素化合价是否改变的角度,反应可分为两类,其中一种镁元素化合价发生改变,如氯化镁在通电的条件下反应生成镁和氯气,该反应的化学方程式为:;
其中一种镁元素的化合价不变,如氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠,该反应的化学方程式为:;
但无论化学反应多么复杂,根据质量守恒定律,化学反应前后,元素的种类和原子的个数不变,故从宏观看元素不会消失,从微观看原子不会消失。
13. 否(或不相同) 前者指碳元素,后者指二氧化碳 否(或不正确) 解:设每个家庭消耗甲烷生成二氧化碳的质量为x
x=0.88kg
故按三亿个家庭计算,每天向大气中排放:0.88kg×300000000=2.64×108kg二氧化碳
沼气燃烧产生二氧化碳,植物光合作用吸收二氧化碳,形成碳循环,不会额外增加碳排放量 减少 不影响
【详解】(1)“碳循环”与“碳中和”中的“碳”,含义不相同,前者指碳元素,后者指二氧化碳;
(2)不正确,如碳燃烧生成二氧化碳,碳由游离态转化为化合态。化合价发生了改变,该反应的化学方程式为:;
(3)①见答案;
②沼气是利用植物秸秆等废物发酵而成,沼气的主要成分是甲烷,甲烷燃烧生成二氧化碳。植物又可通过光合作用吸收二氧化碳,形成碳循环,不会额外增加碳排放量;
③方法一:在一定条件下,二氧化碳和氢气反应生成甲醇和水,用甲醇生产人造纤维,反应消耗了二氧化碳,且没有二氧化碳生成,能减小二氧化碳含量;
方法二:将二氧化碳转化为甲醇后用作燃料。甲醇燃烧又生成二氧化碳和水,根据质量守恒定律,化学反应前后,元素的种类和质量不变,甲醇中碳元素完全来自于二氧化碳,故生成二氧化碳的质量与消耗二氧化碳的质量相等,故填:不影响。
14.(1) 合金的硬度比纯金属的大 无毒(合理即可) 耐腐蚀(合理即可) 铝制易拉罐提炼会产生污染(合理即可) 不易破(合理即可) 携带方便(合理即可) D
(2) -1 AlH3+3H2O=3H2↑+Al(OH)3
(3)
(4) 原子的最外层电子数相同
【详解】(1)①易拉罐是由铝合金制成的,将易拉罐剪成条状,打磨后与纯铝片相互刻画,发现纯铝片表面有划痕,说明合金的硬度比组成它的纯金属硬度更大;
②某品牌碳酸饮料的易拉罐是由铝合金制成的,内壁附着一层有机薄膜,由此可推测组成有机薄膜的物质无毒、耐腐蚀、不能与酸反应等;
③有同学认为应该停止使用铝制易拉罐,理由可能铝制易拉罐提炼会产生污染;铝是一种低毒金属元素,它并非人体需要的微量元素,不会导致急性中毒,但食品中含有的铝超过国家标准就会对人体造成危害。也有同学支持继续使用铝制易拉罐,可能是因为其具有重量轻,体积小,不易破碎,便于携带等优点;
④废弃易拉罐含有金属,属于可回收垃圾,故可与废旧铁锅作为同一类投放。
故选D;
(2)氢化铝中铝元素显+3价,根据化合物中正负化合价的代数和为0可知,氢元素的化合价为-1;
氢化铝与水反应释放氢气,同时生成氢氧化铝,反应的化学方程式为:AlH3+3H2O=3H2↑+Al(OH)3。
(3)氧化铝在通电的条件下反应生成铝和氧气,反应的化学方程式为:。
(4)最外层电子数决定元素的化学性质,由图2可知铝、铟的原子最外层电子数都是3,所以可推测金属铟与铝的化学性质相似;
铟与稀盐酸反应生成氯化铟和氢气,反应的化学方程式为:。
15.解:根据表中数据分析得知,完全反应产生二氧化碳的质量为
(或)
设废液中氯化氢的质量为x
x=7.3g
盐酸的溶质质量分数=
答:盐酸的溶质质量分数为3.65%。
【详解】详见答案。
16. CO2 N2 Ar O2 H2O Ca2+、 火星上一年四季温差很大,温度高于-78.5℃时,干冰转化为气态二氧化碳,温度低于-78.5℃时,大气中的二氧化碳又变为干冰 水、氧气、糖类、油脂、蛋白质、维生素 不仅能获得氧气,还能消除宇航员呼出的二氧化碳 是(或有可能) 反应物为肼和氧气,含有氢元素和氧元素,依据化学反应前后元素种类不变,生成物中可能有水 氢气和氮气的沸点不同 防止肼泄漏;反应容器不能用玻璃、橡胶制品 、
【详解】(1)二氧化碳由二氧化碳分子构成,分子用化学式表示,故填:CO2;
氮气由氮分子构成,分子用化学式表示,故填:N2;
氩气由氩原子构成,原子用元素符号表示,故填:Ar;
氧气由氧分子构成,分子用化学式表示,故填:O2;
水蒸气由水分子构成,分子用化学式表示,故填:H2O;
碳酸钙由钙离子和碳酸根离子构成,离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故填:Ca2+、;
(2)火星上一年四季温差很大,温度高于-78.5℃时,干冰转化为气态二氧化碳,温度低于-78.5℃时,大气中的二氧化碳又变为干冰;
(3)由资料可知,火星上有大气,但总量很小,密度只有地球空气的1%左右,主要成分是二氧化碳,缺少供给呼吸的氧气,且火星地表没有发现水,土壤及岩石中含有的无机盐跟地球相似,表层土壤主要为氧化铁,但是缺少蛋白质、油脂、糖类、维生素等营养物质,故填:水、氧气、糖类、油脂、蛋白质、维生素;
(4)①用铁酸镍(NiFe2O4)做催化剂,用舱外太阳能电池发电,通电分解二氧化碳可生成氧气和碳,该方法不仅能获得氧气,还能消除宇航员呼出的二氧化碳;
二氧化碳在铁酸镍催化作用下通电分解生成碳和氧气,该反应的化学方程式为:;
②反应物为肼和氧气,含有氢元素和氧元素,依据化学反应前后元素种类不变,生成物中可能有水,故有可能获得水;
③肼在金属铂(Pt)的催化作用下,常温即可分解产生氢气和氮气,该反应的化学方程式为:;
氢气和氮气的沸点不同,故可从氢气、氮气混合气体中分离出氢气;
④肼是一种无色、易挥发、有刺激性气味的油状液体,有腐蚀性,能腐蚀玻璃和橡胶,有剧毒。故在使用肼制取氢气时,为保障安全,需要注意的问题有防止肼泄漏;反应容器不能用玻璃、橡胶制品等;
⑤碳能与二氧化碳在高温下反应生成一氧化碳,该反应的化学方程式为:;一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,该反应的化学方程式为: 。
17.(1) 6CO2+6H2OC6H12O6+6O 化学能
(2) 碳、氢、氧 36:5:40 取物质少量于试管中,滴加少量碘水,若变蓝,说明含有淀粉 CO2+3H2CH3OH+H2O 可以降低空气中二氧化碳的含量 缓解人类粮食短缺问题(合理即可) 不对,化学反应前后元素的种类不变
【详解】(1)绿色植物光合作用反应的化学方程式为:6CO2+6H2OC6H12O6+6O2;能量转化为太阳能转化为化学能;
(2)①经检测,人工合成淀粉与光合作用生成的淀粉一模一样,所以人工合成淀粉的组成元素是 碳氢氧,淀粉中碳、氢、氧元素的质量比为(12×6n):(1×10n):(16×5n)=36:5:40;
②淀粉遇碘变蓝色,检验物质中含有淀粉,可采用滴加碘水的方法;
③在催化剂催化作用下二氧化碳和氢气反应生成甲醇(CH3OH)和水,反应的化学方程式:CO2+3H2CH3OH+H2O;
④实验分析表明人工合成的淀粉与天然淀粉非常接近,该项研究成果的实际应用价值:可以降低空气中二氧化碳的含量、缓解人类粮食短缺问题、可以节约耕地资源等;
⑤原子是化学变化中的最小粒子,反应前后元素的种类、质量都不变,所以利用化学变化不可能将一种元素变成另一种元素,故此说法错误。
试卷第1页,共3页
试卷第1页,共3页
一、单选题
1.(2020·山东威海·统考中考真题)下列过程主要发生化学变化的是
A.用水银温度计测量体温
B.用消毒液对环境进行消毒
C.佩戴口罩预防疾病传染
D.教室和宿舍经常通风
2.(2020·山东威海·统考中考真题)下列对物质变化的认识不正确的是
A.在物理变化中分子的能量、间隔、相互作用均不变
B.水的天然循环只发生物理变化
C.物质能否发生化学变化是由构成物质的微粒决定的
D.研究化学变化的意义在于实现物质和能量的转化
3.(2021·山东威海·统考中考真题)下列物质的用途中,利用其物理性质的是
A.用生石灰做干燥剂 B.用75%的酒精溶液对皮肤消毒
C.用活性炭除去自来水中的异味和色素 D.用白醋除去水壶中的水垢
4.(2021·山东威海·统考中考真题)下列关于物质及变化的认识,正确的是
A.电子、光子、量子属于化学物质
B.化学变化有可能创造出世界上原来不存在的物质
C.任何变化都遵循质量守恒定律
D.只有通过化学变化才能获得物质和能量
5.(2021·山东威海·统考中考真题)下列关于物质组成和构成的认识,不正确的是
A.看似庞杂无序的化学物质均统一于种类有限的元素之中
B.“元素论”和“原子-分子论”是物质科学的基石,是科学和哲学的重要思想工具
C.核外电子特别是外层电子,是决定原子间作用方式的重要原因
D.跟卢瑟福原子模型比较,道尔顿原子模型不科学,对科学发展的贡献不大
6.(2021·山东威海·统考中考真题)下图为某反应的微观示意图,有关说法正确的是
A.反应中丙、丁的化学计量数之比为1:1 B.反应前后各元素的化合价没有改变
C.反应中物质乙发生还原反应 D.反应前后甲、丁的质量比为1:1
7.(2022·山东威海·中考真题)2022年2月,北京成功举办第24届冬奥会。大量创新技术的应用为“绿色奥运”增光添彩。下列过程中涉及化学变化的是
A.利用二氧化碳跨临界制冷技术为比赛场馆制冰
B.利用氢燃料电池为奥运村客车提供动力
C.利用加压技术将氢气液化储存在“飞扬”火炬中
D.利用模具压制“冰墩墩”硅胶外壳
8.(2022·山东威海·中考真题)模型认知是化学研究的重要科学方法。如图是工业制取硝酸第一步反应的微观示意图。下列说法不正确的是
A.生成的丙、丁的分子个数比为1:1
B.参加反应的甲、乙的质量比为17:40
C.反应前后金属铂的质量和化学性质不变
D.丙是空气污染物之一
9.(2022·山东威海·中考真题)某工厂生产高锰酸钾(KMnO4)的流程如图所示,下列说法不正确的是
A.混合加热室中发生物理变化
B.氧化室中一定有O2参与反应
C.电解室中K2MnO4发生分解反应
D.该过程中可循环利用的物质是KOH
二、填空题
10.(2020·山东威海·统考中考真题)化学与航天
2019年12月27日长征五号系列运载火箭(以下简称“胖五”)发射成功。请回答下列问题:
(1)“胖五”两种发动机分别采用液氢、液氧做推进剂和煤油、液氧做推进剂,而旧的长征火箭采用的推进剂是有毒的偏二甲肼(N2H4)和液态四氧化二氮(N2O4),其燃烧时还会因泄露和不充分燃烧产生大量氮的氧化物。
①“胖五”的两种推进剂中属于可燃物的是_____________________。
②科学家发现,煤在一定条件下加氢制得煤油,称之为煤的液化,属于__________变化。
③写出煤油(以C12H16为例)完全燃烧的化学方程式_______________________。
④从环境保护的角度分析,“胖五”的两种发动机采用的推进剂优点是_________________。
(2)铝合金在火箭制造中被广泛应用。
①铝合金中的铝化学性质活泼,原因是_______________________________。
②铝在岩石圈中以化合物形式存在,工业采用电解氧化铝的方法冶炼铝,写出反应的化学方程式_______________________。
11.(2020·山东威海·统考中考真题)认识消毒剂过氧乙酸,过氧乙酸(C2H4O3)是一种高效绿色的消毒剂。请回答下列问题:
(1)下列有关过氧乙酸的说法,正确的是___________(填选项序号)。
A 是一种氧化物 B 由三种元素组成 C 分子中含有臭氧(O3)分子 D 氧元素的质量分数最大
(2)凡是含有“”结构的物质都具有杀菌消毒作用。研究发现,过氧乙酸分子结构中也含有“”结构,所以过氧乙酸也具有杀菌消毒作用。获得这一结论所运用的科学方法属于___________推理(填选项序号)。
A 归纳 B 演绎 C 类比
(3)过氧乙酸具有如下性质:
A 无色易挥发液体 B 有酸性 C 有很强的腐蚀性 D 易溶于水和乙醇 E 不稳定,易分解放出氧气 F 有毒性
其中属于化学性质的有__________________(填选项序号)。
(4)醋酸(C2H4O2)与过氧化氢在室温下混合均匀,即可反应生成过氧乙酸和水,写出该反应的化学方程式__________________________。
(5)配制1L溶质质量分数为0.5%的过氧乙酸溶液。现有以下物品:
水、溶质质量分数20%的过氧乙酸溶液、量筒(规格分别为1000mL、50mL)、塑料桶、铁桶、木棍、口罩、护目镜、橡皮手套。
①需要20%的过氧乙酸溶液____________mL(计算时,将水、20%和0.5%过氧乙酸溶液的密度都近似为1g/cm3)。
②戴好防护用品,用_____________mL量筒量取所需20%的过氧乙酸溶液倒入塑料桶中,按比例兑水,用木棍搅拌后,盖好桶盖备用。
③请你根据(3)中过氧乙酸的性质分析,进行配制时,不用铁桶的理由是_______。
12.(2021·山东威海·统考中考真题)焰火中的化学
五光十色的焰火让人叹为观止。焰火中的白光主要是由金属镁燃烧产生。下图是有关微粒的结构示意图,请回答下列问题:
(1)燃烧前
图中属于原子的有(填序号)______,属于阴离子的有(填序号)______。氧原子(填“能”或“不能”)______直接构成物质。保持金属镁化学性质的微粒是(填符号)______。
(2)燃烧中
在空气中点燃镁条,镁主要跟氧气反应,还能跟氮气反应生成少量氮化镁(氮元素显-3价)。
①镁跟氮气反应的微观实质是______。镁跟氮气反应的化学方程式为______,所属基本反应类型为______。
②焰火中燃烧金属镁是为了把______能转化为______能。
(3)燃烧后
氧化镁能跟盐酸反应生成氯化镁,要把氯化镁中的镁元素重新分配到其它物质中,从化学变化中镁元素化合价是否改变的角度,反应可分为两类,请举例说明(用化学方程式表示)______和______。但无论化学反应多么复杂,从宏观看______不会消失,从微观看______不会消失。
13.(2021·山东威海·统考中考真题)碳中和,中国在行动
人类在向大自然获取物质和能源的过程中,对物质的循环产生影响。有研究表明,大气中的碳元素只占地球碳总量的0.0000319%。通常,这部分碳是通过自然界中的碳循环(包括大气、海洋、地表生物、火山爆发等)实现平衡。由于人类过度开采使用地下碳(主要是化石燃料),导致工业革命以来碳排放量急剧增加,正是这部分碳打破了大气中二氧化碳的平衡。
为减缓温室效应,我国政府向世界庄严承诺,中国将在2060年前实现碳中和,请回答以下问题:
(1)“碳循环”与“碳中和”中的“碳”,含义是否相同?______。为什么?______。
(2)有人认为碳循环过程中碳元素的化合价始终保持不变,你认为是否正确?______,你的证据是(用化学方程式表示)______。
(3)碳循环中的关键物质一一二氧化碳
①天然气的主要成分是甲烷,若每个家庭每天平均消耗甲烷0.32kg,按三亿个家庭计算,每天向大气中排放______kg二氧化碳(假设甲烷完全燃烧)。
②沼气的主要成分也是甲烷,是利用植物秸秆等废物发酵而成。为解决能源需求跟气候变暖之间的矛盾,有学者建议:用沼气替代天然气,这样就不会额外增加二氧化碳的排放量。请你解释其中的道理______。
③某研究机构发明了转化大气中二氧化碳的技术。方法一:在一定条件下,二氧化碳和氢气反应生成甲醇(CH3OH)和水,用甲醇生产人造纤维:方法二:将二氧化碳转化为甲醇后用作燃料。这两种转化方法对大气中二氧化碳含量的影响是(填“增加”“减少”“不影响”):方法一______;方法二______。
14.(2022·山东威海·中考真题)物尽其用——金属之“铝”
社会发展离不开金属,生产生活中铁、铝及其合金制品随处可见。
(1)铝制易拉罐(如图1)
某品牌碳酸饮料的易拉罐是由铝合金制成的,内壁附着一层有机薄膜。该铝合金中铝的含量约为97%,还含有镁、锰、铁、铟(In)等。
①将易拉罐剪成条状,打磨后与纯铝片相互刻画,发现纯铝片表面有划痕,说明 _____。
②请你推测组成有机薄膜的物质具有的性质:_____、_____(写两条即可)。
③“是否应该停止使用铝制易拉罐”是当前的一个社会性科学议题。有同学认为应该停止使用铝制易拉罐,理由可能 _____(写一条即可);也有同学支持继续使用铝制易拉罐,请你结合铝的性质阐述理由 _____、_____(写两条即可)。
④生活垃圾要分类投放,可与废弃易拉罐作为同一类投放的是 _____(填字母序号)。
A.废旧电池
B.废弃口罩
C.厨余垃圾
D.废旧铁锅
(2)储氢材料
储氢材料的研发是氢能源技术的关键之一。金属铝可用作储氢材料,储氢后生成氢化铝(AlH3),其中氢元素的化合价为 _____;释氢原理为氢化铝与水反应释放氢气,同时生成氢氧化铝,其反应的化学方程式为 _____。
(3)制备铝
工业上常用电解氧化铝的方法制备金属铝,反应的化学方程式为 _____。
(4)铝合金中的铟(In)
如图2为铝、铟的原子结构示意图。某同学推测金属铟与铝的化学性质相似,理由是 _____。实验证明,铟可以与稀盐酸反应,其反应的化学方程式为 _____。
三、计算题
15.(2021·山东威海·统考中考真题)为测定某盐酸的溶质质量分数,取200g样品于烧杯中,将50g碳酸钠溶液分为5等份,分5次加入盛有样品的烧杯中、测出每次反应后溶液的总质量,实验数据如下表:
第一次 第二次 第三次 第四次 第五次
加入Na2CO3溶液的质量 10g 10g 10g 10g 10g
反应后溶液的质量 208.9g 217.8g 226.7g 235.6g 245.6g
请根据实验数据计算盐酸的溶质质量分数。
四、科普阅读题
16.(2021·山东威海·统考中考真题)探秘火星上的化学物质
2021年5月15日,我国自主研制的天问一号搭载祝融号火星车,成功登陆火星。
研究表明,火星上有大气,但总量很小,密度只有地球空气的1%左右,主要成分是二氧化碳,年平均气温-55℃,冬季最低至-133℃,夏季最高至27℃。火星地表没有发现水,但地表下发现有水冰的痕迹,并有大量干冰。土壤及岩石中含有的无机盐跟地球相似,表层土壤主要为氧化铁。到目前为止,火星上还没有发现生命迹象。
(1)下表是火星大气及土壤的部分成分。请你完善下表信息:
成分 二氧化碳 氮气 氩气 氧气 水蒸气 碳酸钙
构成微粒(写符号) ______ ______ ______ ______ ______ ______
体积分数 95.3% 2.7% 1.6% 0.15% 0.03% /
(2)已知干冰在-78.5℃升华。一年四季火星大气中二氧化碳的含量波动较大,原因是______。
(3)移居火星是人类的梦想,根据题中信息回答:跟地球相比,火星上没有或含量不足以支持人类生命活动的基本物质有哪些?______。
(4)要在太空中制取氧气、水和铁,有关物质的信息如下:
资料1、用铁酸镍(NiFe2O4)做催化剂,用舱外太阳能电池发电,通电分解二氧化碳可生成氧气和碳。
资料2、氮气的沸点-196℃:氢气的沸点-253℃。肼(分子式为N2H4,读音:jing)的沸点114℃:肼是一种无色、易挥发、有刺激性气味的油状液体,有腐蚀性,能腐蚀玻璃和橡胶,有剧毒。肼是航空器上常用的燃料。
请根据提供的信息,探究制取氧气、水和铁的方法。
①在密闭的太空舱中,用资料1中的方法制备氧气的优点是______,该反应的化学方程式为______。
②肼在氧气中燃烧是否有可能获得水?请说明理由。______,______。
③已知肼在金属铂(Pt)的催化作用下,常温即可分解产生氢气和氮气,反应的化学方程式为______。写出从氢气、氮气混合气体中分离出氢气的依据______。分离出的氢气在氧气中燃烧可制得水。
④根据资料2中肼的性质,在使用肼制取氢气时,为保障安全,需要注意的问题有______。
⑤以资料1中二氧化碳分解产生的碳、火星大气中的二氧化碳和火星土壤中的氧化铁为原料制备金属铁,反应的化学方程式为______。
17.(2022·山东威海·中考真题)神奇的转化——二氧化碳合成淀粉
2021年9月,中国科学院天津工业生物技术研究所在《科学》杂志发表论文,表示其研究团队在人工合成淀粉方面取得重大突破性进展,首次在实验室实现了二氧化碳到淀粉的人工合成。
淀粉是人体生命活动所需的重要物质。在此之前,人类通过种植玉米、小麦等农作物获取淀粉,即农作物借助光合作用先将二氧化碳转化为葡萄糖,再经过复杂的变化转化为淀粉[(C6H10O5)n]。
我国科学家人工合成淀粉的过程为:在催化剂的作用下,将二氧化碳和氢气转化为甲醇(CH3OH)和水,再经过较复杂的变化将甲醇转化为淀粉。经检测,人工合成淀粉与光合作用生成的淀粉一模一样。
(1)植物合成淀粉
光合作用中生成葡萄糖的化学方程式 _____,从能量转化角度看,绿色植物固定了太阳能,将其转化为 _____。
(2)人工合成淀粉
①从宏观角度看,人工合成淀粉的组成元素是 _____(填名称),其质量比为 _____。
②检验合成的物质是淀粉的实验方案是 _____。
③该过程中生成甲醇的化学方程式 _____。
④你认为该成果实现工业化生产后的现实意义是 _____、_____(写两条即可)。
⑤淀粉的合成实现了无机物到有机物的转化。有人认为化学变化无所不能,还能将一种元素变成另一种元素。你是否赞成这一观点?请结合你对化学变化实质和元素概念的理解,谈谈你的看法 _____。
参考答案:
1.B
【分析】物理变化和化学变化的唯一标志是有无新物质生成,有新物质生成的为化学变化,没有新物质生成的为物理变化。
【详解】A、用水银温度计测量体温,只是水银受热膨胀,没有新物质生成,属于物理变化,故A错误;
B、消毒液消毒的原理是使细菌或病毒的蛋白质变性,有新物质生成,属于化学变化,故B正确;
C、佩戴口罩预防疾病传染没有新物质生成,属于物理变化,故C错误;
D、教室和宿舍经常通风没有新物质生成,属于物理变化,故C错误;
故选B。
2.A
【详解】A、物理变化的实质是无新物质生成,但是分子的能量、间隔、相互作用可能发生改变,如水由气态变为液态,属于物理变化,但是分子间隔变小,符合题意;
B、水的天然循环,只是水的状态发生了改变,无新物质生成,属于物理变化,不符合题意;
C、化学变化的实质是由新物质生成,故发生化学变化,物质的微粒一定发生了改变,物质能否发生化学变化,要看构成物质的微粒是否改变,不符合题意;
D、研究化学变化的意义在于实现物质和能量的转化,用于我们的生活,改变我们的生活,说法正确,不符合题意。
故选A。
3.C
【详解】A、用生石灰做干燥剂,是因为氧化钙能与水反应生成氢氧化钙,利用的是其化学性质,不符合题意;
B、用75%的酒精溶液对皮肤消毒,能使蛋白质变性,需要通过化学变化表现出来,利用的是其化学性质,不符合题意;
C、用活性炭除去自来水中的异味和色素,是因为活性炭具有吸附性,利用的是其物理性质,符合题意;
D、用白醋除去水壶中的水垢,是因为醋酸能与氢氧化镁和碳酸钙反应,利用的是其化学性质,不符合题意。
故选C。
4.B
【详解】A、光子不属于化学物质,不符合题意;
B、化学变化能生成新物质,有可能创造出世界上原来不存在的物质,符合题意;
C、化学变化遵循质量守恒定律,物理变化不遵循质量守恒定律,不符合题意;
D、物理变化也能获得能量,如氢氧化钠溶于水,放出热量,不符合题意。
故选B。
5.D
【详解】A、物质是由元素组成的,有限的元素可组成种类繁多的物质,不符合题意;
B、“元素论”和“原子-分子论”是物质科学的基石,是科学和哲学的重要思想工具,说法正确,不符合题意;
C、最外层电子数决定元素的化学性质,核外电子特别是外层电子,是决定原子间作用方式的重要原因,不符合题意;
D、跟卢瑟福原子模型比较,道尔顿原子模型不科学,但是推动了科学的发展,为以后的研究奠定了基础,符合题意。
故选D。
6.C
【分析】由图可知,该反应为一氧化碳和一氧化氮在催化剂的作用下反应生成二氧化碳和氮气,该反应的化学方程式为:。
【详解】A、由化学方程式可知,反应中丙、丁的化学计量数之比为2:1,不符合题意;
B、由图可知,反应前后,氮元素由化合态转化为游离态,化合价一定发生了改变,不符合题意;
C、在该反应中,物质乙失去氧,属于氧化剂,发生还原反应,符合题意;
D、反应前后甲、丁的质量比为:2×(12+16):(14×2)=2:1,不符合题意。
故选C。
7.B
【详解】A、采用二氧化碳跨临界直冷技术制冰过程没有产生新物质,属于物理变化,故错误;
B、氢气燃烧生成水,产生新物质,属于化学变化,故正确;
C、利用加压技术将氢气液化储存在“飞扬”火炬中,只是氢气的状态发生改变,没有产生新物质,属于物理变化,故错误;
D、利用模具压制“冰墩墩”硅胶外壳,没有产生新物质,属于物理变化,故错误。
故选B。
8.A
【分析】依据图示的分子结构可知该反应的化学方程式为:4NH3+5O24NO+6H2O。
【详解】A、由4NH3+5O24NO+6H2O可知,生成的丙、丁的分子个数比为4:6=2:3,故说法错误;
B、由4NH3+5O24NO+6H2O可知,参加反应的甲、乙的质量比为(17×4):(5×32)=17:40,故说法正确;
C、铂是该反应的催化剂,反应前后金属铂的质量和化学性质不变,故说法正确;
D、丙是一氧化氮,是空气污染物之一,故说法正确。
故选A。
9.C
【详解】A、由流程图可知:混合加热室中二氧化锰和氢氧化钾由固体变为熔融物,状态改变,无新物质生成,属于物理变化,说法正确;
B、由流程图可知:氧化室中发生反应后,空气成分减少了氧气,所以氧化室中一定有O2参与反应,说法正确;
C、由流程图可知:电解室发生反应后,生成高锰酸钾、氢氧化钾和氢气,反应后含有钾、氢、锰、氧元素,依据化学反应前后,元素种类不变,反应物中也应该含有钾、氢、锰、氧元素,锰酸钾中只含有钾、锰、氧元素,可确定反应物还有其他物质含有氢元素,所以该反应的反应物不是一种物质,不属于分解反应,电解室中K2MnO4发生的不是分解反应,说法不正确;
D、由流程图可知:该过程中原料中有氢氧化钾,电解室中又生成氢氧化钾,可循环利用的物质是氢氧化钾,说法正确。
故选C。
10. 液氢、煤油 化学 原料无毒,产物无污染 铝原子核外有13个电子,最外层电子数为3,易失电子
【详解】(1)①“胖五”的两种推进剂中液氧是助燃剂,属于可燃物的是液氢、煤油;
②科学家发现,煤在一定条件下加氢制得煤油,称之为煤的液化,变化中产生了新物质煤油,属于化学变化;
③煤油(以C12H16为例)完全燃烧,反应物是煤油和氧气,生成物是二氧化碳和水,化学方程式是:;
④因为旧的长征火箭采用的燃料偏二甲肼(N2H4)有毒,燃烧时还会因泄露和不充分燃烧产生大量氮的氧化物,氮的氧化物溶于雨水会形成酸雨,而“胖五”采用的燃料液氢、煤油本身无毒,生成物是水和二氧化碳,对环境无污染,所以从环境保护的角度分析,“胖五”的两种发动机采用的推进剂优点是:原料无毒,产物无污染;
(2)①元素的化学性质主要决定于原子的最外层电子数。铝化学性质活泼,原因是铝原子核外有13个电子,最外层电子数为3,易失电子;
②电解氧化铝生成铝和氧气,反应的化学方程式为:。
11. BD B BCEF 25 50 过氧乙酸显酸性,能与铁反应
【详解】(1)A、 过氧乙酸含三种元素,不是氧化物,故A错误;
B、过氧乙酸由碳、氢、氧三种元素组成,故B正确。
C、过氧乙酸分子中不含有臭氧(O3)分子,C错误;
D、过氧乙酸中,碳氢氧元素的质量比为(12×2):(1×4):(16×3)=6:1:12,氧元素质量分数最大,故D正确。
故选:BD。
(2)凡是含有“”结构的物质都具有杀菌消毒作用。研究发现,过氧乙酸分子结构中也含有“”结构,所以过氧乙酸也具有杀菌消毒作用。获得这一结论所运用的科学方法属于演绎,故填:B。
(3)A 无色易挥发液体,物理性质;
B 有酸性,属于化学性质;
C 有很强的腐蚀性,化学性质;
D 易溶于水和乙醇,物理性质;
E 不稳定,易分解放出氧气,化学性质;
F 有毒性,化学性质。
故选:BCEF。
(4)C2H4O2与过氧化氢在室温下混合均匀,即可反应生成过氧乙酸和水,化学方程式为,故填:。
(5)①设需要过氧乙酸体积为x,则1000mL×1g/mL×0.5%=x×1g/mL×20%,x=25mL,故填:25。
②为准确量取过氧乙酸溶液,戴好防护用品,量取25mL液体,用50mL量筒量取,故填:50。
③请你根据(3)中过氧乙酸的性质分析,进行配制时,不用铁桶的理由是过氧乙酸显酸性,能与铁反应,故填:过氧乙酸显酸性,能与铁反应。
12. BCE DF 不能 Mg 镁原子失去电子变成镁离子,氮原子得到电子变成氮离子,镁离子与氮离子结合生成氮化镁 化合反应 化学 光 元素 原子
【详解】(1)A、质子数大于核外电子数,表示阳离子;B、质子数=核外电子数,表示原子;C、质子数=核外电子数,表示原子;D、质子数小于核外电子数,表示阴离子;E、质子数=核外电子数,表示原子;F、质子数小于核外电子数,表示阴离子,故表示原子的有BCE;
属于阴离子的有:DF;
氧原子不能直接构成物质;
镁由镁原子构成,保持镁化学性质的微粒为镁原子,故填:Mg;
(2)①镁跟氮气反应的微观实质是:镁原子失去电子变成镁离子,氮原子得到电子变成氮离子,镁离子与氮离子结合生成氮化镁;
镁在氮气中燃烧生成氮化镁,氮化镁中镁元素显+2价,氮元素显-3价,故氮化镁的化学式为:Mg3N2,该反应的化学方程式为:;
该反应符合“多变一”的特点,属于化合反应;
②焰火中燃烧金属镁是为了把化学能转化为光能;
(3)从化学变化中镁元素化合价是否改变的角度,反应可分为两类,其中一种镁元素化合价发生改变,如氯化镁在通电的条件下反应生成镁和氯气,该反应的化学方程式为:;
其中一种镁元素的化合价不变,如氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠,该反应的化学方程式为:;
但无论化学反应多么复杂,根据质量守恒定律,化学反应前后,元素的种类和原子的个数不变,故从宏观看元素不会消失,从微观看原子不会消失。
13. 否(或不相同) 前者指碳元素,后者指二氧化碳 否(或不正确) 解:设每个家庭消耗甲烷生成二氧化碳的质量为x
x=0.88kg
故按三亿个家庭计算,每天向大气中排放:0.88kg×300000000=2.64×108kg二氧化碳
沼气燃烧产生二氧化碳,植物光合作用吸收二氧化碳,形成碳循环,不会额外增加碳排放量 减少 不影响
【详解】(1)“碳循环”与“碳中和”中的“碳”,含义不相同,前者指碳元素,后者指二氧化碳;
(2)不正确,如碳燃烧生成二氧化碳,碳由游离态转化为化合态。化合价发生了改变,该反应的化学方程式为:;
(3)①见答案;
②沼气是利用植物秸秆等废物发酵而成,沼气的主要成分是甲烷,甲烷燃烧生成二氧化碳。植物又可通过光合作用吸收二氧化碳,形成碳循环,不会额外增加碳排放量;
③方法一:在一定条件下,二氧化碳和氢气反应生成甲醇和水,用甲醇生产人造纤维,反应消耗了二氧化碳,且没有二氧化碳生成,能减小二氧化碳含量;
方法二:将二氧化碳转化为甲醇后用作燃料。甲醇燃烧又生成二氧化碳和水,根据质量守恒定律,化学反应前后,元素的种类和质量不变,甲醇中碳元素完全来自于二氧化碳,故生成二氧化碳的质量与消耗二氧化碳的质量相等,故填:不影响。
14.(1) 合金的硬度比纯金属的大 无毒(合理即可) 耐腐蚀(合理即可) 铝制易拉罐提炼会产生污染(合理即可) 不易破(合理即可) 携带方便(合理即可) D
(2) -1 AlH3+3H2O=3H2↑+Al(OH)3
(3)
(4) 原子的最外层电子数相同
【详解】(1)①易拉罐是由铝合金制成的,将易拉罐剪成条状,打磨后与纯铝片相互刻画,发现纯铝片表面有划痕,说明合金的硬度比组成它的纯金属硬度更大;
②某品牌碳酸饮料的易拉罐是由铝合金制成的,内壁附着一层有机薄膜,由此可推测组成有机薄膜的物质无毒、耐腐蚀、不能与酸反应等;
③有同学认为应该停止使用铝制易拉罐,理由可能铝制易拉罐提炼会产生污染;铝是一种低毒金属元素,它并非人体需要的微量元素,不会导致急性中毒,但食品中含有的铝超过国家标准就会对人体造成危害。也有同学支持继续使用铝制易拉罐,可能是因为其具有重量轻,体积小,不易破碎,便于携带等优点;
④废弃易拉罐含有金属,属于可回收垃圾,故可与废旧铁锅作为同一类投放。
故选D;
(2)氢化铝中铝元素显+3价,根据化合物中正负化合价的代数和为0可知,氢元素的化合价为-1;
氢化铝与水反应释放氢气,同时生成氢氧化铝,反应的化学方程式为:AlH3+3H2O=3H2↑+Al(OH)3。
(3)氧化铝在通电的条件下反应生成铝和氧气,反应的化学方程式为:。
(4)最外层电子数决定元素的化学性质,由图2可知铝、铟的原子最外层电子数都是3,所以可推测金属铟与铝的化学性质相似;
铟与稀盐酸反应生成氯化铟和氢气,反应的化学方程式为:。
15.解:根据表中数据分析得知,完全反应产生二氧化碳的质量为
(或)
设废液中氯化氢的质量为x
x=7.3g
盐酸的溶质质量分数=
答:盐酸的溶质质量分数为3.65%。
【详解】详见答案。
16. CO2 N2 Ar O2 H2O Ca2+、 火星上一年四季温差很大,温度高于-78.5℃时,干冰转化为气态二氧化碳,温度低于-78.5℃时,大气中的二氧化碳又变为干冰 水、氧气、糖类、油脂、蛋白质、维生素 不仅能获得氧气,还能消除宇航员呼出的二氧化碳 是(或有可能) 反应物为肼和氧气,含有氢元素和氧元素,依据化学反应前后元素种类不变,生成物中可能有水 氢气和氮气的沸点不同 防止肼泄漏;反应容器不能用玻璃、橡胶制品 、
【详解】(1)二氧化碳由二氧化碳分子构成,分子用化学式表示,故填:CO2;
氮气由氮分子构成,分子用化学式表示,故填:N2;
氩气由氩原子构成,原子用元素符号表示,故填:Ar;
氧气由氧分子构成,分子用化学式表示,故填:O2;
水蒸气由水分子构成,分子用化学式表示,故填:H2O;
碳酸钙由钙离子和碳酸根离子构成,离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故填:Ca2+、;
(2)火星上一年四季温差很大,温度高于-78.5℃时,干冰转化为气态二氧化碳,温度低于-78.5℃时,大气中的二氧化碳又变为干冰;
(3)由资料可知,火星上有大气,但总量很小,密度只有地球空气的1%左右,主要成分是二氧化碳,缺少供给呼吸的氧气,且火星地表没有发现水,土壤及岩石中含有的无机盐跟地球相似,表层土壤主要为氧化铁,但是缺少蛋白质、油脂、糖类、维生素等营养物质,故填:水、氧气、糖类、油脂、蛋白质、维生素;
(4)①用铁酸镍(NiFe2O4)做催化剂,用舱外太阳能电池发电,通电分解二氧化碳可生成氧气和碳,该方法不仅能获得氧气,还能消除宇航员呼出的二氧化碳;
二氧化碳在铁酸镍催化作用下通电分解生成碳和氧气,该反应的化学方程式为:;
②反应物为肼和氧气,含有氢元素和氧元素,依据化学反应前后元素种类不变,生成物中可能有水,故有可能获得水;
③肼在金属铂(Pt)的催化作用下,常温即可分解产生氢气和氮气,该反应的化学方程式为:;
氢气和氮气的沸点不同,故可从氢气、氮气混合气体中分离出氢气;
④肼是一种无色、易挥发、有刺激性气味的油状液体,有腐蚀性,能腐蚀玻璃和橡胶,有剧毒。故在使用肼制取氢气时,为保障安全,需要注意的问题有防止肼泄漏;反应容器不能用玻璃、橡胶制品等;
⑤碳能与二氧化碳在高温下反应生成一氧化碳,该反应的化学方程式为:;一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,该反应的化学方程式为: 。
17.(1) 6CO2+6H2OC6H12O6+6O 化学能
(2) 碳、氢、氧 36:5:40 取物质少量于试管中,滴加少量碘水,若变蓝,说明含有淀粉 CO2+3H2CH3OH+H2O 可以降低空气中二氧化碳的含量 缓解人类粮食短缺问题(合理即可) 不对,化学反应前后元素的种类不变
【详解】(1)绿色植物光合作用反应的化学方程式为:6CO2+6H2OC6H12O6+6O2;能量转化为太阳能转化为化学能;
(2)①经检测,人工合成淀粉与光合作用生成的淀粉一模一样,所以人工合成淀粉的组成元素是 碳氢氧,淀粉中碳、氢、氧元素的质量比为(12×6n):(1×10n):(16×5n)=36:5:40;
②淀粉遇碘变蓝色,检验物质中含有淀粉,可采用滴加碘水的方法;
③在催化剂催化作用下二氧化碳和氢气反应生成甲醇(CH3OH)和水,反应的化学方程式:CO2+3H2CH3OH+H2O;
④实验分析表明人工合成的淀粉与天然淀粉非常接近,该项研究成果的实际应用价值:可以降低空气中二氧化碳的含量、缓解人类粮食短缺问题、可以节约耕地资源等;
⑤原子是化学变化中的最小粒子,反应前后元素的种类、质量都不变,所以利用化学变化不可能将一种元素变成另一种元素,故此说法错误。
试卷第1页,共3页
试卷第1页,共3页
同课章节目录
