化学人教版(2019)选择性必修3 3.2.1 醇(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.2.1 醇(共30张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 26.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-04 08:36:49 | ||
图片预览




文档简介
(共30张PPT)
第三章 烃的衍生物
第二节 醇 酚
第一课时 醇
高 中 化 学 选 择 性 必 修 三 ( 2019 人 教 版 )
核心素养发展目标
1.宏观辨识与微观探析:
结合醇的代表物了解醇的分类、组成和结构,理解醇的性质。
2.变化观念与证据推理:
以乙醇为代表物,从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系。
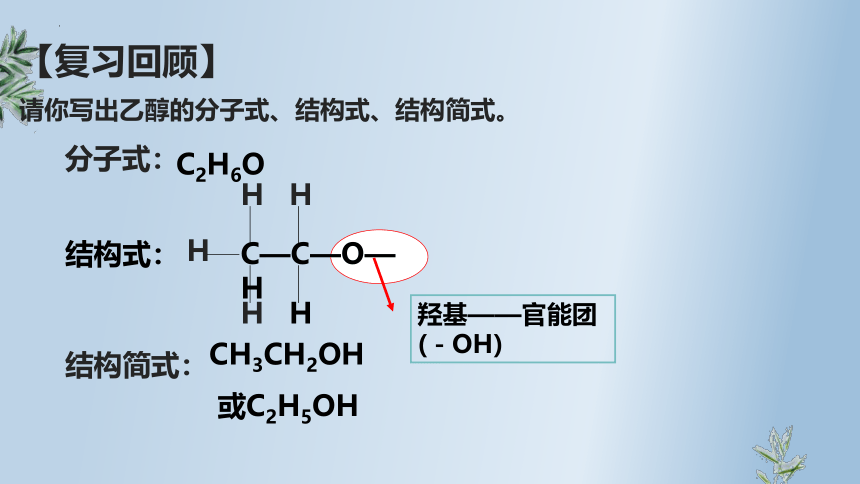
羟基——官能团
(-OH)
C—C—O—H
H
H
H
H
H
CH3CH2OH
或C2H5OH
C2H6O
结构式:
分子式:
结构简式:
【复习回顾】
请你写出乙醇的分子式、结构式、结构简式。
CH3CH2OH
乙醇
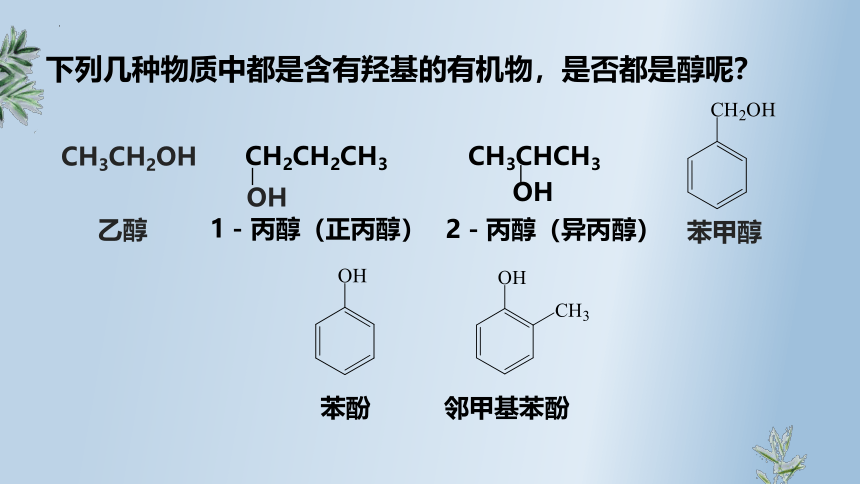
苯甲醇
邻甲基苯酚
苯酚
CH3CHCH3
OH
2-丙醇(异丙醇)
CH2CH2CH3
OH
1-丙醇(正丙醇)
下列几种物质中都是含有羟基的有机物,是否都是醇呢?
(1)定义:羟基与饱和碳原子相连的化合物称为醇。
一、醇
CnH2n+1OH 或 CnH2n+2O (n≥1)
羟基(—OH)
(2)官能团:
(3)饱和一元醇通式: , 可简写为R—OH。
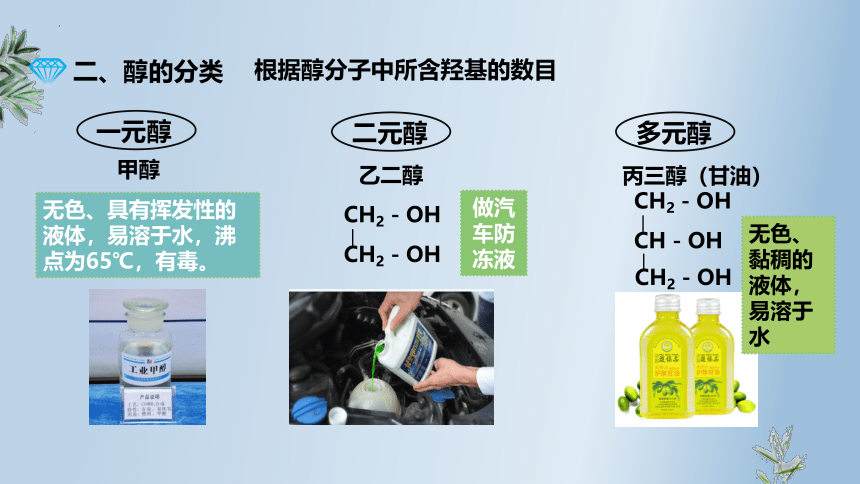
二、醇的分类
一元醇
二元醇
多元醇
甲醇
无色、具有挥发性的液体,易溶于水,沸点为65℃,有毒。
乙二醇
丙三醇(甘油)
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
无色、黏稠的液体,易溶于水
做汽车防冻液
根据醇分子中所含羟基的数目
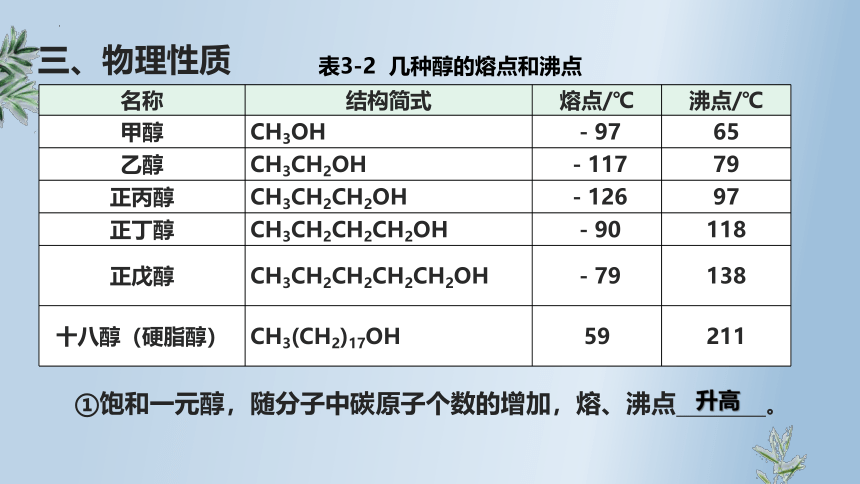
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
①饱和一元醇,随分子中碳原子个数的增加,熔、沸点 。
升高
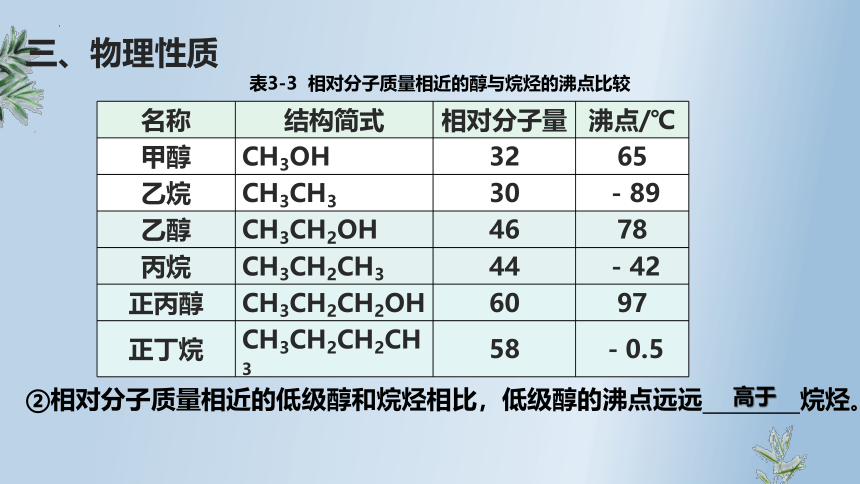
三、物理性质
表3-3 相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
②相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远 烷烃。
高于
三、物理性质
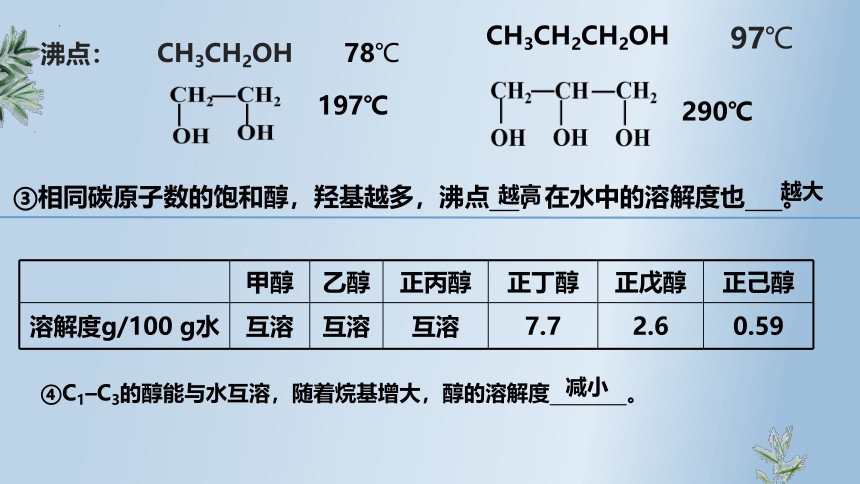
③相同碳原子数的饱和醇,羟基越多,沸点 ,在水中的溶解度也 。
CH3CH2OH
78℃
CH3CH2CH2OH
97℃
沸点:
197℃
290℃
越高
越大
甲醇 乙醇 正丙醇 正丁醇 正戊醇 正己醇
溶解度g/100 g水 互溶 互溶 互溶 7.7 2.6 0.59
④C1–C3的醇能与水互溶,随着烷基增大,醇的溶解度 。
减小
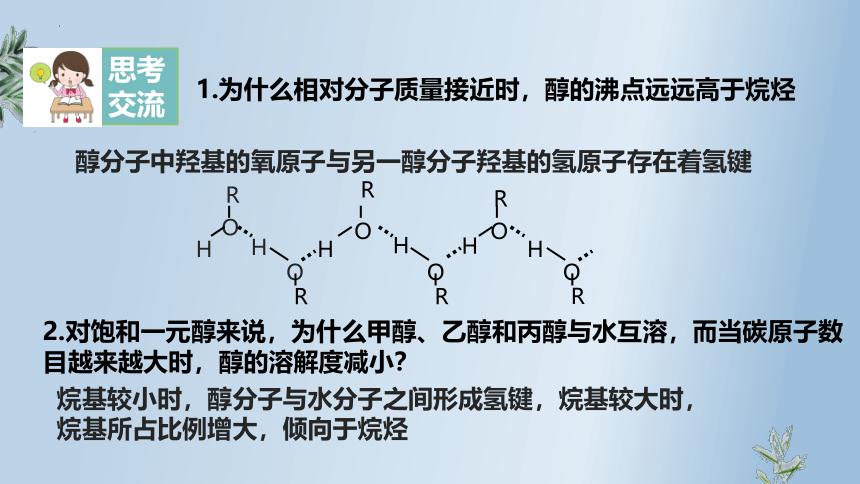
1.为什么相对分子质量接近时,醇的沸点远远高于烷烃
醇分子中羟基的氧原子与另一醇分子羟基的氢原子存在着氢键
2.对饱和一元醇来说,为什么甲醇、乙醇和丙醇与水互溶,而当碳原子数
目越来越大时,醇的溶解度减小?
烷基较小时,醇分子与水分子之间形成氢键,烷基较大时,
烷基所占比例增大,倾向于烷烃
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
思考
交流
四.醇的化学性质
以乙醇为例
【复习回顾】
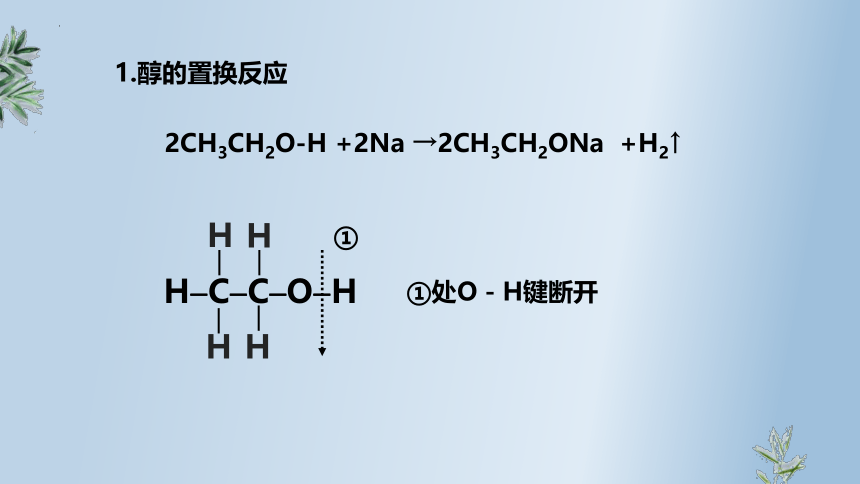
回顾乙醇的化学性质,写出我们学过的有关乙醇的化学方程式
2CH3CH2O-H +2Na →2CH3CH2ONa +H2↑
H C C O H
H
H
H
H
①
①处O-H键断开
1.醇的置换反应
(1)酯化反应
酸脱羟基、醇脱羟基上的氢原子
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
H C C O H
H
H
H
H
2、醇的取代反应
通过分析这两个反应中,乙醇的断键位置,你能从共价键的极性角度去分析断键的原因吗?
思考
交流
在醇分子中,由于氧原子吸引电子的能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。因此,醇在发生反应时,O—H容易断裂,使羟基中的氢原子被取代,同样,C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
CH3CH2OH + HBr
CH3CH2Br + H2O
2、醇的取代反应
(2)与氢卤酸(HX)反应
△
可用于制备卤代烃
强碱水溶液,加热
—X被—OH取代
氢卤酸,加热
—OH被—X取代
卤代烷
醇
H C C O H
H
H
H
H
(3)分子间脱水
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
一分子脱羟基,另一分子脱羟基氢
乙醚
像乙醚这样有两个烃基通过一个氧原子连接起来的化合物叫做醚
醚的结构可用R-O-R’来表示,R和R'都是烃基,可以相同,也可以不同。
醚类物质可用作溶剂和麻醉剂
2、醇的取代反应
C2H5OH+3O2 2CO2+3H2O
点燃
(1)可燃性
实验室里也常用乙醇作为燃料,
乙醇也可用作内燃机的燃料
3、氧化反应
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu/Ag
△
(2)催化氧化反应
3、氧化反应
①-③位断键
①
③
R2—C—O—H
R1
H
+ O2
2
+ 2H2O
—C=O
R1
R2
2
Cu
△
醇的催化氧化
※羟基所在碳上有两个氢催化氧化生成醛
去羟基上的氢和羟基所连碳上的氢,碳原子和氧原子形成碳氧双键。
※羟基所在碳上有一个氢催化氧化生成酮
※羟基所在碳上没有氢不能发生催化氧化
实验视频:乙醇与重铬酸钾酸性溶液的反应
紫红色→无色
重铬酸钾(K2Cr2O7)酸性溶液
Cr2O72-→Cr3+
(橙红色)→(绿色)
CH3CH2OH
CH3CHO
氧化
氧化
CH3COOH
(3)醇与强氧化剂反应
酸性重铬酸溶液由橙色变为绿色,判定司机饮酒超标。
KMnO4酸性溶液
①羟基所在碳上有两个氢可氧化生成酸
②羟基所在碳上有一个氢可氧化生成酮
③羟基所在碳上没有氢不能被氧化
R CH2OH
R COOH
KMnO4(H+)或
K2Cr2O7(H+)
R1 CH R2
OH
KMnO4(H+)或
K2Cr2O7(H+)
R1 C R2
O
小结:醇与强氧化剂反应
氧化反应:有机化合物分子中失去氢原子或加入氧原子的反应
还原反应:有机化合物分子中加入氢原子或失去氧原子的反应
CH3CH2OH
CH3CHO
氧化
氧化
CH3COOH
H C C H
H
H
H
OH
4、醇的消去反应
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键的化合物的反应叫做消去反应。
现象 解释
(1)实验现象
酸性高锰酸钾溶液褪色
反应生成的乙烯与其发生氧化反应
溴的四氯化碳溶液褪色
反应生成乙烯与其发生加成反应
CH2=CH2 ↑ +H2O
1700C
浓H2SO4
CH3CH2OH
乙烯的实验室制法:
(2)实验结论
(1)为什么要先将气体通入氢氧化钠溶液中?
(2)为什么要迅速升温至170℃?
乙醇和浓硫酸的混合物140℃左右,两个乙醇分子间脱水。(取代反应)
吸收SO2和乙醇
问题探究
(3)浓硫酸的作用?
脱水剂和催化剂
【学习与评价】下列醇能否都能发生消去反应?
(2)CH3CH2CH(OH)CH3
CH3—
CH 3
— OH
C
CH3
(1)CH3CH2CH2OH
(3)
(4)CH3OH
(5)(CH3)3CCH2OH
醇发生消去反应:要求与羟基相连碳的邻位碳原子上有氢原子。
溴乙烷与乙醇都能发生消去反应,二者的反应有什么异同
现象 CH3CH2Br CH3CH2OH
反应条件
化学键断裂
化学键生成
反应产物
NaOH乙醇溶液 加热
C—Br C—H
碳碳双键
CH2=CH2 NaBr H2O
浓硫酸,加热至170 ℃
C—O C—H
碳碳双键
CH2=CH2 H2O
课 堂 小 结
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
反应 断键位置
分子间脱水
与HX反应
②④
②
①③
①②
与金属反应
消去反应
催化氧化
①
第三章 烃的衍生物
第二节 醇 酚
第一课时 醇
高 中 化 学 选 择 性 必 修 三 ( 2019 人 教 版 )
核心素养发展目标
1.宏观辨识与微观探析:
结合醇的代表物了解醇的分类、组成和结构,理解醇的性质。
2.变化观念与证据推理:
以乙醇为代表物,从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系。
羟基——官能团
(-OH)
C—C—O—H
H
H
H
H
H
CH3CH2OH
或C2H5OH
C2H6O
结构式:
分子式:
结构简式:
【复习回顾】
请你写出乙醇的分子式、结构式、结构简式。
CH3CH2OH
乙醇
苯甲醇
邻甲基苯酚
苯酚
CH3CHCH3
OH
2-丙醇(异丙醇)
CH2CH2CH3
OH
1-丙醇(正丙醇)
下列几种物质中都是含有羟基的有机物,是否都是醇呢?
(1)定义:羟基与饱和碳原子相连的化合物称为醇。
一、醇
CnH2n+1OH 或 CnH2n+2O (n≥1)
羟基(—OH)
(2)官能团:
(3)饱和一元醇通式: , 可简写为R—OH。
二、醇的分类
一元醇
二元醇
多元醇
甲醇
无色、具有挥发性的液体,易溶于水,沸点为65℃,有毒。
乙二醇
丙三醇(甘油)
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
无色、黏稠的液体,易溶于水
做汽车防冻液
根据醇分子中所含羟基的数目
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
①饱和一元醇,随分子中碳原子个数的增加,熔、沸点 。
升高
三、物理性质
表3-3 相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
②相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远 烷烃。
高于
三、物理性质
③相同碳原子数的饱和醇,羟基越多,沸点 ,在水中的溶解度也 。
CH3CH2OH
78℃
CH3CH2CH2OH
97℃
沸点:
197℃
290℃
越高
越大
甲醇 乙醇 正丙醇 正丁醇 正戊醇 正己醇
溶解度g/100 g水 互溶 互溶 互溶 7.7 2.6 0.59
④C1–C3的醇能与水互溶,随着烷基增大,醇的溶解度 。
减小
1.为什么相对分子质量接近时,醇的沸点远远高于烷烃
醇分子中羟基的氧原子与另一醇分子羟基的氢原子存在着氢键
2.对饱和一元醇来说,为什么甲醇、乙醇和丙醇与水互溶,而当碳原子数
目越来越大时,醇的溶解度减小?
烷基较小时,醇分子与水分子之间形成氢键,烷基较大时,
烷基所占比例增大,倾向于烷烃
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
思考
交流
四.醇的化学性质
以乙醇为例
【复习回顾】
回顾乙醇的化学性质,写出我们学过的有关乙醇的化学方程式
2CH3CH2O-H +2Na →2CH3CH2ONa +H2↑
H C C O H
H
H
H
H
①
①处O-H键断开
1.醇的置换反应
(1)酯化反应
酸脱羟基、醇脱羟基上的氢原子
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
H C C O H
H
H
H
H
2、醇的取代反应
通过分析这两个反应中,乙醇的断键位置,你能从共价键的极性角度去分析断键的原因吗?
思考
交流
在醇分子中,由于氧原子吸引电子的能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。因此,醇在发生反应时,O—H容易断裂,使羟基中的氢原子被取代,同样,C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
CH3CH2OH + HBr
CH3CH2Br + H2O
2、醇的取代反应
(2)与氢卤酸(HX)反应
△
可用于制备卤代烃
强碱水溶液,加热
—X被—OH取代
氢卤酸,加热
—OH被—X取代
卤代烷
醇
H C C O H
H
H
H
H
(3)分子间脱水
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
一分子脱羟基,另一分子脱羟基氢
乙醚
像乙醚这样有两个烃基通过一个氧原子连接起来的化合物叫做醚
醚的结构可用R-O-R’来表示,R和R'都是烃基,可以相同,也可以不同。
醚类物质可用作溶剂和麻醉剂
2、醇的取代反应
C2H5OH+3O2 2CO2+3H2O
点燃
(1)可燃性
实验室里也常用乙醇作为燃料,
乙醇也可用作内燃机的燃料
3、氧化反应
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu/Ag
△
(2)催化氧化反应
3、氧化反应
①-③位断键
①
③
R2—C—O—H
R1
H
+ O2
2
+ 2H2O
—C=O
R1
R2
2
Cu
△
醇的催化氧化
※羟基所在碳上有两个氢催化氧化生成醛
去羟基上的氢和羟基所连碳上的氢,碳原子和氧原子形成碳氧双键。
※羟基所在碳上有一个氢催化氧化生成酮
※羟基所在碳上没有氢不能发生催化氧化
实验视频:乙醇与重铬酸钾酸性溶液的反应
紫红色→无色
重铬酸钾(K2Cr2O7)酸性溶液
Cr2O72-→Cr3+
(橙红色)→(绿色)
CH3CH2OH
CH3CHO
氧化
氧化
CH3COOH
(3)醇与强氧化剂反应
酸性重铬酸溶液由橙色变为绿色,判定司机饮酒超标。
KMnO4酸性溶液
①羟基所在碳上有两个氢可氧化生成酸
②羟基所在碳上有一个氢可氧化生成酮
③羟基所在碳上没有氢不能被氧化
R CH2OH
R COOH
KMnO4(H+)或
K2Cr2O7(H+)
R1 CH R2
OH
KMnO4(H+)或
K2Cr2O7(H+)
R1 C R2
O
小结:醇与强氧化剂反应
氧化反应:有机化合物分子中失去氢原子或加入氧原子的反应
还原反应:有机化合物分子中加入氢原子或失去氧原子的反应
CH3CH2OH
CH3CHO
氧化
氧化
CH3COOH
H C C H
H
H
H
OH
4、醇的消去反应
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键的化合物的反应叫做消去反应。
现象 解释
(1)实验现象
酸性高锰酸钾溶液褪色
反应生成的乙烯与其发生氧化反应
溴的四氯化碳溶液褪色
反应生成乙烯与其发生加成反应
CH2=CH2 ↑ +H2O
1700C
浓H2SO4
CH3CH2OH
乙烯的实验室制法:
(2)实验结论
(1)为什么要先将气体通入氢氧化钠溶液中?
(2)为什么要迅速升温至170℃?
乙醇和浓硫酸的混合物140℃左右,两个乙醇分子间脱水。(取代反应)
吸收SO2和乙醇
问题探究
(3)浓硫酸的作用?
脱水剂和催化剂
【学习与评价】下列醇能否都能发生消去反应?
(2)CH3CH2CH(OH)CH3
CH3—
CH 3
— OH
C
CH3
(1)CH3CH2CH2OH
(3)
(4)CH3OH
(5)(CH3)3CCH2OH
醇发生消去反应:要求与羟基相连碳的邻位碳原子上有氢原子。
溴乙烷与乙醇都能发生消去反应,二者的反应有什么异同
现象 CH3CH2Br CH3CH2OH
反应条件
化学键断裂
化学键生成
反应产物
NaOH乙醇溶液 加热
C—Br C—H
碳碳双键
CH2=CH2 NaBr H2O
浓硫酸,加热至170 ℃
C—O C—H
碳碳双键
CH2=CH2 H2O
课 堂 小 结
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
反应 断键位置
分子间脱水
与HX反应
②④
②
①③
①②
与金属反应
消去反应
催化氧化
①
