化学人教版(2019)选择性必修3 3.4.1 羧酸(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.4.1 羧酸(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 50.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-04 08:51:07 | ||
图片预览




文档简介
(共20张PPT)
第四节 羧酸 羧酸衍生物
第1课时 羧酸
1. 能写出羧酸和酯的官能团、乙酸的结构简式和名称
能够列举乙酸和乙酸乙酯的主要物理性质。
2.能描述和分析乙酸、乙酸乙酯的重要反应,书写相应的反应式。
3.能基于官能团、化学键的特点与反应规律分析和推断含有羧基、
酯基官能团的有机化合物的化学性质。根据信息书写相应的反应式。
金刀利,锦鲤肥,更那堪玉葱纤细。
添得____来风韵美,试尝道甚生滋味。
醋
柴米油盐酱___茶
琴棋书画诗酒花
醋
羧酸:由烃基与羧基相连构成的有机化合物。
官能团: 羧基
—C—O—H
O
或 —COOH
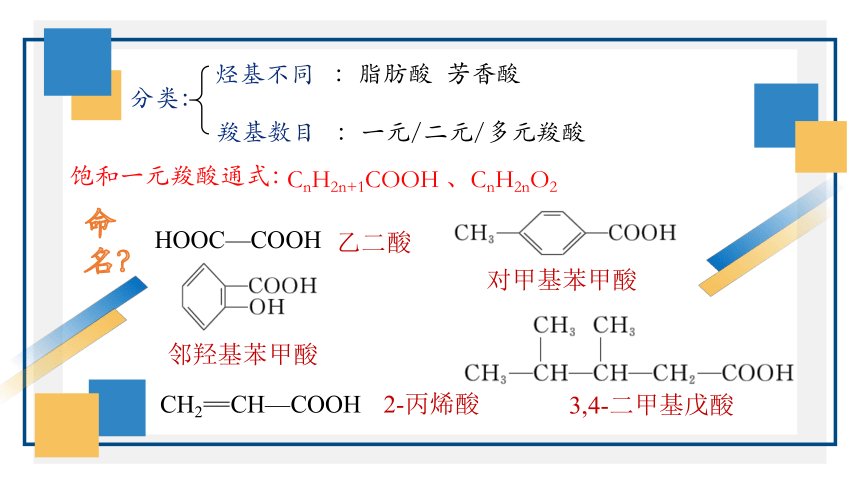
分类:
烃基不同
羧基数目
:脂肪酸 芳香酸
:一元/二元/多元羧酸
饱和一元羧酸通式:
CnH2n+1COOH 、CnH2nO2
3,4-二甲基戊酸
对甲基苯甲酸
邻羟基苯甲酸
2-丙烯酸
乙二酸
CH2==CH—COOH
HOOC—COOH
命名?
物理性质
⑷熔沸点:随碳原子数的增加,熔沸点逐渐升高。
羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
⑴状态:非气体
⑵气味:强烈刺激性气味
⑶溶解性:甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。 随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。高级脂肪酸是不溶于水的蜡状固体。
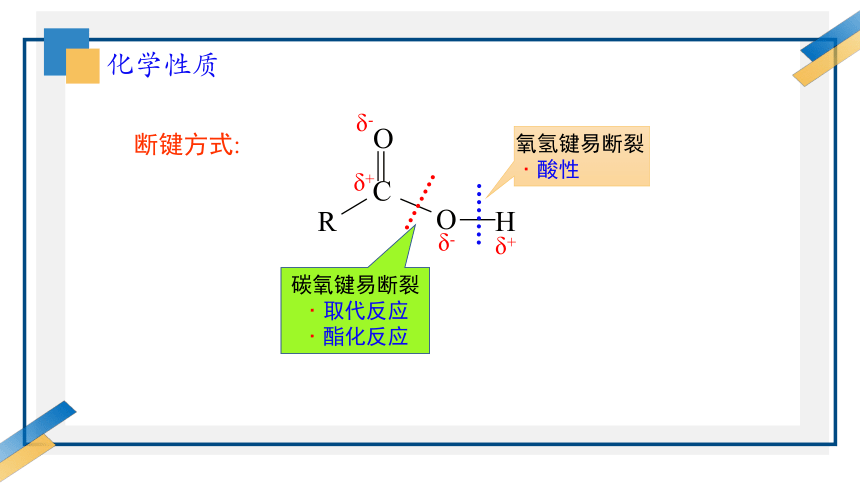
化学性质
断键方式:
C
O
H
R
O
δ-
δ+
碳氧键易断裂
﹒取代反应
﹒酯化反应
氧氢键易断裂
﹒酸性
δ+
δ-
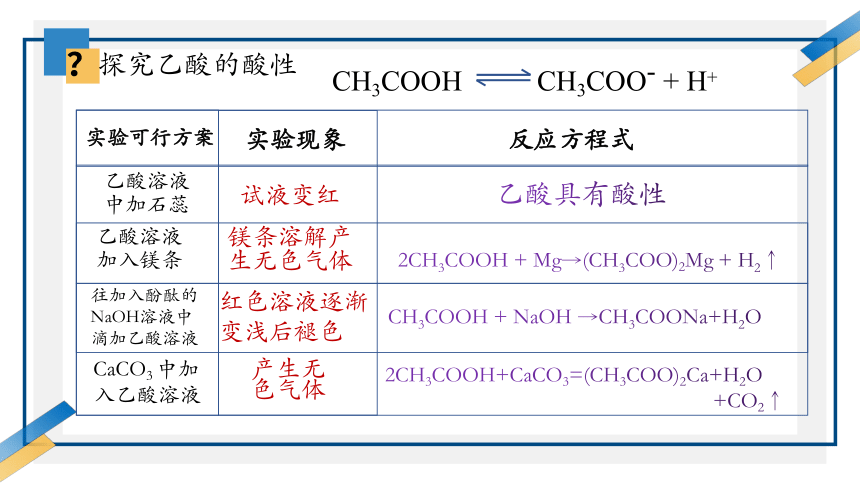
?
探究乙酸的酸性
CH3COOH
CH3COO- + H+
实验可行方案
乙酸溶液
中加石蕊
乙酸溶液
加入镁条
往加入酚酞的NaOH溶液中滴加乙酸溶液
CaCO3 中加入乙酸溶液
实验现象
反应方程式
试液变红
镁条溶解产生无色气体
红色溶液逐渐变浅后褪色
产生无色气体
乙酸具有酸性
2CH3COOH + Mg→(CH3COO)2Mg + H2↑
CH3COOH + NaOH →CH3COONa+H2O
2CH3COOH+CaCO3=(CH3COO)2Ca+H2O
+CO2↑
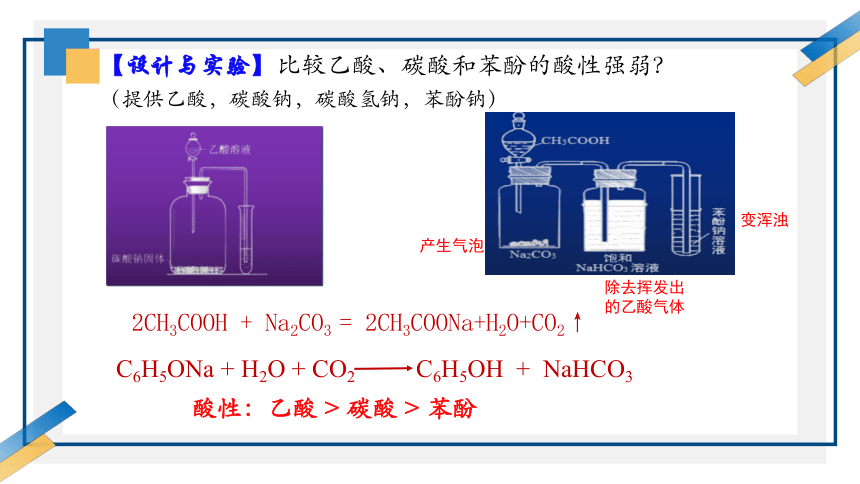
产生气泡
除去挥发出的乙酸气体
变浑浊
2CH3COOH + Na2CO3 = 2CH3COONa+H2O+CO2↑
C6H5ONa + H2O + CO2 C6H5OH + NaHCO3
酸性:乙酸 > 碳酸 > 苯酚
【设计与实验】比较乙酸、碳酸和苯酚的酸性强弱?
(提供乙酸,碳酸钠,碳酸氢钠,苯酚钠)
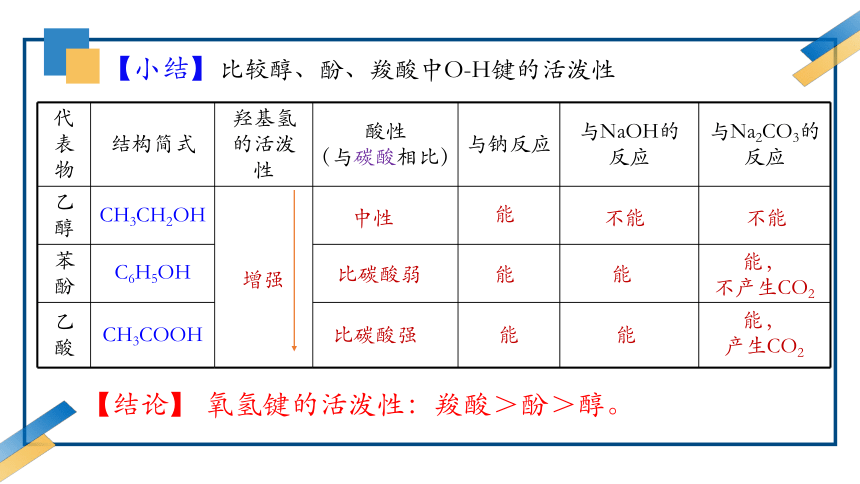
代表物 结构简式 羟基氢的活泼性 酸性 (与碳酸相比) 与钠反应 与NaOH的 反应 与Na2CO3的
反应
乙醇 CH3CH2OH
苯酚 C6H5OH
乙酸 CH3COOH
【小结】比较醇、酚、羧酸中O-H键的活泼性
【结论】 氧氢键的活泼性:羧酸>酚>醇。
增强
中性
比碳酸弱
比碳酸强
能
能
能
不能
能
能
不能
能,
不产生CO2
能,
产生CO2
比较甲酸、乙酸和丙酸的酸性强弱?
名称 甲酸 乙酸 丙酸 苯甲酸
结构简式 HCOOH CH3COOH CH3CH2COOH
溶解度 g·(100gH2O)-1 ∞ ∞ ∞ 0.34
pKa 3.77 4.74 4.88 4.20
酸性:甲酸>乙酸 > 丙酸
(推电子效应)烃基中碳原子数目越多,羧酸酸性越弱:
电负性C例.某有机物A的结构简式为 ,取Na、NaOH、NaHCO3分别与
等物质的量的该物质充分反应(反应时可加热煮沸),则消耗Na、NaOH、NaHCO3三种物质的物质的量之比为( )
A.2∶2∶1 B.1∶1∶1 C.3∶2∶1 D.3∶3∶2
解析:有机物A的分子中含有醇羟基、酚羟基、醛基、羧基;
与钠反应的官能团是酚羟基、羧基、醇羟基;
与NaOH反应的官能团是酚羟基、羧基;
与NaHCO3反应的官能团只有羧基
故消耗Na、NaOH、NaHCO3三种物质的物质的量之比为3∶2∶1。
C
酯化反应可能哪些脱水方式 如何确定
(2)酯化反应
同位素示踪法
乙酸分子中羧基的羟基与乙醇分子中羟基的氢原子结合成水,其余部分相互结合成酯。
现象:饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。
催化剂和脱水剂
导气兼冷凝回流
(乙酸和乙醇)
a、乙酸乙酯在饱和碳酸钠溶液中的溶解度最小,利于分层;
b、乙酸与Na2CO3反应,生成无味的CH3COONa而被除去;
C、C2H5OH被Na2CO3溶液吸收,便于除去乙酸及乙醇气味的干扰。
加碎瓷片防暴沸
乙酸、乙醇、
浓硫酸的混合物
饱和Na2CO3溶液
这个实验产率其实并不高(酯层少),产率包括速率和转化率两个方面,酯化反应是可逆反应,那么我们能否从平衡的角度去改进这套装置,进而提高产率。
根据化学平衡原理,提高乙酸乙酯产率的措施有:
①由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。
②使用过量的乙醇,可提高乙酸转化率。
③使用浓H2SO4作吸水剂,提高反应转化率。
④冷凝回流,提高产率。
酒越陈越香的原因?
乙醇
乙醛
乙酸
乙酸乙酯
醇
醛
酯
羧酸
氧化(O2)
氧化
还原(H2)
(O2、酸性KMnO4溶液、溴水、 新制Cu(OH)2、Ag(NH3)2OH )
酯化反应
酸性
O
—C—O—R
=
O
—C—O—H
=
O
—C—H
=
R—O—H
O
—C—O-
=
1.甲酸-俗称蚁酸
物理性质:无色有强烈刺激性的液体,可与水混溶,也能溶于
乙醇、乙醚等有机溶剂,有毒性。
结构特点:
O
H—C—O—H
醛基
具有醛和羧酸的性质
羧基
用途:在工业上可用作还原剂,也是合成医药、农药和染料等的原料。
2.苯甲酸—俗称安息香酸
苯甲酸是一种无色晶体,易升华,微溶于水,易溶于乙醇,酸性比乙酸强,比甲酸弱。苯甲酸可以用于合成香料、药物等,它的钠盐或钾盐是常用的食品防腐剂。
COOH
3.乙二酸—俗称草酸
COOH
COOH
乙二酸是二元羧酸,无色透明晶体,可溶于水和乙醇。通常以结晶水合物(COOH)2 2H2O形式存在,加热至100℃时失水成无水草酸。常用于化学分析的还原剂,是重要的化工原料。
【化学性质】草酸是最简单的饱和二元羧酸,是二元羧酸中酸性最强的,它具有一些特殊的化学性质。能使酸性高锰酸钾溶液褪色、可作漂白剂。
1.阿魏酸化学名称为4-羟基-3-甲氧基肉桂酸,可以作医药、保健品、化
妆品原料和食品添加剂,结构简式为 。在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团。下列试剂、现象、结论都正确的是
选项 试剂 现象 结论
A 氯化铁溶液 溶液变蓝色 含有酚羟基
B 银氨溶液 产生银镜 含有醛基
C 碳酸氢钠溶液 产生气泡 含有羧基
D 溴水 溶液褪色 含有碳碳双键
C
2.下列将CH3CHO和CH3COOH分离的正确方法是( )
A.蒸馏
B.加入Na2CO3溶液后,通过分液的方法分离
C.加入烧碱溶液后蒸馏出乙醛,再加入浓硫酸,蒸馏出乙酸
D.和Na反应后,通过蒸馏的方法分离
C
【解析】CH3CHO、CH3COOH均溶于水,均易挥发,沸点不同。
A.CH3CHO、CH3COOH均易挥发,直接加热蒸馏不能得到纯净物,故A错误;
B.乙酸能够与碳酸钠反应,产物乙酸钠与乙醛混溶,不能分液分离,故B错误;
C.先加入烧碱溶液,产物乙酸钠与乙醛的沸点差异增大,蒸馏乙醛,再加入浓H2SO4,与乙酸钠反应生成乙酸,蒸出乙酸,故C正确;
D.乙酸与Na反应生成乙酸钠,蒸馏分离得到乙酸钠,需将乙酸钠转化为乙酸,未达到分离目的,故D错误。
3.(2019·重庆市第三十中学高二期中)草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,
易溶于水,受热脱水、升华,170 ℃以上分解。
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是_____________________________,由此可知草酸晶体分解的产物中有____。装置B的主要作
有气泡冒出且澄清石灰水变浑浊
CO2
冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验
(2)设计实验:
①证明草酸的酸性比碳酸的强(简述操作步骤和现象,下同):
②用简单的方法鉴别草酸和甲酸:
向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生
用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量是甲酸的2倍
第四节 羧酸 羧酸衍生物
第1课时 羧酸
1. 能写出羧酸和酯的官能团、乙酸的结构简式和名称
能够列举乙酸和乙酸乙酯的主要物理性质。
2.能描述和分析乙酸、乙酸乙酯的重要反应,书写相应的反应式。
3.能基于官能团、化学键的特点与反应规律分析和推断含有羧基、
酯基官能团的有机化合物的化学性质。根据信息书写相应的反应式。
金刀利,锦鲤肥,更那堪玉葱纤细。
添得____来风韵美,试尝道甚生滋味。
醋
柴米油盐酱___茶
琴棋书画诗酒花
醋
羧酸:由烃基与羧基相连构成的有机化合物。
官能团: 羧基
—C—O—H
O
或 —COOH
分类:
烃基不同
羧基数目
:脂肪酸 芳香酸
:一元/二元/多元羧酸
饱和一元羧酸通式:
CnH2n+1COOH 、CnH2nO2
3,4-二甲基戊酸
对甲基苯甲酸
邻羟基苯甲酸
2-丙烯酸
乙二酸
CH2==CH—COOH
HOOC—COOH
命名?
物理性质
⑷熔沸点:随碳原子数的增加,熔沸点逐渐升高。
羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
⑴状态:非气体
⑵气味:强烈刺激性气味
⑶溶解性:甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。 随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。高级脂肪酸是不溶于水的蜡状固体。
化学性质
断键方式:
C
O
H
R
O
δ-
δ+
碳氧键易断裂
﹒取代反应
﹒酯化反应
氧氢键易断裂
﹒酸性
δ+
δ-
?
探究乙酸的酸性
CH3COOH
CH3COO- + H+
实验可行方案
乙酸溶液
中加石蕊
乙酸溶液
加入镁条
往加入酚酞的NaOH溶液中滴加乙酸溶液
CaCO3 中加入乙酸溶液
实验现象
反应方程式
试液变红
镁条溶解产生无色气体
红色溶液逐渐变浅后褪色
产生无色气体
乙酸具有酸性
2CH3COOH + Mg→(CH3COO)2Mg + H2↑
CH3COOH + NaOH →CH3COONa+H2O
2CH3COOH+CaCO3=(CH3COO)2Ca+H2O
+CO2↑
产生气泡
除去挥发出的乙酸气体
变浑浊
2CH3COOH + Na2CO3 = 2CH3COONa+H2O+CO2↑
C6H5ONa + H2O + CO2 C6H5OH + NaHCO3
酸性:乙酸 > 碳酸 > 苯酚
【设计与实验】比较乙酸、碳酸和苯酚的酸性强弱?
(提供乙酸,碳酸钠,碳酸氢钠,苯酚钠)
代表物 结构简式 羟基氢的活泼性 酸性 (与碳酸相比) 与钠反应 与NaOH的 反应 与Na2CO3的
反应
乙醇 CH3CH2OH
苯酚 C6H5OH
乙酸 CH3COOH
【小结】比较醇、酚、羧酸中O-H键的活泼性
【结论】 氧氢键的活泼性:羧酸>酚>醇。
增强
中性
比碳酸弱
比碳酸强
能
能
能
不能
能
能
不能
能,
不产生CO2
能,
产生CO2
比较甲酸、乙酸和丙酸的酸性强弱?
名称 甲酸 乙酸 丙酸 苯甲酸
结构简式 HCOOH CH3COOH CH3CH2COOH
溶解度 g·(100gH2O)-1 ∞ ∞ ∞ 0.34
pKa 3.77 4.74 4.88 4.20
酸性:甲酸>乙酸 > 丙酸
(推电子效应)烃基中碳原子数目越多,羧酸酸性越弱:
电负性C
等物质的量的该物质充分反应(反应时可加热煮沸),则消耗Na、NaOH、NaHCO3三种物质的物质的量之比为( )
A.2∶2∶1 B.1∶1∶1 C.3∶2∶1 D.3∶3∶2
解析:有机物A的分子中含有醇羟基、酚羟基、醛基、羧基;
与钠反应的官能团是酚羟基、羧基、醇羟基;
与NaOH反应的官能团是酚羟基、羧基;
与NaHCO3反应的官能团只有羧基
故消耗Na、NaOH、NaHCO3三种物质的物质的量之比为3∶2∶1。
C
酯化反应可能哪些脱水方式 如何确定
(2)酯化反应
同位素示踪法
乙酸分子中羧基的羟基与乙醇分子中羟基的氢原子结合成水,其余部分相互结合成酯。
现象:饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。
催化剂和脱水剂
导气兼冷凝回流
(乙酸和乙醇)
a、乙酸乙酯在饱和碳酸钠溶液中的溶解度最小,利于分层;
b、乙酸与Na2CO3反应,生成无味的CH3COONa而被除去;
C、C2H5OH被Na2CO3溶液吸收,便于除去乙酸及乙醇气味的干扰。
加碎瓷片防暴沸
乙酸、乙醇、
浓硫酸的混合物
饱和Na2CO3溶液
这个实验产率其实并不高(酯层少),产率包括速率和转化率两个方面,酯化反应是可逆反应,那么我们能否从平衡的角度去改进这套装置,进而提高产率。
根据化学平衡原理,提高乙酸乙酯产率的措施有:
①由于乙酸乙酯的沸点比乙酸、乙醇都低,因此从反应物中不断蒸出乙酸乙酯可提高其产率。
②使用过量的乙醇,可提高乙酸转化率。
③使用浓H2SO4作吸水剂,提高反应转化率。
④冷凝回流,提高产率。
酒越陈越香的原因?
乙醇
乙醛
乙酸
乙酸乙酯
醇
醛
酯
羧酸
氧化(O2)
氧化
还原(H2)
(O2、酸性KMnO4溶液、溴水、 新制Cu(OH)2、Ag(NH3)2OH )
酯化反应
酸性
O
—C—O—R
=
O
—C—O—H
=
O
—C—H
=
R—O—H
O
—C—O-
=
1.甲酸-俗称蚁酸
物理性质:无色有强烈刺激性的液体,可与水混溶,也能溶于
乙醇、乙醚等有机溶剂,有毒性。
结构特点:
O
H—C—O—H
醛基
具有醛和羧酸的性质
羧基
用途:在工业上可用作还原剂,也是合成医药、农药和染料等的原料。
2.苯甲酸—俗称安息香酸
苯甲酸是一种无色晶体,易升华,微溶于水,易溶于乙醇,酸性比乙酸强,比甲酸弱。苯甲酸可以用于合成香料、药物等,它的钠盐或钾盐是常用的食品防腐剂。
COOH
3.乙二酸—俗称草酸
COOH
COOH
乙二酸是二元羧酸,无色透明晶体,可溶于水和乙醇。通常以结晶水合物(COOH)2 2H2O形式存在,加热至100℃时失水成无水草酸。常用于化学分析的还原剂,是重要的化工原料。
【化学性质】草酸是最简单的饱和二元羧酸,是二元羧酸中酸性最强的,它具有一些特殊的化学性质。能使酸性高锰酸钾溶液褪色、可作漂白剂。
1.阿魏酸化学名称为4-羟基-3-甲氧基肉桂酸,可以作医药、保健品、化
妆品原料和食品添加剂,结构简式为 。在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团。下列试剂、现象、结论都正确的是
选项 试剂 现象 结论
A 氯化铁溶液 溶液变蓝色 含有酚羟基
B 银氨溶液 产生银镜 含有醛基
C 碳酸氢钠溶液 产生气泡 含有羧基
D 溴水 溶液褪色 含有碳碳双键
C
2.下列将CH3CHO和CH3COOH分离的正确方法是( )
A.蒸馏
B.加入Na2CO3溶液后,通过分液的方法分离
C.加入烧碱溶液后蒸馏出乙醛,再加入浓硫酸,蒸馏出乙酸
D.和Na反应后,通过蒸馏的方法分离
C
【解析】CH3CHO、CH3COOH均溶于水,均易挥发,沸点不同。
A.CH3CHO、CH3COOH均易挥发,直接加热蒸馏不能得到纯净物,故A错误;
B.乙酸能够与碳酸钠反应,产物乙酸钠与乙醛混溶,不能分液分离,故B错误;
C.先加入烧碱溶液,产物乙酸钠与乙醛的沸点差异增大,蒸馏乙醛,再加入浓H2SO4,与乙酸钠反应生成乙酸,蒸出乙酸,故C正确;
D.乙酸与Na反应生成乙酸钠,蒸馏分离得到乙酸钠,需将乙酸钠转化为乙酸,未达到分离目的,故D错误。
3.(2019·重庆市第三十中学高二期中)草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,
易溶于水,受热脱水、升华,170 ℃以上分解。
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是_____________________________,由此可知草酸晶体分解的产物中有____。装置B的主要作
有气泡冒出且澄清石灰水变浑浊
CO2
冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验
(2)设计实验:
①证明草酸的酸性比碳酸的强(简述操作步骤和现象,下同):
②用简单的方法鉴别草酸和甲酸:
向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生
用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量是甲酸的2倍
