初中科学2023年中考复习专题十二 金属(含答案)
文档属性
| 名称 | 初中科学2023年中考复习专题十二 金属(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 236.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
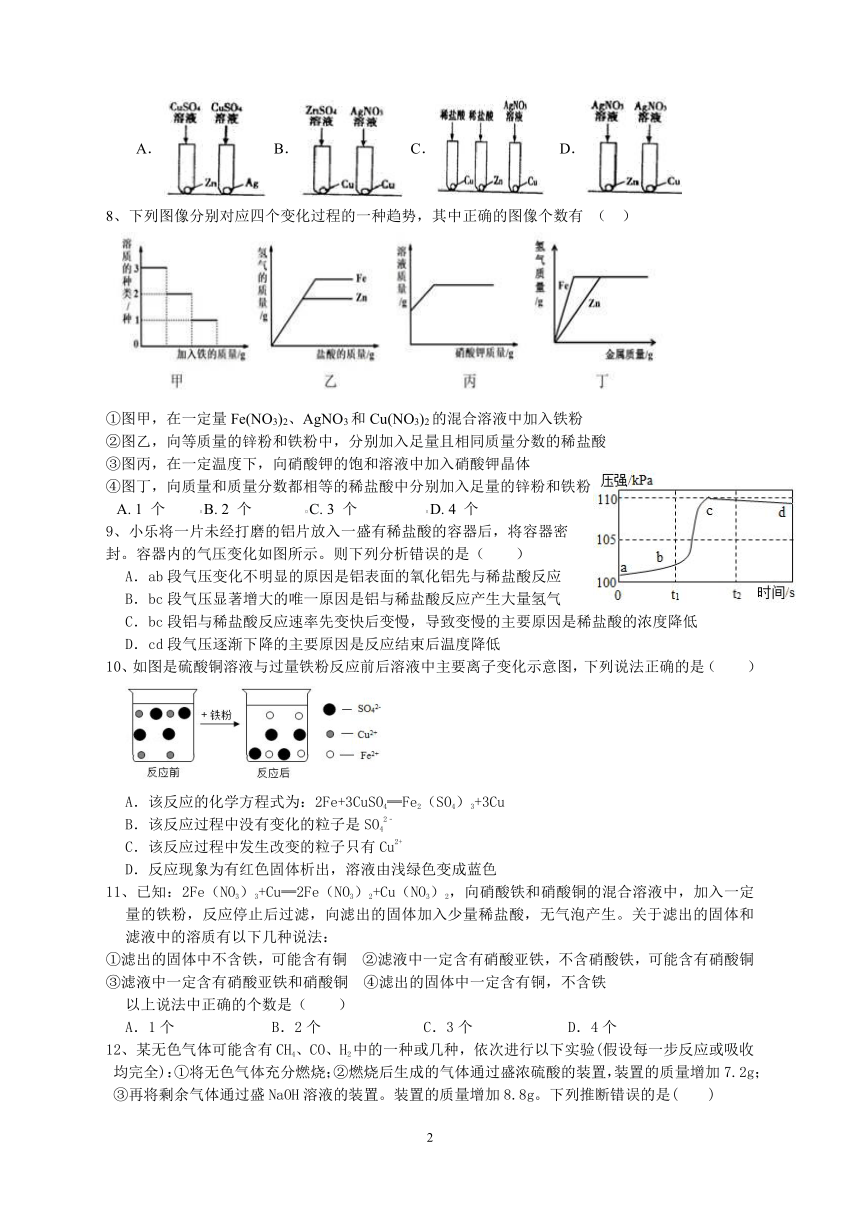
| 科目 | 科学 | ||
| 更新时间 | 2023-04-03 22:43:35 | ||
图片预览


文档简介
初中科学2023年中考复习专题十二:金属
一、选择题
1、某电镀厂的电镀液中含有金盐,为了回收其中的金元素,技术人员制作了如图的“吸金球”,“吸金球”是装入一些“吸金”物质的纱袋,把“吸金球”浸入电镀液,能“吸”出盐溶液中的金。据上所述,“吸金球”中的“吸金”物质可能是 ( )
A.活性炭(C)
B.磁石(主要成分是Fe3O4)
C.铁屑(Fe)
D.胆矾(CuSO4·5H2O)
2、有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z表面没有变化。根据以上事实,判断这三种金属的活动性由强到弱的顺序为 ( )
A.Z、Y、X B.Y、X、Z C.X、Y、Z D.Z、X、Y
3、如图是铁与其他物质之间的性质关系(“—”表示相连物质间
能发生反应,“→”表示两种物质间的转化关系,部分物质和反应
条件已略去),下列有关说法正确的是 ( )
A.变化①的过程中,固体的质量逐渐减少
B.变化②中可滴加NaCl判断过量的AgNO3
C.变化③可通过细铁丝在空气中燃烧实现
D.变化④可能是:2Fe+6HCl=2FeCl3+3H2↑
4、某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系(如图所示)。下列说法不正确的是 ( )
A.当溶液溶质为1种时,金属单质可能为1种
B.从m1变化到m2,溶液中Cu(NO3)2的质量分数变大
C.Cu活动性比Ag强,只用盐酸无法比较两者活动性强弱
D.c~d间(不含c、d两点)的溶液中金属离子为Cu2+、Zn2+
5、右图为氢气还原氧化铜的实验装置图,下列有关分析正确的是( )
A﹒装置中试管口需略向下倾斜,主要是为了利于通入氢气
B﹒在给试管内药品加热前,需先通氢气排尽试管内的空气
C﹒待药品完全反应后,需同时撤去酒精灯和通氢气的导管
D﹒该实验装置也可直接用于一氧化碳还原氧化铜的实验
6、不纯的锌 6 克(含杂质金属 M)和不纯的铁 6 克(含杂质金属 N)。当它们分别跟足量的稀硫酸反应至不再有氢气产生,得到的氢气都是 0.2 克,则 M、N 可能是( )
A. M为Mg,N为Cu B.M为Fe,N为Al
C.M为Al,N为Mg D.M为Cu,N为Mg
7、某化学兴趣小组,为了探究Ag、Zn、Cu三种金属活动性顺序,设计了如图所示的4种实验方案,请你判断其中不能达到目的是( )
A. B. C. D.
8、下列图像分别对应四个变化过程的一种趋势,其中正确的图像个数有 ( )
①图甲,在一定量Fe(NO3)2、AgNO3和Cu(NO3)2的混合溶液中加入铁粉
②图乙,向等质量的锌粉和铁粉中,分别加入足量且相同质量分数的稀盐酸
③图丙,在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
④图丁,向质量和质量分数都相等的稀盐酸中分别加入足量的锌粉和铁粉
A. 1 个 B. 2 个 C. 3 个 D. 4 个
9、小乐将一片未经打磨的铝片放入一盛有稀盐酸的容器后,将容器密
封。容器内的气压变化如图所示。则下列分析错误的是( )
A.ab段气压变化不明显的原因是铝表面的氧化铝先与稀盐酸反应
B.bc段气压显著增大的唯一原因是铝与稀盐酸反应产生大量氢气
C.bc段铝与稀盐酸反应速率先变快后变慢,导致变慢的主要原因是稀盐酸的浓度降低
D.cd段气压逐渐下降的主要原因是反应结束后温度降低
10、如图是硫酸铜溶液与过量铁粉反应前后溶液中主要离子变化示意图,下列说法正确的是( )
A.该反应的化学方程式为:2Fe+3CuSO4═Fe2(SO4)3+3Cu
B.该反应过程中没有变化的粒子是SO42﹣
C.该反应过程中发生改变的粒子只有Cu2+
D.反应现象为有红色固体析出,溶液由浅绿色变成蓝色
11、已知:2Fe(NO3)3+Cu═2Fe(NO3)2+Cu(NO3)2,向硝酸铁和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,向滤出的固体加入少量稀盐酸,无气泡产生。关于滤出的固体和滤液中的溶质有以下几种说法:
①滤出的固体中不含铁,可能含有铜 ②滤液中一定含有硝酸亚铁,不含硝酸铁,可能含有硝酸铜③滤液中一定含有硝酸亚铁和硝酸铜 ④滤出的固体中一定含有铜,不含铁
以上说法中正确的个数是( )
A.1个 B.2个 C.3个 D.4个
某无色气体可能含有CH4、CO、H2中的一种或几种,依次进行以下实验(假设每一步反应或吸收
均完全):①将无色气体充分燃烧;②燃烧后生成的气体通过盛浓硫酸的装置,装置的质量增加7.2g;③再将剩余气体通过盛NaOH溶液的装置。装置的质量增加8.8g。下列推断错误的是( )
A. 原无色气体中可能只含H2和CH4 B. 原无色气体中可能只含CH4
C. 原无色气体中可能只含CO和H2 D. 原无色气体中一定含有碳元素、氢元素
13、建立模型是科学学习中常用的方法。向等质量的锌粉和铁粉中,分别加入相同质量分数的稀硫酸。下列模型能正确反映实验中产生氢气质量与加入硫酸质量之间关系的是( )
A.B.C. D.
14、向盛有10g质量分数为49%稀硫酸的烧杯中加入5.6g的铁粉,充分反应后有固体残留,t1时迅
速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示。分析错误的是( )
A.a→b点,溶液的pH逐渐增大 B.取b点时的溶液,加入锌粉,无气泡放出
C.c点时,溶液中有两种溶质 D.d点固体,加入盐酸有气泡产生
15、.在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液, 充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )
A.所加溶液质量为M1g时,生成Cu的质量为m1g
B.bc段发生的是Cu和AgNO3溶液的反应
C.m3的值为21.6
D.e点溶液中不含Cu(NO3)2
二、填空题
16、地铁是以地下运行为主的城市轨道交通系统,地铁建设中各种材料被广泛应用。
(1)锰钢主要成分是铁、锰、碳,主要用于制造钢轨、挖掘机铲斗等,锰钢属于 (填“纯净物”或“混合物”)。
(2)在钢轨上喷涂防锈涂料,可防止钢轨生锈。该防锈方法的原理是 。
(3)地铁中常用氢氧化镁作为阻燃材料,氢氧化镁不溶于水,可用海水中提取的氯化镁与熟石灰在溶液中反应制取,该制取反应的化学方程式是 。
17、小丽在探究金属化学性质时,做了如图甲、乙所示的实验。
(1)图甲是向滤液中加入稀盐酸,产生白色沉淀,滤渣中一定含有的金属是 。
(2)图乙是向滤渣中加入稀盐酸,产生无色气体,滤液中一定含有的溶质为 。
18、据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费
和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、
Pd(钯,银白色)。如图是某工厂回收其中部分金属的流程图。(假设流程图中各反应均恰好
完全反应。已知:2Cu+O2+2H2SO42CuSO4+2H2O)
(1)步骤②中产生的气体是 。
(2)滤渣2中含有的金属是 。
(3)步骤⑤反应的化学方程式 。
(4)步骤⑥回收的纯净物B是 (写化学式)。
(5)金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是 。
三、实验探究题
19、还原性铁粉在潮湿的空气中容易生锈。现有m1 g生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理)。
(1)装置A中反应的化学方程式是 。
(2)某同学欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数。B中的最佳试剂是 (填序号),实验时B中反应的化学方程式是 。
① 澄清石灰水 ② 氢氧化钠浓溶液 ③ 稀盐酸 ④ 水
(3)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:① 实验开始时,排尽装置中的空气,防止加热时发生爆炸;② 停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③ 。
(4)完全反应后,甲同学称得铁粉的质量为m2 g,同时测得装置B增重m3 g,则铁粉样品中氧化铁的质量分数为 。
四、分析计算题
20、某科学小组的同学们对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成。他们取了7.2g固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示。
请计算:
(1)该样品中铁粉的质量分数。(计算结果精确到0.1%)
(2)该样品中铁元素与氧元素的质量比。
21、为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数进行如下实验:
①取200g混合溶液加人足量的AgNO3溶液,经过滤洗涤、干燥、称量得到143.5gAgCl固体;21cnkxtj2008
②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别 一 二 三 四 五
混合溶液质量/g 200 200 200 200 200
铁屑质量/g 6 9 12 15 18
析出铜的质量/g 6.4 9.6 m 16 16
请分析计算:
(1)表中第三组实验的m值为 。
(2)第 组实验恰好完全反应。21cnkxtj2008
(3)铁屑中铁的质量分数为多少? (计算结果精确到0.1%)
(4)原混合溶液中FeCl2的质量分数为多少?(计算结果精确到0.1%)
参考答案
选择题
C 2、C 3、B 4、A 5、b 6、A 7、D 8、C 9、B 10、B 11、B 12、D
A 14、A 15、C
填空题
混合物;隔绝氧气和水;MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;
(1)银;(2)硝酸锌
18、(1):过滤。(2):Fe2+。(3):Cu、Ag。
(4):Fe+NiSO4═FeSO4+Ni或Fe+H2SO4═FeSO4+H2↑。(5):Ni、Cu、Ag。
19、(1)3CO + Fe2O32Fe + 3CO2 (2)② CO2+2NaOH= Na2CO3 + H2O
(3)将装置中的CO2送入NaOH溶液中。
(4)10(m1-m2) / 3m1或 40 m3/33 m1
20、【方法1】解:设氧化铁的质量为x。
3CO + Fe2O3 2Fe + 3CO2 固体减重
160 112 48
x (7.2 g-6 g)
=
x=4g
Fe%==44.4%
【方法2】固体减重:7.2 g-6g==1.2g
即为氧化铁中氧元素的质量,则氧化铁的质量为 1.2g÷=4g
Fe%==44.4%
(2)Fe元素总质量:(7.2 g-4 g)+4g×=6g
O元素总质量:4g×=1.2g
m(Fe):m(0)=6g:1.2g=5:1
21、 (1) 12.8
(2)四21cnkxtj2008
(3)解:设参加反应的铁的质量为a
Fe+CuCl2 == Cu+FeCl2
56 64
a 16g
Fe% = × 100% = ×100% = 93.3%
答:铁屑中铁的质量分数为93.3%.
(4)解:设参加反应的氧化铜的质量为x,生成氯化银的质量为y,参加反应的氯化亚铁的质量为z。21cnkxtj2008
Fe + CuCl2 == Cu + FeCl2
135 64
x 16g
x=71.75g
2AgNO3 + CuCl2 == Cu(NO3)2 + 2AgC1↓
135 287
33.75g y
y=31.75g
m=m总-m1=143.5g-71.75g=71.75g
2AgNO3 + FeCl2 == Fe(NO3)2 +2AgC1↓
127 287
z 71.75g
z=31.75g
FeCl2% = = ×100% = 15.9%
答:原混合溶液中FeCl;的质量分数为15.9%。
一、选择题
1、某电镀厂的电镀液中含有金盐,为了回收其中的金元素,技术人员制作了如图的“吸金球”,“吸金球”是装入一些“吸金”物质的纱袋,把“吸金球”浸入电镀液,能“吸”出盐溶液中的金。据上所述,“吸金球”中的“吸金”物质可能是 ( )
A.活性炭(C)
B.磁石(主要成分是Fe3O4)
C.铁屑(Fe)
D.胆矾(CuSO4·5H2O)
2、有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z表面没有变化。根据以上事实,判断这三种金属的活动性由强到弱的顺序为 ( )
A.Z、Y、X B.Y、X、Z C.X、Y、Z D.Z、X、Y
3、如图是铁与其他物质之间的性质关系(“—”表示相连物质间
能发生反应,“→”表示两种物质间的转化关系,部分物质和反应
条件已略去),下列有关说法正确的是 ( )
A.变化①的过程中,固体的质量逐渐减少
B.变化②中可滴加NaCl判断过量的AgNO3
C.变化③可通过细铁丝在空气中燃烧实现
D.变化④可能是:2Fe+6HCl=2FeCl3+3H2↑
4、某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系(如图所示)。下列说法不正确的是 ( )
A.当溶液溶质为1种时,金属单质可能为1种
B.从m1变化到m2,溶液中Cu(NO3)2的质量分数变大
C.Cu活动性比Ag强,只用盐酸无法比较两者活动性强弱
D.c~d间(不含c、d两点)的溶液中金属离子为Cu2+、Zn2+
5、右图为氢气还原氧化铜的实验装置图,下列有关分析正确的是( )
A﹒装置中试管口需略向下倾斜,主要是为了利于通入氢气
B﹒在给试管内药品加热前,需先通氢气排尽试管内的空气
C﹒待药品完全反应后,需同时撤去酒精灯和通氢气的导管
D﹒该实验装置也可直接用于一氧化碳还原氧化铜的实验
6、不纯的锌 6 克(含杂质金属 M)和不纯的铁 6 克(含杂质金属 N)。当它们分别跟足量的稀硫酸反应至不再有氢气产生,得到的氢气都是 0.2 克,则 M、N 可能是( )
A. M为Mg,N为Cu B.M为Fe,N为Al
C.M为Al,N为Mg D.M为Cu,N为Mg
7、某化学兴趣小组,为了探究Ag、Zn、Cu三种金属活动性顺序,设计了如图所示的4种实验方案,请你判断其中不能达到目的是( )
A. B. C. D.
8、下列图像分别对应四个变化过程的一种趋势,其中正确的图像个数有 ( )
①图甲,在一定量Fe(NO3)2、AgNO3和Cu(NO3)2的混合溶液中加入铁粉
②图乙,向等质量的锌粉和铁粉中,分别加入足量且相同质量分数的稀盐酸
③图丙,在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
④图丁,向质量和质量分数都相等的稀盐酸中分别加入足量的锌粉和铁粉
A. 1 个 B. 2 个 C. 3 个 D. 4 个
9、小乐将一片未经打磨的铝片放入一盛有稀盐酸的容器后,将容器密
封。容器内的气压变化如图所示。则下列分析错误的是( )
A.ab段气压变化不明显的原因是铝表面的氧化铝先与稀盐酸反应
B.bc段气压显著增大的唯一原因是铝与稀盐酸反应产生大量氢气
C.bc段铝与稀盐酸反应速率先变快后变慢,导致变慢的主要原因是稀盐酸的浓度降低
D.cd段气压逐渐下降的主要原因是反应结束后温度降低
10、如图是硫酸铜溶液与过量铁粉反应前后溶液中主要离子变化示意图,下列说法正确的是( )
A.该反应的化学方程式为:2Fe+3CuSO4═Fe2(SO4)3+3Cu
B.该反应过程中没有变化的粒子是SO42﹣
C.该反应过程中发生改变的粒子只有Cu2+
D.反应现象为有红色固体析出,溶液由浅绿色变成蓝色
11、已知:2Fe(NO3)3+Cu═2Fe(NO3)2+Cu(NO3)2,向硝酸铁和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,向滤出的固体加入少量稀盐酸,无气泡产生。关于滤出的固体和滤液中的溶质有以下几种说法:
①滤出的固体中不含铁,可能含有铜 ②滤液中一定含有硝酸亚铁,不含硝酸铁,可能含有硝酸铜③滤液中一定含有硝酸亚铁和硝酸铜 ④滤出的固体中一定含有铜,不含铁
以上说法中正确的个数是( )
A.1个 B.2个 C.3个 D.4个
某无色气体可能含有CH4、CO、H2中的一种或几种,依次进行以下实验(假设每一步反应或吸收
均完全):①将无色气体充分燃烧;②燃烧后生成的气体通过盛浓硫酸的装置,装置的质量增加7.2g;③再将剩余气体通过盛NaOH溶液的装置。装置的质量增加8.8g。下列推断错误的是( )
A. 原无色气体中可能只含H2和CH4 B. 原无色气体中可能只含CH4
C. 原无色气体中可能只含CO和H2 D. 原无色气体中一定含有碳元素、氢元素
13、建立模型是科学学习中常用的方法。向等质量的锌粉和铁粉中,分别加入相同质量分数的稀硫酸。下列模型能正确反映实验中产生氢气质量与加入硫酸质量之间关系的是( )
A.B.C. D.
14、向盛有10g质量分数为49%稀硫酸的烧杯中加入5.6g的铁粉,充分反应后有固体残留,t1时迅
速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示。分析错误的是( )
A.a→b点,溶液的pH逐渐增大 B.取b点时的溶液,加入锌粉,无气泡放出
C.c点时,溶液中有两种溶质 D.d点固体,加入盐酸有气泡产生
15、.在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液, 充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )
A.所加溶液质量为M1g时,生成Cu的质量为m1g
B.bc段发生的是Cu和AgNO3溶液的反应
C.m3的值为21.6
D.e点溶液中不含Cu(NO3)2
二、填空题
16、地铁是以地下运行为主的城市轨道交通系统,地铁建设中各种材料被广泛应用。
(1)锰钢主要成分是铁、锰、碳,主要用于制造钢轨、挖掘机铲斗等,锰钢属于 (填“纯净物”或“混合物”)。
(2)在钢轨上喷涂防锈涂料,可防止钢轨生锈。该防锈方法的原理是 。
(3)地铁中常用氢氧化镁作为阻燃材料,氢氧化镁不溶于水,可用海水中提取的氯化镁与熟石灰在溶液中反应制取,该制取反应的化学方程式是 。
17、小丽在探究金属化学性质时,做了如图甲、乙所示的实验。
(1)图甲是向滤液中加入稀盐酸,产生白色沉淀,滤渣中一定含有的金属是 。
(2)图乙是向滤渣中加入稀盐酸,产生无色气体,滤液中一定含有的溶质为 。
18、据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费
和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、
Pd(钯,银白色)。如图是某工厂回收其中部分金属的流程图。(假设流程图中各反应均恰好
完全反应。已知:2Cu+O2+2H2SO42CuSO4+2H2O)
(1)步骤②中产生的气体是 。
(2)滤渣2中含有的金属是 。
(3)步骤⑤反应的化学方程式 。
(4)步骤⑥回收的纯净物B是 (写化学式)。
(5)金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是 。
三、实验探究题
19、还原性铁粉在潮湿的空气中容易生锈。现有m1 g生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理)。
(1)装置A中反应的化学方程式是 。
(2)某同学欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数。B中的最佳试剂是 (填序号),实验时B中反应的化学方程式是 。
① 澄清石灰水 ② 氢氧化钠浓溶液 ③ 稀盐酸 ④ 水
(3)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:① 实验开始时,排尽装置中的空气,防止加热时发生爆炸;② 停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③ 。
(4)完全反应后,甲同学称得铁粉的质量为m2 g,同时测得装置B增重m3 g,则铁粉样品中氧化铁的质量分数为 。
四、分析计算题
20、某科学小组的同学们对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成。他们取了7.2g固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示。
请计算:
(1)该样品中铁粉的质量分数。(计算结果精确到0.1%)
(2)该样品中铁元素与氧元素的质量比。
21、为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数进行如下实验:
①取200g混合溶液加人足量的AgNO3溶液,经过滤洗涤、干燥、称量得到143.5gAgCl固体;21cnkxtj2008
②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别 一 二 三 四 五
混合溶液质量/g 200 200 200 200 200
铁屑质量/g 6 9 12 15 18
析出铜的质量/g 6.4 9.6 m 16 16
请分析计算:
(1)表中第三组实验的m值为 。
(2)第 组实验恰好完全反应。21cnkxtj2008
(3)铁屑中铁的质量分数为多少? (计算结果精确到0.1%)
(4)原混合溶液中FeCl2的质量分数为多少?(计算结果精确到0.1%)
参考答案
选择题
C 2、C 3、B 4、A 5、b 6、A 7、D 8、C 9、B 10、B 11、B 12、D
A 14、A 15、C
填空题
混合物;隔绝氧气和水;MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;
(1)银;(2)硝酸锌
18、(1):过滤。(2):Fe2+。(3):Cu、Ag。
(4):Fe+NiSO4═FeSO4+Ni或Fe+H2SO4═FeSO4+H2↑。(5):Ni、Cu、Ag。
19、(1)3CO + Fe2O32Fe + 3CO2 (2)② CO2+2NaOH= Na2CO3 + H2O
(3)将装置中的CO2送入NaOH溶液中。
(4)10(m1-m2) / 3m1或 40 m3/33 m1
20、【方法1】解:设氧化铁的质量为x。
3CO + Fe2O3 2Fe + 3CO2 固体减重
160 112 48
x (7.2 g-6 g)
=
x=4g
Fe%==44.4%
【方法2】固体减重:7.2 g-6g==1.2g
即为氧化铁中氧元素的质量,则氧化铁的质量为 1.2g÷=4g
Fe%==44.4%
(2)Fe元素总质量:(7.2 g-4 g)+4g×=6g
O元素总质量:4g×=1.2g
m(Fe):m(0)=6g:1.2g=5:1
21、 (1) 12.8
(2)四21cnkxtj2008
(3)解:设参加反应的铁的质量为a
Fe+CuCl2 == Cu+FeCl2
56 64
a 16g
Fe% = × 100% = ×100% = 93.3%
答:铁屑中铁的质量分数为93.3%.
(4)解:设参加反应的氧化铜的质量为x,生成氯化银的质量为y,参加反应的氯化亚铁的质量为z。21cnkxtj2008
Fe + CuCl2 == Cu + FeCl2
135 64
x 16g
x=71.75g
2AgNO3 + CuCl2 == Cu(NO3)2 + 2AgC1↓
135 287
33.75g y
y=31.75g
m=m总-m1=143.5g-71.75g=71.75g
2AgNO3 + FeCl2 == Fe(NO3)2 +2AgC1↓
127 287
z 71.75g
z=31.75g
FeCl2% = = ×100% = 15.9%
答:原混合溶液中FeCl;的质量分数为15.9%。
