东北师大附中 高中化学人教选修四 教学课件:第四章第三节 电解池(实验班提高用)
文档属性
| 名称 | 东北师大附中 高中化学人教选修四 教学课件:第四章第三节 电解池(实验班提高用) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-05-13 00:00:00 | ||
图片预览






文档简介
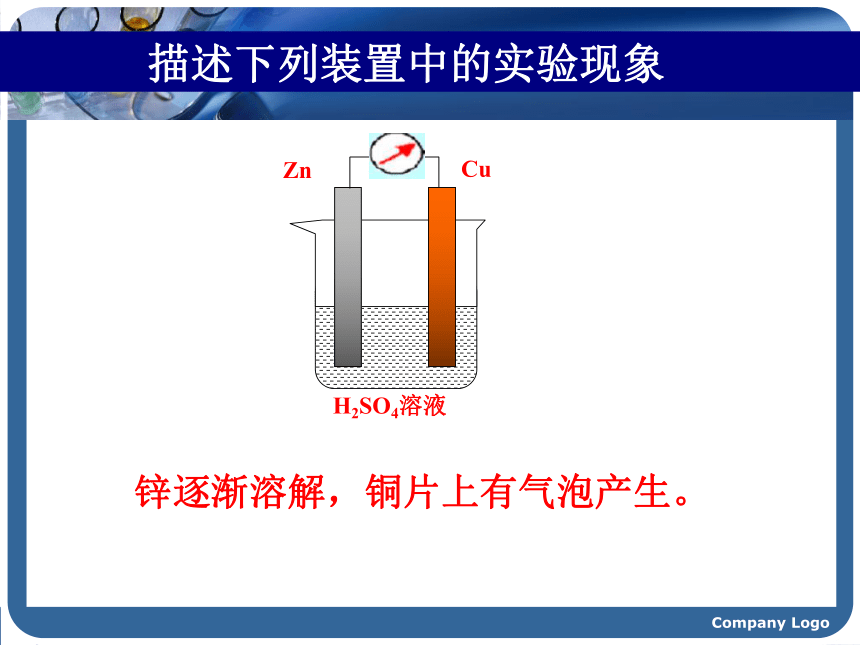
课件48张PPT。Company Logo化学故事 “1799年,当意大利人发明了最原始的电池——伏打电池之后,许多科学家对电产生了浓厚的兴趣,电给世界带来了太多的不可思议,好奇心驱使着人们去进行各种尝试,想看看它还能否出现什么奇特的现象。
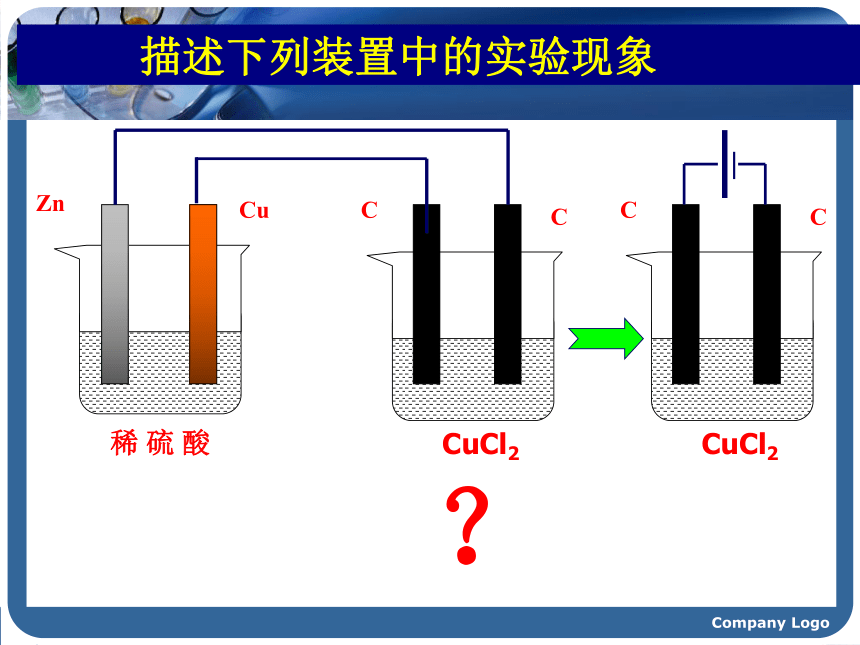
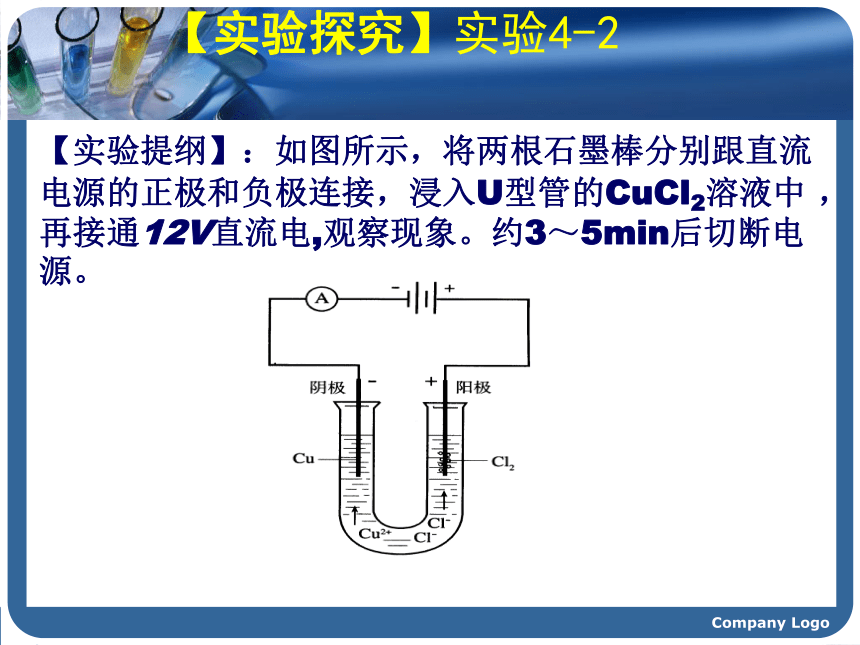
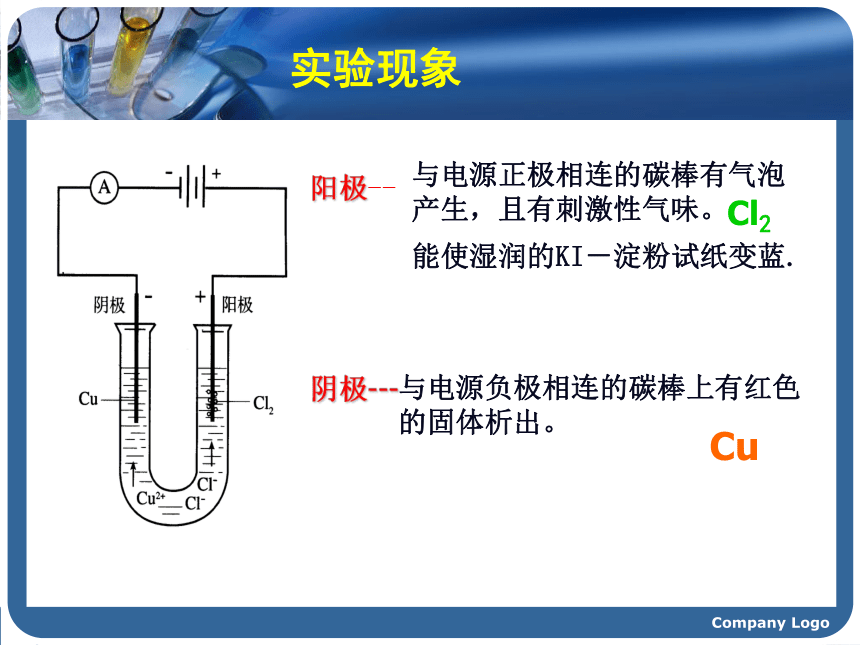
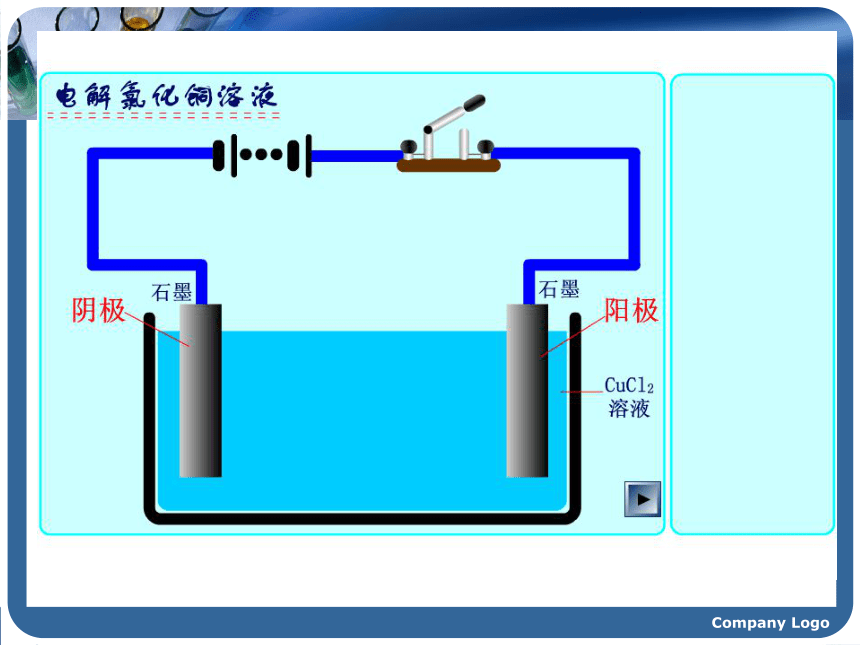
1807年,当英国化学家戴维将铂电极插入熔融的氢氧化钾并接通直流电源时,奇迹终于发生了!在阴极附近产生一种银白色的金属,随即形成紫色的火焰。这就是发现钾元素的主要过程,当时在社会上引起了轰动。他随后用电解法又相继发现了钠、钙、锶、钡、镁、硼、硅等元素,戴维成为发现化学元素最多的人。这其中的奥妙是什么呢?电解时,物质的变化是如何发生的呢?……” Company Logo 描述下列装置中的实验现象锌逐渐溶解,铜片上有气泡产生。Company Logo 稀 硫 酸ZnCu 描述下列装置中的实验现象CCCuCl2?Company Logo【实验提纲】:如图所示,将两根石墨棒分别跟直流电源的正极和负极连接,浸入U型管的CuCl2溶液中 ,再接通12V直流电,观察现象。约3~5min后切断电源。【实验探究】实验4-2Company Logo实验现象 阳极--与电源正极相连的碳棒有气泡产生,且有刺激性气味。与电源负极相连的碳棒上有红色的固体析出。阴极--- Cl2Cu 能使湿润的KI-淀粉试纸变蓝.Company Logo想一想: CuCl2溶液在电流的作用下为什么会生成Cu和Cl2呢? Company Logo【合作交流】问题1:通电前,氯化铜溶液中含有哪些微粒?
问题2:在通电时这些微粒各向什么区移动?
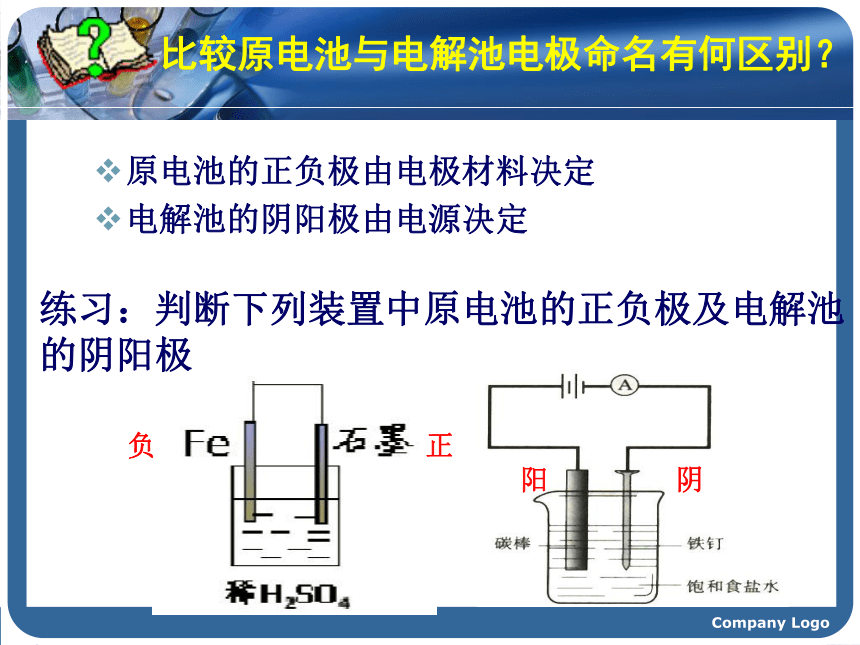
问题3:通电后在阳极和阴极各会发生什么样的电极反应?Company Logo第三节 电解池(1)东北师大附中 周西柳Company Logo1.电解: 使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的过程,叫做电解。一、电解原理2.电解池:电能转为化学的装置。Company Logo3.构成电解池的条件:①直流电源;与电源负极相连的电极为阴极与电源正极相连的电极为阳极②阴、阳电极③电解质溶液或熔融电解质;④形成闭合回路Company Logo 比较原电池与电解池电极命名有何区别?原电池的正负极由电极材料决定
电解池的阴阳极由电源决定练习:判断下列装置中原电池的正负极及电解池的阴阳极负正阳阴Company Logo练习:判断下列装置中原电池的正负极及电解池的阴阳极。负正阳阴Company LogoCu2+oooooooooooooooooooo? - +- +阴极阳极CuCl2电解氯化铜溶液实验装置e-e-单击电子流动4.电解池中电子的移动方向 负极阴极阳离子正极阳极阴离子Company Logo5、电解本质:阳极——发生氧化反应
阴极——发生还原反应 Company Logo(1)放电:6.电解质在水溶液中放电规律(2)影响离子放电的因素:阴、阳离子得失电子的过程叫放电。Company Logo ①活性材料作电极时:
金属在阳极失电子被氧化成阳离子进入溶液,阴离子不容易在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由难到易)是: 金属电极> S 2->SO32->I ->Br ->Cl ->OH ->(含氧酸根离子)>F-(3)阳极的放电顺序:Company Logo Ag+>Fe3+ >Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+> Al3+>Mg2+>Na+>Ca+>K+
(前提:离子浓度近似相等时)
无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子在阴极上放电顺序是:(4)阴极的放电顺序:Company Logo(包括水的电离,并分 成阳离子组和阴离子组)②明确溶液中存在哪些离子③判断阴阳离子的放电顺序④根据阳极氧化,阴极还原完成电极反应式书写电极反应式及总方程式的方法小结①判断电极材料掌握方法
事半功倍哟!(注意得失电子守恒)⑤由阴阳两电极反应式,合并得总反应式(弱电解质的须保持分子形式)
Company LogoCuCuFeCuCuSO4溶液稀硫酸溶液思考: 下列两个电解池的电极反应式。阳极阴极Cu - 2e- = Cu2 + Cu2+ + 2e- = CuCu - 2e- = Cu2 + 2H+ + 2e- = H2 ↑Company Logo(1)惰性电极:(只考虑溶液中离子放电)
阴极:阳离子还原
阳极:阴离子氧化
(2)活泼电极:阳极为金属(除Pt、Au)
阴极:阳离子还原
阳极:构成阳极的金属发生氧化反应
7.电极反应式的书写Company Logo [例]以石墨碳棒为电极,请写出电解下列溶液时,在阴、阳两极上发生的电极反应式及总的化学方程式。
CuSO4溶液:
想一想、做一做 阳极:4OH--4e-=2H2O+O2↑ 或(4H2O 4H++4OH-)
阴极:2Cu2+ +4e-=2Cu 电解总反应式:2Cu2++2H2O= 2Cu+O2↑+4H+想一想,H+应该在哪一极生成?Company Logo [例]以石墨碳棒为电极,请写出电解NaCl溶液时,在阴、阳两极上发生的电极反应式及总的化学方程式。 想一想、做一做阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2↑ 或(2H2O 2H++2OH-)总反应方程式:2Cl-+2H2O == Cl2↑+H2↑+2OH- 电解OH-在哪一极?Company Logo1.已知A、B、C是三种金属,满足:
①将A和B浸在稀硫酸溶液中用导线相连,A上有气泡产生,B逐步溶解;
②用惰性电极电解物质的量浓度相同的A、C的硝酸盐混合溶液时,阴极上先析出C。
根据下列①②两个实验,确定它们的还原性强弱顺序为 。
B>A>C 习题巩固Company Logo2.在水中加入等物质的量的Ag+、Na+、Pb2+、NO3-、Cl-、SO42-,用惰性电极电解该溶液片刻,氧化产物与还原产物的质量比为( )
A.8:1 B.2:27
C.35.5:108 D.108:35.5A 习题巩固Company Logo 3.在下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
AC 习题巩固Thank You !Company Logo4.用两支惰性电极插入50mLAgNO3溶液中,
通电电解。当电解液的pH从6.0变为3.0时(设电
解时阴极没有氢气析出,且电解液在电解前后体
积变化可以忽略),电极上析出银的质量大约是:
A、27mg B、54mg
C、108mg D、216mgBCompany LogoCompany LogoCompany LogoCompany LogoCompany LogoCompany LogoCompany Logo1.离子移动
通电前:CuCl2 = Cu2+ + 2Cl-
H2O H+ + OH- 通电后:Cu2+ H+移向阴极,
Cl- OH-移向阳极;2.电极反应:2Cl- - 2e- = Cl2↑(氧化反应)Cu2+ + 2e- = Cu(还原反应)CuCl2电解实验微观解释阳极:阴极:Company Logo 与电源正极连 +电源-与电源负极连
氧化反应 还原反应
2Cl—2e-=Cl2 阳极 惰性电极 阴极 Cu2++2e-=Cu
阴离子移向 CuCl2溶液 阳离子移向
电子流出电子流入电解的工作原理:Company Logo电解池与原电池有哪些异同?①两电极接直流电源
②电解质溶液
③形成闭合回路①活泼性不同的两电极
②电解质溶液
③形成闭合回路形成条件将电能
转变成化学能的装置将化学能
转变成电能的装置定义装置
实例电解池原电池装置自发的氧化还原反应不自发的氧化还原反应,
要在外加电场作用下才可发生Company LogoCuCuFeCuCuSO4溶液稀硫酸溶液思考: 下列两个电解池的电极反应式阳极阴极Cu - 2e- = Cu2 + Cu2+ + 2e- = CuCu - 2e- = Cu2 + 2H+ + 2e- = H2 ↑Company Logo↑通电电解质溶于水或受热融化状态
电解质电离后,再通直流电
电解质电离成为自由移动的离子例:CuCl2=Cu2++2Cl-阴阳离子定向移动,在两极上失得电子成为原子或分子。如:
CuCl2==Cu+Cl2只产生自由移动的离子
发生氧化还原反应生成了新物质 电解必须建立在电离的基础上 Company Logo二、电解规律(用惰性电极电解时)1.电解含氧酸、强碱溶液、活泼金属的含氧酸盐
溶液时,如电解H2SO4、HNO3、NaOH、Na2SO4等
溶液时其电极反应式为: 电解后溶液中溶质的质量分数 ,若要恢复原来的浓度,只需加入一定量的 即可。实质:电解水增大水Company Logo电解后溶液的pH变化如何?H2SO4溶液pH减小
NaOH溶液pH增大
Na2SO4溶液pH不变
Company Logo2.电解无氧酸溶液(氢氟酸除外)、不活泼金属的
无氧酸盐溶液,如电解盐酸、CuCl2溶液等 电解后溶液中溶质的质量分数 ,若要恢复
原来的组成和浓度,需加入一定量的 (通入一
定量的HCl气体)阳极: 2Cl -- 2e-=Cl2↑阴极: 2H+ +2e-= H2 ↑ 例如:电解盐酸实质:电解质本身被电解减小溶质电解后溶液的pH .增大Company Logo 电解后原溶液中溶质的质量分数 ,若要恢
复原来的组成和浓度,需通入一定量的 。阳极 (C): 2Cl -- 2e-=Cl2↑阴极 (C): 2H+ +2e-= H2 ↑ 3.电解不活泼金属的含氧酸盐、活泼金属的无氧酸盐溶液,如电解CuSO4溶液、NaCl溶液等。例如:电解NaCl溶液减小HCl电解后溶液的pH .增大实质:电解质和水都参与电解Company Logo⑶电解不活泼金属的含氧酸盐、活泼金属的无氧酸盐溶液,如电解CuSO4溶液、NaCl溶液等。阳极 : 4OH--4e-=2H2O +O2↑阴极: 2Cu2+ +4e-=2Cu 电解后原溶液中溶质的质量分数 ,若要恢
复原来的组成和浓度,需加入一定量 。例如:电解CuSO4溶液实质:电解质和水都参与电解减小金属氧化物
(CuO)电解后溶液的pH .减小Company Logo阳极阴极总电极反应AgNO3溶液CC4OH- - 4e- = O2 ↑ +2H2O4Ag+ + 4e- = 4Ag总反应式:4AgNO3+2H2O== 4Ag +O2 ↑+4HNO3练习:
书写电解硝酸银溶液的电极反应式及总方程式电解Company Logo练习:从H+,Cu2+,Na+ ,SO42-,OH-,Cl-六种离子中恰当地组成电解质,并将其溶于水后按下列要求进行电解。
(1)以碳棒为电极,使电解质质量减小,水量不变,应采用的电解质 。
(2)以碳棒为电极,使电解质质量不变,水量减小,应采用的电解质 。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量均减小,应采用的电解质 。HCl CuCl2NaOH H2SO4 Na2SO4
NaCl CuSO4Company Logo[小结]解答有关电解问题步骤1.首先观察是否有外接电源2.分析电解质水溶液的组成,找全离子分两组.3.观察阳极是否为金属, 金属作阳极失电子4.根据阴阳两极放电顺序写出两极反应式.5.合并两极反应写出电解反应式.Company Logo
1807年,当英国化学家戴维将铂电极插入熔融的氢氧化钾并接通直流电源时,奇迹终于发生了!在阴极附近产生一种银白色的金属,随即形成紫色的火焰。这就是发现钾元素的主要过程,当时在社会上引起了轰动。他随后用电解法又相继发现了钠、钙、锶、钡、镁、硼、硅等元素,戴维成为发现化学元素最多的人。这其中的奥妙是什么呢?电解时,物质的变化是如何发生的呢?……” Company Logo 描述下列装置中的实验现象锌逐渐溶解,铜片上有气泡产生。Company Logo 稀 硫 酸ZnCu 描述下列装置中的实验现象CCCuCl2?Company Logo【实验提纲】:如图所示,将两根石墨棒分别跟直流电源的正极和负极连接,浸入U型管的CuCl2溶液中 ,再接通12V直流电,观察现象。约3~5min后切断电源。【实验探究】实验4-2Company Logo实验现象 阳极--与电源正极相连的碳棒有气泡产生,且有刺激性气味。与电源负极相连的碳棒上有红色的固体析出。阴极--- Cl2Cu 能使湿润的KI-淀粉试纸变蓝.Company Logo想一想: CuCl2溶液在电流的作用下为什么会生成Cu和Cl2呢? Company Logo【合作交流】问题1:通电前,氯化铜溶液中含有哪些微粒?
问题2:在通电时这些微粒各向什么区移动?
问题3:通电后在阳极和阴极各会发生什么样的电极反应?Company Logo第三节 电解池(1)东北师大附中 周西柳Company Logo1.电解: 使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的过程,叫做电解。一、电解原理2.电解池:电能转为化学的装置。Company Logo3.构成电解池的条件:①直流电源;与电源负极相连的电极为阴极与电源正极相连的电极为阳极②阴、阳电极③电解质溶液或熔融电解质;④形成闭合回路Company Logo 比较原电池与电解池电极命名有何区别?原电池的正负极由电极材料决定
电解池的阴阳极由电源决定练习:判断下列装置中原电池的正负极及电解池的阴阳极负正阳阴Company Logo练习:判断下列装置中原电池的正负极及电解池的阴阳极。负正阳阴Company LogoCu2+oooooooooooooooooooo? - +- +阴极阳极CuCl2电解氯化铜溶液实验装置e-e-单击电子流动4.电解池中电子的移动方向 负极阴极阳离子正极阳极阴离子Company Logo5、电解本质:阳极——发生氧化反应
阴极——发生还原反应 Company Logo(1)放电:6.电解质在水溶液中放电规律(2)影响离子放电的因素:阴、阳离子得失电子的过程叫放电。Company Logo ①活性材料作电极时:
金属在阳极失电子被氧化成阳离子进入溶液,阴离子不容易在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由难到易)是: 金属电极> S 2->SO32->I ->Br ->Cl ->OH ->(含氧酸根离子)>F-(3)阳极的放电顺序:Company Logo Ag+>Fe3+ >Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+> Al3+>Mg2+>Na+>Ca+>K+
(前提:离子浓度近似相等时)
无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子在阴极上放电顺序是:(4)阴极的放电顺序:Company Logo(包括水的电离,并分 成阳离子组和阴离子组)②明确溶液中存在哪些离子③判断阴阳离子的放电顺序④根据阳极氧化,阴极还原完成电极反应式书写电极反应式及总方程式的方法小结①判断电极材料掌握方法
事半功倍哟!(注意得失电子守恒)⑤由阴阳两电极反应式,合并得总反应式(弱电解质的须保持分子形式)
Company LogoCuCuFeCuCuSO4溶液稀硫酸溶液思考: 下列两个电解池的电极反应式。阳极阴极Cu - 2e- = Cu2 + Cu2+ + 2e- = CuCu - 2e- = Cu2 + 2H+ + 2e- = H2 ↑Company Logo(1)惰性电极:(只考虑溶液中离子放电)
阴极:阳离子还原
阳极:阴离子氧化
(2)活泼电极:阳极为金属(除Pt、Au)
阴极:阳离子还原
阳极:构成阳极的金属发生氧化反应
7.电极反应式的书写Company Logo [例]以石墨碳棒为电极,请写出电解下列溶液时,在阴、阳两极上发生的电极反应式及总的化学方程式。
CuSO4溶液:
想一想、做一做 阳极:4OH--4e-=2H2O+O2↑ 或(4H2O 4H++4OH-)
阴极:2Cu2+ +4e-=2Cu 电解总反应式:2Cu2++2H2O= 2Cu+O2↑+4H+想一想,H+应该在哪一极生成?Company Logo [例]以石墨碳棒为电极,请写出电解NaCl溶液时,在阴、阳两极上发生的电极反应式及总的化学方程式。 想一想、做一做阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2↑ 或(2H2O 2H++2OH-)总反应方程式:2Cl-+2H2O == Cl2↑+H2↑+2OH- 电解OH-在哪一极?Company Logo1.已知A、B、C是三种金属,满足:
①将A和B浸在稀硫酸溶液中用导线相连,A上有气泡产生,B逐步溶解;
②用惰性电极电解物质的量浓度相同的A、C的硝酸盐混合溶液时,阴极上先析出C。
根据下列①②两个实验,确定它们的还原性强弱顺序为 。
B>A>C 习题巩固Company Logo2.在水中加入等物质的量的Ag+、Na+、Pb2+、NO3-、Cl-、SO42-,用惰性电极电解该溶液片刻,氧化产物与还原产物的质量比为( )
A.8:1 B.2:27
C.35.5:108 D.108:35.5A 习题巩固Company Logo 3.在下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
AC 习题巩固Thank You !Company Logo4.用两支惰性电极插入50mLAgNO3溶液中,
通电电解。当电解液的pH从6.0变为3.0时(设电
解时阴极没有氢气析出,且电解液在电解前后体
积变化可以忽略),电极上析出银的质量大约是:
A、27mg B、54mg
C、108mg D、216mgBCompany LogoCompany LogoCompany LogoCompany LogoCompany LogoCompany LogoCompany Logo1.离子移动
通电前:CuCl2 = Cu2+ + 2Cl-
H2O H+ + OH- 通电后:Cu2+ H+移向阴极,
Cl- OH-移向阳极;2.电极反应:2Cl- - 2e- = Cl2↑(氧化反应)Cu2+ + 2e- = Cu(还原反应)CuCl2电解实验微观解释阳极:阴极:Company Logo 与电源正极连 +电源-与电源负极连
氧化反应 还原反应
2Cl—2e-=Cl2 阳极 惰性电极 阴极 Cu2++2e-=Cu
阴离子移向 CuCl2溶液 阳离子移向
电子流出电子流入电解的工作原理:Company Logo电解池与原电池有哪些异同?①两电极接直流电源
②电解质溶液
③形成闭合回路①活泼性不同的两电极
②电解质溶液
③形成闭合回路形成条件将电能
转变成化学能的装置将化学能
转变成电能的装置定义装置
实例电解池原电池装置自发的氧化还原反应不自发的氧化还原反应,
要在外加电场作用下才可发生Company LogoCuCuFeCuCuSO4溶液稀硫酸溶液思考: 下列两个电解池的电极反应式阳极阴极Cu - 2e- = Cu2 + Cu2+ + 2e- = CuCu - 2e- = Cu2 + 2H+ + 2e- = H2 ↑Company Logo↑通电电解质溶于水或受热融化状态
电解质电离后,再通直流电
电解质电离成为自由移动的离子例:CuCl2=Cu2++2Cl-阴阳离子定向移动,在两极上失得电子成为原子或分子。如:
CuCl2==Cu+Cl2只产生自由移动的离子
发生氧化还原反应生成了新物质 电解必须建立在电离的基础上 Company Logo二、电解规律(用惰性电极电解时)1.电解含氧酸、强碱溶液、活泼金属的含氧酸盐
溶液时,如电解H2SO4、HNO3、NaOH、Na2SO4等
溶液时其电极反应式为: 电解后溶液中溶质的质量分数 ,若要恢复原来的浓度,只需加入一定量的 即可。实质:电解水增大水Company Logo电解后溶液的pH变化如何?H2SO4溶液pH减小
NaOH溶液pH增大
Na2SO4溶液pH不变
Company Logo2.电解无氧酸溶液(氢氟酸除外)、不活泼金属的
无氧酸盐溶液,如电解盐酸、CuCl2溶液等 电解后溶液中溶质的质量分数 ,若要恢复
原来的组成和浓度,需加入一定量的 (通入一
定量的HCl气体)阳极: 2Cl -- 2e-=Cl2↑阴极: 2H+ +2e-= H2 ↑ 例如:电解盐酸实质:电解质本身被电解减小溶质电解后溶液的pH .增大Company Logo 电解后原溶液中溶质的质量分数 ,若要恢
复原来的组成和浓度,需通入一定量的 。阳极 (C): 2Cl -- 2e-=Cl2↑阴极 (C): 2H+ +2e-= H2 ↑ 3.电解不活泼金属的含氧酸盐、活泼金属的无氧酸盐溶液,如电解CuSO4溶液、NaCl溶液等。例如:电解NaCl溶液减小HCl电解后溶液的pH .增大实质:电解质和水都参与电解Company Logo⑶电解不活泼金属的含氧酸盐、活泼金属的无氧酸盐溶液,如电解CuSO4溶液、NaCl溶液等。阳极 : 4OH--4e-=2H2O +O2↑阴极: 2Cu2+ +4e-=2Cu 电解后原溶液中溶质的质量分数 ,若要恢
复原来的组成和浓度,需加入一定量 。例如:电解CuSO4溶液实质:电解质和水都参与电解减小金属氧化物
(CuO)电解后溶液的pH .减小Company Logo阳极阴极总电极反应AgNO3溶液CC4OH- - 4e- = O2 ↑ +2H2O4Ag+ + 4e- = 4Ag总反应式:4AgNO3+2H2O== 4Ag +O2 ↑+4HNO3练习:
书写电解硝酸银溶液的电极反应式及总方程式电解Company Logo练习:从H+,Cu2+,Na+ ,SO42-,OH-,Cl-六种离子中恰当地组成电解质,并将其溶于水后按下列要求进行电解。
(1)以碳棒为电极,使电解质质量减小,水量不变,应采用的电解质 。
(2)以碳棒为电极,使电解质质量不变,水量减小,应采用的电解质 。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量均减小,应采用的电解质 。HCl CuCl2NaOH H2SO4 Na2SO4
NaCl CuSO4Company Logo[小结]解答有关电解问题步骤1.首先观察是否有外接电源2.分析电解质水溶液的组成,找全离子分两组.3.观察阳极是否为金属, 金属作阳极失电子4.根据阴阳两极放电顺序写出两极反应式.5.合并两极反应写出电解反应式.Company Logo
