2023年中考化学人教版(五四学制)二轮复习题--金属和金属材料(含解析)
文档属性
| 名称 | 2023年中考化学人教版(五四学制)二轮复习题--金属和金属材料(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 370.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-04 16:11:20 | ||
图片预览



文档简介
2023年中考化学人教版(五四学制)二轮复习题--金属和金属材料
一、单选题
1.哈尔滨地铁是中国黑龙江省哈尔滨市的城市轨道交通系统。始建于2008年,是哈尔滨市历史上最大的城市基础设施项目,现在继续在拓展和延伸,下面有关说法不正确的是
A.地铁建设大大缓解了哈市的交通压力,使市民出行更顺畅
B.地铁的轨道材料是采用韧性好、硬度大的生铁制成的
C.在地铁车厢内,安装了塑料座椅,塑料属于合成材料
D.地铁站的电动扶梯扶手是不锈钢制成的,不锈钢属于金属材料
2.下列有关金属的叙述,错误的是
A.焊锡(锡铅合金)的熔点比锡高 B.铜具有良好的导电性
C.铁锅炒菜是利用铁的导热性 D.铝制成铝箔是利用铝的延展性
3.科学研究发现,金星大气的成分之一是三氧化二碳(C2O3)。实验证明三氧化二碳的化学性质与一氧化碳相似。下列关于三氧化二碳的叙述不正确的是
A.是一种有毒气体 B.能使澄清石灰水变浑浊
C.在一定条件下能还原氧化铁 D.在O2中充分燃烧的产物是CO2
4.下列说法正确的是( )
A.生铁就是钢,因为主要成分都是铁
B.动植物体内也含铁元素
C.纯铁是很硬、很脆的金属
D.通常铁的导电性大于银的导电性
5.镍的抗腐蚀性佳,主要用来制造不锈钢和其他抗腐蚀合金。火法炼镍的原理是:。下列说法错误的是
A.NiO中Ni的化合价为+2
B.反应中NiO发生氧化反应
C.该反应属于置换反应
D.含镍不锈钢属于混合物
6.下列推理正确的是( )
A.金属能和稀盐酸反应生成气体,所以能和稀盐酸反应生成气体的物质一定是金属
B.单质是由同种元素组成的物质,所以由同种元素组成的物质是单质。
C.铜锈的主要成分是,所以铜生锈可能与H2O、CO2、O2有关
D.镁条在氧气和二氧化碳中均能燃烧,所以二氧化碳分子中有氧分子
7.下列有关金属的说法正确的是
A.所有金属都呈银白色 B.金属在空气中都易被氧化
C.黄铜和青铜都属于纯净物 D.生铁和钢都属于铁的合金
8.下图表示向一定量镁条中加入足量稀盐酸的过程中,某变量y随稀盐酸质量变化的趋势。纵坐标表示的是
A.镁条的质量
B.氢气的质量
C.稀盐酸中水的质量
D.溶液中氢元素的质量
9.化学家谢赫特曼研究发现:铝锰合金晶体中的原子排列方式(如下图)没有出现“规则有序而重复排列”的普遍现象。他提出了“准晶体”概念,因此获得了2011年诺贝尔化学奖。下列观点正确的是
A.铝是由铝分子构成的
B.铝锰合金属于金属材料
C.铝锰合金的硬度大,说明物质的微粒间不存在间隙
D.合金中原子排列方式与纯金属中原子排列方式相同
10.相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图。下列叙述正确的是
A.金属的活动性强弱关系:N>M
B.生成H2的体积大小关系:N>M
C.相对原子质量大小关系:N>M
D.反应消耗盐酸的质量关系:N>M
11.构建绿色发展体系,让人们生活更健康。下列说法不正确的是( )
A.回收废旧金属,有利于保护金属资源
B.农作物丰收,需要大量使用化肥、农药
C.地沟油经化学方法处理制成燃油,实现变废为宝
D.新能源汽车的开发与使用,可减少汽车尾气对空气的污染
12.现有甲、乙、丙三种金属,采用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如图所示)。则三种金属的活动性由弱到强的顺序是( )
A.甲 丙 乙 B.丙 甲 乙 C.乙 甲 丙 D.甲 乙 丙
二、填空题
13.用化学用语完成下列各空:
(1)导电性最好的金属______;
(2)标出硝酸铁中铁元素的化合价______;
(3)2个乙醇分子______
14.2018年长沙市地铁建设正在如火如荼地进行,一共有6条线在建或即将开通。生铁和钢在钢轨铺设及地铁列车的制造中应用广泛,请根据所学化学知识回答下列相关问题:
(1)钢轨及地铁列车的的制造需要大量的钢材,而钢的主要成份是铁,请你写出工业利用赤铁矿炼铁的方程式: _________ 。
(2)地铁列车的车窗主要用的是聚酯塑料,请你回答:聚酯塑料属于_____________(填“合成材料”或“复合材料”)。
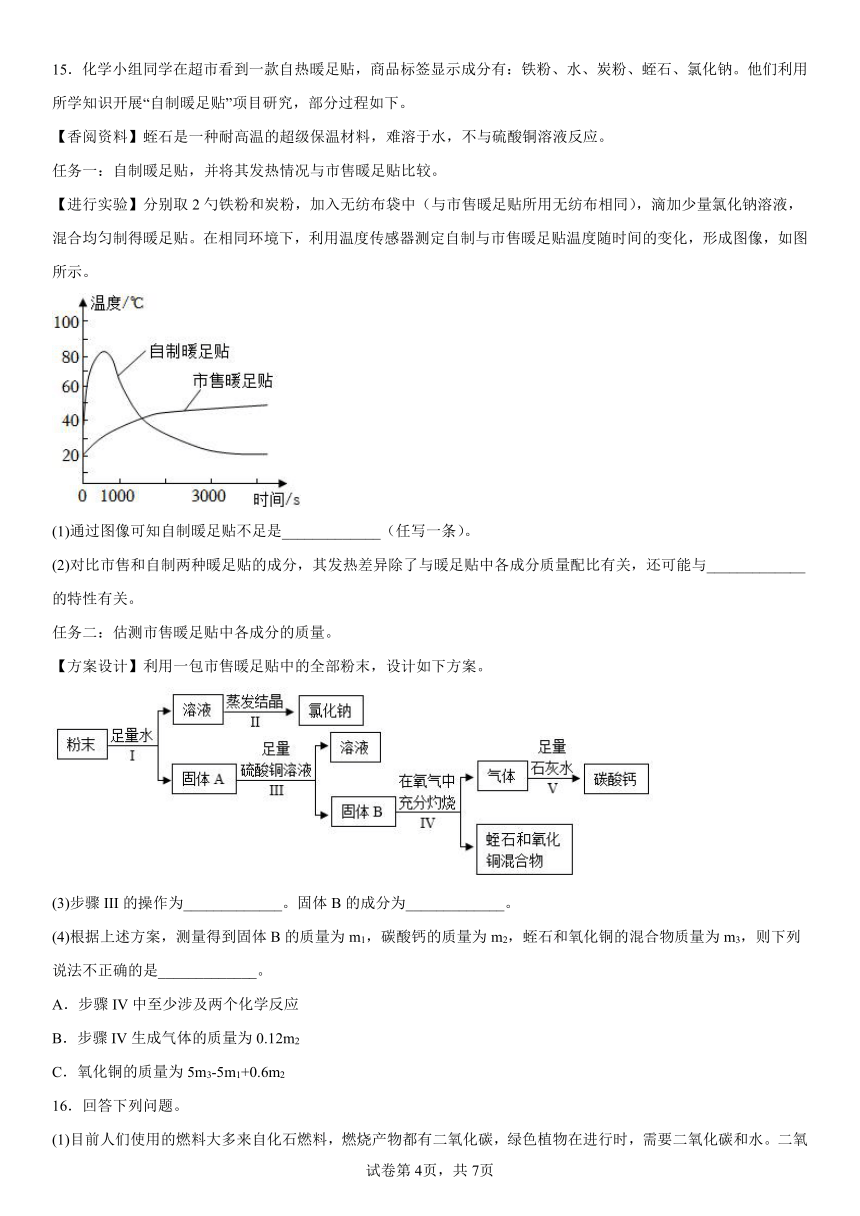
15.化学小组同学在超市看到一款自热暖足贴,商品标签显示成分有:铁粉、水、炭粉、蛭石、氯化钠。他们利用所学知识开展“自制暖足贴”项目研究,部分过程如下。
【香阅资料】蛭石是一种耐高温的超级保温材料,难溶于水,不与硫酸铜溶液反应。
任务一:自制暖足贴,并将其发热情况与市售暖足贴比较。
【进行实验】分别取2勺铁粉和炭粉,加入无纺布袋中(与市售暖足贴所用无纺布相同),滴加少量氯化钠溶液,混合均匀制得暖足贴。在相同环境下,利用温度传感器测定自制与市售暖足贴温度随时间的变化,形成图像,如图所示。
(1)通过图像可知自制暖足贴不足是_____________(任写一条)。
(2)对比市售和自制两种暖足贴的成分,其发热差异除了与暖足贴中各成分质量配比有关,还可能与_____________的特性有关。
任务二:估测市售暖足贴中各成分的质量。
【方案设计】利用一包市售暖足贴中的全部粉末,设计如下方案。
(3)步骤III的操作为_____________。固体B的成分为_____________。
(4)根据上述方案,测量得到固体B的质量为m1,碳酸钙的质量为m2,蛭石和氧化铜的混合物质量为m3,则下列说法不正确的是_____________。
A.步骤IV中至少涉及两个化学反应
B.步骤IV生成气体的质量为0.12m2
C.氧化铜的质量为5m3-5m1+0.6m2
16.回答下列问题。
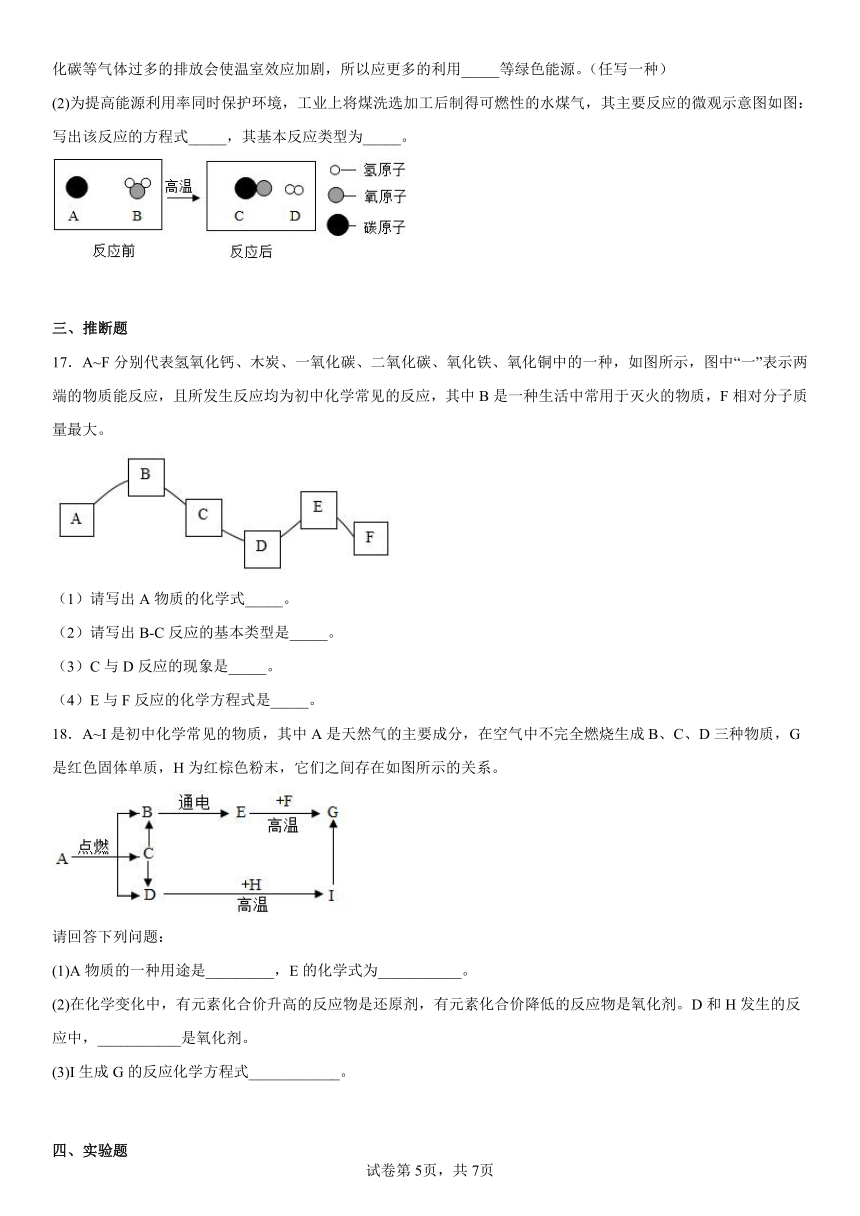
(1)目前人们使用的燃料大多来自化石燃料,燃烧产物都有二氧化碳,绿色植物在进行时,需要二氧化碳和水。二氧化碳等气体过多的排放会使温室效应加剧,所以应更多的利用_____等绿色能源。(任写一种)
(2)为提高能源利用率同时保护环境,工业上将煤洗选加工后制得可燃性的水煤气,其主要反应的微观示意图如图:写出该反应的方程式_____,其基本反应类型为_____。
三、推断题
17.A~F分别代表氢氧化钙、木炭、一氧化碳、二氧化碳、氧化铁、氧化铜中的一种,如图所示,图中“一”表示两端的物质能反应,且所发生反应均为初中化学常见的反应,其中B是一种生活中常用于灭火的物质,F相对分子质量最大。
(1)请写出A物质的化学式_____。
(2)请写出B-C反应的基本类型是_____。
(3)C与D反应的现象是_____。
(4)E与F反应的化学方程式是_____。
18.A~I是初中化学常见的物质,其中A是天然气的主要成分,在空气中不完全燃烧生成B、C、D三种物质,G是红色固体单质,H为红棕色粉末,它们之间存在如图所示的关系。
请回答下列问题:
(1)A物质的一种用途是_________,E的化学式为___________。
(2)在化学变化中,有元素化合价升高的反应物是还原剂,有元素化合价降低的反应物是氧化剂。D和H发生的反应中,___________是氧化剂。
(3)I生成G的反应化学方程式____________。
四、实验题
19.现有试管、镁条、铁片、铜片、稀盐酸、硫酸镁溶液和硝酸银溶液等药品和各种仪器,请设计实验,比较铁、铜、银的金属活动性强弱,并用简洁规范的语言填写下表。
实验目的 实验操作 现象和结论
比较铁、铜的活动性 ________ ________
比较铜、银的活动性 ________ ________
20.硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
(1)波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,有效成分是Cu4(OH)6SO4,其中铜元素的化合价为______。
(2)为验证A1的化学性质比铜活泼,进行以下实验,现象如下表:
A1片(未打磨) A1片(打磨)
实验1 CuSO4溶液(5%,5mL) 无变化,数小时后铝片上附有极少气泡,几乎无红色物质 极少气泡,附着极少红色物质
实验2 CuSO4溶液(10%,5mL) 无变化,数小时后铝片附有稍多气泡,有极少红色斑点 稍多气泡,附着少量红色物质
实验3 CuC12溶液(5%,5mL) 多量气泡,迅速出现红色物质,溶液慢慢变成无色,且温度升高 大量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高
①能说明A1片和铜盐溶液反应速率与反应物的浓度有关的两组实验是______。铜盐溶液中的C1-对反应速率起______(填“加快”或“抑制”)作用。未打磨的A1片反应明显较慢,这是因为表面其有一层致密的氧化膜,用化学方程式表示其形成的原理______。
②该组反应中产生的无色、无味的气体是什么?甲同学提出可能是CO2、SO2、H2中的一种。乙同学立即否定了其中两种。你认为理由是(任选一种评价):______。
(3)某气体a中可能含水蒸气、甲烷、氢气中的一种或几种(夹持仪器未画出,假设每步反应均完全)。
已知:无水硫酸铜粉末为白色固体,遇水变蓝色。
:
①装置A的作用是______。装置B中的物质是______(填试剂名称)。
②若反应后装置D、E分别增重4.0g、4.4g,则a中一定含有______;装置C中的现象是______。
五、计算题
21.将铁粉和铜粉的混合物10g,放入100g的稀盐酸中,恰好完全反应。此时烧杯内各物质的总质量为109.8g。请计算:
(1)根据质量守恒定律,计算反应后生成氢气的质量________。
(2)计算混合物中含铜的质量_____。
22.小刚同学想测定黄铜(铜锌合金)中铜的质量分数,他取20g黄铜样品,加入足量稀硫酸,反应后生成了0.2g气体,请你帮他计算该合金中铜元素的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A. 地铁建设大大缓解了哈市的交通压力,使市民出行更顺畅,正确;B. 地铁的轨道材料是采用抗腐蚀性较好的钢制成的,错误;C. 在地铁车厢内,安装了塑料座椅,塑料属于合成材料,正确;D. 地铁站的电动扶梯扶手是不锈钢制成的,不锈钢属于金属材料,正确。故选B。
2.A
【详解】A、合金的熔点比组成它的成分金属的熔点低,故A错误,符合题意;
B、铜具有良好的导电性,叙述正确,不符合题意;
C、铁锅炒菜是利用铁的导热性,叙述正确,不符合题意;
D、铝制成铝箔是利用铝的延展性,叙述正确,不符合题意;
故选A。
3.B
【详解】A、由于CO具有毒性,三氧化二碳化学性质与一氧化碳相似,可判断C2O3是一种有毒气体,正确;
B、由于CO不能使澄清石灰水变浑浊,三氧化二碳化学性质与一氧化碳相似,可判断C2O3不能使澄清石灰水变浑浊,错误;
C、由于CO具有还原性,而三氧化二碳化学性质与一氧化碳相似,可判断C2O3具有还原性,在一定条件下能还原氧化铁,正确;
D、由于CO具有可燃性,而三氧化二碳化学性质与一氧化碳相似,可判断C2O3具有可燃性,在O2中充分燃烧的产物是CO2,正确。
故选B
4.B
【详解】A、生铁的含碳量是2%﹣4.3%;钢中碳的含量是0.03%﹣2%,故A不正确;
B、动植物体内都含铁元素,故B正确;
C、纯铁质软,故C不正确;
D、银的导电性大于铁的导电性,故D不正确。故选B。
5.B
【详解】A、化合物中各元素的化合价代数和为0。NiO中O元素化合价为-2价,Ni的化合价为+2价。正确。
B、反应中NiO失去氧,发生还原反应。 错误。
C、该反应是单质与化合物反应生成单质与化合物的反应,属于置换反应。正确。
D、含镍不锈钢含有多种物质,属于混合物。正确。
故选B。
6.C
【详解】A、金属能和稀盐酸反应生成气体,但是能和稀盐酸反应生成气体的物质不一定是金属,还有可能是碳酸盐,A错误。
B、单质是由同种元素组成的纯净物,所以由同种元素组成的物质不一定是单质还有可能是混合物,如红磷和白磷,B错误。
C、铜锈的主要成分是Cu2(OH)2CO3,根据质量守恒,反应前后元素种类不变,所以铜生锈可能与H2O、CO2、O2有关,C正确。
D、分子由原子构成,二氧化碳分子中不含氧分子,D错误。
故选:C。
7.D
【详解】A、不是所有金属都是呈银白色的,如铜是紫红色,错误;
B、不是金属在空气中都易被氧化,如金即使在高温下也不容易和氧气反应,错误;
C、黄铜和青铜都是铜的合金,都是混合物,错误;
D、生铁和钢都属于铁的合金,但含碳量不同,正确;
故选D。
8.B
【详解】一定量镁条中加入足量稀盐酸,镁和盐酸反应生成氯化镁和氢气。A. 镁条的质量逐渐减少,不符合题意;B. 反应前氢气的质量为零,反应中氢气的质量增多,镁反应完,氢气的质量不再增加,符合题意;C. 水不是该反应的反应物,也不是生成物,故反应中,稀盐酸中水的质量不变,不符合题意;D. 溶液中氢元素的质量被置换生成氢气,所以溶液中氢元素的质量减少,不符合题意。故选B。
点睛:图像的问题主要是结合化学反应分析图的起点的位置,变化趋势,终点的位置是否正确。
9.B
【详解】A、铝是一种金属单质,是由铝原子构成的,此选项说法错误,不符合题意;
B、金属材料包括纯金属和它们的合金,故铝锰合金属于金属材料,此选项说法正确,符合题意;
C、铝锰合金的硬度大,是因为合金比组成它们的纯金属的硬度大,不能说明物质的微粒间不存在间隙,此选项说法错误,不符合题意;
D、将纯金属制成合金,就改变了金属的内部结构,所以合金中原子排列方式与纯金属中原子排列方式不同,此选项说法错误,不符合题意。
故选B。
10.C
【详解】A、M反应时间较短,说明M比N活泼,该选项说法不正确;
B、M反应生成氢气多,生成H2的体积大小关系:N<M,该选项说法不正确;
C、生成氢气的质量=金属质量×化合价/相对原子质量,M、N在生成物中均为+2价,质量相同,相对原子质量越大,生成的氢气质量越小,N反应生成的氢气质量较小,因此相对原子质量大小关系:N>M,该选项说法正确;
D、反应生成的氢气中的氢元素完全来自于盐酸,生成氢气质量越大,消耗盐酸越多,M反应生成氢气多,因此M消耗盐酸多,反应消耗盐酸的质量关系:N<M,该选项说法不正确。
故选:C。
11.B
【详解】A、回收废旧金属,有利于保护金属资源,故A 正确;
B、大量使用化肥和农药既造成浪费,又会污染环境,故B错误;
C、地沟油经化学方法处理制成燃油,实现变废为宝,故C正确;
D、新能源汽车的开发与使用,减少化石能源的消耗,可减少汽车尾气对空气的污染,故D正确。故选B。
12.B
【详解】现有甲、乙、丙三种金属,采用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,甲能与盐溶液反应生成乙,说明甲的活动性比乙强;丙能与盐溶液反应生成甲,说明丙的活动性比甲强;丙能与盐溶液反应生成乙,说明丙的活动性比乙强;则三种金属活动性由强到弱的顺序是丙、甲、乙。故选B。
13. Ag 2C2H5OH
【详解】(1)导电性最好的金属是银,银的化学式为:Ag;
(2)硝酸铁中铁元素的化合价是+3价,元素化合价的表示方法是在化学式该元素的上方用正负号和数字表示,正负号标在数字前面。故硝酸铁中铁元素的化合价表示为:;
(3)分子用化学式表示,多个分子就是在化学式前面加上相应的数字,故2个乙醇分子表示为:2C2H5OH。
14. 合成材料
【详解】(1)炼铁的原理是利用赤铁矿中的氧化铁与一氧化碳反应生成铁和二氧化碳, 注意配平方程式,前后均有气体,不需加气体符号。
(2)聚酯塑料是人工合成的有机物,属于合成材料。
15.(1)发热时间较短(合理即可)
(2)保温材料
(3) 过滤 铜、炭粉、蛭石
(4)B
【详解】(1)根据图像对比可知自制暖足贴与市售的暖足贴相比,发热时间较短,难以长时间使用;
(2)自制的暖足贴与市售的制作材料相比少了保温材料蛭石,则发热差异除了与暖足贴中各成分质量配比有关,还可能与保温材料的性质有关;
(3)步骤III为将固体与溶液分离的操作,则为过滤;该粉末中含有铁粉、炭粉、蛭石、氯化钠,加水溶解后过滤得到的固体A为铁粉、炭粉、蛭石,则加入足量的硫酸铜溶液,其中铁能与硫酸铜反应生成铜与硫酸亚铁,故反应后过滤得到的固体B为铜、炭粉、蛭石的混合物;
(4)A、根据上述分析可知固体B为铜、炭粉、蛭石的混合物,步骤IV为固体B在空气中灼烧,其中铜能与氧气反应生成氧化铜,炭粉能与氧气反应生成二氧化碳,则至少发生2个化学反应,故选项说法正确;
B、步骤IV中的炭粉反应后完全转化为CO2,CO2通入澄清的石灰水反应后生成CaCO3沉淀与H2O,反应前后碳元素质量不变,则设生成的CO2的质量为x,,得出x=0.44m2,故选项说法错误;
C、设氧化铜的质量为y
则蛭石的质量=m3-y
炭粉的质量=,
根据铜元素守恒得出Cu的质量=
则m1=0.8y+0.12m2+(m3-y)
y= 5m3-5m1+0.6m2,故选项说法正确;
故选B。
16.(1)光合作用;太阳能(或风能、地热能等)
(2) 置换反应
【详解】(1)常见绿色能源包括:太阳能、风能、地热能、潮汐能、生物质能、氢气和核能;
(2)由微观示意图可知:碳与水在高温条件下反应生成一氧化碳和氢气,该反应化学方程式:,一种单质和一种化合物反应生成另一种单质和另一种化合物的反应叫做置换反应,该反应基本反应类型为:置换反应。
17. Ca(OH)2 化合反应 黑色固体变红色,澄清石灰水变浑浊
【分析】B是一种生活中常用于灭火的物质,为二氧化碳;F相对分子质量最大,所给物质中氧化铁相对分子质量最大,故F为氧化铁;二氧化碳能碳及氢氧化钙反应,氢氧化钙只能和二氧化碳反应,故A为氢氧化钙、C为碳;碳可以和氧化铁、氧化铜反应,则D为氧化铜;氧化铜能和一氧化碳反应,故E为一氧化碳;代入推理正确;
【详解】(1)由上述分析可知,A物质的化学式Ca(OH)2。
(2)B-C反应为二氧化碳和碳在高温下生成一氧化碳,符合多变一的特点,属于化合反应。
(3)C与D反应为碳还原氧化铜生成铜和二氧化碳的反应,现象为黑色固体变红色,澄清石灰水变浑浊。
(4)E与F反应为一氧化碳在高温下和氧化铁反应生成二氧化碳和铁,反应的化学方程式为。
18.(1) 作燃料 H2
(2)氧化铁
(3)
【分析】A是天然气的主要成分,为甲烷;G是红色固体单质,为铜;H为红棕色粉末,为氧化铁;B通电反应,所以B为水;水通电分解生成氢气和氧气,E与F在加热的条件下生成铜,所以E为氢气,F为氧化铜;D和氧化铁在高温下反应,且D为甲烷不完全燃烧的产物,所以D为一氧化碳,I为铁;
(1)
根据以上推断,A为甲烷,有可燃性,可作燃料;E为氢气,化学式为H2;
(2)
D和H发生的反应,即一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,,化合价发生变化的元素是碳元素和铁元素,一氧化碳中碳元素显+2价,二氧化碳中碳元素显+4价,化合价升高,所以一氧化碳为还原剂;氧化铁中铁元素的化合价为+3价,铁中铁元素的化合价为0从,化合价降低,所以氧化铁为氧化剂;
(3)
I生成G的反应,即铁生成铜的反应,可以是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:。
【点睛】
19. 向试管中放入铁片、铜片,分别加入等量的稀盐酸 一支试管中产生气泡,另一支试管中无明显变化,产生气泡的是铁片,无明显变化的是铜片,说明铁的金属活动性比铜强 向试管中放入铜片,加入2mL硝酸银溶液 铜片的表面覆盖一层银白色物质,说明铜的金属活动性比银强
【分析】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析解答。
【详解】解:比较铁、铜的活动性,可利用铁能与稀盐酸反应生成氯化亚铁溶液和氢气,铜不与稀盐酸反应,向试管中放入铁片、铜片,分别加入等量的稀盐酸,产生气泡的是铁片,无明显变化的是铜片,说明铁的金属活动性比铜强;
比较铜、银的活动性,可向试管中放入铜片,加入2mL硝酸银溶液,铜片的表面覆盖一层银白色物质,说明铜的金属活动性比银强。
20.(1)+2
(2) 实验1与实验2 加快 气体无色无味,不可能是SO2 反应物中无C元素,不可能生成CO2
(3) 检验气体a中是否有水 浓硫酸 甲烷、氢气 CH4、H2 黑色固体逐渐变红
【解析】(1)
根据化合物中正负化合价代数和为零,则Cu4(OH)6SO4中氧元素的化合价为-2价,氢元素化合价为+1价,硫元素的化合价为+6价,设铜元素的化合价为x, ,解得x=+2,则Cu4(OH)6SO4中铜元素的化合价为+2;
(2)
①根据表格中的实验现象可知,能说明A1片和铜盐溶液反应速率与反应物的浓度有关的两组实验是实验1和实验2;
铜盐溶液中的C1-能加快反应速率,即对反应速率起加快作用;
铝与空气中的氧气反应生成氧化铝,化学方程式为;
②该组反应中产生的无色、无味的气体是可能是CO2、SO2、H2中的一种,但不可能是二氧化硫,二氧化硫有刺激性气味,由于气体无色无味,不可能是SO2;根据质量守恒定律,反应物中无C元素,不可能生成CO2;
(3)
①装置A是无水硫酸铜,无水硫酸铜粉末为白色固体,遇水变蓝色,无水硫酸铜的作用是检验气体a中是否有水;装置B中的物质是要干燥气体并且吸收水蒸气,由于浓硫酸具有吸水性,可以干燥气体并吸收水蒸气,则装置B是浓硫酸;
②若反应后装置D、E分别增重4.0g、4.4g,说明装置D、E增重的分别是水和二氧化碳的质量,根据元素守恒,则a中一定含有氢气和甲烷气体;
氢气和甲烷气体均能与氧化铜反应生成铜,则在装置C中观察的现象为黑色粉末变为红色。
21. 0.2g 解:设铁的质量为x
x=5.6g
混合物中含铜的质量=
答:混合物中含铜的质量为4.4克。
【详解】(1)根据质量守恒定律,化学反应前后,物质的总质量变,故反应后生成氢气的质量=
(2)见答案。
22.解:设锌的质量为x
x=6.5g
铜的质量分数为。
答:该合金中铜元素的质量分数67.5%。
【分析】铜活动性较弱,不与酸发生反应;锌与稀硫酸反应生成氢气和硫酸锌。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.哈尔滨地铁是中国黑龙江省哈尔滨市的城市轨道交通系统。始建于2008年,是哈尔滨市历史上最大的城市基础设施项目,现在继续在拓展和延伸,下面有关说法不正确的是
A.地铁建设大大缓解了哈市的交通压力,使市民出行更顺畅
B.地铁的轨道材料是采用韧性好、硬度大的生铁制成的
C.在地铁车厢内,安装了塑料座椅,塑料属于合成材料
D.地铁站的电动扶梯扶手是不锈钢制成的,不锈钢属于金属材料
2.下列有关金属的叙述,错误的是
A.焊锡(锡铅合金)的熔点比锡高 B.铜具有良好的导电性
C.铁锅炒菜是利用铁的导热性 D.铝制成铝箔是利用铝的延展性
3.科学研究发现,金星大气的成分之一是三氧化二碳(C2O3)。实验证明三氧化二碳的化学性质与一氧化碳相似。下列关于三氧化二碳的叙述不正确的是
A.是一种有毒气体 B.能使澄清石灰水变浑浊
C.在一定条件下能还原氧化铁 D.在O2中充分燃烧的产物是CO2
4.下列说法正确的是( )
A.生铁就是钢,因为主要成分都是铁
B.动植物体内也含铁元素
C.纯铁是很硬、很脆的金属
D.通常铁的导电性大于银的导电性
5.镍的抗腐蚀性佳,主要用来制造不锈钢和其他抗腐蚀合金。火法炼镍的原理是:。下列说法错误的是
A.NiO中Ni的化合价为+2
B.反应中NiO发生氧化反应
C.该反应属于置换反应
D.含镍不锈钢属于混合物
6.下列推理正确的是( )
A.金属能和稀盐酸反应生成气体,所以能和稀盐酸反应生成气体的物质一定是金属
B.单质是由同种元素组成的物质,所以由同种元素组成的物质是单质。
C.铜锈的主要成分是,所以铜生锈可能与H2O、CO2、O2有关
D.镁条在氧气和二氧化碳中均能燃烧,所以二氧化碳分子中有氧分子
7.下列有关金属的说法正确的是
A.所有金属都呈银白色 B.金属在空气中都易被氧化
C.黄铜和青铜都属于纯净物 D.生铁和钢都属于铁的合金
8.下图表示向一定量镁条中加入足量稀盐酸的过程中,某变量y随稀盐酸质量变化的趋势。纵坐标表示的是
A.镁条的质量
B.氢气的质量
C.稀盐酸中水的质量
D.溶液中氢元素的质量
9.化学家谢赫特曼研究发现:铝锰合金晶体中的原子排列方式(如下图)没有出现“规则有序而重复排列”的普遍现象。他提出了“准晶体”概念,因此获得了2011年诺贝尔化学奖。下列观点正确的是
A.铝是由铝分子构成的
B.铝锰合金属于金属材料
C.铝锰合金的硬度大,说明物质的微粒间不存在间隙
D.合金中原子排列方式与纯金属中原子排列方式相同
10.相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图。下列叙述正确的是
A.金属的活动性强弱关系:N>M
B.生成H2的体积大小关系:N>M
C.相对原子质量大小关系:N>M
D.反应消耗盐酸的质量关系:N>M
11.构建绿色发展体系,让人们生活更健康。下列说法不正确的是( )
A.回收废旧金属,有利于保护金属资源
B.农作物丰收,需要大量使用化肥、农药
C.地沟油经化学方法处理制成燃油,实现变废为宝
D.新能源汽车的开发与使用,可减少汽车尾气对空气的污染
12.现有甲、乙、丙三种金属,采用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如图所示)。则三种金属的活动性由弱到强的顺序是( )
A.甲 丙 乙 B.丙 甲 乙 C.乙 甲 丙 D.甲 乙 丙
二、填空题
13.用化学用语完成下列各空:
(1)导电性最好的金属______;
(2)标出硝酸铁中铁元素的化合价______;
(3)2个乙醇分子______
14.2018年长沙市地铁建设正在如火如荼地进行,一共有6条线在建或即将开通。生铁和钢在钢轨铺设及地铁列车的制造中应用广泛,请根据所学化学知识回答下列相关问题:
(1)钢轨及地铁列车的的制造需要大量的钢材,而钢的主要成份是铁,请你写出工业利用赤铁矿炼铁的方程式: _________ 。
(2)地铁列车的车窗主要用的是聚酯塑料,请你回答:聚酯塑料属于_____________(填“合成材料”或“复合材料”)。
15.化学小组同学在超市看到一款自热暖足贴,商品标签显示成分有:铁粉、水、炭粉、蛭石、氯化钠。他们利用所学知识开展“自制暖足贴”项目研究,部分过程如下。
【香阅资料】蛭石是一种耐高温的超级保温材料,难溶于水,不与硫酸铜溶液反应。
任务一:自制暖足贴,并将其发热情况与市售暖足贴比较。
【进行实验】分别取2勺铁粉和炭粉,加入无纺布袋中(与市售暖足贴所用无纺布相同),滴加少量氯化钠溶液,混合均匀制得暖足贴。在相同环境下,利用温度传感器测定自制与市售暖足贴温度随时间的变化,形成图像,如图所示。
(1)通过图像可知自制暖足贴不足是_____________(任写一条)。
(2)对比市售和自制两种暖足贴的成分,其发热差异除了与暖足贴中各成分质量配比有关,还可能与_____________的特性有关。
任务二:估测市售暖足贴中各成分的质量。
【方案设计】利用一包市售暖足贴中的全部粉末,设计如下方案。
(3)步骤III的操作为_____________。固体B的成分为_____________。
(4)根据上述方案,测量得到固体B的质量为m1,碳酸钙的质量为m2,蛭石和氧化铜的混合物质量为m3,则下列说法不正确的是_____________。
A.步骤IV中至少涉及两个化学反应
B.步骤IV生成气体的质量为0.12m2
C.氧化铜的质量为5m3-5m1+0.6m2
16.回答下列问题。
(1)目前人们使用的燃料大多来自化石燃料,燃烧产物都有二氧化碳,绿色植物在进行时,需要二氧化碳和水。二氧化碳等气体过多的排放会使温室效应加剧,所以应更多的利用_____等绿色能源。(任写一种)
(2)为提高能源利用率同时保护环境,工业上将煤洗选加工后制得可燃性的水煤气,其主要反应的微观示意图如图:写出该反应的方程式_____,其基本反应类型为_____。
三、推断题
17.A~F分别代表氢氧化钙、木炭、一氧化碳、二氧化碳、氧化铁、氧化铜中的一种,如图所示,图中“一”表示两端的物质能反应,且所发生反应均为初中化学常见的反应,其中B是一种生活中常用于灭火的物质,F相对分子质量最大。
(1)请写出A物质的化学式_____。
(2)请写出B-C反应的基本类型是_____。
(3)C与D反应的现象是_____。
(4)E与F反应的化学方程式是_____。
18.A~I是初中化学常见的物质,其中A是天然气的主要成分,在空气中不完全燃烧生成B、C、D三种物质,G是红色固体单质,H为红棕色粉末,它们之间存在如图所示的关系。
请回答下列问题:
(1)A物质的一种用途是_________,E的化学式为___________。
(2)在化学变化中,有元素化合价升高的反应物是还原剂,有元素化合价降低的反应物是氧化剂。D和H发生的反应中,___________是氧化剂。
(3)I生成G的反应化学方程式____________。
四、实验题
19.现有试管、镁条、铁片、铜片、稀盐酸、硫酸镁溶液和硝酸银溶液等药品和各种仪器,请设计实验,比较铁、铜、银的金属活动性强弱,并用简洁规范的语言填写下表。
实验目的 实验操作 现象和结论
比较铁、铜的活动性 ________ ________
比较铜、银的活动性 ________ ________
20.硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
(1)波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,有效成分是Cu4(OH)6SO4,其中铜元素的化合价为______。
(2)为验证A1的化学性质比铜活泼,进行以下实验,现象如下表:
A1片(未打磨) A1片(打磨)
实验1 CuSO4溶液(5%,5mL) 无变化,数小时后铝片上附有极少气泡,几乎无红色物质 极少气泡,附着极少红色物质
实验2 CuSO4溶液(10%,5mL) 无变化,数小时后铝片附有稍多气泡,有极少红色斑点 稍多气泡,附着少量红色物质
实验3 CuC12溶液(5%,5mL) 多量气泡,迅速出现红色物质,溶液慢慢变成无色,且温度升高 大量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高
①能说明A1片和铜盐溶液反应速率与反应物的浓度有关的两组实验是______。铜盐溶液中的C1-对反应速率起______(填“加快”或“抑制”)作用。未打磨的A1片反应明显较慢,这是因为表面其有一层致密的氧化膜,用化学方程式表示其形成的原理______。
②该组反应中产生的无色、无味的气体是什么?甲同学提出可能是CO2、SO2、H2中的一种。乙同学立即否定了其中两种。你认为理由是(任选一种评价):______。
(3)某气体a中可能含水蒸气、甲烷、氢气中的一种或几种(夹持仪器未画出,假设每步反应均完全)。
已知:无水硫酸铜粉末为白色固体,遇水变蓝色。
:
①装置A的作用是______。装置B中的物质是______(填试剂名称)。
②若反应后装置D、E分别增重4.0g、4.4g,则a中一定含有______;装置C中的现象是______。
五、计算题
21.将铁粉和铜粉的混合物10g,放入100g的稀盐酸中,恰好完全反应。此时烧杯内各物质的总质量为109.8g。请计算:
(1)根据质量守恒定律,计算反应后生成氢气的质量________。
(2)计算混合物中含铜的质量_____。
22.小刚同学想测定黄铜(铜锌合金)中铜的质量分数,他取20g黄铜样品,加入足量稀硫酸,反应后生成了0.2g气体,请你帮他计算该合金中铜元素的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A. 地铁建设大大缓解了哈市的交通压力,使市民出行更顺畅,正确;B. 地铁的轨道材料是采用抗腐蚀性较好的钢制成的,错误;C. 在地铁车厢内,安装了塑料座椅,塑料属于合成材料,正确;D. 地铁站的电动扶梯扶手是不锈钢制成的,不锈钢属于金属材料,正确。故选B。
2.A
【详解】A、合金的熔点比组成它的成分金属的熔点低,故A错误,符合题意;
B、铜具有良好的导电性,叙述正确,不符合题意;
C、铁锅炒菜是利用铁的导热性,叙述正确,不符合题意;
D、铝制成铝箔是利用铝的延展性,叙述正确,不符合题意;
故选A。
3.B
【详解】A、由于CO具有毒性,三氧化二碳化学性质与一氧化碳相似,可判断C2O3是一种有毒气体,正确;
B、由于CO不能使澄清石灰水变浑浊,三氧化二碳化学性质与一氧化碳相似,可判断C2O3不能使澄清石灰水变浑浊,错误;
C、由于CO具有还原性,而三氧化二碳化学性质与一氧化碳相似,可判断C2O3具有还原性,在一定条件下能还原氧化铁,正确;
D、由于CO具有可燃性,而三氧化二碳化学性质与一氧化碳相似,可判断C2O3具有可燃性,在O2中充分燃烧的产物是CO2,正确。
故选B
4.B
【详解】A、生铁的含碳量是2%﹣4.3%;钢中碳的含量是0.03%﹣2%,故A不正确;
B、动植物体内都含铁元素,故B正确;
C、纯铁质软,故C不正确;
D、银的导电性大于铁的导电性,故D不正确。故选B。
5.B
【详解】A、化合物中各元素的化合价代数和为0。NiO中O元素化合价为-2价,Ni的化合价为+2价。正确。
B、反应中NiO失去氧,发生还原反应。 错误。
C、该反应是单质与化合物反应生成单质与化合物的反应,属于置换反应。正确。
D、含镍不锈钢含有多种物质,属于混合物。正确。
故选B。
6.C
【详解】A、金属能和稀盐酸反应生成气体,但是能和稀盐酸反应生成气体的物质不一定是金属,还有可能是碳酸盐,A错误。
B、单质是由同种元素组成的纯净物,所以由同种元素组成的物质不一定是单质还有可能是混合物,如红磷和白磷,B错误。
C、铜锈的主要成分是Cu2(OH)2CO3,根据质量守恒,反应前后元素种类不变,所以铜生锈可能与H2O、CO2、O2有关,C正确。
D、分子由原子构成,二氧化碳分子中不含氧分子,D错误。
故选:C。
7.D
【详解】A、不是所有金属都是呈银白色的,如铜是紫红色,错误;
B、不是金属在空气中都易被氧化,如金即使在高温下也不容易和氧气反应,错误;
C、黄铜和青铜都是铜的合金,都是混合物,错误;
D、生铁和钢都属于铁的合金,但含碳量不同,正确;
故选D。
8.B
【详解】一定量镁条中加入足量稀盐酸,镁和盐酸反应生成氯化镁和氢气。A. 镁条的质量逐渐减少,不符合题意;B. 反应前氢气的质量为零,反应中氢气的质量增多,镁反应完,氢气的质量不再增加,符合题意;C. 水不是该反应的反应物,也不是生成物,故反应中,稀盐酸中水的质量不变,不符合题意;D. 溶液中氢元素的质量被置换生成氢气,所以溶液中氢元素的质量减少,不符合题意。故选B。
点睛:图像的问题主要是结合化学反应分析图的起点的位置,变化趋势,终点的位置是否正确。
9.B
【详解】A、铝是一种金属单质,是由铝原子构成的,此选项说法错误,不符合题意;
B、金属材料包括纯金属和它们的合金,故铝锰合金属于金属材料,此选项说法正确,符合题意;
C、铝锰合金的硬度大,是因为合金比组成它们的纯金属的硬度大,不能说明物质的微粒间不存在间隙,此选项说法错误,不符合题意;
D、将纯金属制成合金,就改变了金属的内部结构,所以合金中原子排列方式与纯金属中原子排列方式不同,此选项说法错误,不符合题意。
故选B。
10.C
【详解】A、M反应时间较短,说明M比N活泼,该选项说法不正确;
B、M反应生成氢气多,生成H2的体积大小关系:N<M,该选项说法不正确;
C、生成氢气的质量=金属质量×化合价/相对原子质量,M、N在生成物中均为+2价,质量相同,相对原子质量越大,生成的氢气质量越小,N反应生成的氢气质量较小,因此相对原子质量大小关系:N>M,该选项说法正确;
D、反应生成的氢气中的氢元素完全来自于盐酸,生成氢气质量越大,消耗盐酸越多,M反应生成氢气多,因此M消耗盐酸多,反应消耗盐酸的质量关系:N<M,该选项说法不正确。
故选:C。
11.B
【详解】A、回收废旧金属,有利于保护金属资源,故A 正确;
B、大量使用化肥和农药既造成浪费,又会污染环境,故B错误;
C、地沟油经化学方法处理制成燃油,实现变废为宝,故C正确;
D、新能源汽车的开发与使用,减少化石能源的消耗,可减少汽车尾气对空气的污染,故D正确。故选B。
12.B
【详解】现有甲、乙、丙三种金属,采用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,甲能与盐溶液反应生成乙,说明甲的活动性比乙强;丙能与盐溶液反应生成甲,说明丙的活动性比甲强;丙能与盐溶液反应生成乙,说明丙的活动性比乙强;则三种金属活动性由强到弱的顺序是丙、甲、乙。故选B。
13. Ag 2C2H5OH
【详解】(1)导电性最好的金属是银,银的化学式为:Ag;
(2)硝酸铁中铁元素的化合价是+3价,元素化合价的表示方法是在化学式该元素的上方用正负号和数字表示,正负号标在数字前面。故硝酸铁中铁元素的化合价表示为:;
(3)分子用化学式表示,多个分子就是在化学式前面加上相应的数字,故2个乙醇分子表示为:2C2H5OH。
14. 合成材料
【详解】(1)炼铁的原理是利用赤铁矿中的氧化铁与一氧化碳反应生成铁和二氧化碳, 注意配平方程式,前后均有气体,不需加气体符号。
(2)聚酯塑料是人工合成的有机物,属于合成材料。
15.(1)发热时间较短(合理即可)
(2)保温材料
(3) 过滤 铜、炭粉、蛭石
(4)B
【详解】(1)根据图像对比可知自制暖足贴与市售的暖足贴相比,发热时间较短,难以长时间使用;
(2)自制的暖足贴与市售的制作材料相比少了保温材料蛭石,则发热差异除了与暖足贴中各成分质量配比有关,还可能与保温材料的性质有关;
(3)步骤III为将固体与溶液分离的操作,则为过滤;该粉末中含有铁粉、炭粉、蛭石、氯化钠,加水溶解后过滤得到的固体A为铁粉、炭粉、蛭石,则加入足量的硫酸铜溶液,其中铁能与硫酸铜反应生成铜与硫酸亚铁,故反应后过滤得到的固体B为铜、炭粉、蛭石的混合物;
(4)A、根据上述分析可知固体B为铜、炭粉、蛭石的混合物,步骤IV为固体B在空气中灼烧,其中铜能与氧气反应生成氧化铜,炭粉能与氧气反应生成二氧化碳,则至少发生2个化学反应,故选项说法正确;
B、步骤IV中的炭粉反应后完全转化为CO2,CO2通入澄清的石灰水反应后生成CaCO3沉淀与H2O,反应前后碳元素质量不变,则设生成的CO2的质量为x,,得出x=0.44m2,故选项说法错误;
C、设氧化铜的质量为y
则蛭石的质量=m3-y
炭粉的质量=,
根据铜元素守恒得出Cu的质量=
则m1=0.8y+0.12m2+(m3-y)
y= 5m3-5m1+0.6m2,故选项说法正确;
故选B。
16.(1)光合作用;太阳能(或风能、地热能等)
(2) 置换反应
【详解】(1)常见绿色能源包括:太阳能、风能、地热能、潮汐能、生物质能、氢气和核能;
(2)由微观示意图可知:碳与水在高温条件下反应生成一氧化碳和氢气,该反应化学方程式:,一种单质和一种化合物反应生成另一种单质和另一种化合物的反应叫做置换反应,该反应基本反应类型为:置换反应。
17. Ca(OH)2 化合反应 黑色固体变红色,澄清石灰水变浑浊
【分析】B是一种生活中常用于灭火的物质,为二氧化碳;F相对分子质量最大,所给物质中氧化铁相对分子质量最大,故F为氧化铁;二氧化碳能碳及氢氧化钙反应,氢氧化钙只能和二氧化碳反应,故A为氢氧化钙、C为碳;碳可以和氧化铁、氧化铜反应,则D为氧化铜;氧化铜能和一氧化碳反应,故E为一氧化碳;代入推理正确;
【详解】(1)由上述分析可知,A物质的化学式Ca(OH)2。
(2)B-C反应为二氧化碳和碳在高温下生成一氧化碳,符合多变一的特点,属于化合反应。
(3)C与D反应为碳还原氧化铜生成铜和二氧化碳的反应,现象为黑色固体变红色,澄清石灰水变浑浊。
(4)E与F反应为一氧化碳在高温下和氧化铁反应生成二氧化碳和铁,反应的化学方程式为。
18.(1) 作燃料 H2
(2)氧化铁
(3)
【分析】A是天然气的主要成分,为甲烷;G是红色固体单质,为铜;H为红棕色粉末,为氧化铁;B通电反应,所以B为水;水通电分解生成氢气和氧气,E与F在加热的条件下生成铜,所以E为氢气,F为氧化铜;D和氧化铁在高温下反应,且D为甲烷不完全燃烧的产物,所以D为一氧化碳,I为铁;
(1)
根据以上推断,A为甲烷,有可燃性,可作燃料;E为氢气,化学式为H2;
(2)
D和H发生的反应,即一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,,化合价发生变化的元素是碳元素和铁元素,一氧化碳中碳元素显+2价,二氧化碳中碳元素显+4价,化合价升高,所以一氧化碳为还原剂;氧化铁中铁元素的化合价为+3价,铁中铁元素的化合价为0从,化合价降低,所以氧化铁为氧化剂;
(3)
I生成G的反应,即铁生成铜的反应,可以是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:。
【点睛】
19. 向试管中放入铁片、铜片,分别加入等量的稀盐酸 一支试管中产生气泡,另一支试管中无明显变化,产生气泡的是铁片,无明显变化的是铜片,说明铁的金属活动性比铜强 向试管中放入铜片,加入2mL硝酸银溶液 铜片的表面覆盖一层银白色物质,说明铜的金属活动性比银强
【分析】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析解答。
【详解】解:比较铁、铜的活动性,可利用铁能与稀盐酸反应生成氯化亚铁溶液和氢气,铜不与稀盐酸反应,向试管中放入铁片、铜片,分别加入等量的稀盐酸,产生气泡的是铁片,无明显变化的是铜片,说明铁的金属活动性比铜强;
比较铜、银的活动性,可向试管中放入铜片,加入2mL硝酸银溶液,铜片的表面覆盖一层银白色物质,说明铜的金属活动性比银强。
20.(1)+2
(2) 实验1与实验2 加快 气体无色无味,不可能是SO2 反应物中无C元素,不可能生成CO2
(3) 检验气体a中是否有水 浓硫酸 甲烷、氢气 CH4、H2 黑色固体逐渐变红
【解析】(1)
根据化合物中正负化合价代数和为零,则Cu4(OH)6SO4中氧元素的化合价为-2价,氢元素化合价为+1价,硫元素的化合价为+6价,设铜元素的化合价为x, ,解得x=+2,则Cu4(OH)6SO4中铜元素的化合价为+2;
(2)
①根据表格中的实验现象可知,能说明A1片和铜盐溶液反应速率与反应物的浓度有关的两组实验是实验1和实验2;
铜盐溶液中的C1-能加快反应速率,即对反应速率起加快作用;
铝与空气中的氧气反应生成氧化铝,化学方程式为;
②该组反应中产生的无色、无味的气体是可能是CO2、SO2、H2中的一种,但不可能是二氧化硫,二氧化硫有刺激性气味,由于气体无色无味,不可能是SO2;根据质量守恒定律,反应物中无C元素,不可能生成CO2;
(3)
①装置A是无水硫酸铜,无水硫酸铜粉末为白色固体,遇水变蓝色,无水硫酸铜的作用是检验气体a中是否有水;装置B中的物质是要干燥气体并且吸收水蒸气,由于浓硫酸具有吸水性,可以干燥气体并吸收水蒸气,则装置B是浓硫酸;
②若反应后装置D、E分别增重4.0g、4.4g,说明装置D、E增重的分别是水和二氧化碳的质量,根据元素守恒,则a中一定含有氢气和甲烷气体;
氢气和甲烷气体均能与氧化铜反应生成铜,则在装置C中观察的现象为黑色粉末变为红色。
21. 0.2g 解:设铁的质量为x
x=5.6g
混合物中含铜的质量=
答:混合物中含铜的质量为4.4克。
【详解】(1)根据质量守恒定律,化学反应前后,物质的总质量变,故反应后生成氢气的质量=
(2)见答案。
22.解:设锌的质量为x
x=6.5g
铜的质量分数为。
答:该合金中铜元素的质量分数67.5%。
【分析】铜活动性较弱,不与酸发生反应;锌与稀硫酸反应生成氢气和硫酸锌。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
