2023届新高考化学模拟冲刺卷(湖南卷)(含解析)
文档属性
| 名称 | 2023届新高考化学模拟冲刺卷(湖南卷)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-04 23:11:00 | ||
图片预览


文档简介
2023届新高考化学模拟冲刺卷(湖南卷)
可能用到的相对原子质量:H-1 C-12 O-16 Si-28 Cl-35.5 Ti-48 Cu-64
一、单项选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学为人类的生产、生活提供了物质保证。下列工业生产原理不属于化学变化的是( )
A.湿法冶炼铜 B.分馏法提炼汽油 C.接触法制取硫酸 D.发酵法生产香醋
2.磷酸奥司他韦是临床常用的抗病毒药物,常用于甲型和乙型流感治疗。其中间体结构如图所示,下列关于该有机物的说法错误的是( )
A.分子中的含氧官能团为醚键、酯基与羰基
B.分子中满足杂化轨道类型的原子对应的元素有3种
C.该有机物可以使溴水褪色
D.1 mol该有机物最多能与发生加成反应
3.下列实验装置和操作均正确的是( )
A析出晶体 B制取并收集氨气 C牺牲阳极法保护铁 D除去中少量
A.A B.B C.C D.D
4.EDTA及其钠盐常用作滴定掩蔽剂,易与形成配合物,下列说法错误的是( )
A.EDTA分子可与水形成氢键 B.EDTA与酸、碱均可发生反应
C.该配合物中的配位数为6 D.该配合物结构不稳定,易解离
5.设表示阿伏加德罗常数的值。下列说法错误的是( )
A.常温下,中含有Si—O极性键的数目为4
B.常温下,16.8g铁粉与足量浓硝酸反应转移电子数为0.9
C.叠氮化铵()可发生爆炸反应:,则每收集标准状况下89.6L气体转移电子数为4
D.1L0.1mol/L的溶液中的粒子总数为0.1
6.下列离子方程式书写正确的是( )
A.碳酸氢铵稀溶液中加入足量烧碱溶液:
B.向溶液中通入等物质的量的:
C.溶液中加入过量的HI溶液:
D.明矾溶液中滴入溶液使恰好完全沉淀:
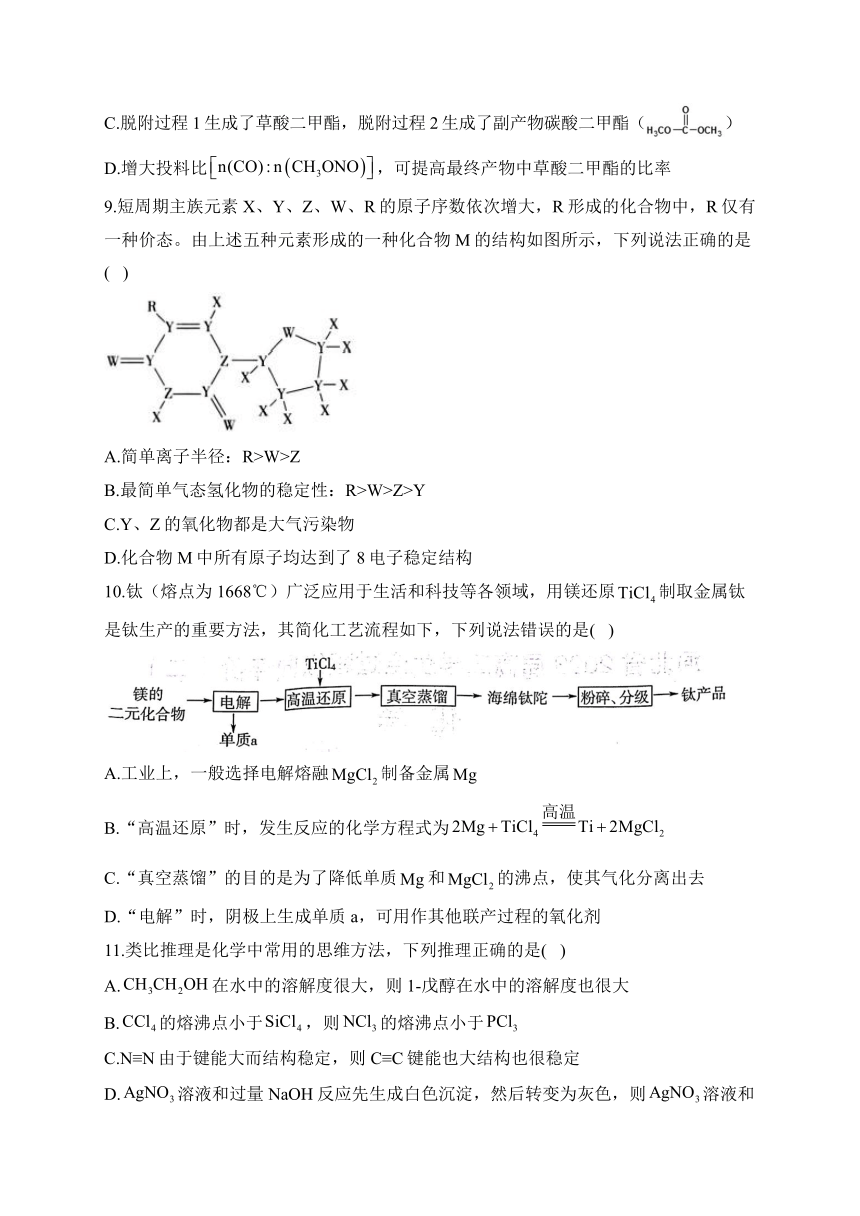
7.新能源汽车在我国蓬勃发展,新能源汽车所用电池多采用三元锂电池,某三元锂电池放电时工作原理如图所示。下列说法错误的是( )
A.充电时,M极有电子流入,发生还原反应
B.锂电池的优点是质量小,电容量大,可重复使用
C.用该电池电解精炼铜,当电池中迁移时,理论上可获得纯铜
D.充电时,N极的电极反应式为
8.草酸二甲酯()是一种重要的化工基本原料,主要用于制药、农药、有机合成,也用作增塑剂。可由CO与亚硝酸甲酯()在Pd催化剂作用下发生反应:+2NO,反应的机理如右图所示,下列说法错误的是( )
A.催化剂Pd参加了化学反应
B.中氮氧双键在Pd表面断裂
C.脱附过程1生成了草酸二甲酯,脱附过程2生成了副产物碳酸二甲酯()
D.增大投料比,可提高最终产物中草酸二甲酯的比率
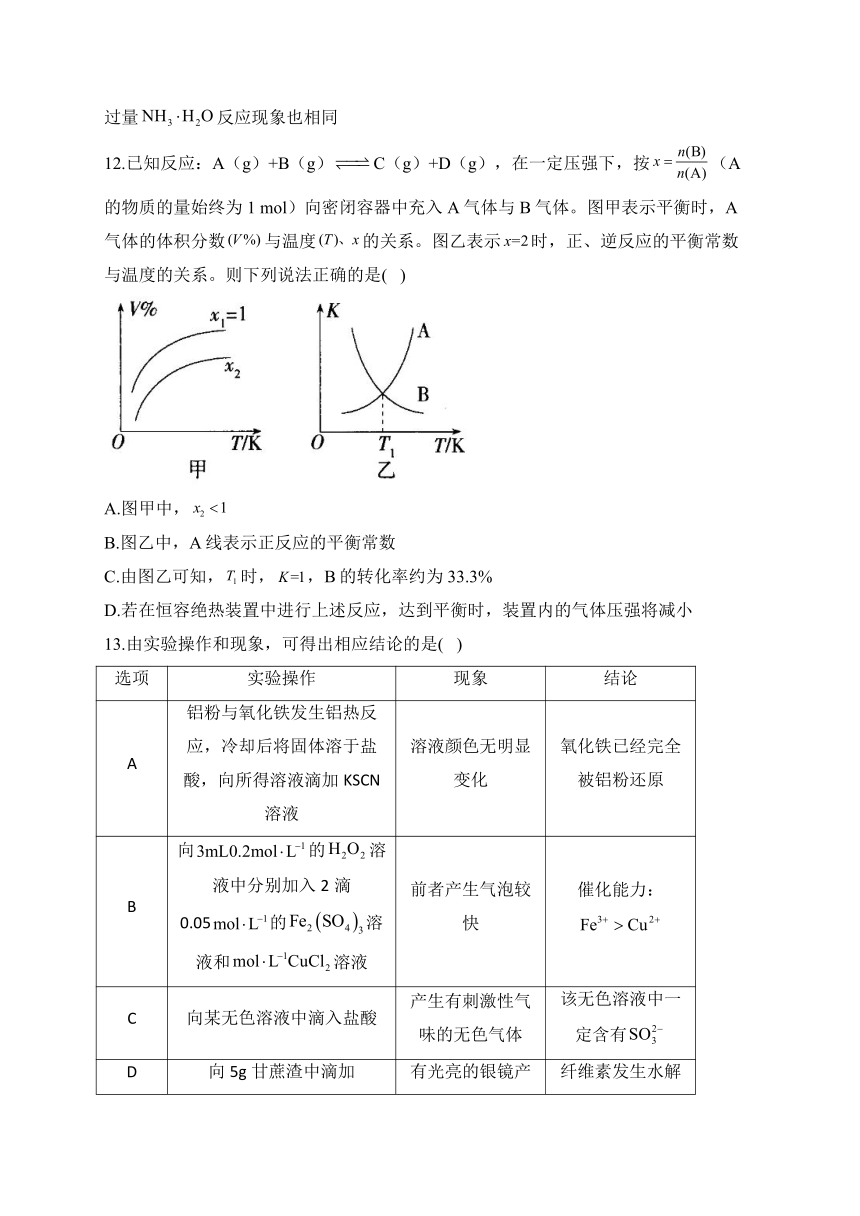
9.短周期主族元素X、Y、Z、W、R的原子序数依次增大,R形成的化合物中,R仅有一种价态。由上述五种元素形成的一种化合物M的结构如图所示,下列说法正确的是( )
A.简单离子半径:R>W>Z
B.最简单气态氢化物的稳定性:R>W>Z>Y
C.Y、Z的氧化物都是大气污染物
D.化合物M中所有原子均达到了8电子稳定结构
10.钛(熔点为1668℃)广泛应用于生活和科技等各领域,用镁还原制取金属钛是钛生产的重要方法,其简化工艺流程如下,下列说法错误的是( )
A.工业上,一般选择电解熔融制备金属
B.“高温还原”时,发生反应的化学方程式为
C.“真空蒸馏”的目的是为了降低单质和的沸点,使其气化分离出去
D.“电解”时,阴极上生成单质a,可用作其他联产过程的氧化剂
11.类比推理是化学中常用的思维方法,下列推理正确的是( )
A.在水中的溶解度很大,则1-戊醇在水中的溶解度也很大
B.的熔沸点小于,则的熔沸点小于
C.N≡N由于键能大而结构稳定,则C≡C键能也大结构也很稳定
D.溶液和过量NaOH反应先生成白色沉淀,然后转变为灰色,则溶液和过量反应现象也相同
12.已知反应:A(g)+B(g)C(g)+D(g),在一定压强下,按(A的物质的量始终为1 mol)向密闭容器中充入A气体与B气体。图甲表示平衡时,A气体的体积分数与温度的关系。图乙表示时,正、逆反应的平衡常数与温度的关系。则下列说法正确的是( )
A.图甲中,
B.图乙中,A线表示正反应的平衡常数
C.由图乙可知,时,,B的转化率约为33.3%
D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将减小
13.由实验操作和现象,可得出相应结论的是( )
选项 实验操作 现象 结论
A 铝粉与氧化铁发生铝热反应,冷却后将固体溶于盐酸,向所得溶液滴加KSCN溶液 溶液颜色无明显变化 氧化铁已经完全被铝粉还原
B 向的溶液中分别加入2滴0.05的溶液和溶液 前者产生气泡较快 催化能力:
C 向某无色溶液中滴入盐酸 产生有刺激性气味的无色气体 该无色溶液中一定含有
D 向5g甘蔗渣中滴加10mL75%的浓硫酸,加热;而后过滤,向滤液中加入固体NaOH,调节溶液pH=9,加入银氨溶液2mL,水浴加热 有光亮的银镜产生 纤维素发生水解产生了还原糖
A.A B.B C.C D.D
14.25℃时,向20mL溶液中滴加0.1的NaOH溶液,滴定曲线如图1,各种含磷微粒占含磷微粒总量的物质的量分数随pH变化关系如图2(已知点的纵坐标为0.5)。下列说法正确的是( )
A.点溶液显中性
B.点溶液中存在关系:
C.点所加NaOH溶液为20mL,则该点溶液中微粒浓度大小关系:
D.点溶液中的水解离子方程式为
二、非选择题:共58分。考生根据要求作答。
15.(14分)四氯化钛()是无色或淡黄色液体,熔点为30℃,沸点为136.4℃,极易水解,在工业生产中有广泛的用途。在实验室用钛铁矿()为原料制备的实验装置如图所示(实验原理:)
已知:(1)熔点为306℃,沸点为316℃,极易水解;
(2)①;②。
请回答下列问题:
(1)装置B中盛放的试剂为_______。
(2)装置E中冷凝水应从_______(填“a”或“b”)通入。
(3)装置A中发生反应的化学方程式为_______。
(4)该制备装置不足之处是_______。
(5)停止滴加浓盐酸并关闭止水夹a,将装置c中所得物质转移到装置E中进行相关操作。装置E的锥形瓶中得到的物质是_______。
(6)已知:,测定产品纯度的实验如下:
①E装置相关操作结束后,待锥形瓶中的液体冷却至室温,准确称取14.00g产品,置于盛有60.00mL蒸馏水的水解瓶中,盖塞后摇动至完全水解,过滤后将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL2.900mol/L标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X溶液为指示剂,用0.1000mol/LKSCN溶液滴定过量溶液,达到滴定终点时共用去10.00mLKSCN溶液。
试剂X为_______(用化学式表示),已知产品中杂质不参与反应,根据以上步骤计算产品中的质量分数为_______;若装KSCN溶液的滴定管滴定前尖嘴有气泡,滴定后气泡消失,所测定产品的质量分数将会_______(选填“偏大”、“偏小”或“不变”)。
16.(15分)某课题组合成了一种非天然氨基酸X,合成路线如下(Ph—表示苯基):
已知:
请回答:
(1)下列说法正确的是________。
A.化合物B的分子结构中含有亚甲基和次甲基
B.谱显示化合物F中有2种不同化学环境的氢原子
C.G→H的反应类型是取代反应
D.化合物X的分子式是
(2)化合物A的结构简式是_____;化合物E的结构简式是______。
(3)C→D的化学方程式是_____。
(4)写出3种同时符合下列条件的化合物H的同分异构体的结构简式(不包括立体异构体)_____。
①包含;
②包含(双键两端的C不再连接H)片段;
③除②中片段外只含有1个
(5)以化合物F、溴苯和甲醛为原料,设计下图所示化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)。
(也可表示为)
17.(14分)钯催化剂(主要成分为Pd、,还含少量铁、铜等)在使用过程中,Pd易被氧化为难溶于酸的PdO而失活。一种从废钯催化剂中回收海绵钯的工艺流程如下图:
(1)“还原I”加入甲酸的目的是还原_______(填化学式)。
(2)“酸浸”过程用盐酸和,Pd转化为的离子方程式为_______。
(3)“还原II”中氧化剂和还原剂的物质的量之比为_______。
(4)酸浸在一定温度下充分浸取钯,得到氯亚钯酸()溶液,钯的浸出率与反应的温度、HCl浓度的关系如图所示。最佳的浸取温度是_______,最佳的HCl浓度为_______。
(5)“离子交换”和“洗脱”可简单表示为(RCl为阴离子交换树脂):,“离子交换”流出液中阳离子有、_______(填离子符号)。
(6)“沉钯”过程中先加入氨水得到溶液,再加入盐酸后得到沉淀,用化学平衡知识解释加入盐酸的作用_______。
(7)已知:常温下,。假设在流出液中各离子的浓度均为0.1mol/L,加入氨水调节pH后过滤,滤液经一系列操作可以得到。需调节pH的范围是_______。(当离子浓度小于时认为已沉淀完全)。
18.(15分)研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼()。
已知:①
②
③
则的为_______。
(2)碘蒸气存在能大幅度提高的分解速率,反应历程为:
第一步:(快反应)
第二步:(慢反应)
第三步:(快反应)
实验表明,含碘时分解速率方程(k为速率常数)。下列表述正确的是_______。
A.分解反应中,k值与碘蒸气浓度大小有关
B.v(第二步的逆反应)C.IO为反应的催化剂
D.第二步活化能比第三步大
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应。实验测得:。其中、分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。
①达到平衡后,仅升高温度,增大的倍数_______(填“大于”“小于”或“等于”)增大的倍数。
②一定温度下在刚性密闭容器中充入CO、NO和物质的量之比为2:2:1,压强为kPa。达平衡时压强为0.9kPa,则_______。
(4)我国科技人员计算了在一定温度范围内下列反应的平衡常数Kp:
①
②
绘制和的线性关系图如图所示:(已知:pKp=-1gKp)
①由图可知,_______0(填“>”或“<”)。
②反应的K=_______(用表示);该反应的______0(填“>”或“<”),写出推理过程_______。
答案以及解析
1.答案:B
解析:湿法冶炼铜中发生了置换反应,A项不符合题意;分馏法提炼汽油,是利用物质的沸点不同进行分离,属于物理变化,B项符合题意;接触法制取硫酸,二氧化硫转化为三氧化硫,最后转化为硫酸,C项不符合题意;发酵法生产香醋的过程中,由淀粉转化为乙醇,最后转化为乙酸,D项不符合题意。
2.答案:A
解析:分子中的含氧官能团为醚键、酯基和酰胺基,A错误;满足杂化轨道类型的原子为C、N、O,B正确;该有机物含有官能团碳碳双键,可以使溴水褪色,C正确;1 mol该有机物只有1 mol碳碳双键,和发生加成反应最多消耗1 mol ,D正确。
3.答案:C
解析:胶头滴管不能伸入试管,故A错误;
氯化钙会与氨气反应,故不能干燥氨气,故B错误;
锌作为阳极失去电子保护铁电极,故C正确;
会被碳酸钠溶液吸收,除去中少量应通入饱和碳酸氢钠溶液,故D错误。
则答案为C。
4.答案:D
解析:A.EDTA分子、水分子均含有O原子,故EDTA分子可与水形成氢键,A正确;
B.EDTA含有羧基,可以和碱反应,也含有叔胺,可以和酸反应,B正确;
C.该配合物中的配位数为6,C正确;
D.易与形成配合物,说明该配合物结构稳定,不易解离,D错误;
故选D。
5.答案:B
解析:本题考查阿伏加德罗常数。是原子晶体,晶体中每个Si原子连接4个O原子,所以1 mol 中含有Si—O极性键数目为,A正确;常温下铁被浓硝酸钝化,反应不能进行,转移电子数无法计算,B错误;反应中氢元素化合价由+1变为0,得1个电子,4mol氢原子转移电子数4mol,标况下收集气体的总物质的量为,即4mol气体中有2mol氮气和2mol氢气,爆炸时转移电子数为,C正确;由题知物质的量为0.1mol,根据物料守恒,含碳微粒的总数为,D正确。
6.答案:A
解析:碳酸氢铵稀溶液中加入足量烧碱溶液,无氨气逸出:,A正确;的还原性大于的还原性,氯气先与反应,将氧化完后,再氧化,根据得失电子守恒可知,等物质的量的刚好氧化,不被氧化,正确的离子方程式为,B错误;溶液中加入过量的HI溶液,正确离子方程式为,C错误;明矾溶液中滴入溶液使恰好完全沉淀时,的物质的量之比是1:4,二者反应生成,离子方程式为,D错误。
7.答案:C
解析:A.充电时,M极连接外接电源的负极,M为阴极,阴极有电子流入,发生还原反应,A正确;
B.锂电池的能量比较高,优点是质量小,电容量大,可重复使用,B正确;
C.根据电子守恒可知,,当电池中迁移时,理论上可获得32g纯铜,C错误;
D.充电时,N极为阳极,发生氧化反应,电极反应式为,D正确;
故选C。
8.答案:B
9.答案:B
解析:R形成的化合物中R仅有一种价态,结合图示可知R为F元素,由此分析可得X、Y、Z、W依次为H、C、N、O。
简单离子半径大小:,A项错误;
Y、Z的氧化物有CO、、NO、等,其中不是大气污染物,C项错误;
化合物M中氢原子属于2电子稳定结构,D项错误。
10.答案:D
解析:由于的熔点高,电解制备金属能耗大,工业生产一般采用电解熔融的方法,A项正确;还原时,发生反应的化学方程式为,B项正确;真空蒸馏时,需要将金属、分离除去,由于金属钛的熔点很高,因此真空蒸馏的目的是为了降低单质和的沸点,C项正确;工业生产中,阳极上发生反应2,可用作其他联产过程的氧化剂,D项错误。
11.答案:B
解析:A.在水中的溶解度很大,乙醇与水的结构相似,而1-戊醇与水的结构比乙醇与水的结构相差大,因此1-戊醇在水中的溶解度比乙醇在水中的溶解度减小,A错误;B.的熔沸点小于都是分子晶体,物质的相对分子质量越大,范德华力越大,熔沸点越高,因此的熔沸点小于,B正确;C.N≡N由于键能大而结构稳定,而C≡C的键能也大,但结构不稳定,一般断裂其中的一根或两根键,C错误;D.溶液和过量NaOH反应先生成白色沉淀,然后转变为灰色,而溶液和过量反应,先生成沉淀,后沉淀逐渐溶解,两者现象不相同,D错误;故合理选项是B。
12.答案:C
解析:增大B的量,平衡正向移动,A的体积分数减小,则图甲中,A错误;由图甲可知,升高温度A的体积分数增大,可知正反应为放热反应,则升高温度正反应的平衡常数减小,图乙中曲线B表示正反应的平衡常数,B错误;由图乙可知,时,,设平衡时B转化的物质的量为,容器的体积为,列三段式:
,解得,则B的转化率=,C正确;由于正反应为气体分子数不变的放热反应,恒容绝热装置中进行题述反应,气体物质的量不变,压强随温度的变化而变化,则达到平衡时,装置内的气体压强将增大,D错误。
13.答案:D
解析:铝粉与氧化铁发生铝热反应生成氧化铝和铁,若反应后的固体中含有少量未反应的,冷却后溶于盐酸,由于可以被单质Fe还原为,则滴加KSCN溶液后也不会有明显颜色变化,A错误;由于和所含阴离子种类不相同,则不能比较和的催化能力,B错误;也可以与反应产生有刺激性气味的无色气体,C错误;甘蔗渣的主要成分为纤维素,在75%的浓硫酸、加热条件下会发生水解,其水解产物在碱性条件下能发生银镜反应,说明有还原糖生成,D正确。
14.答案:C
解析:由图1和图2可知,次磷酸为一元弱酸,由点可知,图2中点的纵坐标为0.5,溶液中、pH=5,溶液呈酸性,A项错误;点溶液中溶质为等浓度的和,溶液中存在电荷守恒:①,存在元素质量守恒:②,①×2-②整理得到,B项错误;点溶液中溶质为,此时因次磷酸根离子水解而使溶液呈碱性,所以溶液中的各微粒浓度大小关系为,C项正确;点溶液中溶质为和NaOH,水解的离子方程式为,D项错误。
15.答案:(1)浓硫酸
(2)a
(3)
(4)没有处理CO、尾气;空气中的水蒸气会进入D中,使产品发生水解
(5)
(6);95%;偏小
解析:(1)根据上述分析可知,装置B的作用是除去氯气中的水蒸气,所以盛放的试剂为浓硫酸;
(2)装置E为蒸馏装置,冷凝水从从a口进,b口出,达到冷凝导气的作用,故答案为:a;
(3)装置A中氯酸钾与浓盐酸常温下发生归中反应,生成氯气、氯化钾和水,发生反应的化学方程式为;
(4)根据题给信息知极易水解,所以该装置的不足之处是缺少吸收空气中水蒸气进入的装置,空气中水蒸气会进入C中使产品发生水解,也没有无尾气处理装置,CO与剩余会污染环境,故答案为:没有处理CO、尾气;空气中的水蒸气会进入D中,使产品发生水解;
(5)由分析可知,装置E为分离氯化铁和氯化钛的蒸馏装置,根据题给的沸点可知,蒸馏出来的是;
(6)由题意可知,硝酸银消耗氯离子,过量的硝酸银用硫氰化钾滴定,铁离子可与硫氰化钾显红色,作其指示剂,因银离子只与硝酸根离子可共存,所以加入的试剂X应为硝酸铁;与硫氰化钾溶液反应的过量硝酸银的物质的量为,则与溶液中氯离子反应的硝酸银的物质的量为,可得14.0g产品中的质量分数为;装KSCN溶液的滴定管滴定前尖嘴有气泡,滴定后气泡消失,会导致滴定过量硝酸银消耗硫氰化钾溶液体积偏大,使得氯离子的物质的量减小,的质量分数测定结果偏小,故答案为:95%;偏小。
16.(1)答案:CD
解析:A项,化合物B中存在亚甲基(),但不存在次甲基(),错误;B项,物质F中只有1种化学环境的H原子,错误;C项,G→H的反应可以看作取代了—MgBr,为取代反应,正确;D项,根据X的键线式可得X的分子式为,正确。
(2)答案:
解析:化合物A与HCl发生取代反应,3个—OH被3个—Cl取代之后得到物质B,根据A的分子式可以得出该物质是。由转化关系可知D的结构简式为,由已知信息可得E的结构简式为。
(3)答案:
解析:C→D为卤代烃在氢氧化钠醇溶液中发生的消去反应。
(4)答案:;;
解析:H的分子式为,其同分异构体中包含了、和另外一个,只剩下1个碳原子和1个不饱和度。根据条件可判断,剩余结构中应该含有环状结构,可在环内也可在环外,碳碳双键应该在环内。根据碳原子个数可以判断是三元环或四元环。
(5)答案:
解析:原料是、、HCHO,合成的目标物质为。参考题干中的F→G与第二条已知信息。首先利用已知信息使溴苯发生反应,再利用流程图中F→G的信息可获得以下流程:,接着再利用第二条已知信息的后半部分,,最后利用醇与HBr的取代反应得到目标产物。
17.答案:(1)PdO
(2)
(3)2:1
(4)80℃;5mol/L
(5)
(6)加入盐酸与氨反应,使平衡正向进行,生成
(7)3~4.5
解析:(1)“还原I”后进行的操作是酸浸,而PdO难溶于酸,所以需将PdO还原为钯,由此得出加入甲酸的目的是还原PdO。答案为:PdO;
(2)“酸浸”过程中,Pd与盐酸、反应,生成等,离子方程式为。答案为:;
(3)“还原II”中,是用还原,氧化剂中Pd由+2价降低为0价,还原剂中N元素由-2价升高为0价,则氧化剂与还原剂的物质的量之比为2:1。答案为:2:1;
(4)从图中可以看出,当温度达到80℃时,钯的浸出率达到98%以上,温度再升高时,钯的浸出率变化不大,所以最佳的浸取温度是80C;当HCl浓度达到5mol/L时,钯的浸出率达到99%,再增大HCl的浓度,钯的浸出率变化不大,所以最佳的HCl浓度为5mol/L。答案为:80℃;5mol/L;
(5)因为用盐酸和进行“酸浸”后,只得到难溶物,所以浸出液中应含有,从而得出“离子交换”流出液中阳离子有。答案为;
(6)“沉钯”过程中先加入氨水得到溶液,再加入盐酸后得到沉淀,则加入的HCl应与结合为,从而得出加入盐酸的作用是加入盐酸与氨反应,使平衡正向进行,生成。答案为:加入盐酸与氨反应,使平衡正向进行,生成;
(7)加入氨水调节pH后,完全转化为,不参与反应,对来说,;对来说,,,所以需调节pH的范围是3~4.5。答案为:3~4.5。
18.答案:(1)
(2)BD
(3)①小于;②或
(4)①<;②;③<;④设,由图可知:则:,即,因此该反应正反应为放热反应
解析:(1)由盖斯定律可知,①-2×②-4×③得反应:,则;
(2)A.k为速率常数受温度、催化剂、固体表面积性质等影响,不受浓度影响,A错误;B.平衡时v(正)=v(逆),第二步反应为慢反应,反应速率较慢,则v(第二步的逆反应)也较慢,第三步反应为快反应,反应速率较快,故v(第二步的逆反应)
可能用到的相对原子质量:H-1 C-12 O-16 Si-28 Cl-35.5 Ti-48 Cu-64
一、单项选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学为人类的生产、生活提供了物质保证。下列工业生产原理不属于化学变化的是( )
A.湿法冶炼铜 B.分馏法提炼汽油 C.接触法制取硫酸 D.发酵法生产香醋
2.磷酸奥司他韦是临床常用的抗病毒药物,常用于甲型和乙型流感治疗。其中间体结构如图所示,下列关于该有机物的说法错误的是( )
A.分子中的含氧官能团为醚键、酯基与羰基
B.分子中满足杂化轨道类型的原子对应的元素有3种
C.该有机物可以使溴水褪色
D.1 mol该有机物最多能与发生加成反应
3.下列实验装置和操作均正确的是( )
A析出晶体 B制取并收集氨气 C牺牲阳极法保护铁 D除去中少量
A.A B.B C.C D.D
4.EDTA及其钠盐常用作滴定掩蔽剂,易与形成配合物,下列说法错误的是( )
A.EDTA分子可与水形成氢键 B.EDTA与酸、碱均可发生反应
C.该配合物中的配位数为6 D.该配合物结构不稳定,易解离
5.设表示阿伏加德罗常数的值。下列说法错误的是( )
A.常温下,中含有Si—O极性键的数目为4
B.常温下,16.8g铁粉与足量浓硝酸反应转移电子数为0.9
C.叠氮化铵()可发生爆炸反应:,则每收集标准状况下89.6L气体转移电子数为4
D.1L0.1mol/L的溶液中的粒子总数为0.1
6.下列离子方程式书写正确的是( )
A.碳酸氢铵稀溶液中加入足量烧碱溶液:
B.向溶液中通入等物质的量的:
C.溶液中加入过量的HI溶液:
D.明矾溶液中滴入溶液使恰好完全沉淀:
7.新能源汽车在我国蓬勃发展,新能源汽车所用电池多采用三元锂电池,某三元锂电池放电时工作原理如图所示。下列说法错误的是( )
A.充电时,M极有电子流入,发生还原反应
B.锂电池的优点是质量小,电容量大,可重复使用
C.用该电池电解精炼铜,当电池中迁移时,理论上可获得纯铜
D.充电时,N极的电极反应式为
8.草酸二甲酯()是一种重要的化工基本原料,主要用于制药、农药、有机合成,也用作增塑剂。可由CO与亚硝酸甲酯()在Pd催化剂作用下发生反应:+2NO,反应的机理如右图所示,下列说法错误的是( )
A.催化剂Pd参加了化学反应
B.中氮氧双键在Pd表面断裂
C.脱附过程1生成了草酸二甲酯,脱附过程2生成了副产物碳酸二甲酯()
D.增大投料比,可提高最终产物中草酸二甲酯的比率
9.短周期主族元素X、Y、Z、W、R的原子序数依次增大,R形成的化合物中,R仅有一种价态。由上述五种元素形成的一种化合物M的结构如图所示,下列说法正确的是( )
A.简单离子半径:R>W>Z
B.最简单气态氢化物的稳定性:R>W>Z>Y
C.Y、Z的氧化物都是大气污染物
D.化合物M中所有原子均达到了8电子稳定结构
10.钛(熔点为1668℃)广泛应用于生活和科技等各领域,用镁还原制取金属钛是钛生产的重要方法,其简化工艺流程如下,下列说法错误的是( )
A.工业上,一般选择电解熔融制备金属
B.“高温还原”时,发生反应的化学方程式为
C.“真空蒸馏”的目的是为了降低单质和的沸点,使其气化分离出去
D.“电解”时,阴极上生成单质a,可用作其他联产过程的氧化剂
11.类比推理是化学中常用的思维方法,下列推理正确的是( )
A.在水中的溶解度很大,则1-戊醇在水中的溶解度也很大
B.的熔沸点小于,则的熔沸点小于
C.N≡N由于键能大而结构稳定,则C≡C键能也大结构也很稳定
D.溶液和过量NaOH反应先生成白色沉淀,然后转变为灰色,则溶液和过量反应现象也相同
12.已知反应:A(g)+B(g)C(g)+D(g),在一定压强下,按(A的物质的量始终为1 mol)向密闭容器中充入A气体与B气体。图甲表示平衡时,A气体的体积分数与温度的关系。图乙表示时,正、逆反应的平衡常数与温度的关系。则下列说法正确的是( )
A.图甲中,
B.图乙中,A线表示正反应的平衡常数
C.由图乙可知,时,,B的转化率约为33.3%
D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将减小
13.由实验操作和现象,可得出相应结论的是( )
选项 实验操作 现象 结论
A 铝粉与氧化铁发生铝热反应,冷却后将固体溶于盐酸,向所得溶液滴加KSCN溶液 溶液颜色无明显变化 氧化铁已经完全被铝粉还原
B 向的溶液中分别加入2滴0.05的溶液和溶液 前者产生气泡较快 催化能力:
C 向某无色溶液中滴入盐酸 产生有刺激性气味的无色气体 该无色溶液中一定含有
D 向5g甘蔗渣中滴加10mL75%的浓硫酸,加热;而后过滤,向滤液中加入固体NaOH,调节溶液pH=9,加入银氨溶液2mL,水浴加热 有光亮的银镜产生 纤维素发生水解产生了还原糖
A.A B.B C.C D.D
14.25℃时,向20mL溶液中滴加0.1的NaOH溶液,滴定曲线如图1,各种含磷微粒占含磷微粒总量的物质的量分数随pH变化关系如图2(已知点的纵坐标为0.5)。下列说法正确的是( )
A.点溶液显中性
B.点溶液中存在关系:
C.点所加NaOH溶液为20mL,则该点溶液中微粒浓度大小关系:
D.点溶液中的水解离子方程式为
二、非选择题:共58分。考生根据要求作答。
15.(14分)四氯化钛()是无色或淡黄色液体,熔点为30℃,沸点为136.4℃,极易水解,在工业生产中有广泛的用途。在实验室用钛铁矿()为原料制备的实验装置如图所示(实验原理:)
已知:(1)熔点为306℃,沸点为316℃,极易水解;
(2)①;②。
请回答下列问题:
(1)装置B中盛放的试剂为_______。
(2)装置E中冷凝水应从_______(填“a”或“b”)通入。
(3)装置A中发生反应的化学方程式为_______。
(4)该制备装置不足之处是_______。
(5)停止滴加浓盐酸并关闭止水夹a,将装置c中所得物质转移到装置E中进行相关操作。装置E的锥形瓶中得到的物质是_______。
(6)已知:,测定产品纯度的实验如下:
①E装置相关操作结束后,待锥形瓶中的液体冷却至室温,准确称取14.00g产品,置于盛有60.00mL蒸馏水的水解瓶中,盖塞后摇动至完全水解,过滤后将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL2.900mol/L标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X溶液为指示剂,用0.1000mol/LKSCN溶液滴定过量溶液,达到滴定终点时共用去10.00mLKSCN溶液。
试剂X为_______(用化学式表示),已知产品中杂质不参与反应,根据以上步骤计算产品中的质量分数为_______;若装KSCN溶液的滴定管滴定前尖嘴有气泡,滴定后气泡消失,所测定产品的质量分数将会_______(选填“偏大”、“偏小”或“不变”)。
16.(15分)某课题组合成了一种非天然氨基酸X,合成路线如下(Ph—表示苯基):
已知:
请回答:
(1)下列说法正确的是________。
A.化合物B的分子结构中含有亚甲基和次甲基
B.谱显示化合物F中有2种不同化学环境的氢原子
C.G→H的反应类型是取代反应
D.化合物X的分子式是
(2)化合物A的结构简式是_____;化合物E的结构简式是______。
(3)C→D的化学方程式是_____。
(4)写出3种同时符合下列条件的化合物H的同分异构体的结构简式(不包括立体异构体)_____。
①包含;
②包含(双键两端的C不再连接H)片段;
③除②中片段外只含有1个
(5)以化合物F、溴苯和甲醛为原料,设计下图所示化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)。
(也可表示为)
17.(14分)钯催化剂(主要成分为Pd、,还含少量铁、铜等)在使用过程中,Pd易被氧化为难溶于酸的PdO而失活。一种从废钯催化剂中回收海绵钯的工艺流程如下图:
(1)“还原I”加入甲酸的目的是还原_______(填化学式)。
(2)“酸浸”过程用盐酸和,Pd转化为的离子方程式为_______。
(3)“还原II”中氧化剂和还原剂的物质的量之比为_______。
(4)酸浸在一定温度下充分浸取钯,得到氯亚钯酸()溶液,钯的浸出率与反应的温度、HCl浓度的关系如图所示。最佳的浸取温度是_______,最佳的HCl浓度为_______。
(5)“离子交换”和“洗脱”可简单表示为(RCl为阴离子交换树脂):,“离子交换”流出液中阳离子有、_______(填离子符号)。
(6)“沉钯”过程中先加入氨水得到溶液,再加入盐酸后得到沉淀,用化学平衡知识解释加入盐酸的作用_______。
(7)已知:常温下,。假设在流出液中各离子的浓度均为0.1mol/L,加入氨水调节pH后过滤,滤液经一系列操作可以得到。需调节pH的范围是_______。(当离子浓度小于时认为已沉淀完全)。
18.(15分)研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼()。
已知:①
②
③
则的为_______。
(2)碘蒸气存在能大幅度提高的分解速率,反应历程为:
第一步:(快反应)
第二步:(慢反应)
第三步:(快反应)
实验表明,含碘时分解速率方程(k为速率常数)。下列表述正确的是_______。
A.分解反应中,k值与碘蒸气浓度大小有关
B.v(第二步的逆反应)
D.第二步活化能比第三步大
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应。实验测得:。其中、分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。
①达到平衡后,仅升高温度,增大的倍数_______(填“大于”“小于”或“等于”)增大的倍数。
②一定温度下在刚性密闭容器中充入CO、NO和物质的量之比为2:2:1,压强为kPa。达平衡时压强为0.9kPa,则_______。
(4)我国科技人员计算了在一定温度范围内下列反应的平衡常数Kp:
①
②
绘制和的线性关系图如图所示:(已知:pKp=-1gKp)
①由图可知,_______0(填“>”或“<”)。
②反应的K=_______(用表示);该反应的______0(填“>”或“<”),写出推理过程_______。
答案以及解析
1.答案:B
解析:湿法冶炼铜中发生了置换反应,A项不符合题意;分馏法提炼汽油,是利用物质的沸点不同进行分离,属于物理变化,B项符合题意;接触法制取硫酸,二氧化硫转化为三氧化硫,最后转化为硫酸,C项不符合题意;发酵法生产香醋的过程中,由淀粉转化为乙醇,最后转化为乙酸,D项不符合题意。
2.答案:A
解析:分子中的含氧官能团为醚键、酯基和酰胺基,A错误;满足杂化轨道类型的原子为C、N、O,B正确;该有机物含有官能团碳碳双键,可以使溴水褪色,C正确;1 mol该有机物只有1 mol碳碳双键,和发生加成反应最多消耗1 mol ,D正确。
3.答案:C
解析:胶头滴管不能伸入试管,故A错误;
氯化钙会与氨气反应,故不能干燥氨气,故B错误;
锌作为阳极失去电子保护铁电极,故C正确;
会被碳酸钠溶液吸收,除去中少量应通入饱和碳酸氢钠溶液,故D错误。
则答案为C。
4.答案:D
解析:A.EDTA分子、水分子均含有O原子,故EDTA分子可与水形成氢键,A正确;
B.EDTA含有羧基,可以和碱反应,也含有叔胺,可以和酸反应,B正确;
C.该配合物中的配位数为6,C正确;
D.易与形成配合物,说明该配合物结构稳定,不易解离,D错误;
故选D。
5.答案:B
解析:本题考查阿伏加德罗常数。是原子晶体,晶体中每个Si原子连接4个O原子,所以1 mol 中含有Si—O极性键数目为,A正确;常温下铁被浓硝酸钝化,反应不能进行,转移电子数无法计算,B错误;反应中氢元素化合价由+1变为0,得1个电子,4mol氢原子转移电子数4mol,标况下收集气体的总物质的量为,即4mol气体中有2mol氮气和2mol氢气,爆炸时转移电子数为,C正确;由题知物质的量为0.1mol,根据物料守恒,含碳微粒的总数为,D正确。
6.答案:A
解析:碳酸氢铵稀溶液中加入足量烧碱溶液,无氨气逸出:,A正确;的还原性大于的还原性,氯气先与反应,将氧化完后,再氧化,根据得失电子守恒可知,等物质的量的刚好氧化,不被氧化,正确的离子方程式为,B错误;溶液中加入过量的HI溶液,正确离子方程式为,C错误;明矾溶液中滴入溶液使恰好完全沉淀时,的物质的量之比是1:4,二者反应生成,离子方程式为,D错误。
7.答案:C
解析:A.充电时,M极连接外接电源的负极,M为阴极,阴极有电子流入,发生还原反应,A正确;
B.锂电池的能量比较高,优点是质量小,电容量大,可重复使用,B正确;
C.根据电子守恒可知,,当电池中迁移时,理论上可获得32g纯铜,C错误;
D.充电时,N极为阳极,发生氧化反应,电极反应式为,D正确;
故选C。
8.答案:B
9.答案:B
解析:R形成的化合物中R仅有一种价态,结合图示可知R为F元素,由此分析可得X、Y、Z、W依次为H、C、N、O。
简单离子半径大小:,A项错误;
Y、Z的氧化物有CO、、NO、等,其中不是大气污染物,C项错误;
化合物M中氢原子属于2电子稳定结构,D项错误。
10.答案:D
解析:由于的熔点高,电解制备金属能耗大,工业生产一般采用电解熔融的方法,A项正确;还原时,发生反应的化学方程式为,B项正确;真空蒸馏时,需要将金属、分离除去,由于金属钛的熔点很高,因此真空蒸馏的目的是为了降低单质和的沸点,C项正确;工业生产中,阳极上发生反应2,可用作其他联产过程的氧化剂,D项错误。
11.答案:B
解析:A.在水中的溶解度很大,乙醇与水的结构相似,而1-戊醇与水的结构比乙醇与水的结构相差大,因此1-戊醇在水中的溶解度比乙醇在水中的溶解度减小,A错误;B.的熔沸点小于都是分子晶体,物质的相对分子质量越大,范德华力越大,熔沸点越高,因此的熔沸点小于,B正确;C.N≡N由于键能大而结构稳定,而C≡C的键能也大,但结构不稳定,一般断裂其中的一根或两根键,C错误;D.溶液和过量NaOH反应先生成白色沉淀,然后转变为灰色,而溶液和过量反应,先生成沉淀,后沉淀逐渐溶解,两者现象不相同,D错误;故合理选项是B。
12.答案:C
解析:增大B的量,平衡正向移动,A的体积分数减小,则图甲中,A错误;由图甲可知,升高温度A的体积分数增大,可知正反应为放热反应,则升高温度正反应的平衡常数减小,图乙中曲线B表示正反应的平衡常数,B错误;由图乙可知,时,,设平衡时B转化的物质的量为,容器的体积为,列三段式:
,解得,则B的转化率=,C正确;由于正反应为气体分子数不变的放热反应,恒容绝热装置中进行题述反应,气体物质的量不变,压强随温度的变化而变化,则达到平衡时,装置内的气体压强将增大,D错误。
13.答案:D
解析:铝粉与氧化铁发生铝热反应生成氧化铝和铁,若反应后的固体中含有少量未反应的,冷却后溶于盐酸,由于可以被单质Fe还原为,则滴加KSCN溶液后也不会有明显颜色变化,A错误;由于和所含阴离子种类不相同,则不能比较和的催化能力,B错误;也可以与反应产生有刺激性气味的无色气体,C错误;甘蔗渣的主要成分为纤维素,在75%的浓硫酸、加热条件下会发生水解,其水解产物在碱性条件下能发生银镜反应,说明有还原糖生成,D正确。
14.答案:C
解析:由图1和图2可知,次磷酸为一元弱酸,由点可知,图2中点的纵坐标为0.5,溶液中、pH=5,溶液呈酸性,A项错误;点溶液中溶质为等浓度的和,溶液中存在电荷守恒:①,存在元素质量守恒:②,①×2-②整理得到,B项错误;点溶液中溶质为,此时因次磷酸根离子水解而使溶液呈碱性,所以溶液中的各微粒浓度大小关系为,C项正确;点溶液中溶质为和NaOH,水解的离子方程式为,D项错误。
15.答案:(1)浓硫酸
(2)a
(3)
(4)没有处理CO、尾气;空气中的水蒸气会进入D中,使产品发生水解
(5)
(6);95%;偏小
解析:(1)根据上述分析可知,装置B的作用是除去氯气中的水蒸气,所以盛放的试剂为浓硫酸;
(2)装置E为蒸馏装置,冷凝水从从a口进,b口出,达到冷凝导气的作用,故答案为:a;
(3)装置A中氯酸钾与浓盐酸常温下发生归中反应,生成氯气、氯化钾和水,发生反应的化学方程式为;
(4)根据题给信息知极易水解,所以该装置的不足之处是缺少吸收空气中水蒸气进入的装置,空气中水蒸气会进入C中使产品发生水解,也没有无尾气处理装置,CO与剩余会污染环境,故答案为:没有处理CO、尾气;空气中的水蒸气会进入D中,使产品发生水解;
(5)由分析可知,装置E为分离氯化铁和氯化钛的蒸馏装置,根据题给的沸点可知,蒸馏出来的是;
(6)由题意可知,硝酸银消耗氯离子,过量的硝酸银用硫氰化钾滴定,铁离子可与硫氰化钾显红色,作其指示剂,因银离子只与硝酸根离子可共存,所以加入的试剂X应为硝酸铁;与硫氰化钾溶液反应的过量硝酸银的物质的量为,则与溶液中氯离子反应的硝酸银的物质的量为,可得14.0g产品中的质量分数为;装KSCN溶液的滴定管滴定前尖嘴有气泡,滴定后气泡消失,会导致滴定过量硝酸银消耗硫氰化钾溶液体积偏大,使得氯离子的物质的量减小,的质量分数测定结果偏小,故答案为:95%;偏小。
16.(1)答案:CD
解析:A项,化合物B中存在亚甲基(),但不存在次甲基(),错误;B项,物质F中只有1种化学环境的H原子,错误;C项,G→H的反应可以看作取代了—MgBr,为取代反应,正确;D项,根据X的键线式可得X的分子式为,正确。
(2)答案:
解析:化合物A与HCl发生取代反应,3个—OH被3个—Cl取代之后得到物质B,根据A的分子式可以得出该物质是。由转化关系可知D的结构简式为,由已知信息可得E的结构简式为。
(3)答案:
解析:C→D为卤代烃在氢氧化钠醇溶液中发生的消去反应。
(4)答案:;;
解析:H的分子式为,其同分异构体中包含了、和另外一个,只剩下1个碳原子和1个不饱和度。根据条件可判断,剩余结构中应该含有环状结构,可在环内也可在环外,碳碳双键应该在环内。根据碳原子个数可以判断是三元环或四元环。
(5)答案:
解析:原料是、、HCHO,合成的目标物质为。参考题干中的F→G与第二条已知信息。首先利用已知信息使溴苯发生反应,再利用流程图中F→G的信息可获得以下流程:,接着再利用第二条已知信息的后半部分,,最后利用醇与HBr的取代反应得到目标产物。
17.答案:(1)PdO
(2)
(3)2:1
(4)80℃;5mol/L
(5)
(6)加入盐酸与氨反应,使平衡正向进行,生成
(7)3~4.5
解析:(1)“还原I”后进行的操作是酸浸,而PdO难溶于酸,所以需将PdO还原为钯,由此得出加入甲酸的目的是还原PdO。答案为:PdO;
(2)“酸浸”过程中,Pd与盐酸、反应,生成等,离子方程式为。答案为:;
(3)“还原II”中,是用还原,氧化剂中Pd由+2价降低为0价,还原剂中N元素由-2价升高为0价,则氧化剂与还原剂的物质的量之比为2:1。答案为:2:1;
(4)从图中可以看出,当温度达到80℃时,钯的浸出率达到98%以上,温度再升高时,钯的浸出率变化不大,所以最佳的浸取温度是80C;当HCl浓度达到5mol/L时,钯的浸出率达到99%,再增大HCl的浓度,钯的浸出率变化不大,所以最佳的HCl浓度为5mol/L。答案为:80℃;5mol/L;
(5)因为用盐酸和进行“酸浸”后,只得到难溶物,所以浸出液中应含有,从而得出“离子交换”流出液中阳离子有。答案为;
(6)“沉钯”过程中先加入氨水得到溶液,再加入盐酸后得到沉淀,则加入的HCl应与结合为,从而得出加入盐酸的作用是加入盐酸与氨反应,使平衡正向进行,生成。答案为:加入盐酸与氨反应,使平衡正向进行,生成;
(7)加入氨水调节pH后,完全转化为,不参与反应,对来说,;对来说,,,所以需调节pH的范围是3~4.5。答案为:3~4.5。
18.答案:(1)
(2)BD
(3)①小于;②或
(4)①<;②;③<;④设,由图可知:则:,即,因此该反应正反应为放热反应
解析:(1)由盖斯定律可知,①-2×②-4×③得反应:,则;
(2)A.k为速率常数受温度、催化剂、固体表面积性质等影响,不受浓度影响,A错误;B.平衡时v(正)=v(逆),第二步反应为慢反应,反应速率较慢,则v(第二步的逆反应)也较慢,第三步反应为快反应,反应速率较快,故v(第二步的逆反应)
同课章节目录
