2023年人教版高中化学选择性必修2教学课件 第一节 第一课时 能层与能级 基态与激发态 原子光谱 构造原理与电子排布式(共43张PPT)
文档属性
| 名称 | 2023年人教版高中化学选择性必修2教学课件 第一节 第一课时 能层与能级 基态与激发态 原子光谱 构造原理与电子排布式(共43张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-05 08:32:48 | ||
图片预览








文档简介
(共43张PPT)
第一课时 能层与能级 基态与激发态 原子光谱 构造原理与电子排布式
第一章
2023年人教版高中化学选择性必修2教学课件★★
素养目标
1.通过认识原子结构及核外电子排布,知道原子核外电子的能层、能级及电子排布规律,形成宏观辨识与微观探析的核心素养。
2.结合原子模型的演变过程,掌握原子核外电子排布的构造原理,形成证据推理与模型认知的核心素养。
【知识铺垫】
1.原子是由原子核和核外电子组成的,核外电子是分层排布的;离核越远的电子能量越高。
2.写出氮、氧、钠、氯的原子结构示意图:
【自主梳理】
1.能层与能级
(1)能层
核外电子按能量不同分成能层,能层序数一、二、三、四、五、六、七分别用K、L、M、N、O、P、Q表示。能层越高,电子的能量越高,能量的高低顺序为E(K) < E(L) < E(M) < E(N)(2)能级
①同一能层的电子,又被分成不同能级。任一能层的能级总是从 s 能级开始,能级的字母代号按s、p、d、f……排序,每个能级最多可容纳的电子数依次为自然数 1 、 3 、 5 、 7 ……的2倍。
②同一能层不同能级的能量顺序:E(ns) < E(np) < E(nd) < E(nf)……
任何能层均有s能级
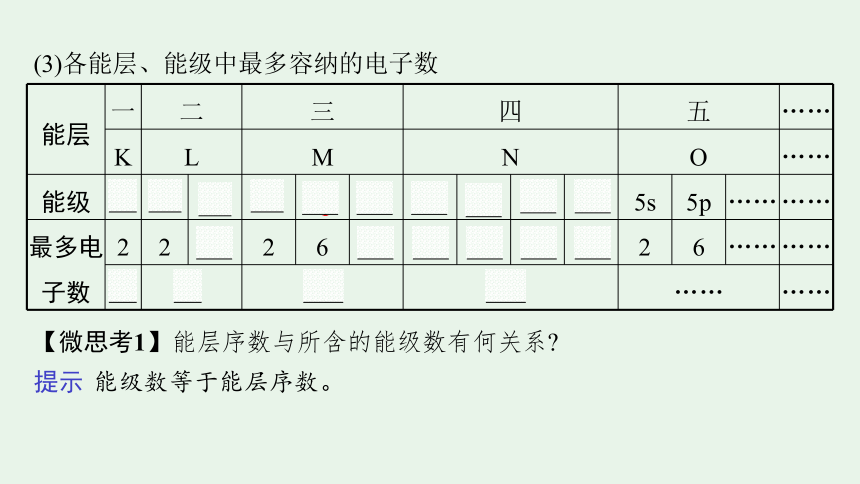
(3)各能层、能级中最多容纳的电子数
能层 一 二 三 四 五 ……
K L M N O ……
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …… ……
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …… ……
2 8 18 32 …… ……
【微思考1】能层序数与所含的能级数有何关系
提示 能级数等于能层序数。
2.基态与激发态 原子光谱
(1)基态原子与激发态原子
(2)原子光谱与光谱分析
①光谱的成因及分类
②光谱分析:现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
【微思考2】金属的焰色试验中,一些金属元素呈现不同焰色的原因是什么
提示 激发态原子中的电子跃迁到低能级时,多余的能量以光的形式释放出来。
3.构造原理与电子排布式
(1)构造原理
①含义
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
即电子填充能级的顺序
②示意图
(2)电子排布式
①定义:将能级上所容纳的电子数标在该能级符号右上角,并按照能层从左到右的顺序排列的式子。
②表示方法:如氮原子的电子排布式为
③能级交错。
随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层,如电子是按3p→4s→3d的顺序而不是按3p→ 3d → 4s 的顺序填充的,这种现象被称为能级交错。
基态铬、铜的核外电子排布不符合构造原理,Cr、Cu基态原子的电子排布式分别为1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1。
【微思考3】基态原子的电子排布式是按照构造原理的顺序依次书写的吗
提示 不是。基态原子按照构造原理填充电子,可能存在能级交错;而电子排布式是按照能层由低到高、同一能层按照能级由低到高的顺序书写的。
【自我检测】
1.判断下列说法的正误,正确的画“√”,错误的画“×”。
(1)原子中第n能层容纳的电子数一定是2n2( )
(2)最外层电子排布式为4s1的元素一定为K( )
(3)能层序数大,该能层中能级的能量一定高( )
(4)原子光谱是原子发生电子得失而引起的( )
(5)K的电子排布式为1s22s22p63s23p63d1( )
×
×
×
×
×
2.下列能级表示正确(实际存在的)且最多容纳的电子数按照从少到多的顺序排列的是( )
A.1s、2p、3d B.1s、2s、3s
C.2s、2p、2d D.3p、3d、3f
答案 A
解析 不同能层中符号相同的能级最多容纳的电子数相同,B项错误;从M层开始有d能级,不存在2d能级,C项错误;从N层开始有f能级,不存在3f能级,D项错误。
3.(1)根据构造原理,试比较下列能级的能量高低(填“>”或“<”)。
①4s 3d;②6s 4f 5d。
(2)根据构造原理,写出下列基态原子的核外电子排布式:
①2He: ;
②8O: ;
③10Ne: ;
④14Si: ;
⑤18Ar: 。
答案 (1)①< ②< <
(2)①1s2 ②1s22s22p4 ③1s22s22p6 ④1s22s22p63s23p2 ⑤1s22s22p63s23p6
4.(2021河北卷,17节选)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是 (填离子符号)。
答案 K+、P3-
课堂篇 素养提升
探究1
能层与能级的组成以及能量关系
【问题探究】
在多电子的原子中,同一能层的电子,能量也可能不同,据此把它们分为能级。
(1)符号相同的不同能级(如2p、3p)中所能容纳的最多电子数是否相同
提示 相同。如2p、3p能级最多容纳的电子数都是6。
(2)不同能层的s能级之间,能量高低有何关系 同一能层不同能级之间能量高低有何关系
提示 1s<2s<3s<4s<……;ns【深化拓展】
能层中各能级之间能量的大小关系
(1)能层或能级的能量关系
(2)不同能层中不同能级的能量高低顺序(按构造原理排序,存在能级交错):
ns<(n-2)f<(n-1)d【素能应用】
典例1已知n为能层序数,下列有关认识正确的是( )
A.各能层含有的电子数为2n2
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍
答案 D
解析 各能层最多含有的电子数为2n2,A项错误;各能层的能级都是从s能级开始,但并不是都到f能级结束,如第1、2、3能层,B项错误;各能层含有的能级数与其能层序数相等,C项错误;各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍,D项正确。
易错警示 能层与能级的认识误区
(1)任何能层均含有s能级,但不是任何能层均含有s、p、d、f能级。
(2)能层就是电子层,各能层具有的能级数等于能层序数,例如:K层只有1s能级;L层有2s、2p两个能级等。
(3)从第3能层(M层)开始出现d能级,且3d能级的能量大于4s能级。
变式训练1按能量由低到高的顺序排列,正确的一组是( )
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.3p、3d、4s、4p
答案 C
解析 电子能量的高低主要由能层和能级决定。当能级符号相同时,能层序数越大,能量越高,例如E1s方法技巧 判断能级能量高低的方法
(1)首先看能层,一般能层序数越大,能量越高。
(2)再看能级,同一能层中的各能级,能量由低到高的顺序是ns(3)还要注意能级交错现象,即高能层的s、p能级的能量可能会小于低能层的d、f能级,如4s<3d,6p<5f等。
探究2
构造原理与电子排布式的书写方法
【问题探究】
根据构造原理示意图回答以下问题:
(1)分别写出O、Na、23V、26Fe的电子填充顺序和电子排布式。
提示
元素 O Na 23V 26Fe
电子 填充顺序 1s22s22p4 1s22s22p63s1 1s22s22p63s23p64s23d3 1s22s22p63s23p64s23d6
电子 排布式 1s22s22p4 1s22s22p63s1 1s22s22p63s23p63d34s2 1s22s22p63s23p63d64s2
(2)已知Cr的电子排布式为1s22s22p63s23p63d54s1,Cu的电子排布式为1s22s22p63s23p63d104s1。这两种元素的基态原子核外电子排布不符合构造原理,是根据什么确定其电子排布的
提示 Cr、Cu两种元素基态原子的电子填充顺序与构造原理不符合,这是根据Cr、Cu的原子光谱确定的。
(3)元素周期表中钠原子的简化电子排布式写成[Ne]3s1,方括号里的符号是什么意义 模仿钠原子的简化电子排布式写出8号、14号、26号元素原子的简化电子排布式。
提示 方括号里符号的意义是对应稀有气体元素原子的电子排布式。8号、14号、26号元素分别为O、Si、Fe,其简化电子排布式分别为: O[He]2s22p4;Si[Ne]3s23p2;Fe[Ar]3d64s2。
【深化拓展】
电子排布式的书写方法
(1)简单原子的电子排布式
按照构造原理将电子依次填充到能量逐渐升高的能级中。如6C:1s22s22p2。
(2)复杂原子的核外电子排布式
↓ ↓
例如 26Fe:1s22s22p63s23p64s23d6 1s22s22p63s23p63d64s2
(3)特殊原子
当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。如24Cr:
(4)简化电子排布式
为了避免电子排布式过于烦琐,可以把内层电子达到稀有气体电子层结构的部分,以相应稀有气体元素符号外加方括号来表示。如K:1s22s22p63s23p64s1,其简化电子排布式为[Ar]4s1,其中[Ar]代表Ar的核外电子排布式,即1s22s22p63s23p6。
【素能应用】
典例2写出下列原子的电子排布式。
(1)基态Cl原子的电子排布式是
。
(2)基态Ge原子的核外电子排布式为
。
(3)写出基态As原子的电子排布式:
。
(4)P原子的电子排布式是 。
答案 (1)1s22s22p63s23p5或[Ne]3s23p5
(2)1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2
(3)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3
(4)1s22s22p63s23p3或[Ne]3s23p3
解析 根据构造原理填充核外电子,根据能层序数由低到高的顺序书写电子排布式。要注意从3d能级开始出现“能级交错”现象。
易错警示 (1)与化合价有关的电子叫价层电子,价层电子并不都是指原子的最外层电子,主族元素的价层电子就是最外层电子,但过渡元素的价层电子包括最外层s电子,次外层d电子,有的还包括倒数第三层f电子。
(2)书写电子排布式时,同一能层按能级由低到高顺序连在一起。如基态Fe原子的电子排布式为1s22s22p63s23p63d64s2,而不能写成1s22s22p63s23p64s23d6。
(3)并不是所有的原子核外电子的排布都遵循构造原理。Cr原子和Cu原子具有特殊性,Cr:[Ar]3d54s1,Cu:[Ar]3d104s1。
(4)在原子失去价电子时,并不都是按照填充的相反顺序失去,而是按电子排布式顺序从外层向内层失去。如基态Fe3+的电子排布式为1s22s22p63s23p63d5,即Fe→Fe3+是失去4s能级上的两个电子和3d能级上的一个电子。
变式训练2下列基态原子或离子的电子排布式错误的是( )
A.Ca 1s22s22p63s23p64s2 B.Mg2+ 1s22s22p6
C.F- 1s22s22p5 D.Br 1s22s22p63s23p63d104s24p5
答案 C
解析 Ca原子核外有20个电子,根据构造原理,其电子排布式为1s22s22p63s23p64s2,A项正确;Mg2+核外有10个电子,根据构造原理,其电子排布式为1s22s22p6,B项正确;F-核外有10个电子,根据构造原理,其电子排布式为1s22s22p6,C项错误;Br原子核外有35个电子,根据构造原理,其电子排布式为1s22s22p63s23p63d104s24p5,D项正确。
素养脉络
随堂检测
1.下列能级不属于M能层的是( )
A.3s B.4s C.3p D.3d
答案 B
解析 M能层包含3s、3p、3d三个能级。
2.下列说法正确的是( )
A.基态原子的能量一定比激发态原子的能量低
B.1s22s12p1表示的是基态原子的电子排布
C.日常生活中我们看到的许多可见光,如霓虹灯光、节日焰火,都与原子核外电子发生跃迁释放能量有关
D.电子仅在激发态跃迁到基态时才会产生原子光谱
答案 C
解析 同类原子基态比激发态的能量低,A选项错误;1s22s12p1不符合构造原理,该原子处于激发态,B选项错误;原子光谱有发射光谱和吸收光谱两种,电子从激发态跃迁到基态时产生发射光谱,从基态跃迁到激发态时产生吸收光谱,D选项错误。
3.下列各基态原子的电子排布式正确的是( )
A.Be:1s22p2 B.C:1s22s22p2
C.He:1s12s1 D.Cl:1s22s22p63s23p6
答案 B
解析 A项中基态Be原子的电子排布式应为1s22s2;C项中基态He原子的电子排布式应为1s2;D项中基态Cl原子的电子排布式为1s22s22p63s23p5。
4.写出下列原子在基态时的电子排布式:
(1)11Na ;(2)16S ;
(3)35Br ;(4)19K ;
(5)31Ga ;(6)30Zn 。
答案 (1)1s22s22p63s1 (2)1s22s22p63s23p4
(3)1s22s22p63s23p63d104s24p5
(4)1s22s22p63s23p64s1
(5)1s22s22p63s23p63d104s24p1
(6)1s22s22p63s23p63d104s2
解析 根据构造原理填充各能级中的电子,按能层序数从小到大的顺序书写原子的电子排布式。注意从3d能级开始出现“能级交错”现象。
5.某元素的原子序数为34,则:
(1)此元素原子的电子总数是 ,有 个电子层, 个能级。
(2)它的价电子排布式为 。
答案 (1)34 4 8
(2)4s24p4
解析 原子序数为34的元素,原子核外的电子总数是34,根据原子的核外电子数,其基态原子的电子排布式为1s22s22p63s23p63d104s24p4,有4个电子层,8个能级;它的价电子排布式为4s24p4。
本 课 结 束
第一课时 能层与能级 基态与激发态 原子光谱 构造原理与电子排布式
第一章
2023年人教版高中化学选择性必修2教学课件★★
素养目标
1.通过认识原子结构及核外电子排布,知道原子核外电子的能层、能级及电子排布规律,形成宏观辨识与微观探析的核心素养。
2.结合原子模型的演变过程,掌握原子核外电子排布的构造原理,形成证据推理与模型认知的核心素养。
【知识铺垫】
1.原子是由原子核和核外电子组成的,核外电子是分层排布的;离核越远的电子能量越高。
2.写出氮、氧、钠、氯的原子结构示意图:
【自主梳理】
1.能层与能级
(1)能层
核外电子按能量不同分成能层,能层序数一、二、三、四、五、六、七分别用K、L、M、N、O、P、Q表示。能层越高,电子的能量越高,能量的高低顺序为E(K) < E(L) < E(M) < E(N)
①同一能层的电子,又被分成不同能级。任一能层的能级总是从 s 能级开始,能级的字母代号按s、p、d、f……排序,每个能级最多可容纳的电子数依次为自然数 1 、 3 、 5 、 7 ……的2倍。
②同一能层不同能级的能量顺序:E(ns) < E(np) < E(nd) < E(nf)……
任何能层均有s能级
(3)各能层、能级中最多容纳的电子数
能层 一 二 三 四 五 ……
K L M N O ……
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …… ……
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …… ……
2 8 18 32 …… ……
【微思考1】能层序数与所含的能级数有何关系
提示 能级数等于能层序数。
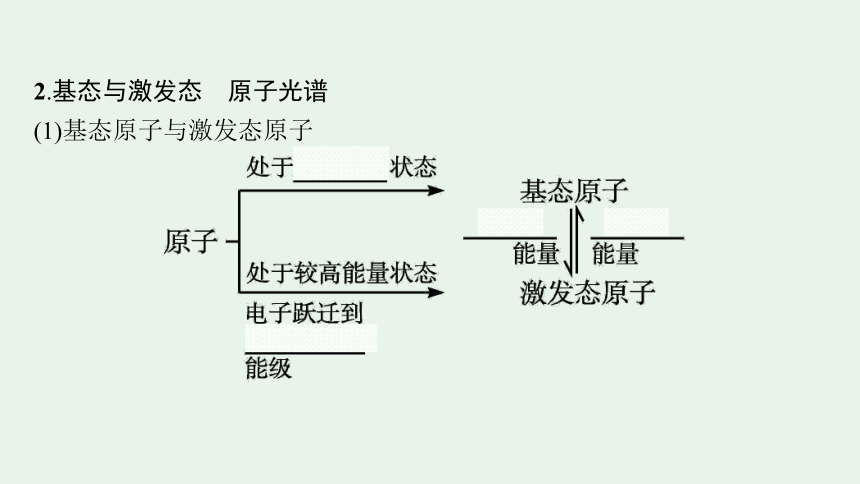
2.基态与激发态 原子光谱
(1)基态原子与激发态原子
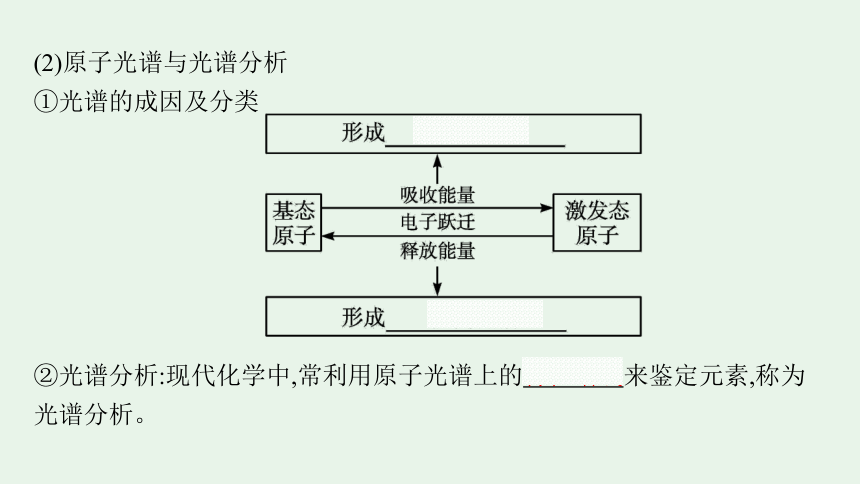
(2)原子光谱与光谱分析
①光谱的成因及分类
②光谱分析:现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
【微思考2】金属的焰色试验中,一些金属元素呈现不同焰色的原因是什么
提示 激发态原子中的电子跃迁到低能级时,多余的能量以光的形式释放出来。
3.构造原理与电子排布式
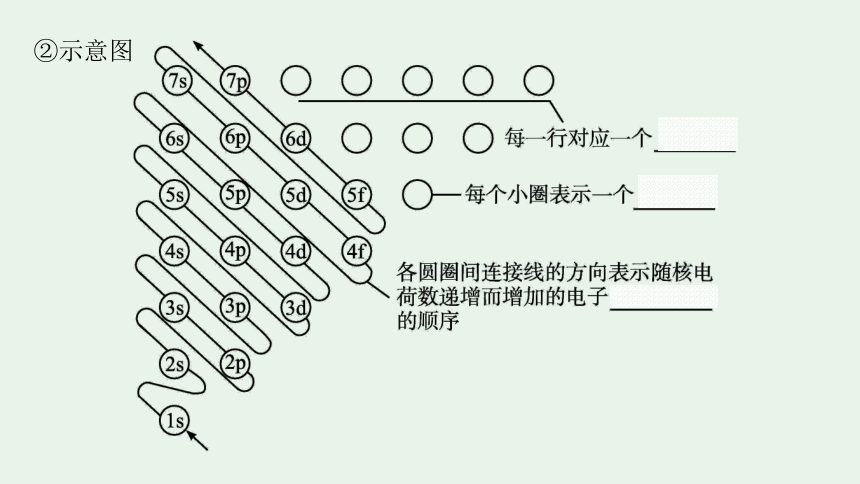
(1)构造原理
①含义
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
即电子填充能级的顺序
②示意图
(2)电子排布式
①定义:将能级上所容纳的电子数标在该能级符号右上角,并按照能层从左到右的顺序排列的式子。
②表示方法:如氮原子的电子排布式为
③能级交错。
随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层,如电子是按3p→4s→3d的顺序而不是按3p→ 3d → 4s 的顺序填充的,这种现象被称为能级交错。
基态铬、铜的核外电子排布不符合构造原理,Cr、Cu基态原子的电子排布式分别为1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1。
【微思考3】基态原子的电子排布式是按照构造原理的顺序依次书写的吗
提示 不是。基态原子按照构造原理填充电子,可能存在能级交错;而电子排布式是按照能层由低到高、同一能层按照能级由低到高的顺序书写的。
【自我检测】
1.判断下列说法的正误,正确的画“√”,错误的画“×”。
(1)原子中第n能层容纳的电子数一定是2n2( )
(2)最外层电子排布式为4s1的元素一定为K( )
(3)能层序数大,该能层中能级的能量一定高( )
(4)原子光谱是原子发生电子得失而引起的( )
(5)K的电子排布式为1s22s22p63s23p63d1( )
×
×
×
×
×
2.下列能级表示正确(实际存在的)且最多容纳的电子数按照从少到多的顺序排列的是( )
A.1s、2p、3d B.1s、2s、3s
C.2s、2p、2d D.3p、3d、3f
答案 A
解析 不同能层中符号相同的能级最多容纳的电子数相同,B项错误;从M层开始有d能级,不存在2d能级,C项错误;从N层开始有f能级,不存在3f能级,D项错误。
3.(1)根据构造原理,试比较下列能级的能量高低(填“>”或“<”)。
①4s 3d;②6s 4f 5d。
(2)根据构造原理,写出下列基态原子的核外电子排布式:
①2He: ;
②8O: ;
③10Ne: ;
④14Si: ;
⑤18Ar: 。
答案 (1)①< ②< <
(2)①1s2 ②1s22s22p4 ③1s22s22p6 ④1s22s22p63s23p2 ⑤1s22s22p63s23p6
4.(2021河北卷,17节选)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是 (填离子符号)。
答案 K+、P3-
课堂篇 素养提升
探究1
能层与能级的组成以及能量关系
【问题探究】
在多电子的原子中,同一能层的电子,能量也可能不同,据此把它们分为能级。
(1)符号相同的不同能级(如2p、3p)中所能容纳的最多电子数是否相同
提示 相同。如2p、3p能级最多容纳的电子数都是6。
(2)不同能层的s能级之间,能量高低有何关系 同一能层不同能级之间能量高低有何关系
提示 1s<2s<3s<4s<……;ns
能层中各能级之间能量的大小关系
(1)能层或能级的能量关系
(2)不同能层中不同能级的能量高低顺序(按构造原理排序,存在能级交错):
ns<(n-2)f<(n-1)d
典例1已知n为能层序数,下列有关认识正确的是( )
A.各能层含有的电子数为2n2
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍
答案 D
解析 各能层最多含有的电子数为2n2,A项错误;各能层的能级都是从s能级开始,但并不是都到f能级结束,如第1、2、3能层,B项错误;各能层含有的能级数与其能层序数相等,C项错误;各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍,D项正确。
易错警示 能层与能级的认识误区
(1)任何能层均含有s能级,但不是任何能层均含有s、p、d、f能级。
(2)能层就是电子层,各能层具有的能级数等于能层序数,例如:K层只有1s能级;L层有2s、2p两个能级等。
(3)从第3能层(M层)开始出现d能级,且3d能级的能量大于4s能级。
变式训练1按能量由低到高的顺序排列,正确的一组是( )
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.3p、3d、4s、4p
答案 C
解析 电子能量的高低主要由能层和能级决定。当能级符号相同时,能层序数越大,能量越高,例如E1s
(1)首先看能层,一般能层序数越大,能量越高。
(2)再看能级,同一能层中的各能级,能量由低到高的顺序是ns
探究2
构造原理与电子排布式的书写方法
【问题探究】
根据构造原理示意图回答以下问题:
(1)分别写出O、Na、23V、26Fe的电子填充顺序和电子排布式。
提示
元素 O Na 23V 26Fe
电子 填充顺序 1s22s22p4 1s22s22p63s1 1s22s22p63s23p64s23d3 1s22s22p63s23p64s23d6
电子 排布式 1s22s22p4 1s22s22p63s1 1s22s22p63s23p63d34s2 1s22s22p63s23p63d64s2
(2)已知Cr的电子排布式为1s22s22p63s23p63d54s1,Cu的电子排布式为1s22s22p63s23p63d104s1。这两种元素的基态原子核外电子排布不符合构造原理,是根据什么确定其电子排布的
提示 Cr、Cu两种元素基态原子的电子填充顺序与构造原理不符合,这是根据Cr、Cu的原子光谱确定的。
(3)元素周期表中钠原子的简化电子排布式写成[Ne]3s1,方括号里的符号是什么意义 模仿钠原子的简化电子排布式写出8号、14号、26号元素原子的简化电子排布式。
提示 方括号里符号的意义是对应稀有气体元素原子的电子排布式。8号、14号、26号元素分别为O、Si、Fe,其简化电子排布式分别为: O[He]2s22p4;Si[Ne]3s23p2;Fe[Ar]3d64s2。
【深化拓展】
电子排布式的书写方法
(1)简单原子的电子排布式
按照构造原理将电子依次填充到能量逐渐升高的能级中。如6C:1s22s22p2。
(2)复杂原子的核外电子排布式
↓ ↓
例如 26Fe:1s22s22p63s23p64s23d6 1s22s22p63s23p63d64s2
(3)特殊原子
当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。如24Cr:
(4)简化电子排布式
为了避免电子排布式过于烦琐,可以把内层电子达到稀有气体电子层结构的部分,以相应稀有气体元素符号外加方括号来表示。如K:1s22s22p63s23p64s1,其简化电子排布式为[Ar]4s1,其中[Ar]代表Ar的核外电子排布式,即1s22s22p63s23p6。
【素能应用】
典例2写出下列原子的电子排布式。
(1)基态Cl原子的电子排布式是
。
(2)基态Ge原子的核外电子排布式为
。
(3)写出基态As原子的电子排布式:
。
(4)P原子的电子排布式是 。
答案 (1)1s22s22p63s23p5或[Ne]3s23p5
(2)1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2
(3)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3
(4)1s22s22p63s23p3或[Ne]3s23p3
解析 根据构造原理填充核外电子,根据能层序数由低到高的顺序书写电子排布式。要注意从3d能级开始出现“能级交错”现象。
易错警示 (1)与化合价有关的电子叫价层电子,价层电子并不都是指原子的最外层电子,主族元素的价层电子就是最外层电子,但过渡元素的价层电子包括最外层s电子,次外层d电子,有的还包括倒数第三层f电子。
(2)书写电子排布式时,同一能层按能级由低到高顺序连在一起。如基态Fe原子的电子排布式为1s22s22p63s23p63d64s2,而不能写成1s22s22p63s23p64s23d6。
(3)并不是所有的原子核外电子的排布都遵循构造原理。Cr原子和Cu原子具有特殊性,Cr:[Ar]3d54s1,Cu:[Ar]3d104s1。
(4)在原子失去价电子时,并不都是按照填充的相反顺序失去,而是按电子排布式顺序从外层向内层失去。如基态Fe3+的电子排布式为1s22s22p63s23p63d5,即Fe→Fe3+是失去4s能级上的两个电子和3d能级上的一个电子。
变式训练2下列基态原子或离子的电子排布式错误的是( )
A.Ca 1s22s22p63s23p64s2 B.Mg2+ 1s22s22p6
C.F- 1s22s22p5 D.Br 1s22s22p63s23p63d104s24p5
答案 C
解析 Ca原子核外有20个电子,根据构造原理,其电子排布式为1s22s22p63s23p64s2,A项正确;Mg2+核外有10个电子,根据构造原理,其电子排布式为1s22s22p6,B项正确;F-核外有10个电子,根据构造原理,其电子排布式为1s22s22p6,C项错误;Br原子核外有35个电子,根据构造原理,其电子排布式为1s22s22p63s23p63d104s24p5,D项正确。
素养脉络
随堂检测
1.下列能级不属于M能层的是( )
A.3s B.4s C.3p D.3d
答案 B
解析 M能层包含3s、3p、3d三个能级。
2.下列说法正确的是( )
A.基态原子的能量一定比激发态原子的能量低
B.1s22s12p1表示的是基态原子的电子排布
C.日常生活中我们看到的许多可见光,如霓虹灯光、节日焰火,都与原子核外电子发生跃迁释放能量有关
D.电子仅在激发态跃迁到基态时才会产生原子光谱
答案 C
解析 同类原子基态比激发态的能量低,A选项错误;1s22s12p1不符合构造原理,该原子处于激发态,B选项错误;原子光谱有发射光谱和吸收光谱两种,电子从激发态跃迁到基态时产生发射光谱,从基态跃迁到激发态时产生吸收光谱,D选项错误。
3.下列各基态原子的电子排布式正确的是( )
A.Be:1s22p2 B.C:1s22s22p2
C.He:1s12s1 D.Cl:1s22s22p63s23p6
答案 B
解析 A项中基态Be原子的电子排布式应为1s22s2;C项中基态He原子的电子排布式应为1s2;D项中基态Cl原子的电子排布式为1s22s22p63s23p5。
4.写出下列原子在基态时的电子排布式:
(1)11Na ;(2)16S ;
(3)35Br ;(4)19K ;
(5)31Ga ;(6)30Zn 。
答案 (1)1s22s22p63s1 (2)1s22s22p63s23p4
(3)1s22s22p63s23p63d104s24p5
(4)1s22s22p63s23p64s1
(5)1s22s22p63s23p63d104s24p1
(6)1s22s22p63s23p63d104s2
解析 根据构造原理填充各能级中的电子,按能层序数从小到大的顺序书写原子的电子排布式。注意从3d能级开始出现“能级交错”现象。
5.某元素的原子序数为34,则:
(1)此元素原子的电子总数是 ,有 个电子层, 个能级。
(2)它的价电子排布式为 。
答案 (1)34 4 8
(2)4s24p4
解析 原子序数为34的元素,原子核外的电子总数是34,根据原子的核外电子数,其基态原子的电子排布式为1s22s22p63s23p63d104s24p4,有4个电子层,8个能级;它的价电子排布式为4s24p4。
本 课 结 束
