2.3分子结构与物质性质 基础练习(含解析) 2022-2023学年高二上学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3分子结构与物质性质 基础练习(含解析) 2022-2023学年高二上学期化学人教版(2019)选择性必修2 |  | |
| 格式 | zip | ||
| 文件大小 | 151.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-07 10:07:10 | ||
图片预览




文档简介
2.3分子结构与物质性质
一、单选题(本大题共14小题)
1. 下列说法不正确的是( )
A. 、、、的酸性依次增强
B. 苹果酸含有个手性碳原子
C. 、、均易溶于水的原因之一是与分子均形成氢键
D. 以极性键结合的分子不一定是极性分子
2. 下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C. 的稳定性很强,是因为其分子间能形成氢键
D. 由图可知酸性:,是因为分子中有个非羟基氧原子
3. 下列对分子结构及其性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 乳酸属于手性分子,因分子中存在一个手性碳原子
C. 配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道
D. 酸性,是因为分子非羟基氧原子数目比多
4. 下列对分子性质的解释中,正确的是( )
A. 极易溶于水而难溶于水只是因为是极性分子,是非极性分子
B. 由于乳酸中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C. 水很稳定以上才会部分分解是因为水分子间存在大量的氢键
D. 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物。
5. 下列有关叙述正确的是( )
A. 氢键是一种特殊化学键,它广泛地存在于自然界中
B. 在分子中含有个手性原子
C. 碘单质在水溶液中溶解度很小是因为和都是非极性分子
D. 含氧酸可用通式来表示,若值越大,则含氧酸的酸性越大
6. 关于、、三种物质的说法中正确的是( )
A. 在水中的溶解度很小,是由于其属于极性分子
B. 和均易溶于水,原因之一是它们都是极性分子
C. 和的分子结构相似,均为非极性分子
D. 在水中溶解度很大只是由于分子有极性
7. 在半导体生产或灭火剂的使用中,会向空气中逸散气体,如:、、等。它们虽然是微量的,有些却是强温室气体。下列推测正确的是( )
A. 中没有非极性共价键
B. 在中溶解度比在水中的小
C. 存在手性碳原子
D. 、、均为极性分子
8. 解释下列现象的原因正确的是( )
选项 现象 原因
的稳定性强于 分子之间除范德华力外还存在氢键
用皮毛摩擦的橡胶棒分别靠近水和的液流,水流发生偏转,流不偏转 分子中有孤电子对,可与橡胶棒产生静电作用;中没有孤电子对
对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高 对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键
可用萃取碘水中的 与均含有非极性键
A. B. C. D.
9. 下列各组物质性质的比较,结论正确的是( )
A. 分子的极性: B. 物质的硬度:
C. 物质的沸点: D. 在中的溶解度:
10. 下列对分子的性质的解释中,不正确的是( )
A. 溴单质易溶于四氯化碳,难溶于水都可用相似相溶原理解释
B. 酸性:,因为的非羟基氧原子数比的多
C. 水很稳定 以上才会部分分解是因为水中含有大量的氢键所致
D. 、均易溶于水的原因之一是与均能形成氢键
11. 下列有关叙述正确的是( )
A. 氢键是一种特殊化学键,它广泛地存在于自然界中
B. 在分子中含有个手性原子
C. 碘单质在水溶液中溶解度很小是因为和都是非极性分子
D. 含氧酸可用通式表示,若值越大,则含氧酸的酸性越强
12. 下列对分子性质的解释,错误的是 ( )
A. 易溶于水,是因为与水分子间形成氢键
B. 分子中只含有个手性碳原子
C. 次磷酸与足量的溶液反应生成,可知是一元酸
D. 分子的结构为,可知为极性分子
13. 下列关于分子性质,说法正确的是( )
A. 比稳定是因为水分子间存在氢键
B. 由于和分子中非羟基氧原子个数均为,故二者酸性接近
C. 根据“相似相溶”原理,非极性分子在非极性溶剂中溶解度很大
D. 分子中仅有个“手性碳原子”
14. 下列说法不正确的是( )
A. 水很稳定是因为水中含有大量氢键
B. 乳酸分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶规律解释
D. 由图可知酸性:,因为的非羟基氧原子数大于次氯酸的非羟基氧原子数
二、填空题(本大题共4小题)
15. 含碳元素的物质是化学世界中最庞大的家族。回答下列问题:
碳在形成化合物时,其键型以共价键为主,中的化学键从形成的过程来看属于________填“”或“”键,从其极性来看属于________填“极性”或“非极性”键。
和分子中属于非极性分子的是________。
有机物中含氧官能团的名称为________,其中含有________个手性碳原子。
甲醇与乙烷的相对分子质量和范德华力均相近,但是二者的沸点相差很大,造成该差异的原因是__________________________。
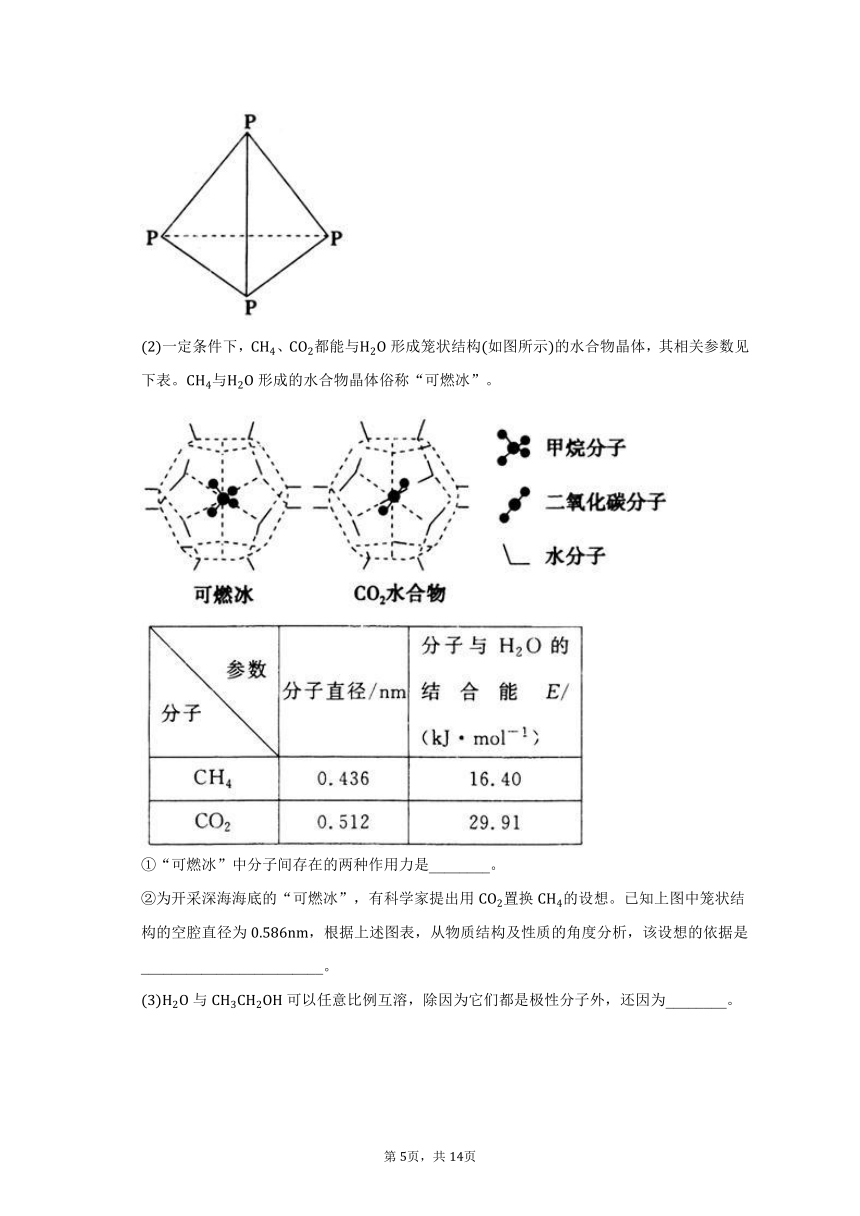
16. 已知白磷结构如图所示,可知每个磷原子以________个共价键与另外的________个磷原子结合成正四面体结构,它应该是________填“极性”或“非极性”分子,在中________填“能”或“不能”溶解,原子的杂化方式是________。
一定条件下,、都能与形成笼状结构如图所示的水合物晶体,其相关参数见下表。与形成的水合物晶体俗称“可燃冰”。
“可燃冰”中分子间存在的两种作用力是________。
为开采深海海底的“可燃冰”,有科学家提出用置换的设想。已知上图中笼状结构的空腔直径为,根据上述图表,从物质结构及性质的角度分析,该设想的依据是________________________。
与可以任意比例互溶,除因为它们都是极性分子外,还因为________。
17. 试解释下列事实。
常温常压下,水的沸点比硫化氢的沸点高_______。
常温常压下,氯单质为气态,溴单质为液态_______。
酒精能与水以任意比例互溶,而四氯化碳不溶于水_______。
酸性:硫酸磷酸_______________________________。
、 、 的键能依次减小,键长依次增大______________________________________
18. 在、、、、、、中,含有配位键的微粒有 ;含有非极性键的微粒有 ;含有极性键的微粒有 ;极性键由强到弱的顺序为 。
答案和解析
1.【答案】
【解答】
A. 、、、分子中非羟基氧原子数依次为:、、、,含氧酸中非羟基氧原子个数越多,酸性越强,则、、、的酸性依次增强,故A正确;
B.苹果酸中连接羟基的碳原子上连接有个不同的原子或原子团,是手性碳原子,故B正确;
C.与水分子之间不能形成氢键,故C错误;
D.含有极性键的分子可能为极性分子,也可为非极性分子,如甲烷是由极性键构成的非极性分子,故D正确。
故选C。
2.【答案】
【解答】
A.碘是非极性分子易溶于非极性溶剂四氯化碳,甲烷属于非极性分子难溶于极性溶剂水,所以都可用相似相溶原理解释,故A正确;
B.碳原子连接四个不同的原子或原子团时,该碳原子为手性碳原子,所以乳酸中第二个为手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子,故B正确;
C.分子稳定性与共价键强度有关,共价键越强,分子越稳定,与氢键无关,氢键决定分子的物理性质,故C错误;
D.的非羟基氧原子数大于次氯酸的非羟基氧原子数,含氧酸中非羟基氧原子数越多,酸性越强,所以磷酸的酸性大于次氯酸,故D正确;
故选C。
3.【答案】
【解答】
A.碘是非极性分子易溶于非极性溶剂四氯化碳,甲烷属于非极性分子难溶于极性溶剂水,所以都可用相似相溶原理解释,故A正确;
B.碳原子连接四个不同的原子或原子团时,该碳原子为手性碳原子,所以乳酸中第二个为手性碳原子,该分子存在一个手性碳原子,故B正确;
C.含有孤电子对的微粒与含有空轨道的微粒易形成配合物,因而不仅是过渡金属才能形成配合物,故C错误;
D.的非羟基氧原子数大于次氯酸的非羟基氧原子数,所以磷酸的酸性大于次氯酸,故D正确。
故选C。
4.【答案】
【解答】
A.极易溶于水而难溶于水的原因是极性分子、氨分子能够与水分子形成氢键、氨分子能够与水反应,是非极性分子,故A错误;
B.手性碳原子指的是同一个碳原子上连接四个不同原子或原子团的碳原子,所以由于乳酸中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子,故 B正确;
C.水很稳定以上才会部分分解是因为水分子中氢氧键的键能大,不是氢键的影响,故C错误;
D.除了过渡元素能够形成配合物,某些主族金属的离子也能形成配合物,如铝离子能够形成等,故D错误。
故选B。
5.【答案】
【解答】
A.氢键是一种分子间作用力,不是化学键,故A错误;
B.一个碳原子与其它四个不同的原子或原子团相连的碳为手性原子,在分子中中间的碳为手性原子,故B正确;
C.是非极性分子而是极性分子,由相似相溶原理知,非极性分子难溶于极性溶剂,所以碘单质在水溶液中溶解度很小,故C错误;
D.含氧酸可用通式来表示,式中大于等于的是强酸,为的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,故D错误;
故选B。
6.【答案】
【解答】
根据“相似相溶”原理,水是极性分子,是非极性分子,和都是极性分子,故A错误、B正确; 是直线形分子,属于非极性分子,为形分子,属于极性分子,故C错;在水中溶解度很大,除了由于分子有极性外,还因为分子和分子之间可以形成氢键,故D错。
7.【答案】
【解答】
A. 根据原子成键规律,分子中存在碳碳非极性共价键,故A错误;
B.有机物一般难溶于水,易溶于有机物,、均属于有机物,在中溶解度比在水中的大,故B错误;
C.原子连有个不同的基团,具有手性,故CHC存在手性碳原子,故C正确;
D.为正四面体结构,正负电荷中性重合,为非极性分子,故D错误;
故选C。
8.【答案】
【解答】
A.氢化物的稳定性与化学键有关,与分子间作用力和氢键无关,的稳定性强于不能用分子间作用力和氢键解释,故A错误;
B.用皮毛摩擦的橡胶棒分别靠近水和的液流,水流发生偏转,是因为水分子中正负电荷中心不重合,而流不偏转,是因为四氯化碳分子中正负电荷中心重合,故B错误;
C.对羟基苯甲醛形成分子间氢键,其熔沸点较高,邻羟基苯甲醛形成分子内氢键,其熔沸点较低,所以对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高,故C正确;
D.与均为非极性分子,而水是极性分子,根据相似相溶原理知,碘易溶于四氯化碳溶液而不易溶于水,所以可用萃取碘水中的,故D错误。
9.【答案】
【解答】
A.为平面正三角形分子,正负电荷中心重合,为非极性分子,而为极性分子,则分子极性:,故A正确;
B.和都是离子化合物,所带电荷相等,但离子半径:氟离子碘离子,所以形成的离子键较强,其硬度较大,即物质的硬度:,故B错误;
C.分子间存在氢键,导致其沸点较高,则物质的沸点:,故C错误;
D.为非极性溶剂,为非极性分子,为极性分子,结合相似相溶原理可知,在中的溶解度:,故D错误。
10.【答案】
【解答】
A.溴单质是非极性分子易溶于非极性溶剂四氯化碳,属于非极性分子难溶于极性溶剂水,所以都可用相似相溶原理解释,故A正确;
B.两种酸的结构分别为:,的非羟基氧原子数大于次氯酸的非羟基氧原子数,所以磷酸的酸性大于次氯酸,故B正确;
C.分子稳定性与共价键强度有关,共价键越强,分子越稳定,与氢键无关,氢键决定分子的物理性质,故C错误;
D.、均易溶于水的原因之一是与均能形成氢键,故D正确;
故选C。
11.【答案】
【解答】
A.氢键为分子间作用力的一种,氢键不是化学键,故A错误;
B.分子的中间碳原子上连个不同的原子或者原子团,为手性碳原子,含有个手性原子,故B正确;
C.碘是非极性分子,水是极性分子,二者极性不同,所以碘单质在水溶液中溶解度很小,故C错误;
D.含氧酸可用通式来表示,非羟基氧原子数目越大,酸性越强,即值越大,酸性越强,故D错误。
故选B。
12.【答案】
【解答】
A.与水分子间形成氢键,所以易溶于水,故A正确;
B.分子中含有个手性碳原子,分别是,故B错误;
C.次磷酸与足量的溶液反应生成,说明是一元酸,故C正确;
D.分子的结构为,由图可知正负电荷中心不重合,为极性分子,故D正确。
故选B。
13.【答案】
【解答】
A.氢键能使的熔沸点比高,比稳定是因为氢氧键比氢硫键稳定,故A错误.
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性,所以酸性,故B错误.
C.根据相似相溶原理:极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂,和都是非极性分子,所以碘易溶于四氯化碳,故C正确。
D.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,中有两个手性碳原子,故D错误。
14.【答案】
【解答】水很稳定是因为水分子中键的键能大,共价键牢固,不易被破坏,氢键主要影响物质的熔沸点,故A错误;
B.根据手性碳原子的概念可知,中与羟基相连的原子为手性碳原子,故B正确;
C.碘易溶于四氯化碳是因为都是非极性分子,甲烷难溶于水是因为甲烷是非极性分子,水是极性分子,所以都可用相似相溶规律解释,故C正确;
D.的非羟基氧原子数大于次氯酸的非羟基氧原子数,所以磷酸的酸性大于次氯酸,故D正确。
故选A。
15.【答案】;极性
、羧基;
甲醇分子间存在氢键,因此其沸点远高于乙烷
【解答】
个分子中含有四个共价键,单键为键,从共价键的极性来看属于极性键,故答案为:;极性;
和结构对称,分子中正负电荷重心重叠,都为非极性分子,故答案为:、;
有机物中含氧官能团的名称为羧基,连有四个不同基团的碳原子形象地称为手性碳原子常以标记手性碳原子,即,该化合物中含有个手性碳原子;故答案为:羧基;;
甲醇分子间存在氢键,会使其沸点远高于乙烷,这样虽然甲醇与乙烷的相对分子质量和范德华力均相近,但是二者的沸点相差很大;故答案为:甲醇分子间存在氢键,因此其沸点远高于乙烷。
16.【答案】;;非极性;能;
氢键、范德华力;
二氧化碳的分子直径小于笼状结构的空腔直径,且与水的结合能力强于甲烷
与分子之间可以形成氢键
【解答】
由白磷的结构图可知,每个磷原子以个共价键与另外的个磷原子结合成正四面体结构,四个原子位于正四面体顶点上,则白磷分子是非极性分子;它与二硫化碳分子都是非极性分子,相似相溶,所以白磷能溶于中;分子中每个原子与相邻的个原子形成个键、含有对孤对电子,杂化轨道数目为,则原子采取杂化;
故答案为:;;非极性;能;;
与形成的水合物俗称“可燃冰”,分子之间存在范德华力,水分子之间存在氢键;
故答案为:氢键、范德华力;
由表格可知:二氧化碳的分子直径小于笼状结构的空腔直径,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷;
故答案为:二氧化碳的分子直径小于笼状结构的空腔直径,且二氧化碳与水的结合能力强于甲烷;
与间能够形成氢键,且都为极性分子,二者互溶;
故答案为:与分子之间可以形成氢键。
17.【答案】水分子间有氢键
分子晶体的相对分子质量越大,范德华力越大,熔沸点越高
酒精是极性分子,且与水之间形成氢键
含氧酸非羟基氧原子越多,酸性越强,硫酸含有个非羟基氧原子,磷酸有一个;
氯原子、溴原子、碘原子半径逐渐增大
【解答】
常温常压下,水的沸点比硫化氢的沸点高的原因是水分子间有氢键;
结构相似的分子晶体,相对分子质量越大,范德华力越大,熔沸点越高常温常压下,则氯单质为气态,溴单质为液态;
酒精是极性分子,且与水之间形成氢键,酒精能与水以任意比例互溶,而四氯化碳不溶于水;
含氧酸非羟基氧原子越多,酸性越强,硫酸含有个非羟基氧原子,磷酸有一个,故酸性:硫酸磷酸;
氯原子、溴原子、碘原子半径逐渐增大,则 、 、 的键能依次减小,键长依次增大。
18.【答案】、
、
、、、、
【解答】
中提供孤电子对,提供空轨道,二者能形成配位键,中提供孤电子对,提供空轨道,二者能形成配位键,其余物质都不能形成配位键,故含有配位键的微粒为:、;同种元素原子之间形成非极性共价键,所以含有非极性键的微粒为、;不同元素原子之间形成极性共价键,所以含有极性键的微粒为、、、、;极性共价键的电负性相差越大,其极性键越强,、、、、分别形成、、,其中、、的电负性大小为,所以极性键由强到弱的顺序为。
第1页,共1页
一、单选题(本大题共14小题)
1. 下列说法不正确的是( )
A. 、、、的酸性依次增强
B. 苹果酸含有个手性碳原子
C. 、、均易溶于水的原因之一是与分子均形成氢键
D. 以极性键结合的分子不一定是极性分子
2. 下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C. 的稳定性很强,是因为其分子间能形成氢键
D. 由图可知酸性:,是因为分子中有个非羟基氧原子
3. 下列对分子结构及其性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 乳酸属于手性分子,因分子中存在一个手性碳原子
C. 配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道
D. 酸性,是因为分子非羟基氧原子数目比多
4. 下列对分子性质的解释中,正确的是( )
A. 极易溶于水而难溶于水只是因为是极性分子,是非极性分子
B. 由于乳酸中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C. 水很稳定以上才会部分分解是因为水分子间存在大量的氢键
D. 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物。
5. 下列有关叙述正确的是( )
A. 氢键是一种特殊化学键,它广泛地存在于自然界中
B. 在分子中含有个手性原子
C. 碘单质在水溶液中溶解度很小是因为和都是非极性分子
D. 含氧酸可用通式来表示,若值越大,则含氧酸的酸性越大
6. 关于、、三种物质的说法中正确的是( )
A. 在水中的溶解度很小,是由于其属于极性分子
B. 和均易溶于水,原因之一是它们都是极性分子
C. 和的分子结构相似,均为非极性分子
D. 在水中溶解度很大只是由于分子有极性
7. 在半导体生产或灭火剂的使用中,会向空气中逸散气体,如:、、等。它们虽然是微量的,有些却是强温室气体。下列推测正确的是( )
A. 中没有非极性共价键
B. 在中溶解度比在水中的小
C. 存在手性碳原子
D. 、、均为极性分子
8. 解释下列现象的原因正确的是( )
选项 现象 原因
的稳定性强于 分子之间除范德华力外还存在氢键
用皮毛摩擦的橡胶棒分别靠近水和的液流,水流发生偏转,流不偏转 分子中有孤电子对,可与橡胶棒产生静电作用;中没有孤电子对
对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高 对羟基苯甲醛形成分子间氢键,而邻羟基苯甲醛形成分子内氢键
可用萃取碘水中的 与均含有非极性键
A. B. C. D.
9. 下列各组物质性质的比较,结论正确的是( )
A. 分子的极性: B. 物质的硬度:
C. 物质的沸点: D. 在中的溶解度:
10. 下列对分子的性质的解释中,不正确的是( )
A. 溴单质易溶于四氯化碳,难溶于水都可用相似相溶原理解释
B. 酸性:,因为的非羟基氧原子数比的多
C. 水很稳定 以上才会部分分解是因为水中含有大量的氢键所致
D. 、均易溶于水的原因之一是与均能形成氢键
11. 下列有关叙述正确的是( )
A. 氢键是一种特殊化学键,它广泛地存在于自然界中
B. 在分子中含有个手性原子
C. 碘单质在水溶液中溶解度很小是因为和都是非极性分子
D. 含氧酸可用通式表示,若值越大,则含氧酸的酸性越强
12. 下列对分子性质的解释,错误的是 ( )
A. 易溶于水,是因为与水分子间形成氢键
B. 分子中只含有个手性碳原子
C. 次磷酸与足量的溶液反应生成,可知是一元酸
D. 分子的结构为,可知为极性分子
13. 下列关于分子性质,说法正确的是( )
A. 比稳定是因为水分子间存在氢键
B. 由于和分子中非羟基氧原子个数均为,故二者酸性接近
C. 根据“相似相溶”原理,非极性分子在非极性溶剂中溶解度很大
D. 分子中仅有个“手性碳原子”
14. 下列说法不正确的是( )
A. 水很稳定是因为水中含有大量氢键
B. 乳酸分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶规律解释
D. 由图可知酸性:,因为的非羟基氧原子数大于次氯酸的非羟基氧原子数
二、填空题(本大题共4小题)
15. 含碳元素的物质是化学世界中最庞大的家族。回答下列问题:
碳在形成化合物时,其键型以共价键为主,中的化学键从形成的过程来看属于________填“”或“”键,从其极性来看属于________填“极性”或“非极性”键。
和分子中属于非极性分子的是________。
有机物中含氧官能团的名称为________,其中含有________个手性碳原子。
甲醇与乙烷的相对分子质量和范德华力均相近,但是二者的沸点相差很大,造成该差异的原因是__________________________。
16. 已知白磷结构如图所示,可知每个磷原子以________个共价键与另外的________个磷原子结合成正四面体结构,它应该是________填“极性”或“非极性”分子,在中________填“能”或“不能”溶解,原子的杂化方式是________。
一定条件下,、都能与形成笼状结构如图所示的水合物晶体,其相关参数见下表。与形成的水合物晶体俗称“可燃冰”。
“可燃冰”中分子间存在的两种作用力是________。
为开采深海海底的“可燃冰”,有科学家提出用置换的设想。已知上图中笼状结构的空腔直径为,根据上述图表,从物质结构及性质的角度分析,该设想的依据是________________________。
与可以任意比例互溶,除因为它们都是极性分子外,还因为________。
17. 试解释下列事实。
常温常压下,水的沸点比硫化氢的沸点高_______。
常温常压下,氯单质为气态,溴单质为液态_______。
酒精能与水以任意比例互溶,而四氯化碳不溶于水_______。
酸性:硫酸磷酸_______________________________。
、 、 的键能依次减小,键长依次增大______________________________________
18. 在、、、、、、中,含有配位键的微粒有 ;含有非极性键的微粒有 ;含有极性键的微粒有 ;极性键由强到弱的顺序为 。
答案和解析
1.【答案】
【解答】
A. 、、、分子中非羟基氧原子数依次为:、、、,含氧酸中非羟基氧原子个数越多,酸性越强,则、、、的酸性依次增强,故A正确;
B.苹果酸中连接羟基的碳原子上连接有个不同的原子或原子团,是手性碳原子,故B正确;
C.与水分子之间不能形成氢键,故C错误;
D.含有极性键的分子可能为极性分子,也可为非极性分子,如甲烷是由极性键构成的非极性分子,故D正确。
故选C。
2.【答案】
【解答】
A.碘是非极性分子易溶于非极性溶剂四氯化碳,甲烷属于非极性分子难溶于极性溶剂水,所以都可用相似相溶原理解释,故A正确;
B.碳原子连接四个不同的原子或原子团时,该碳原子为手性碳原子,所以乳酸中第二个为手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子,故B正确;
C.分子稳定性与共价键强度有关,共价键越强,分子越稳定,与氢键无关,氢键决定分子的物理性质,故C错误;
D.的非羟基氧原子数大于次氯酸的非羟基氧原子数,含氧酸中非羟基氧原子数越多,酸性越强,所以磷酸的酸性大于次氯酸,故D正确;
故选C。
3.【答案】
【解答】
A.碘是非极性分子易溶于非极性溶剂四氯化碳,甲烷属于非极性分子难溶于极性溶剂水,所以都可用相似相溶原理解释,故A正确;
B.碳原子连接四个不同的原子或原子团时,该碳原子为手性碳原子,所以乳酸中第二个为手性碳原子,该分子存在一个手性碳原子,故B正确;
C.含有孤电子对的微粒与含有空轨道的微粒易形成配合物,因而不仅是过渡金属才能形成配合物,故C错误;
D.的非羟基氧原子数大于次氯酸的非羟基氧原子数,所以磷酸的酸性大于次氯酸,故D正确。
故选C。
4.【答案】
【解答】
A.极易溶于水而难溶于水的原因是极性分子、氨分子能够与水分子形成氢键、氨分子能够与水反应,是非极性分子,故A错误;
B.手性碳原子指的是同一个碳原子上连接四个不同原子或原子团的碳原子,所以由于乳酸中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子,故 B正确;
C.水很稳定以上才会部分分解是因为水分子中氢氧键的键能大,不是氢键的影响,故C错误;
D.除了过渡元素能够形成配合物,某些主族金属的离子也能形成配合物,如铝离子能够形成等,故D错误。
故选B。
5.【答案】
【解答】
A.氢键是一种分子间作用力,不是化学键,故A错误;
B.一个碳原子与其它四个不同的原子或原子团相连的碳为手性原子,在分子中中间的碳为手性原子,故B正确;
C.是非极性分子而是极性分子,由相似相溶原理知,非极性分子难溶于极性溶剂,所以碘单质在水溶液中溶解度很小,故C错误;
D.含氧酸可用通式来表示,式中大于等于的是强酸,为的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,故D错误;
故选B。
6.【答案】
【解答】
根据“相似相溶”原理,水是极性分子,是非极性分子,和都是极性分子,故A错误、B正确; 是直线形分子,属于非极性分子,为形分子,属于极性分子,故C错;在水中溶解度很大,除了由于分子有极性外,还因为分子和分子之间可以形成氢键,故D错。
7.【答案】
【解答】
A. 根据原子成键规律,分子中存在碳碳非极性共价键,故A错误;
B.有机物一般难溶于水,易溶于有机物,、均属于有机物,在中溶解度比在水中的大,故B错误;
C.原子连有个不同的基团,具有手性,故CHC存在手性碳原子,故C正确;
D.为正四面体结构,正负电荷中性重合,为非极性分子,故D错误;
故选C。
8.【答案】
【解答】
A.氢化物的稳定性与化学键有关,与分子间作用力和氢键无关,的稳定性强于不能用分子间作用力和氢键解释,故A错误;
B.用皮毛摩擦的橡胶棒分别靠近水和的液流,水流发生偏转,是因为水分子中正负电荷中心不重合,而流不偏转,是因为四氯化碳分子中正负电荷中心重合,故B错误;
C.对羟基苯甲醛形成分子间氢键,其熔沸点较高,邻羟基苯甲醛形成分子内氢键,其熔沸点较低,所以对羟基苯甲醛的熔沸点比邻羟基苯甲醛的高,故C正确;
D.与均为非极性分子,而水是极性分子,根据相似相溶原理知,碘易溶于四氯化碳溶液而不易溶于水,所以可用萃取碘水中的,故D错误。
9.【答案】
【解答】
A.为平面正三角形分子,正负电荷中心重合,为非极性分子,而为极性分子,则分子极性:,故A正确;
B.和都是离子化合物,所带电荷相等,但离子半径:氟离子碘离子,所以形成的离子键较强,其硬度较大,即物质的硬度:,故B错误;
C.分子间存在氢键,导致其沸点较高,则物质的沸点:,故C错误;
D.为非极性溶剂,为非极性分子,为极性分子,结合相似相溶原理可知,在中的溶解度:,故D错误。
10.【答案】
【解答】
A.溴单质是非极性分子易溶于非极性溶剂四氯化碳,属于非极性分子难溶于极性溶剂水,所以都可用相似相溶原理解释,故A正确;
B.两种酸的结构分别为:,的非羟基氧原子数大于次氯酸的非羟基氧原子数,所以磷酸的酸性大于次氯酸,故B正确;
C.分子稳定性与共价键强度有关,共价键越强,分子越稳定,与氢键无关,氢键决定分子的物理性质,故C错误;
D.、均易溶于水的原因之一是与均能形成氢键,故D正确;
故选C。
11.【答案】
【解答】
A.氢键为分子间作用力的一种,氢键不是化学键,故A错误;
B.分子的中间碳原子上连个不同的原子或者原子团,为手性碳原子,含有个手性原子,故B正确;
C.碘是非极性分子,水是极性分子,二者极性不同,所以碘单质在水溶液中溶解度很小,故C错误;
D.含氧酸可用通式来表示,非羟基氧原子数目越大,酸性越强,即值越大,酸性越强,故D错误。
故选B。
12.【答案】
【解答】
A.与水分子间形成氢键,所以易溶于水,故A正确;
B.分子中含有个手性碳原子,分别是,故B错误;
C.次磷酸与足量的溶液反应生成,说明是一元酸,故C正确;
D.分子的结构为,由图可知正负电荷中心不重合,为极性分子,故D正确。
故选B。
13.【答案】
【解答】
A.氢键能使的熔沸点比高,比稳定是因为氢氧键比氢硫键稳定,故A错误.
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性,所以酸性,故B错误.
C.根据相似相溶原理:极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂,和都是非极性分子,所以碘易溶于四氯化碳,故C正确。
D.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,中有两个手性碳原子,故D错误。
14.【答案】
【解答】水很稳定是因为水分子中键的键能大,共价键牢固,不易被破坏,氢键主要影响物质的熔沸点,故A错误;
B.根据手性碳原子的概念可知,中与羟基相连的原子为手性碳原子,故B正确;
C.碘易溶于四氯化碳是因为都是非极性分子,甲烷难溶于水是因为甲烷是非极性分子,水是极性分子,所以都可用相似相溶规律解释,故C正确;
D.的非羟基氧原子数大于次氯酸的非羟基氧原子数,所以磷酸的酸性大于次氯酸,故D正确。
故选A。
15.【答案】;极性
、羧基;
甲醇分子间存在氢键,因此其沸点远高于乙烷
【解答】
个分子中含有四个共价键,单键为键,从共价键的极性来看属于极性键,故答案为:;极性;
和结构对称,分子中正负电荷重心重叠,都为非极性分子,故答案为:、;
有机物中含氧官能团的名称为羧基,连有四个不同基团的碳原子形象地称为手性碳原子常以标记手性碳原子,即,该化合物中含有个手性碳原子;故答案为:羧基;;
甲醇分子间存在氢键,会使其沸点远高于乙烷,这样虽然甲醇与乙烷的相对分子质量和范德华力均相近,但是二者的沸点相差很大;故答案为:甲醇分子间存在氢键,因此其沸点远高于乙烷。
16.【答案】;;非极性;能;
氢键、范德华力;
二氧化碳的分子直径小于笼状结构的空腔直径,且与水的结合能力强于甲烷
与分子之间可以形成氢键
【解答】
由白磷的结构图可知,每个磷原子以个共价键与另外的个磷原子结合成正四面体结构,四个原子位于正四面体顶点上,则白磷分子是非极性分子;它与二硫化碳分子都是非极性分子,相似相溶,所以白磷能溶于中;分子中每个原子与相邻的个原子形成个键、含有对孤对电子,杂化轨道数目为,则原子采取杂化;
故答案为:;;非极性;能;;
与形成的水合物俗称“可燃冰”,分子之间存在范德华力,水分子之间存在氢键;
故答案为:氢键、范德华力;
由表格可知:二氧化碳的分子直径小于笼状结构的空腔直径,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷;
故答案为:二氧化碳的分子直径小于笼状结构的空腔直径,且二氧化碳与水的结合能力强于甲烷;
与间能够形成氢键,且都为极性分子,二者互溶;
故答案为:与分子之间可以形成氢键。
17.【答案】水分子间有氢键
分子晶体的相对分子质量越大,范德华力越大,熔沸点越高
酒精是极性分子,且与水之间形成氢键
含氧酸非羟基氧原子越多,酸性越强,硫酸含有个非羟基氧原子,磷酸有一个;
氯原子、溴原子、碘原子半径逐渐增大
【解答】
常温常压下,水的沸点比硫化氢的沸点高的原因是水分子间有氢键;
结构相似的分子晶体,相对分子质量越大,范德华力越大,熔沸点越高常温常压下,则氯单质为气态,溴单质为液态;
酒精是极性分子,且与水之间形成氢键,酒精能与水以任意比例互溶,而四氯化碳不溶于水;
含氧酸非羟基氧原子越多,酸性越强,硫酸含有个非羟基氧原子,磷酸有一个,故酸性:硫酸磷酸;
氯原子、溴原子、碘原子半径逐渐增大,则 、 、 的键能依次减小,键长依次增大。
18.【答案】、
、
、、、、
【解答】
中提供孤电子对,提供空轨道,二者能形成配位键,中提供孤电子对,提供空轨道,二者能形成配位键,其余物质都不能形成配位键,故含有配位键的微粒为:、;同种元素原子之间形成非极性共价键,所以含有非极性键的微粒为、;不同元素原子之间形成极性共价键,所以含有极性键的微粒为、、、、;极性共价键的电负性相差越大,其极性键越强,、、、、分别形成、、,其中、、的电负性大小为,所以极性键由强到弱的顺序为。
第1页,共1页
