6.1.3 原电池的应用、化学电源 课件(共14张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.3 原电池的应用、化学电源 课件(共14张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 972.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-07 14:04:42 | ||
图片预览






文档简介
(共14张PPT)
化学反应与能量
原电池的应用、化学电源
第3课时
原电池电极反应的书写方法
负极反应:负极金属失电子变成阳离子的反应
正极反应:电解质溶液中阳离子得电子的反应
总反应:负极金属与电解质溶液的离子反应
—氧化反应(失电子)
—还原反应(得电子)
注意事项:
①电极反应式是表示原子或离子在电极上得失电子的式子;(属于离子反应)
②两极反应式中电子得失数目相等;电极反应式中系数一般不化简;
③两电极反应式相加可得原电池总反应式。
1. 加快反应速率
实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率
稀H2SO4
Zn
Cu
Zn+ CuSO4 = Cu + ZnSO4
锌、铜在稀硫酸溶液中形成原电池,加快锌与酸的反应速率
原电池的应用
2. 比较金属活动性顺序
【例】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a
B
一般, 活泼金属作负极,较不活泼的金属作正极
原电池的应用
通常在轮船的尾部和在船壳的水线以下部分,装一定数量的锌块。原因:轮船的船身一般是用铁做的,装上锌块后,铁跟锌形成原电池,此时锌作为负极发生氧化反应溶掉,而铁作为正极被保护起来不受腐蚀。
金属易因发生原电池反应而腐蚀,如何避免轮船船身被腐蚀,延长其寿命?
3. 金属的防护
利用原电池原理,将金属作为正极保护起来
原电池的应用
4. 设计原电池——制化学电源
心脏起搏器
心脏起搏器是一种植入于体内的电子治疗仪器,通过脉冲发生器发放由电池提供能量的电脉冲,通过导线电极的传导,刺激电极所接触的心肌,使心脏激动和收缩,从而达到治疗由于某些心律失常所致的心脏功能障碍的目的。
原电池的应用
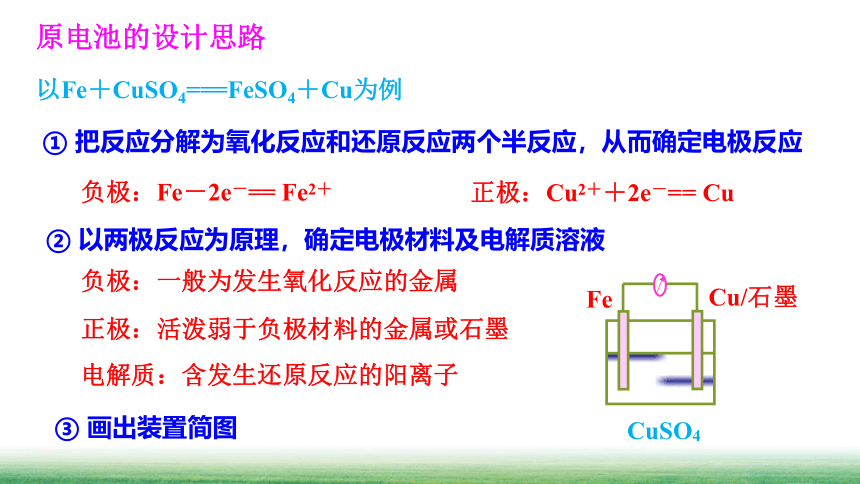
原电池的设计思路
① 把反应分解为氧化反应和还原反应两个半反应,从而确定电极反应
以Fe+CuSO4===FeSO4+Cu为例
② 以两极反应为原理,确定电极材料及电解质溶液
负极:Fe-2e-== Fe2+
正极:Cu2++2e-== Cu
③ 画出装置简图
Cu/石墨
Fe
CuSO4
负极:一般为发生氧化反应的金属
正极:活泼弱于负极材料的金属或石墨
电解质:含发生还原反应的阳离子
练:请利用氧化还原反应 Cu+2Ag+ = Cu2++2Ag,选择适宜的材料和
试剂设计一个原电池装置,回答下列问题。
Ag片/石墨棒
(1)负极材料: ,正极材料: ,
电解质溶液: 。
AgNO3
Cu 片
(2)写出电极反应式:
负极: ,
正极: 。
Cu-2e =Cu2+
2Ag+ +2e =2Ag
Cu C
A
AgNO3溶液
普通锌锰电池
碱性电池
小型高性能燃料电池
镍氢电池
纽扣电池
铅蓄电池
锂电池
化学电源
分类
一次电池:又称不可充电电池
消耗到一定程度,就不能使用
内部的氧化还原反应无法逆向进行电池
二次电池:又称充电电池
放电时所进行的氧化还原反应,在充电时
可以逆向进行
燃料电池
化学电源的分类
石墨棒
MnO2糊
NH4Cl糊
锌筒
最早使用的干电池是锌锰干电池
负极(锌筒):
Zn - 2e- = Zn2+
正极石墨棒,最终被还原的物质是MnO2
电解质:糊状的MnO2和NH4Cl
一次电池(干电池)
缺陷:使用中,锌作负极,会逐渐溶解, 锌外壳
变薄,最后漏液,腐蚀电器;电池寿命短
改进:外壳套上防腐金属筒或塑料筒;
用KOH代替NH4Cl,制成“碱性锌锰电池”
H2SO4
Pb(铅)
PbO2
最早使用的蓄电池是铅蓄电池
总反应: PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O
充电
放电
负极: 金属Pb
正极: PbO2
特点:
电压稳定、使用方便,安全可靠,可反复使用
寿命较短,质量、体积大,不方便携带
放电时:化学能→电能
充电时:电能→化学能
常见的充电电池如:铅蓄电池、镉镍电池、锂电池等
二次电池(充电电池)
电池里含有汞、铅、镉等多种重金属元素,随意丢弃废旧电池,对环境会造成严重的污染。
思考:有什么电池是几乎零污染的吗
电池中的汞:能造成水俣病,佝偻病等
电池中的铅:能引起人体神经紊乱,肾炎
电池中的镉:能造成肾损伤,骨质疏松,软骨病。
大有发展前景的燃料电池
燃料燃烧的化学反应都是氧化还原反应,理论上都可用于设计原电池。
利用氢气、天然气、甲醇等燃料与氧气或空气进行电化学反应时释放出来的化学能直接转化成电能。
原理:
高效、环境友好的发电装置,
能量转化率较高
反应物不储存在电池内部
特点:
两极惰性材料(一般为Pt或石墨),只导电,不参与反应
化学反应与能量
原电池的应用、化学电源
第3课时
原电池电极反应的书写方法
负极反应:负极金属失电子变成阳离子的反应
正极反应:电解质溶液中阳离子得电子的反应
总反应:负极金属与电解质溶液的离子反应
—氧化反应(失电子)
—还原反应(得电子)
注意事项:
①电极反应式是表示原子或离子在电极上得失电子的式子;(属于离子反应)
②两极反应式中电子得失数目相等;电极反应式中系数一般不化简;
③两电极反应式相加可得原电池总反应式。
1. 加快反应速率
实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率
稀H2SO4
Zn
Cu
Zn+ CuSO4 = Cu + ZnSO4
锌、铜在稀硫酸溶液中形成原电池,加快锌与酸的反应速率
原电池的应用
2. 比较金属活动性顺序
【例】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a
B
一般, 活泼金属作负极,较不活泼的金属作正极
原电池的应用
通常在轮船的尾部和在船壳的水线以下部分,装一定数量的锌块。原因:轮船的船身一般是用铁做的,装上锌块后,铁跟锌形成原电池,此时锌作为负极发生氧化反应溶掉,而铁作为正极被保护起来不受腐蚀。
金属易因发生原电池反应而腐蚀,如何避免轮船船身被腐蚀,延长其寿命?
3. 金属的防护
利用原电池原理,将金属作为正极保护起来
原电池的应用
4. 设计原电池——制化学电源
心脏起搏器
心脏起搏器是一种植入于体内的电子治疗仪器,通过脉冲发生器发放由电池提供能量的电脉冲,通过导线电极的传导,刺激电极所接触的心肌,使心脏激动和收缩,从而达到治疗由于某些心律失常所致的心脏功能障碍的目的。
原电池的应用
原电池的设计思路
① 把反应分解为氧化反应和还原反应两个半反应,从而确定电极反应
以Fe+CuSO4===FeSO4+Cu为例
② 以两极反应为原理,确定电极材料及电解质溶液
负极:Fe-2e-== Fe2+
正极:Cu2++2e-== Cu
③ 画出装置简图
Cu/石墨
Fe
CuSO4
负极:一般为发生氧化反应的金属
正极:活泼弱于负极材料的金属或石墨
电解质:含发生还原反应的阳离子
练:请利用氧化还原反应 Cu+2Ag+ = Cu2++2Ag,选择适宜的材料和
试剂设计一个原电池装置,回答下列问题。
Ag片/石墨棒
(1)负极材料: ,正极材料: ,
电解质溶液: 。
AgNO3
Cu 片
(2)写出电极反应式:
负极: ,
正极: 。
Cu-2e =Cu2+
2Ag+ +2e =2Ag
Cu C
A
AgNO3溶液
普通锌锰电池
碱性电池
小型高性能燃料电池
镍氢电池
纽扣电池
铅蓄电池
锂电池
化学电源
分类
一次电池:又称不可充电电池
消耗到一定程度,就不能使用
内部的氧化还原反应无法逆向进行电池
二次电池:又称充电电池
放电时所进行的氧化还原反应,在充电时
可以逆向进行
燃料电池
化学电源的分类
石墨棒
MnO2糊
NH4Cl糊
锌筒
最早使用的干电池是锌锰干电池
负极(锌筒):
Zn - 2e- = Zn2+
正极石墨棒,最终被还原的物质是MnO2
电解质:糊状的MnO2和NH4Cl
一次电池(干电池)
缺陷:使用中,锌作负极,会逐渐溶解, 锌外壳
变薄,最后漏液,腐蚀电器;电池寿命短
改进:外壳套上防腐金属筒或塑料筒;
用KOH代替NH4Cl,制成“碱性锌锰电池”
H2SO4
Pb(铅)
PbO2
最早使用的蓄电池是铅蓄电池
总反应: PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2O
充电
放电
负极: 金属Pb
正极: PbO2
特点:
电压稳定、使用方便,安全可靠,可反复使用
寿命较短,质量、体积大,不方便携带
放电时:化学能→电能
充电时:电能→化学能
常见的充电电池如:铅蓄电池、镉镍电池、锂电池等
二次电池(充电电池)
电池里含有汞、铅、镉等多种重金属元素,随意丢弃废旧电池,对环境会造成严重的污染。
思考:有什么电池是几乎零污染的吗
电池中的汞:能造成水俣病,佝偻病等
电池中的铅:能引起人体神经紊乱,肾炎
电池中的镉:能造成肾损伤,骨质疏松,软骨病。
大有发展前景的燃料电池
燃料燃烧的化学反应都是氧化还原反应,理论上都可用于设计原电池。
利用氢气、天然气、甲醇等燃料与氧气或空气进行电化学反应时释放出来的化学能直接转化成电能。
原理:
高效、环境友好的发电装置,
能量转化率较高
反应物不储存在电池内部
特点:
两极惰性材料(一般为Pt或石墨),只导电,不参与反应
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
