备战2023河南中考考点过关-第九单元 溶液 课件(共60张PPT)
文档属性
| 名称 | 备战2023河南中考考点过关-第九单元 溶液 课件(共60张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-06 19:38:16 | ||
图片预览











文档简介
(共60张PPT)
第九单元 溶液
&1& 溶液的组成及特征
1.溶液
溶液 定义 一种或几种物质分散到另一种物质里,形成的①________、
②________的
③__________
组成 溶质:被溶解的物质,可以是气体、液体或固体
溶剂:能溶解其他物质的物质,④______是最常用的溶剂,
汽油和酒精也可作溶剂
均一
稳定
混合物
水
溶液 特征 ⑤__________:溶液中任意一部分的组成、性质完全相同
⑥__________:外界条件(温度、气压等)不变时,溶质
不会从溶剂中析出
均一性
稳定性
续表
2.物质溶解时的吸热和放热现象
放热 ①____________(固)、 ②__________(液)等 通常会引起密闭容器
内的压强变化
吸热 ③__________(固)等
无明显现象 氯化钠(固)等
氢氧化钠
浓硫酸
硝酸铵
【知识拓展】 (1)将
反应而放出热量。
(2)可以用水鉴别硝酸铵、氢氧化钠、硫酸铜、氯化钠固体。
(3)密闭容器内物质溶解时的吸热和放热现象通常会引起容器内的压强
变化。若吸收热量,则会使密闭容器内压强减小;若放出热量,则会使
密闭容器内压强增大。
3.常见的去污方法及原理
方法 原理 举例
溶解 使污垢溶解于某种溶剂中,从 而去除污垢 用汽油洗去衣服上的油渍
乳化 使乳化剂作用于污垢,发生 ________作用,从而去除污垢 用洗洁精洗去碗碟上的油污
化学 反应 使污垢与某些物质发生反应从 而将其去除 盐酸除铁锈、醋酸除水垢、用含氢
氧化钠的清洁剂清洗油烟机
乳化
辨析易错易混·正误判断
1.溶液都是无色的。 ( )
×
[解析] 溶液不一定是无色的,如
2.均一、稳定的液体不一定是溶液。 ( )
√
[解析] 均一、稳定的液体不一定是溶液,如水。
3.在一种溶液中溶质可以有一种或多种,而溶剂只能有一种。 ( )
√
4.溶液的质量等于溶质质量与溶剂质量之和,溶液的体积等于溶质体积
和溶剂体积之和。 ( )
×
[解析] 因为分子间有间隔,溶液的体积不等于溶质体积和溶剂体积之和。
考点过关练
1.&2& 海纳百川,有容乃大;水可包容万物。
(1) [2022北京中考] 下列物质放入水中能形成溶液的是( )
A.蔗糖 B.泥土 C.面粉 D.花生油
A
(2) 溶液具有________性、________性。________________叫溶质,
溶质具有__________________性,溶质可以通过________的方法从溶液
里分离出来。
均一
稳定
被溶解的物质
可溶(或易溶)
结晶
(3) 有些溶质在溶解过程中有能量变化,如图所示,向
烧杯中加入试剂A,发现澄清石灰水变浑浊,则试剂A可能
是________________________________________________。
氢氧化钠固体(或浓硫酸、氧化钙等,合理即可)
(4) 在水中加入洗涤剂可以除去衣物上的油污,这是因为洗涤剂具有
________作用。
乳化
&3& 溶解度
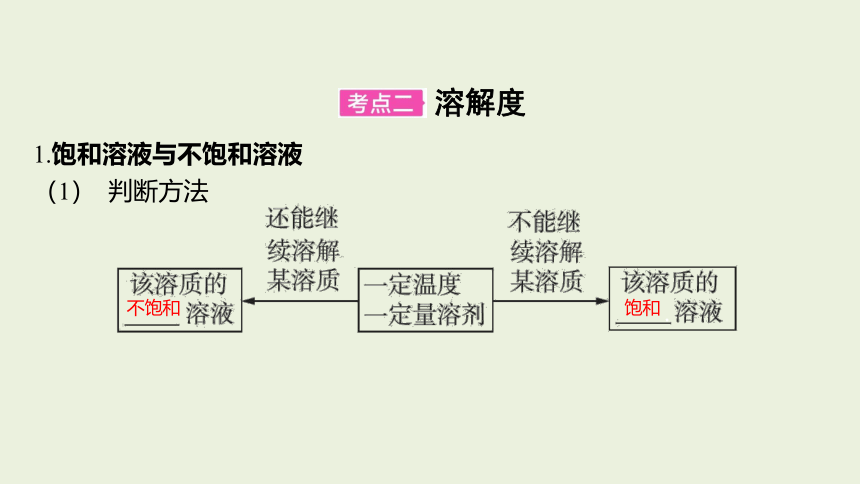
1.饱和溶液与不饱和溶液
(1) 判断方法
.&4& .
不饱和
饱和
(2) 饱和溶液与不饱和溶液的转化
①对于大多数固体(溶解度随温度升高而增大的物质):
不饱和溶液
②对于极少数固体[溶解度随温度升高而减小的物质,如
不饱和溶液
溶质
降低
溶剂
溶剂
升高
溶质
升高
溶剂
溶剂
降低
(3) 溶质结晶方法
①____________(或冷却热饱和溶液):适用于溶解度受温度影响变化
大的物质,如
②____________:适用于溶解度受温度影响变化不大的物质,如
降温结晶
蒸发结晶
2.溶解度
固体溶解度 气体溶解度
定 义 在一定温度下,某固体物质在
饱和状态
固体溶解度 气体溶解度
影响 因素 内因 溶质的性质、溶剂的性质
外因 主要是温度(温度越 高,大多数物质的溶 解度越大,熟石灰等 物质除外) 温度:温度越高,气体的溶解度________
压强:压强越大,气体的溶解度________
越小
越大
续表
固体溶解度 气体溶解度
应用举例 蔗糖在水中没有完全 溶解,稍加热,蔗糖 可以继续溶解,是因 为温度升高,蔗糖的 溶解度增大 打开汽水瓶盖时,会有大量气体涌出,原因是压强减小,气体的溶解度减小;喝汽水后会打嗝,是因为汽水到体内,温度升高,气体的溶解度减小
续表
【整理归纳】 (1)理解固体物质溶解度概念的四个要素:①“一定温
度”——条件;②“
解的质量(溶质)”——单位
(2)固体溶解度(
溶解度
溶解性 ________ 微溶 可溶 ________
举例 碳酸钙、氯化 银 熟石灰、硫酸 钙 碳酸氢钠、硼 酸 硝酸钾、氯化
钠
难溶
易溶
3.溶解度曲线
(1) 定义:用纵轴表示溶解度,横轴表示温度,得到表示物质的溶解
度随________变化的曲线。
温度
(2) 溶解度曲线的意义
溶解度 曲线 点 ①曲线上的点:表示对应温度下的溶解度
②两曲线的交点:表示两物质在某温度下溶解度
________
相等
溶解度曲线 线 反映物质的溶解度随温度变化的趋势 ①大多数物质的溶解度随温度的升
高而增大,如__________
②少数物质的溶解度受温度影响变
化不大,如__________
③极少数物质的溶解度随温度的升
高而减小,如____________
面 ①曲线上方:溶液处于过饱和状态(溶液饱和且有未溶解的溶质) ②曲线下方:溶液处于不饱和状态
硝酸钾
氯化钠
氢氧化钙
续表
辨析易错易混·正误判断
1.饱和溶液不能再溶解任何物质。 ( )
×
[解析] 饱和溶液是相对于某溶质饱和,对于其他溶质不一定饱和。如一
定温度下饱和的氯化钠溶液仍能溶解适量硝酸钾。
2.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液。 ( )
×
3.同一温度下,同种溶质的饱和溶液一定比不饱和溶液浓。 ( )
√
4.接近饱和的氢氧化钙溶液可以通过升温变成饱和溶液。 ( )
√
5.搅拌能使固体物质的溶解度增大。 ( )
×
[解析] 影响固体物质溶解度大小的因素主要是温度和溶剂种类,搅拌只
能改变物质的溶解速率,不能改变物质的溶解度大小。
考点过关练
1. [2022陕西中考] &5
据如下表。
温度
溶解 度
(1)
(2) 如图是
____(填“
质的质量相等,则下列说法不正确 的是_____(填字母)。
C
A.两种溶液中溶剂的质量相等
B.两种溶液中溶质质量分数相等
C.
(3)
下操作:
据此分析,
4.6
105
&6& 溶质的质量分数
1.溶质的质量分数
定义 溶液中溶质的质量分数是________质量与________质量之比
计算公式 (1)所有溶液:
(2)饱和溶液:
溶质
溶液
2.溶液的稀释
原理 溶液稀释前后,溶质的质量不变
计算公式
3.有关溶质质量分数的常见误区
【误区1】溶液中的溶质越多,溶质的质量分数就一定越大。
【点拨】质量分数是一个比值,它的大小既与溶质质量有关,也与溶液
质量有关。
【误区2】在一定温度下,可以配制出任意溶质质量分数的某溶液。
【点拨】一定温度下,当溶液达到饱和状态时,其溶质质量分数最大,
不能配制出更大溶质质量分数的该溶液。
【误区3】将
溶质的质量分数变为
【点拨】根据溶液的均一性,将
掉一半,剩余溶液中溶质的质量分数是不变的,仍为
溶剂和溶液的质量均减小了一半。
【误区4】将
数为
【点拨】两种溶液相混合,溶液的质量具有加和性,但溶质的质量分数
不能相加。实际上,该两种溶液混合后所得溶液中溶质的质量分数为
4.配制一定溶质质量分数的溶液(详见实验帮)
考点过关练
1.[2022荆州中考] 向一定温度、一定量的饱和氢氧化钙溶液中加入适量
的氧化钙,下列图像符合实际变化过程的是( )
A.&7& B.&8&
C.&9& D.&10&
B
2.[2022云南中考] 为探究硝酸钾的溶解性,进行了下图所示实验:
结合硝酸钾在不同温度下的溶解度,判断下列说法不正确 的是( )
温度
A.①③中的溶液均为不饱和溶液
B.②③中溶液的质量:③>②
C.②③④中溶液的溶质质量分数:③>②>④
D.④中析出晶体的质量是
D
实验1 溶解时的吸放热现象
如图,加入
管是______(填“甲”或“乙”),烧杯中悬浮物
________(填“向上”或“向下”)运动。
甲
向上
实验2 探究影响物质溶解性的因素
(1)试管①与试管④中固体几乎不溶解;试管
②中固体完全溶解,溶液呈棕色;试管③中固
体完全溶解,溶液呈紫红色。
(2) 对比试管__________________中的现象,可以得出物质的溶解性
与溶剂的性质有关。
①②(或③④)
(3) 设计实验①③,可探究________________________________。
物质的溶解性与溶质的性质有关
(4) 该实验运用了____________的研究方法。
控制变量
实验 一定溶质质量分数的溶液的配制
1.用固体配制溶液
(1) 所需仪器:托盘天平(带砝码)、镊子、药匙、____________、
烧杯、__________、________。
胶头滴管
玻璃棒
量筒
(2) 操作步骤(以配制
①计算:计算所需氯化钠的质量为________,水的体积为__________
(按水的密度
②称量:用____________称取一定质量的氯化钠。
③量取:用量筒量取一定体积的水(接近所需体积时改用____________)。
④溶解:将氯化钠倒入烧杯中,将量取的水倒入烧杯中,用__________不
断搅拌至氯化钠完全溶解。
⑤装瓶:将配制好的氯化钠溶液转移到试剂瓶中并贴上标签。
整个配制过程如图所示:
托盘天平
胶头滴管
玻璃棒
(3) 注意事项
①用天平称量时要遵循“左物右码”的原则,且左右两个托盘上各放一张
干净的大小相同的纸片(有腐蚀性或易潮解的药品要放在玻璃器皿中称
量)。
②量取液体读数时,应将量筒放平,视线与
____________________________保持水平。
量筒内液体凹液面的最低处
(4)误差分析
误差 原因 举例
溶质质 量分数 偏小 溶质的量 偏少 ①溶质中有杂质;
②药品与砝码位置放反且用到游码;
③天平空载时,指针向左偏;
④转移药品时有撒落(或称量纸上有药品残留);
⑤溶质没有完全溶解
误差 原因 举例
溶质质量分数偏小 溶剂的量 偏多 ①量取溶剂时仰视读数;
②配制前,烧杯或试剂瓶用蒸馏水润洗,即仪器内原来就有少量水
溶质质量分数偏大 溶质的量 偏多 ①所用砝码已生锈或沾有污渍;
②天平空载时,指针向右偏
溶剂的量 偏少 ①量取水时俯视读数;
②向烧杯中倒水时,有水洒出
续表
【反思设问】 将配制好的氯化钠溶液转移到试剂瓶时,仍有部分留在烧杯中,则所配得的氯化钠溶液的质量分数如何变化?
[答案] 没有影响。
2.用浓溶液配制稀溶液
(1) 所需仪器:胶头滴管、烧杯、玻璃棒、量筒。与用固体配制溶液相比,
少了____________、________、________。
托盘天平
镊子
药匙
(2)操作步骤:
①计算:计算所需浓溶液的体积和所需水的体积:
浓溶液的质量=
水的质量=稀溶液的质量-浓溶液的质量=
浓溶液的质量
②量取:用量筒量取浓溶液和水(接近所需体积时改用胶头滴管);
③混匀:将量取的浓溶液和水倒入烧杯中,用玻璃棒搅拌;
④装瓶:将配制好的溶液装入试剂瓶并贴上标签。
&11& 实验室配制
答:
(1) 图中使用到的玻璃仪器有________、量筒、玻璃棒、广口瓶。
烧杯
(2) 图示中正确的操作顺序为______________(填序号)。
②①⑤③④
(3) 溶解时用玻璃棒搅拌的目的是____________________。
加快氯化钠的溶解
(4) 取
20
(5) 将配制好的溶液装瓶并贴上标签。小明同学
贴的标签有不妥之处,如图所示,请在右侧的空白
标签上填写正确内容。
.&12
&
.
(6)经检测,配制的溶液溶质质量分数小于
A.氯化钠固体不纯
B.称量时砝码端忘垫质量相同的纸片
C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠
E.量取水时俯视读数
ABD
命题点1 溶解度及溶解度曲线/表格(必考)
1.[2021河南10] 如图是
( )
B
A.
B.
C.
D.将
溶质的质量保持不变
2.[2020河南10] 甲、乙两种固体的溶解度曲线如图所示。下列说法正确
的是( )
B
A.甲的溶解度大于乙的溶解度
B.
C.
D.将
液中溶质的质量甲大于乙
3.[2016河南8] 下图是甲、乙的溶解度曲线。下列说法不正确 的是( )
D
A.
B.
C.降低温度能使接近饱和的甲溶液变为饱和溶液
D.
质量分数为
4.[2015河南11] 下表是不正确 的是
( )
温度
溶解度
A.
B.两种物质溶解度相等的温度在
C.
D.
C
5.[2022河南17] 氢氧化钙固体的溶解度曲线如图所示。
(1) 由图可知,氢氧化钙的溶解度随着温度的升高而________(填“增
大”或“
减小
(2)
_ ____________________(写出计算式即可)。
6.如图是甲、乙两种固体的溶解度曲线。
第6题图
(1) [2019河南16第一空;2018河南18第一空] 甲和乙的溶解度相等时的
温度为_____
(2) [2018河南18第二空]
乙的饱和溶液,所需要水的质量关系为甲________乙(填“大于”“小于”或
“
小于
(3) [2013河南14第一空]
温至
7.[2017河南18第一、三空] 如图是甲、乙两种固体的溶
解度曲线。将
和溶液降温至
乙的溶解度曲线为_____(填“
将
需加水的质量为______
70
第7题图
8.[2019河南B卷18] 将
的烧杯中充分溶解,测得溶液质量随温度变化的曲线如
下图所示。则
C三点所对应的溶液中,一定是饱和溶液的为_______点
处的溶液;将
的质量为______
AB
9.[2017河南B卷18] 根据如图所示甲、乙两种物质的溶解度曲线回答相
关问题:
(1) 在_____
(2)
_______
(3) 将
变),所得溶液的溶质质量分数的关系是甲_____(填“>”“<”或“=”)
乙。
=
命题点2 溶液的配制(必考)
10.[2019河南10] 实验室用氯化钠配制
下列说法不正确 的是( )
A.所需氯化钠的质量为
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃仪器有烧杯、玻璃棒、量筒等
C
11.[2018河南11] 实验室配制一定溶质质量分数的氯化钠溶液时,下列操
作会导致结果偏小的是( )
①称量的氯化钠固体中含有不溶性杂质;②用量筒量取水时仰视读数;③
往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④
A
12.[2022河南18] 实验室用氯化钠固体配制
实验步骤为计算、__________________、量取、溶解;水的密度近似看做
称量(或称取)
13.[2020河南17] 实验室配制一定溶质质量分数的氯化钠溶液时,所需氯
化钠固体应该放在托盘天平的________(填“左盘”或“右盘”)上进行称
量;若所配制溶液的溶质质量分数偏大,则可能是量取水时________
(填“俯视”或“仰视”)量筒读数所致。
左盘
俯视
14.[2021河南23] 实验室选用下列仪器配制
溶液。
(1) 所需氯化钠固体的质量为_____
3
(2) 完成该实验,上图中有一种仪器不必用到,请写出该仪器的名称。
[答案] 漏斗。
(3) 若其他操作正确,量取水时俯视量筒读数,对结果会造成什么影响?
[答案] 会导致所配制溶液的质量分数偏大。
第九单元 溶液
&1& 溶液的组成及特征
1.溶液
溶液 定义 一种或几种物质分散到另一种物质里,形成的①________、
②________的
③__________
组成 溶质:被溶解的物质,可以是气体、液体或固体
溶剂:能溶解其他物质的物质,④______是最常用的溶剂,
汽油和酒精也可作溶剂
均一
稳定
混合物
水
溶液 特征 ⑤__________:溶液中任意一部分的组成、性质完全相同
⑥__________:外界条件(温度、气压等)不变时,溶质
不会从溶剂中析出
均一性
稳定性
续表
2.物质溶解时的吸热和放热现象
放热 ①____________(固)、 ②__________(液)等 通常会引起密闭容器
内的压强变化
吸热 ③__________(固)等
无明显现象 氯化钠(固)等
氢氧化钠
浓硫酸
硝酸铵
【知识拓展】 (1)将
反应而放出热量。
(2)可以用水鉴别硝酸铵、氢氧化钠、硫酸铜、氯化钠固体。
(3)密闭容器内物质溶解时的吸热和放热现象通常会引起容器内的压强
变化。若吸收热量,则会使密闭容器内压强减小;若放出热量,则会使
密闭容器内压强增大。
3.常见的去污方法及原理
方法 原理 举例
溶解 使污垢溶解于某种溶剂中,从 而去除污垢 用汽油洗去衣服上的油渍
乳化 使乳化剂作用于污垢,发生 ________作用,从而去除污垢 用洗洁精洗去碗碟上的油污
化学 反应 使污垢与某些物质发生反应从 而将其去除 盐酸除铁锈、醋酸除水垢、用含氢
氧化钠的清洁剂清洗油烟机
乳化
辨析易错易混·正误判断
1.溶液都是无色的。 ( )
×
[解析] 溶液不一定是无色的,如
2.均一、稳定的液体不一定是溶液。 ( )
√
[解析] 均一、稳定的液体不一定是溶液,如水。
3.在一种溶液中溶质可以有一种或多种,而溶剂只能有一种。 ( )
√
4.溶液的质量等于溶质质量与溶剂质量之和,溶液的体积等于溶质体积
和溶剂体积之和。 ( )
×
[解析] 因为分子间有间隔,溶液的体积不等于溶质体积和溶剂体积之和。
考点过关练
1.&2& 海纳百川,有容乃大;水可包容万物。
(1) [2022北京中考] 下列物质放入水中能形成溶液的是( )
A.蔗糖 B.泥土 C.面粉 D.花生油
A
(2) 溶液具有________性、________性。________________叫溶质,
溶质具有__________________性,溶质可以通过________的方法从溶液
里分离出来。
均一
稳定
被溶解的物质
可溶(或易溶)
结晶
(3) 有些溶质在溶解过程中有能量变化,如图所示,向
烧杯中加入试剂A,发现澄清石灰水变浑浊,则试剂A可能
是________________________________________________。
氢氧化钠固体(或浓硫酸、氧化钙等,合理即可)
(4) 在水中加入洗涤剂可以除去衣物上的油污,这是因为洗涤剂具有
________作用。
乳化
&3& 溶解度
1.饱和溶液与不饱和溶液
(1) 判断方法
.&4& .
不饱和
饱和
(2) 饱和溶液与不饱和溶液的转化
①对于大多数固体(溶解度随温度升高而增大的物质):
不饱和溶液
②对于极少数固体[溶解度随温度升高而减小的物质,如
不饱和溶液
溶质
降低
溶剂
溶剂
升高
溶质
升高
溶剂
溶剂
降低
(3) 溶质结晶方法
①____________(或冷却热饱和溶液):适用于溶解度受温度影响变化
大的物质,如
②____________:适用于溶解度受温度影响变化不大的物质,如
降温结晶
蒸发结晶
2.溶解度
固体溶解度 气体溶解度
定 义 在一定温度下,某固体物质在
饱和状态
固体溶解度 气体溶解度
影响 因素 内因 溶质的性质、溶剂的性质
外因 主要是温度(温度越 高,大多数物质的溶 解度越大,熟石灰等 物质除外) 温度:温度越高,气体的溶解度________
压强:压强越大,气体的溶解度________
越小
越大
续表
固体溶解度 气体溶解度
应用举例 蔗糖在水中没有完全 溶解,稍加热,蔗糖 可以继续溶解,是因 为温度升高,蔗糖的 溶解度增大 打开汽水瓶盖时,会有大量气体涌出,原因是压强减小,气体的溶解度减小;喝汽水后会打嗝,是因为汽水到体内,温度升高,气体的溶解度减小
续表
【整理归纳】 (1)理解固体物质溶解度概念的四个要素:①“一定温
度”——条件;②“
解的质量(溶质)”——单位
(2)固体溶解度(
溶解度
溶解性 ________ 微溶 可溶 ________
举例 碳酸钙、氯化 银 熟石灰、硫酸 钙 碳酸氢钠、硼 酸 硝酸钾、氯化
钠
难溶
易溶
3.溶解度曲线
(1) 定义:用纵轴表示溶解度,横轴表示温度,得到表示物质的溶解
度随________变化的曲线。
温度
(2) 溶解度曲线的意义
溶解度 曲线 点 ①曲线上的点:表示对应温度下的溶解度
②两曲线的交点:表示两物质在某温度下溶解度
________
相等
溶解度曲线 线 反映物质的溶解度随温度变化的趋势 ①大多数物质的溶解度随温度的升
高而增大,如__________
②少数物质的溶解度受温度影响变
化不大,如__________
③极少数物质的溶解度随温度的升
高而减小,如____________
面 ①曲线上方:溶液处于过饱和状态(溶液饱和且有未溶解的溶质) ②曲线下方:溶液处于不饱和状态
硝酸钾
氯化钠
氢氧化钙
续表
辨析易错易混·正误判断
1.饱和溶液不能再溶解任何物质。 ( )
×
[解析] 饱和溶液是相对于某溶质饱和,对于其他溶质不一定饱和。如一
定温度下饱和的氯化钠溶液仍能溶解适量硝酸钾。
2.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液。 ( )
×
3.同一温度下,同种溶质的饱和溶液一定比不饱和溶液浓。 ( )
√
4.接近饱和的氢氧化钙溶液可以通过升温变成饱和溶液。 ( )
√
5.搅拌能使固体物质的溶解度增大。 ( )
×
[解析] 影响固体物质溶解度大小的因素主要是温度和溶剂种类,搅拌只
能改变物质的溶解速率,不能改变物质的溶解度大小。
考点过关练
1. [2022陕西中考] &5
据如下表。
温度
溶解 度
(1)
(2) 如图是
____(填“
质的质量相等,则下列说法
C
A.两种溶液中溶剂的质量相等
B.两种溶液中溶质质量分数相等
C.
(3)
下操作:
据此分析,
4.6
105
&6& 溶质的质量分数
1.溶质的质量分数
定义 溶液中溶质的质量分数是________质量与________质量之比
计算公式 (1)所有溶液:
(2)饱和溶液:
溶质
溶液
2.溶液的稀释
原理 溶液稀释前后,溶质的质量不变
计算公式
3.有关溶质质量分数的常见误区
【误区1】溶液中的溶质越多,溶质的质量分数就一定越大。
【点拨】质量分数是一个比值,它的大小既与溶质质量有关,也与溶液
质量有关。
【误区2】在一定温度下,可以配制出任意溶质质量分数的某溶液。
【点拨】一定温度下,当溶液达到饱和状态时,其溶质质量分数最大,
不能配制出更大溶质质量分数的该溶液。
【误区3】将
溶质的质量分数变为
【点拨】根据溶液的均一性,将
掉一半,剩余溶液中溶质的质量分数是不变的,仍为
溶剂和溶液的质量均减小了一半。
【误区4】将
数为
【点拨】两种溶液相混合,溶液的质量具有加和性,但溶质的质量分数
不能相加。实际上,该两种溶液混合后所得溶液中溶质的质量分数为
4.配制一定溶质质量分数的溶液(详见实验帮)
考点过关练
1.[2022荆州中考] 向一定温度、一定量的饱和氢氧化钙溶液中加入适量
的氧化钙,下列图像符合实际变化过程的是( )
A.&7& B.&8&
C.&9& D.&10&
B
2.[2022云南中考] 为探究硝酸钾的溶解性,进行了下图所示实验:
结合硝酸钾在不同温度下的溶解度,判断下列说法
温度
A.①③中的溶液均为不饱和溶液
B.②③中溶液的质量:③>②
C.②③④中溶液的溶质质量分数:③>②>④
D.④中析出晶体的质量是
D
实验1 溶解时的吸放热现象
如图,加入
管是______(填“甲”或“乙”),烧杯中悬浮物
________(填“向上”或“向下”)运动。
甲
向上
实验2 探究影响物质溶解性的因素
(1)试管①与试管④中固体几乎不溶解;试管
②中固体完全溶解,溶液呈棕色;试管③中固
体完全溶解,溶液呈紫红色。
(2) 对比试管__________________中的现象,可以得出物质的溶解性
与溶剂的性质有关。
①②(或③④)
(3) 设计实验①③,可探究________________________________。
物质的溶解性与溶质的性质有关
(4) 该实验运用了____________的研究方法。
控制变量
实验 一定溶质质量分数的溶液的配制
1.用固体配制溶液
(1) 所需仪器:托盘天平(带砝码)、镊子、药匙、____________、
烧杯、__________、________。
胶头滴管
玻璃棒
量筒
(2) 操作步骤(以配制
①计算:计算所需氯化钠的质量为________,水的体积为__________
(按水的密度
②称量:用____________称取一定质量的氯化钠。
③量取:用量筒量取一定体积的水(接近所需体积时改用____________)。
④溶解:将氯化钠倒入烧杯中,将量取的水倒入烧杯中,用__________不
断搅拌至氯化钠完全溶解。
⑤装瓶:将配制好的氯化钠溶液转移到试剂瓶中并贴上标签。
整个配制过程如图所示:
托盘天平
胶头滴管
玻璃棒
(3) 注意事项
①用天平称量时要遵循“左物右码”的原则,且左右两个托盘上各放一张
干净的大小相同的纸片(有腐蚀性或易潮解的药品要放在玻璃器皿中称
量)。
②量取液体读数时,应将量筒放平,视线与
____________________________保持水平。
量筒内液体凹液面的最低处
(4)误差分析
误差 原因 举例
溶质质 量分数 偏小 溶质的量 偏少 ①溶质中有杂质;
②药品与砝码位置放反且用到游码;
③天平空载时,指针向左偏;
④转移药品时有撒落(或称量纸上有药品残留);
⑤溶质没有完全溶解
误差 原因 举例
溶质质量分数偏小 溶剂的量 偏多 ①量取溶剂时仰视读数;
②配制前,烧杯或试剂瓶用蒸馏水润洗,即仪器内原来就有少量水
溶质质量分数偏大 溶质的量 偏多 ①所用砝码已生锈或沾有污渍;
②天平空载时,指针向右偏
溶剂的量 偏少 ①量取水时俯视读数;
②向烧杯中倒水时,有水洒出
续表
【反思设问】 将配制好的氯化钠溶液转移到试剂瓶时,仍有部分留在烧杯中,则所配得的氯化钠溶液的质量分数如何变化?
[答案] 没有影响。
2.用浓溶液配制稀溶液
(1) 所需仪器:胶头滴管、烧杯、玻璃棒、量筒。与用固体配制溶液相比,
少了____________、________、________。
托盘天平
镊子
药匙
(2)操作步骤:
①计算:计算所需浓溶液的体积和所需水的体积:
浓溶液的质量=
水的质量=稀溶液的质量-浓溶液的质量=
浓溶液的质量
②量取:用量筒量取浓溶液和水(接近所需体积时改用胶头滴管);
③混匀:将量取的浓溶液和水倒入烧杯中,用玻璃棒搅拌;
④装瓶:将配制好的溶液装入试剂瓶并贴上标签。
&11& 实验室配制
答:
(1) 图中使用到的玻璃仪器有________、量筒、玻璃棒、广口瓶。
烧杯
(2) 图示中正确的操作顺序为______________(填序号)。
②①⑤③④
(3) 溶解时用玻璃棒搅拌的目的是____________________。
加快氯化钠的溶解
(4) 取
20
(5) 将配制好的溶液装瓶并贴上标签。小明同学
贴的标签有不妥之处,如图所示,请在右侧的空白
标签上填写正确内容。
.&12
&
.
(6)经检测,配制的溶液溶质质量分数小于
A.氯化钠固体不纯
B.称量时砝码端忘垫质量相同的纸片
C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠
E.量取水时俯视读数
ABD
命题点1 溶解度及溶解度曲线/表格(必考)
1.[2021河南10] 如图是
( )
B
A.
B.
C.
D.将
溶质的质量保持不变
2.[2020河南10] 甲、乙两种固体的溶解度曲线如图所示。下列说法正确
的是( )
B
A.甲的溶解度大于乙的溶解度
B.
C.
D.将
液中溶质的质量甲大于乙
3.[2016河南8] 下图是甲、乙的溶解度曲线。下列说法
D
A.
B.
C.降低温度能使接近饱和的甲溶液变为饱和溶液
D.
质量分数为
4.[2015河南11] 下表是
( )
温度
溶解度
A.
B.两种物质溶解度相等的温度在
C.
D.
C
5.[2022河南17] 氢氧化钙固体的溶解度曲线如图所示。
(1) 由图可知,氢氧化钙的溶解度随着温度的升高而________(填“增
大”或“
减小
(2)
_ ____________________(写出计算式即可)。
6.如图是甲、乙两种固体的溶解度曲线。
第6题图
(1) [2019河南16第一空;2018河南18第一空] 甲和乙的溶解度相等时的
温度为_____
(2) [2018河南18第二空]
乙的饱和溶液,所需要水的质量关系为甲________乙(填“大于”“小于”或
“
小于
(3) [2013河南14第一空]
温至
7.[2017河南18第一、三空] 如图是甲、乙两种固体的溶
解度曲线。将
和溶液降温至
乙的溶解度曲线为_____(填“
将
需加水的质量为______
70
第7题图
8.[2019河南B卷18] 将
的烧杯中充分溶解,测得溶液质量随温度变化的曲线如
下图所示。则
C三点所对应的溶液中,一定是饱和溶液的为_______点
处的溶液;将
的质量为______
AB
9.[2017河南B卷18] 根据如图所示甲、乙两种物质的溶解度曲线回答相
关问题:
(1) 在_____
(2)
_______
(3) 将
变),所得溶液的溶质质量分数的关系是甲_____(填“>”“<”或“=”)
乙。
=
命题点2 溶液的配制(必考)
10.[2019河南10] 实验室用氯化钠配制
下列说法
A.所需氯化钠的质量为
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃仪器有烧杯、玻璃棒、量筒等
C
11.[2018河南11] 实验室配制一定溶质质量分数的氯化钠溶液时,下列操
作会导致结果偏小的是( )
①称量的氯化钠固体中含有不溶性杂质;②用量筒量取水时仰视读数;③
往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④
A
12.[2022河南18] 实验室用氯化钠固体配制
实验步骤为计算、__________________、量取、溶解;水的密度近似看做
称量(或称取)
13.[2020河南17] 实验室配制一定溶质质量分数的氯化钠溶液时,所需氯
化钠固体应该放在托盘天平的________(填“左盘”或“右盘”)上进行称
量;若所配制溶液的溶质质量分数偏大,则可能是量取水时________
(填“俯视”或“仰视”)量筒读数所致。
左盘
俯视
14.[2021河南23] 实验室选用下列仪器配制
溶液。
(1) 所需氯化钠固体的质量为_____
3
(2) 完成该实验,上图中有一种仪器不必用到,请写出该仪器的名称。
[答案] 漏斗。
(3) 若其他操作正确,量取水时俯视量筒读数,对结果会造成什么影响?
[答案] 会导致所配制溶液的质量分数偏大。
同课章节目录
