备战2023河南中考考点过关-微专项8 溶解度曲线分析课件(共23张PPT)
文档属性
| 名称 | 备战2023河南中考考点过关-微专项8 溶解度曲线分析课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-06 00:00:00 | ||
图片预览







文档简介
(共23张PPT)
微专项8 溶解度曲线分析
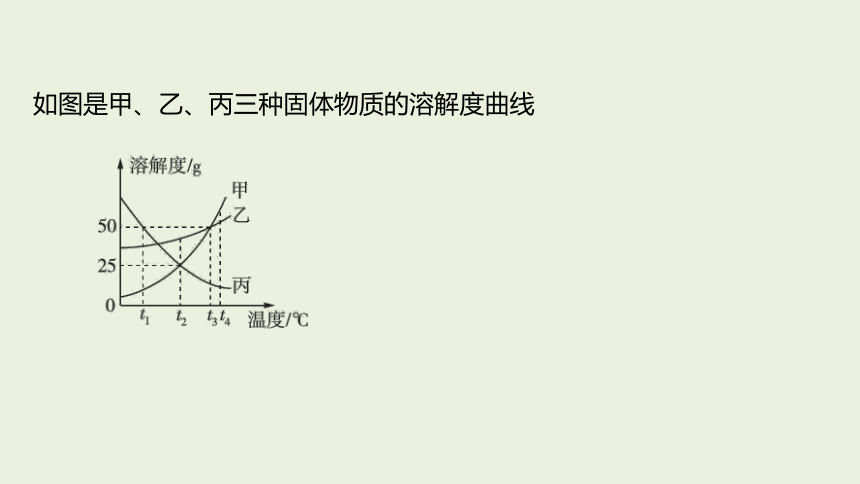
如图是甲、乙、丙三种固体物质的溶解度曲线
突破点1 溶解度大小的判断及比较
(1) 如图所示,
_______;甲和乙溶解度相等时的温度为_____
丙>乙>甲
(2) 甲的溶解度大于乙的溶解度,该说法是________(填“正确”或“错
误”)的。
错误
(3) 由图可知,甲、乙两种物质的溶解度受温度影响较大的是______。
甲
(4)
甲、乙、丙的质量大小关系为______________,形成溶液的质量大小关
系为______________。
丙>乙>甲
丙>乙>甲
(5)
液,所需水的质量大小关系为______________,形成溶液的质量大小关
系为______________。
甲>乙>丙
甲>乙>丙
(6)
大小关系为______________。
甲>乙>丙
【提分技法】
一定温度下配制饱和溶液时溶液质量、溶剂质量与溶质质量的大小关系
比较方法
(1)溶质的质量一定时,溶解度越大所需溶剂的质量越小;
(2)溶剂的质量一定时,溶解度越大所需溶质的质量越大;
(3)溶液的质量一定时,溶解度越大所需溶质的质量越大、所需溶剂的
质量越小。
突破点2 饱和溶液与不饱和溶液的判断及转化
(1)
50
(2)
________(填“饱和”或“不饱和”)溶液。
饱和
(3) 饱和溶液与不饱和溶液的转化
① 将接近饱和的甲溶液转化为饱和溶液的方法有____________________
____________;
降低温度、蒸发溶剂、增加溶质
② 将接近饱和的乙溶液转化为饱和溶液的方法有____________________
____________;
降低温度、蒸发溶剂、增加溶质
③ 将接近饱和的丙溶液转化为饱和溶液的方法有____________________
____________;
升高温度、蒸发溶剂、增加溶质
④
增加溶剂
【提分技法】
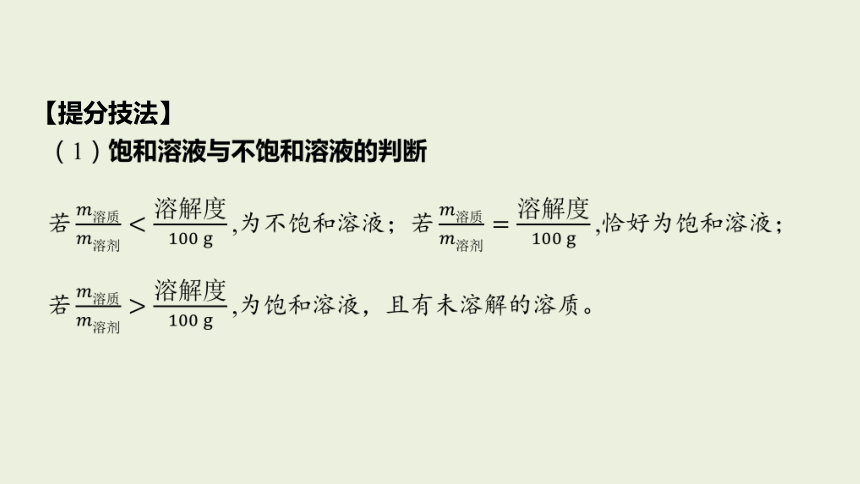
(1)饱和溶液与不饱和溶液的判断
若
若
①改变溶质或溶剂质量(适用于所有物质)
不饱和溶液
②改变温度,升温或降温取决于物质的溶解度曲线随温度的变化趋势
上升型:不饱和溶液
下降型:不饱和溶液
(2)饱和溶液与不饱和溶液的转化
突破点3 根据溶解度曲线的升降情况判断提纯方法
(1) 若甲中混有少量丙,可采用________________________________
的方法提纯甲。
降温结晶(或冷却热饱和溶液)
(2) 若乙中混有少量甲,可采用______________________________的
方法提纯乙。
恒温蒸发溶剂(或蒸发结晶)
(3) 若丙中混有少量甲,可采用____________的方法提纯丙。
升温结晶
(4) 若甲中混有少量乙,可采用________________________________
的方法提纯甲。
降温结晶(或冷却热饱和溶液)
【提分技法】
根据溶解度曲线的升降情况判断物质提纯的方法
溶解度曲线的升降情况 结晶或提纯的方法
陡升型(如甲) 降温结晶(或冷却热饱和溶液)
缓升型(如乙) 蒸发结晶(或恒温蒸发溶剂)
下降型(如丙) 升温结晶
突破点4 析出晶体质量的比较
(1) 分别将
的是______。
甲
(2) 若将
体,则
丙
(3)
则析出晶体的质量是______
15
(4) 将
(填“大于”“小于”“等于”或“不确定”)乙析出的质量。
不确定
【提分技法】
改变温度时饱和溶液中析出晶体质量的比较方法
降低温度后饱和溶液中析出晶体的质量为两个温度下溶液所含溶质
的差值。若饱和溶液的质量相同,且通过改变温度均析出晶体,则曲线
越陡,析出晶体的质量越大。若没有说明两种饱和溶液的质量,则无法
判断降温后二者析出晶体质量的大小关系。
突破点5 溶质质量分数的计算与比较
(1)
量分数为________;
________;
质量分数约为_________。
(2)
“>”“<”或“=”)乙。
=
(3) 将甲、乙、丙三种物质的饱和溶液从
质质量分数不变的是______。
丙
(4) 将甲、乙、丙三种物质的饱和溶液从
的溶质质量分数由大到小的关系为______________。
乙>丙>甲
(5) 将甲、乙、丙三种物质的饱和溶液从
的溶质质量分数由大到小的关系为______________。
乙>甲>丙
(6)
需加水的质量为______
70
(7)
质量分数是________。
【提分技法】
溶液质量的计算方法
(1)能全部溶解:
(2)不能全部溶解:
饱和溶液的质量分数计算公式
某温度下,某饱和溶液的质量分数
1.[2022平凉二模] 硝酸钾的溶解度曲线如图所示。下列有关说法错误的
是( )
C
A.
B.
C.
D.使
2.[2021解析与检测]
列说法正确的是( )
温度
溶解 度
C
A.甲表示
B.
C.若将
到
D.将
3.[2021菏泽中考节选] 如图为
和溶剂的质量关系,则
某医药公司要生产
氯化钠饱和溶液______吨。
36
3.4
4.[2022河南省实验三模] 如图是氯化钠和硝酸钾两种固体的溶解度曲线。
(1)
_____(填“相等”或“不相等”)。
相 等
(2) 若氯化钠中含有少量硝酸钾,提纯方法为
__________________________。
蒸发结晶(或蒸发溶剂)
(3)
温蒸发______
58
5.[2022郑州枫杨外国语三模] 如图是甲、乙两种固体的溶解度曲线。
(1)
_______(填“饱和”或“不饱和”)溶液。
不饱和
(2) 将
的溶质质量分数关系为:甲_____(填“>”“<”或“=”)乙。
=
(3)
350
微专项8 溶解度曲线分析
如图是甲、乙、丙三种固体物质的溶解度曲线
突破点1 溶解度大小的判断及比较
(1) 如图所示,
_______;甲和乙溶解度相等时的温度为_____
丙>乙>甲
(2) 甲的溶解度大于乙的溶解度,该说法是________(填“正确”或“错
误”)的。
错误
(3) 由图可知,甲、乙两种物质的溶解度受温度影响较大的是______。
甲
(4)
甲、乙、丙的质量大小关系为______________,形成溶液的质量大小关
系为______________。
丙>乙>甲
丙>乙>甲
(5)
液,所需水的质量大小关系为______________,形成溶液的质量大小关
系为______________。
甲>乙>丙
甲>乙>丙
(6)
大小关系为______________。
甲>乙>丙
【提分技法】
一定温度下配制饱和溶液时溶液质量、溶剂质量与溶质质量的大小关系
比较方法
(1)溶质的质量一定时,溶解度越大所需溶剂的质量越小;
(2)溶剂的质量一定时,溶解度越大所需溶质的质量越大;
(3)溶液的质量一定时,溶解度越大所需溶质的质量越大、所需溶剂的
质量越小。
突破点2 饱和溶液与不饱和溶液的判断及转化
(1)
50
(2)
________(填“饱和”或“不饱和”)溶液。
饱和
(3) 饱和溶液与不饱和溶液的转化
① 将接近饱和的甲溶液转化为饱和溶液的方法有____________________
____________;
降低温度、蒸发溶剂、增加溶质
② 将接近饱和的乙溶液转化为饱和溶液的方法有____________________
____________;
降低温度、蒸发溶剂、增加溶质
③ 将接近饱和的丙溶液转化为饱和溶液的方法有____________________
____________;
升高温度、蒸发溶剂、增加溶质
④
增加溶剂
【提分技法】
(1)饱和溶液与不饱和溶液的判断
若
若
①改变溶质或溶剂质量(适用于所有物质)
不饱和溶液
②改变温度,升温或降温取决于物质的溶解度曲线随温度的变化趋势
上升型:不饱和溶液
下降型:不饱和溶液
(2)饱和溶液与不饱和溶液的转化
突破点3 根据溶解度曲线的升降情况判断提纯方法
(1) 若甲中混有少量丙,可采用________________________________
的方法提纯甲。
降温结晶(或冷却热饱和溶液)
(2) 若乙中混有少量甲,可采用______________________________的
方法提纯乙。
恒温蒸发溶剂(或蒸发结晶)
(3) 若丙中混有少量甲,可采用____________的方法提纯丙。
升温结晶
(4) 若甲中混有少量乙,可采用________________________________
的方法提纯甲。
降温结晶(或冷却热饱和溶液)
【提分技法】
根据溶解度曲线的升降情况判断物质提纯的方法
溶解度曲线的升降情况 结晶或提纯的方法
陡升型(如甲) 降温结晶(或冷却热饱和溶液)
缓升型(如乙) 蒸发结晶(或恒温蒸发溶剂)
下降型(如丙) 升温结晶
突破点4 析出晶体质量的比较
(1) 分别将
的是______。
甲
(2) 若将
体,则
丙
(3)
则析出晶体的质量是______
15
(4) 将
(填“大于”“小于”“等于”或“不确定”)乙析出的质量。
不确定
【提分技法】
改变温度时饱和溶液中析出晶体质量的比较方法
降低温度后饱和溶液中析出晶体的质量为两个温度下溶液所含溶质
的差值。若饱和溶液的质量相同,且通过改变温度均析出晶体,则曲线
越陡,析出晶体的质量越大。若没有说明两种饱和溶液的质量,则无法
判断降温后二者析出晶体质量的大小关系。
突破点5 溶质质量分数的计算与比较
(1)
量分数为________;
________;
质量分数约为_________。
(2)
“>”“<”或“=”)乙。
=
(3) 将甲、乙、丙三种物质的饱和溶液从
质质量分数不变的是______。
丙
(4) 将甲、乙、丙三种物质的饱和溶液从
的溶质质量分数由大到小的关系为______________。
乙>丙>甲
(5) 将甲、乙、丙三种物质的饱和溶液从
的溶质质量分数由大到小的关系为______________。
乙>甲>丙
(6)
需加水的质量为______
70
(7)
质量分数是________。
【提分技法】
溶液质量的计算方法
(1)能全部溶解:
(2)不能全部溶解:
饱和溶液的质量分数计算公式
某温度下,某饱和溶液的质量分数
1.[2022平凉二模] 硝酸钾的溶解度曲线如图所示。下列有关说法错误的
是( )
C
A.
B.
C.
D.使
2.[2021解析与检测]
列说法正确的是( )
温度
溶解 度
C
A.甲表示
B.
C.若将
到
D.将
3.[2021菏泽中考节选] 如图为
和溶剂的质量关系,则
某医药公司要生产
氯化钠饱和溶液______吨。
36
3.4
4.[2022河南省实验三模] 如图是氯化钠和硝酸钾两种固体的溶解度曲线。
(1)
_____(填“相等”或“不相等”)。
相 等
(2) 若氯化钠中含有少量硝酸钾,提纯方法为
__________________________。
蒸发结晶(或蒸发溶剂)
(3)
温蒸发______
58
5.[2022郑州枫杨外国语三模] 如图是甲、乙两种固体的溶解度曲线。
(1)
_______(填“饱和”或“不饱和”)溶液。
不饱和
(2) 将
的溶质质量分数关系为:甲_____(填“>”“<”或“=”)乙。
=
(3)
350
同课章节目录
