备战2023河南中考考点过关-微专项2 质量守恒定律的应用之定量计算课件(共30张PPT)
文档属性
| 名称 | 备战2023河南中考考点过关-微专项2 质量守恒定律的应用之定量计算课件(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-06 00:00:00 | ||
图片预览











文档简介
(共30张PPT)
微专项2 质量守恒定律的应用之定量计算
1.计算未知量
根据反应前物质的质量总和=反应后物质的质量总和,计算未知物的质量。
2.判断反应物、生成物、催化剂
若反应前质量>反应后质量,为反应物;
若反应前质量<反应后质量,为生成物;
若反应前质量=反应后质量,为催化剂或不参与反应的杂质。
3.计算反应中物质的质量比:先计算出反应前后各物质质量变化,再将
该质量变化相比,即反应中物质质量比。
4.计算化学计量数之比:化学方程式中各物质前的化学计量数之比即各
物质参与反应的分子个数比,等于各物质质量除以本身相对分子质量。
突破点1 定量推断物质的元素组成
&1& [2021湖南怀化] 已知某纯净物
成
( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
B
【思路分析】 根据质量守恒定律,化学反应前后元素的种类和质量不
变,可知该纯净物中一定含有碳、氢元素,其中碳元素的质量为:
一定还含有氧元素。
【提分技法】
根据某物质完全燃烧生成二氧化碳和水,来判断某纯净物元素组成的题目一
般有两类:一类是没有给出数据的,答案是一定含有碳、氢元素,可能含有氧元
素;另一类是给出具体数据的,如本题,对于这样的题目就需要具体计算,根据
数据判断是否含有氧元素。
方法一:根据生成的二氧化碳和水的质量推出纯净物中所含的碳、氢元素的
质量,若碳、氢元素的质量总和等于纯净物的质量,则该纯净物中不含氧元素,
若碳、氢元素的质量总和小于纯净物的质量,则该纯净物中含有氧元素。
方法二:根据质量守恒定律,先求出消耗氧气的质量,再算出二氧化碳和水
中氧元素的质量总和,然后进行比较。若二者相等,则纯净物中只含有碳、氢元
素;若质量总和大于消耗氧气的质量,说明纯净物中还含有氧元素。
&2& [2022洛阳二模] 现有
成,该反应的化学方程式为_ ____________________________________。
碳、氧
【思路分析】 根据质量守恒定律,物质
根据物质质量写化学方程式,可按照下列步骤解答:
第1步,写出反应物和生成物:
第2步,写出各物质的相对分子质量:
32 32 18 44
第3步,写出各物质的实际质量:
第4步,物质的分子个数比(化学计量数之比)等于实际质量除以相对分
子质量之比:
【提分技法】
有时候算出来的某一种物质的化学计量数可能为分数,通分即可。
突破点2 表格型计算
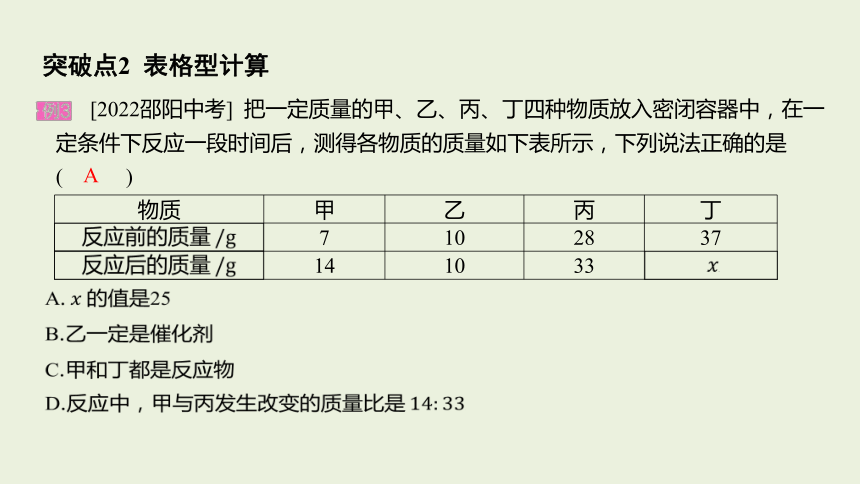
&3& [2022邵阳中考] 把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是( )
物质 甲 乙 丙 丁
反应前的质量
反应后的质量
A.
B.乙一定是催化剂
C.甲和丁都是反应物
D.反应中,甲与丙发生改变的质量比是
A
【思路分析】 反应前后乙的质量没有发生改变,则乙可能是该反应的
催化剂,也可能是与该反应无关的物质。根据质量守恒定律,化学反应
前后物质的总质量不变,则
后甲、丙的质量增大,为生成物,丁的质量减小,为反应物,即丁反应
生成甲和丙:丁
【提分技法】
根据质量守恒定律确定表格数据中的“
出某化学反应前后各物质的质量(其中一种物质的质量为待测值,用“
表示),要求对与该反应有关的内容如反应类型、化学反应中各物质质量
变化的比、某物质的类别等进行判断。解题的关键是根据各物质在反应前
后质量的变化判断出哪些物质是反应物、哪些物质是生成物(反应后质量
增大的是生成物,反应后质量减小的是反应物,反应后质量不变的可能是
该反应的催化剂,也可能是与该反应无关的物质),然后结合所学知识进
行相关分析和判断。
突破点3 图像型计算
&4& 某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了一个
化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下
列说法错误的是( )
A.
B.丁属于化合物
C.当丁为
D.当甲为
D
【思路分析】 分析题中图像信息,可知最初甲的质量为
量为
乙的质量为
知甲、乙是生成物,丁是反应物,丙可能是该反应的催化剂,也可能是
与该反应无关的物质,该反应可简单表示为丁
则丁是化合物,B正确;根据质量守恒定律,有
解得
成乙的质量为
反应中甲、丁的质量比为
则容器中丁的质量为
【提分技法】
此类试题的难点在于对图像信息的准确解读。本题横轴表示甲的质
量,纵轴表示乙、丙、丁三种物质的质量。重点分析反应前和反应后各
物质的质量,并由此进行解答。
突破点4 元素守恒法的应用
&5& 取一定质量的
为
( )
A.
B
【思路分析】 根据钙元素质量守恒,可得反应前碳酸钙的质量为:
的总质量不变)可得反应放出
【提分技法】
元素守恒法就是抓住反应前后某元素质量或质量之和不变来简化计
算的一种方法。
1.[2021焦作一模] 1.
不正确 的是( )
A.该物质中一定含有碳、氢元素
B.该物质中氢元素的质量分数最大
C.该物质中一定不含氧元素
D.该物质的分子中碳、氢原子的个数比为
B
2.[2022常德中考] 一定条件下,密闭容器中发生了某一化学反应,涉及
的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质
量关系。下列说法不正确 的是( )
C
A.
B.甲、丁的相对分子质量之比可能为
C.丁可能为单质
D.反应中消耗甲和乙的质量比为
3.[2022衡阳中考] 甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物
质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列
说法正确的是( )
A.丁是反应物
B.
C.乙是此化学反应的催化剂
D.生成
A
4.[2021桂林中考] 密闭容器中发生的某化学反应,各物质的分子数目随
时间变化情况如图1所示,物质
下列说法正确的是( )
D
A.该反应前后分子总数保持不变
B.参加反应的
C.该反应的化学方程式可表示为
D.若
量为28
5.[2022三门峡一模] 乙醇
用灯帽盖灭酒精灯的灭火原理是____________;一定量的乙醇与
气在点燃的条件下完全反应,生成
质量为
隔绝氧气
8.4
6.[2022平顶山一模] 将
部转化为
中碳元素的质量分数为
该反应的化学方程式为_ _________________________________。
7.[2021郑州一中三模] 乙醇俗称酒精,可以用作燃料,乙醇完全燃烧的化学方
程式为_ ______________________________;现有乙醇和乙醛
合物共
______
4.8
8.[2022解析与检测] 丙烷
丙烷完全燃烧的化学方程式为_ ____________________________。在氧气不足
的情况下,丙烷不充分燃烧会同时生成一氧化碳,若
和
量为_______
144
288
9.[2022衡阳中考] 以下是某同学解答一道计算题的过程,请你一起参与
完成相关问题。
题目:将氯酸钾和二氧化锰的混合物共
剩余固体质量与反应时间的关系如图所示。完全反应后,生成氯化钾的
质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成
答:生成
请回答下列问题:
(1) 从图中可知完全反应后生成
9.6
(2) 上述计算过程是否正确? (填“正确错误“错误”)。如果错误,请你重新利用化学方程式计算生成
解:设生成
错误
答:生成
微专项2 质量守恒定律的应用之定量计算
1.计算未知量
根据反应前物质的质量总和=反应后物质的质量总和,计算未知物的质量。
2.判断反应物、生成物、催化剂
若反应前质量>反应后质量,为反应物;
若反应前质量<反应后质量,为生成物;
若反应前质量=反应后质量,为催化剂或不参与反应的杂质。
3.计算反应中物质的质量比:先计算出反应前后各物质质量变化,再将
该质量变化相比,即反应中物质质量比。
4.计算化学计量数之比:化学方程式中各物质前的化学计量数之比即各
物质参与反应的分子个数比,等于各物质质量除以本身相对分子质量。
突破点1 定量推断物质的元素组成
&1& [2021湖南怀化] 已知某纯净物
成
( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
B
【思路分析】 根据质量守恒定律,化学反应前后元素的种类和质量不
变,可知该纯净物中一定含有碳、氢元素,其中碳元素的质量为:
一定还含有氧元素。
【提分技法】
根据某物质完全燃烧生成二氧化碳和水,来判断某纯净物元素组成的题目一
般有两类:一类是没有给出数据的,答案是一定含有碳、氢元素,可能含有氧元
素;另一类是给出具体数据的,如本题,对于这样的题目就需要具体计算,根据
数据判断是否含有氧元素。
方法一:根据生成的二氧化碳和水的质量推出纯净物中所含的碳、氢元素的
质量,若碳、氢元素的质量总和等于纯净物的质量,则该纯净物中不含氧元素,
若碳、氢元素的质量总和小于纯净物的质量,则该纯净物中含有氧元素。
方法二:根据质量守恒定律,先求出消耗氧气的质量,再算出二氧化碳和水
中氧元素的质量总和,然后进行比较。若二者相等,则纯净物中只含有碳、氢元
素;若质量总和大于消耗氧气的质量,说明纯净物中还含有氧元素。
&2& [2022洛阳二模] 现有
成,该反应的化学方程式为_ ____________________________________。
碳、氧
【思路分析】 根据质量守恒定律,物质
根据物质质量写化学方程式,可按照下列步骤解答:
第1步,写出反应物和生成物:
第2步,写出各物质的相对分子质量:
32 32 18 44
第3步,写出各物质的实际质量:
第4步,物质的分子个数比(化学计量数之比)等于实际质量除以相对分
子质量之比:
【提分技法】
有时候算出来的某一种物质的化学计量数可能为分数,通分即可。
突破点2 表格型计算
&3& [2022邵阳中考] 把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是( )
物质 甲 乙 丙 丁
反应前的质量
反应后的质量
A.
B.乙一定是催化剂
C.甲和丁都是反应物
D.反应中,甲与丙发生改变的质量比是
A
【思路分析】 反应前后乙的质量没有发生改变,则乙可能是该反应的
催化剂,也可能是与该反应无关的物质。根据质量守恒定律,化学反应
前后物质的总质量不变,则
后甲、丙的质量增大,为生成物,丁的质量减小,为反应物,即丁反应
生成甲和丙:丁
【提分技法】
根据质量守恒定律确定表格数据中的“
出某化学反应前后各物质的质量(其中一种物质的质量为待测值,用“
表示),要求对与该反应有关的内容如反应类型、化学反应中各物质质量
变化的比、某物质的类别等进行判断。解题的关键是根据各物质在反应前
后质量的变化判断出哪些物质是反应物、哪些物质是生成物(反应后质量
增大的是生成物,反应后质量减小的是反应物,反应后质量不变的可能是
该反应的催化剂,也可能是与该反应无关的物质),然后结合所学知识进
行相关分析和判断。
突破点3 图像型计算
&4& 某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了一个
化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下
列说法错误的是( )
A.
B.丁属于化合物
C.当丁为
D.当甲为
D
【思路分析】 分析题中图像信息,可知最初甲的质量为
量为
乙的质量为
知甲、乙是生成物,丁是反应物,丙可能是该反应的催化剂,也可能是
与该反应无关的物质,该反应可简单表示为丁
则丁是化合物,B正确;根据质量守恒定律,有
解得
成乙的质量为
反应中甲、丁的质量比为
则容器中丁的质量为
【提分技法】
此类试题的难点在于对图像信息的准确解读。本题横轴表示甲的质
量,纵轴表示乙、丙、丁三种物质的质量。重点分析反应前和反应后各
物质的质量,并由此进行解答。
突破点4 元素守恒法的应用
&5& 取一定质量的
为
( )
A.
B
【思路分析】 根据钙元素质量守恒,可得反应前碳酸钙的质量为:
的总质量不变)可得反应放出
【提分技法】
元素守恒法就是抓住反应前后某元素质量或质量之和不变来简化计
算的一种方法。
1.[2021焦作一模] 1.
A.该物质中一定含有碳、氢元素
B.该物质中氢元素的质量分数最大
C.该物质中一定不含氧元素
D.该物质的分子中碳、氢原子的个数比为
B
2.[2022常德中考] 一定条件下,密闭容器中发生了某一化学反应,涉及
的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质
量关系。下列说法
C
A.
B.甲、丁的相对分子质量之比可能为
C.丁可能为单质
D.反应中消耗甲和乙的质量比为
3.[2022衡阳中考] 甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物
质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列
说法正确的是( )
A.丁是反应物
B.
C.乙是此化学反应的催化剂
D.生成
A
4.[2021桂林中考] 密闭容器中发生的某化学反应,各物质的分子数目随
时间变化情况如图1所示,物质
下列说法正确的是( )
D
A.该反应前后分子总数保持不变
B.参加反应的
C.该反应的化学方程式可表示为
D.若
量为28
5.[2022三门峡一模] 乙醇
用灯帽盖灭酒精灯的灭火原理是____________;一定量的乙醇与
气在点燃的条件下完全反应,生成
质量为
隔绝氧气
8.4
6.[2022平顶山一模] 将
部转化为
中碳元素的质量分数为
该反应的化学方程式为_ _________________________________。
7.[2021郑州一中三模] 乙醇俗称酒精,可以用作燃料,乙醇完全燃烧的化学方
程式为_ ______________________________;现有乙醇和乙醛
合物共
______
4.8
8.[2022解析与检测] 丙烷
丙烷完全燃烧的化学方程式为_ ____________________________。在氧气不足
的情况下,丙烷不充分燃烧会同时生成一氧化碳,若
和
量为_______
144
288
9.[2022衡阳中考] 以下是某同学解答一道计算题的过程,请你一起参与
完成相关问题。
题目:将氯酸钾和二氧化锰的混合物共
剩余固体质量与反应时间的关系如图所示。完全反应后,生成氯化钾的
质量是多少?
该同学很快列出计算过程,求出了氯化钾的质量。请你帮该同学检查是否正确。
解:设生成
答:生成
请回答下列问题:
(1) 从图中可知完全反应后生成
9.6
(2) 上述计算过程是否正确? (填“正确错误“错误”)。如果错误,请你重新利用化学方程式计算生成
解:设生成
错误
答:生成
同课章节目录
