人教版(2019)高中化学必修第二册 《6.2.2 影响化学反应速率的因素》名师作业设计(含答案)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《6.2.2 影响化学反应速率的因素》名师作业设计(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 180.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-07 16:41:41 | ||
图片预览




文档简介
《影响化学反应速率的因素》课后作业
一、单选题
1.对于反应C(S)+CO2(g) =2CO(g),下列措施可使反应速率增大的是( )
A.恒温恒容时通入稀有气体 B.恒温恒压下通入N2
C.增加碳的量 D.将炭块粉碎
2.把下列四种X溶液分别加入四个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃20mL3mol·L-1的X溶液
B.20℃30mL2mol·L-1的X溶液
C.20℃10mL4mol·L-1的X溶液
D.10℃10mL2mol·L-1的X溶液
3.汽车尾气含有NO、CO等多种污染物,已成为城市空气的主要污染源。一定条件下,在密闭容器中发生反应2NO+2CON2+2CO2。为了加快反应速率,下列措施不合理的是( )
A.使用高效催化剂
B.升高温度
C.保持容积不变,再通入一定量的CO
D.将容器的容积扩大到原来的2倍
4.在铁和稀硫酸的反应中,下列方法可以加快其反应速率的是( )
A.用铁钉代替铁粉
B.加入少量氯化钠溶液
C.用98%的浓硫酸代替稀硫酸
D.适当升高反应温度
5.少量锌粒与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤加NaCl溶液 ⑥滴几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.①⑤⑦ B.③⑦⑧ C.②④⑥ D.③⑥⑦⑧
6.某实验探究小组研究300K时的反应:,相关物质的数据如表所示。下列有关说法正确的是
t/min 0 2 4 6 8 10
0.16 0.14 0.12 0.10 0.08 0.08
0 0.03 0.06 0.09 0.12 0.12
A.Y表示G
B.4~6min,用E表示该反应的速率为0.01
C.X的浓度越大,反应速率越快
D.10min之后反应停止了
7.某小组拟探究反应条件对反应速率的影响。所用试剂有:5% 溶液、0.1mol/L 溶液、蒸馏水等。下列说法错误的是
物理量 序号 反应温度/℃ /mL /mL V(水) /mL /mL T /min
① 25℃ 5.0 0 3.0 x1 y1
② 25℃ 4.0 0 a x2 y2
③ 25℃ 5.0 1.0 b x3 y3
④ 25℃ 5.0 0.5 2.5 x4 y4
A.上述实验①②是探究H2O2浓度对化学反应速率的影响,则a可以为4.0
B.若b=2.0,则上述实验①③是探究催化剂Fe2(SO4)3对化学反应速率的影响
C.实验中可固定x1=x2=x3=x4,通过测定y1、y2、y3、y4的大小来比较反应速率的快慢
D.若用单位时间内产生O2的体积表示该反应的速率,则一定有如下关系:x3/y3二、填空题
8.某课外实验小组测定了碳酸钙与稀盐酸反应过程中,生成CO2的浓度随时间的变化关系如下图所示。
(1)碳酸钙与稀盐酸反应的离子方程式是_______。
(2)内用CO2表示的平均反应速率是_______。
(3)比较CO2在、时平均反应速率的大小:υ(0~2)_______υ(2~4)(填“>”、“<”或“=”),说明该反应过程中_______热量,该反应中反应物的总能量_______(填“>”、“<”或“=”)生成物的总能量。
(4)欲减缓该反应的速率,可采取的一种措施是_______。
9.影响化学反应速率的因素有很多,某课外兴趣小组用实验的方法对其进行探究。
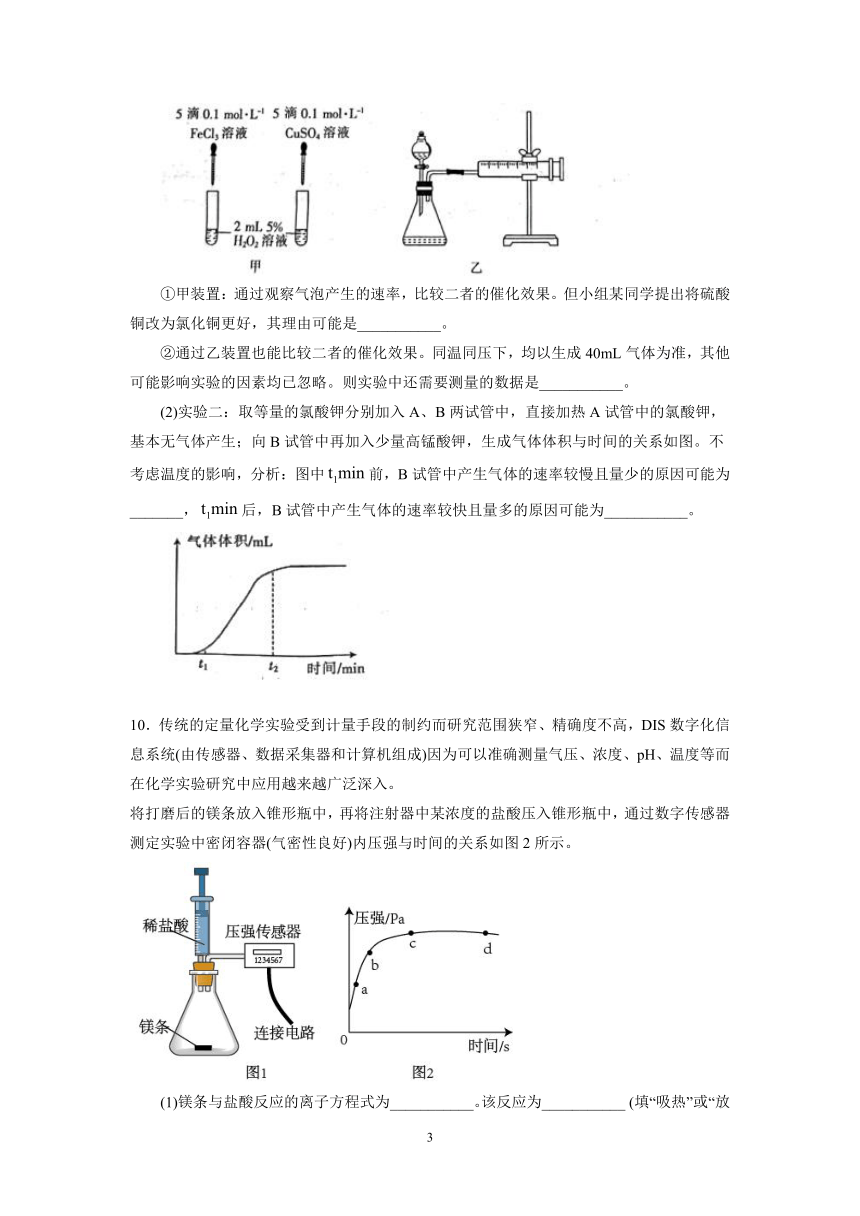
(1)实验一:已知对分解也具有催化作用,为比较和对分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题。
①甲装置:通过观察气泡产生的速率,比较二者的催化效果。但小组某同学提出将硫酸铜改为氯化铜更好,其理由可能是___________。
②通过乙装置也能比较二者的催化效果。同温同压下,均以生成40mL气体为准,其他可能影响实验的因素均已忽略。则实验中还需要测量的数据是___________。
(2)实验二:取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中前,B试管中产生气体的速率较慢且量少的原因可能为_______,后,B试管中产生气体的速率较快且量多的原因可能为___________。
10.传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量气压、浓度、pH、温度等而在化学实验研究中应用越来越广泛深入。
将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图2所示。
(1)镁条与盐酸反应的离子方程式为___________。该反应为___________ (填“吸热”或“放热”)反应。
(2)图2中a、b、c、d四个点中,产生氢气最快的为___________点。
(3)图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是___________。
《影响化学反应速率的因素》课后作业答案解析
一、单选题
1.对于反应C(S)+CO2(g) =2CO(g),下列措施可使反应速率增大的是( )
A.恒温恒容时通入稀有气体 B.恒温恒压下通入N2
C.增加碳的量 D.将炭块粉碎
【参考答案】D
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 气体的浓度不变,反应速率不变 L2
B 恒压,通入氮气,浓度减小,速率减小 L2
C 固体浓度不变,为直接判定 L1
D 增大表面积,为直接判定 L1
2.把下列四种X溶液分别加入四个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃20mL3mol·L-1的X溶液
B.20℃30mL2mol·L-1的X溶液
C.20℃10mL4mol·L-1的X溶液
D.10℃10mL2mol·L-1的X溶液
【参考答案】B
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 温度越高,反应速率越大 反应物浓度越大,反应速率越大 L1
B
C
D
3.汽车尾气含有NO、CO等多种污染物,已成为城市空气的主要污染源。一定条件下,在密闭容器中发生反应2NO+2CON2+2CO2。为了加快反应速率,下列措施不合理的是( )
A.使用高效催化剂
B.升高温度
C.保持容积不变,再通入一定量的CO
D.将容器的容积扩大到原来的2倍
【参考答案】D
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 使用催化剂可加快反应速率 L1
B 温度越高,反应速率越大 L1
C 反应物浓度越大,反应速率越大 L1
D 容积扩大,反应物浓度减小,反应速率变小 L1
4.在铁和稀硫酸的反应中,下列方法可以加快其反应速率的是( )
A.用铁钉代替铁粉
B.加入少量氯化钠溶液
C.用98%的浓硫酸代替稀硫酸
D.适当升高反应温度
【参考答案】D
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 增大表面积,速率加快 L1
B 氯化钠溶液不参与反应,原反应液被稀释,反应物浓度减小,反应速率变慢 L1
C 浓硫酸使铁钝化,改变反应过程 L2
D 温度越高,反应速率越大 L1
5.少量锌粒与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤加NaCl溶液 ⑥滴几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.①⑤⑦ B.③⑦⑧ C.②④⑥ D.③⑥⑦⑧
【参考答案】B
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 ①②④⑤ 反应物浓度减小,反应速率变慢 L1、L2
③ 反应物浓度增大,反应速率加快,但氢气产量增加 L2
⑥ 形成原电池,加快反应速率,且氢气产量不受影响 L2
⑦ 温度越高,反应速率越大,且氢气产量不受影响 L1
⑧ 盐酸浓度变大,而n(H+)未变,速率加快,产量不变 L2
6.某实验探究小组研究300K时的反应:,相关物质的数据如表所示。下列有关说法正确的是
t/min 0 2 4 6 8 10
0.16 0.14 0.12 0.10 0.08 0.08
0 0.03 0.06 0.09 0.12 0.12
A.Y表示G
B.4~6min,用E表示该反应的速率为0.01
C.X的浓度越大,反应速率越快
D.10min之后反应停止了
【参考答案】B
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 化学反应速率之比等于化学计量数之比 L2
B 反应速率的计算 L1
C X为反应物,浓度越大速率越快 L1
D 可逆反应的特征判断 L1
7.某小组拟探究反应条件对反应速率的影响。所用试剂有:5% 溶液、0.1mol/L 溶液、蒸馏水等。下列说法错误的是
物理量 序号 反应温度/℃ /mL /mL V(水) /mL /mL T /min
① 25℃ 5.0 0 3.0 x1 y1
② 25℃ 4.0 0 a x2 y2
③ 25℃ 5.0 1.0 b x3 y3
④ 25℃ 5.0 0.5 2.5 x4 y4
A.上述实验①②是探究H2O2浓度对化学反应速率的影响,则a可以为4.0
B.若b=2.0,则上述实验①③是探究催化剂Fe2(SO4)3对化学反应速率的影响
C.实验中可固定x1=x2=x3=x4,通过测定y1、y2、y3、y4的大小来比较反应速率的快慢
D.若用单位时间内产生O2的体积表示该反应的速率,则一定有如下关系:x3/y3【参考答案】D
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 浓度对反应速率的影响,控制变量的方法 L2
B 催化剂对反应速率的影响,控制变量的方法 L2
C 实验观察对象与数据的选择 L2
D 催化剂浓度越大,反应速率越大,新概念的理解与应用 L3
二、填空题
8.某课外实验小组测定了碳酸钙与稀盐酸反应过程中,生成CO2的浓度随时间的变化关系如下图所示。
(1)碳酸钙与稀盐酸反应的离子方程式是_______。
(2)内用CO2表示的平均反应速率是_______。
(3)比较CO2在、时平均反应速率的大小:υ(0~2)_______υ(2~4)(填“>”、“<”或“=”),说明该反应过程中_______热量,该反应中反应物的总能量_______(填“>”、“<”或“=”)生成物的总能量。
(4)欲减缓该反应的速率,可采取的一种措施是_______。
【参考答案】 < 放出 > 将盐酸稀释
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 (1) 离子方程式的书写 L1
(2) 提取图中信息,反应速率的计算 L2
(3) 图示信息的提取及综合分析 L3
(4) 影响化学反应速率的因素 L1
9.影响化学反应速率的因素有很多,某课外兴趣小组用实验的方法对其进行探究。
(1)实验一:已知对分解也具有催化作用,为比较和对分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题。
①甲装置:通过观察气泡产生的速率,比较二者的催化效果。但小组某同学提出将硫酸铜改为氯化铜更好,其理由可能是___________。
②通过乙装置也能比较二者的催化效果。同温同压下,均以生成40mL气体为准,其他可能影响实验的因素均已忽略。则实验中还需要测量的数据是___________。
(2)实验二:取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中前,B试管中产生气体的速率较慢且量少的原因可能为_______,后,B试管中产生气体的速率较快且量多的原因可能为___________。
【参考答案】前者是氯化铁,用氯化铜可使二者只有金属离子不同,消除阴离子的影响,使得到的实验结论更可靠
收集气体所需要的时间
氯酸钾自身受热分解很缓慢
高锰酸钾的分解产物对氯酸钾的分解起到了催化作用
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 (1)① 控制变量 L2
(1)② 实验观察对象与数据的选择 L1
(2) 真实反应情境与数据的综合分析 L3
10.传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量气压、浓度、pH、温度等而在化学实验研究中应用越来越广泛深入。
将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图2所示。
(1)镁条与盐酸反应的离子方程式为___________。该反应为___________ (填“吸热”或“放热”)反应。
(2)图2中a、b、c、d四个点中,产生氢气最快的为___________点。
(3)图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是___________。
【参考答案】 放热 a 完全反应后不再放热,温度逐渐下降
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 (1) 离子方程式的书写、反应热的判断 L1
(1)② 图示信息的提取与分析 L2
(2) 反应真实情境的综合分析 L2
答案解析
1.D
【详解】
A.恒温恒容时通入稀有气体,参加反应的气体的浓度不变,反应速率不变,A错误;
B.恒温恒压下通入N2,体积增大,参加反应的气体的浓度减小,反应速率减小,B错误;
C. C 是固体,增加 C 的量,不影响反应速率,C错误;
D.将炭块粉碎增大接触面积,反应速率增大,D正确;
故选D。
2.B
【详解】
A.10℃20mL3mol·L-1的X溶液与盐酸混合稀释后,X的浓度为1.2mol/L;
B.20℃30mL2mol·L-1的X溶液与盐酸混合稀释后,X的浓度为1.2mol/L;
C.20℃10mL4mol·L-1的X溶液与盐酸混合稀释后,X的浓度为0.8mol/L;
D.10℃10mL2mol·L-1的X溶液与盐酸混合稀释后,X的浓度为0.4mol/L;
温度越高,反应速率越快,浓度越大,反应速率越快,对比四个选项可知B的温度最高,X的浓度最大,则反应最快,故B正确;
综上所述,答案为B。
3.D
【详解】
A.使用高效催化剂可以降低反应活化能,加快反应速率,A不符合题意;
B.升高温度可以提高活化分子百分数,加快反应速率,B不符合题意;
C.保持容积不变,再通入一定量的CO,反应物浓度增大,反应速率加快,C不符合题意;
D.将容器的容积扩大到原来的2倍,各物质的浓度减小,反应速率减慢,D符合题意;
综上所述答案为D。
4.D
【详解】
A.用铁钉代替铁粉,减小了固体与液体的接触面积,反应速率减慢,A错误;
B.加入少量氯化钠溶液,对稀硫酸进行了稀释,氢离子浓度减小,反应速率减慢,B错误;
C.常温下浓硫酸与铁发生钝化反应,钝化之后反应不能继续进行,C错误;
D.升高温度能加快铁和稀硫酸的反应速率,D正确;
答案为:D。
5.B
【详解】
①加水,稀释了盐酸的浓度,故反应速率变慢;
②加氢氧化钠,与盐酸反应,减少了盐酸的浓度,故反应速率变慢;
③加浓盐酸,氢离子浓度增大,反应速率加快,由于锌粒不足,则生成的氢气量不变;
④加CuO固体与盐酸反应生成氯化铜和水,氯化铜再与锌发生置换反应生成铜,构成原电池,反应速率加快,由于消耗锌影响氢气总量;
⑤加氯化钠溶液,相当于稀释盐酸浓度,故反应速率变慢;
⑥滴加硫酸铜溶液,锌把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的锌减少,故减少了产生氢气的量;
⑦温度升高,反应速率加快,且不影响氢气量;
⑧改用浓度大的盐酸,反应速率加快,且不影响氢气量。
综上,③⑦⑧符合题意,答案选B。
6.B
【详解】
A.由表中数据可知每个相同时间段,,由各物质的变化量之比等于化学计量数之比可知,X表示E、Y表示F,故A错误;
B.4~6min,用E表示该反应的速率为,故B正确;
C.由表可知,在反应达到平衡前,每间隔2min,,则X的浓度对反应速率没有影响,故C错误;
D.10min之后反应到达了平衡,化学平衡是动态平衡,不是反应停止了,故D错误;
故选B。
7.D
【详解】
A.实验①②中,温度相同,均未加,是探究浓度对化学反应速率的影响,其他条件不变,溶液总体积不变,a 为:5.0+3.0-4.0=4.0,故A正确;
B.b=2.0时,实验①③中,浓度相同,①中未使用催化剂,③中使用催化剂,是探究催化剂对化学反应速率的影响,故B正确;
C.实验中可以固定氧气体积相同,即,通过测定时间、、、的大小来比较反应速率的快慢,也可以固定时间相等,通过测定氧气体积的大小来比较反应速率的快慢,故C正确;
D.实验③④相比,③的催化剂较④多,但是④的温度较③高,两组实验速率关系不确定,可能大于、小于或等于,故D错误;
答案选D。
8. < 放出 > 将盐酸稀释
【详解】
(1)碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,其离子方程式是;故答案为:。
(2)内用CO2表示的平均反应速率是;故答案为:。
(3)CO2在时平均反应速率为,时平均反应速率为时平均反应速率为,υ(0~2) <υ(2~4),开始反应物浓度大,但反应速率没有2~4的反应速率大,说明是另外的在影响反应速率,从而说明该反应过程中放出热量,该反应中反应物的总能量>生成物的总能量;故答案为:<;放出;>。
(4)欲减缓该反应的速率,可以降低反应物浓度,由于碳酸钙是固体,因此可采取的一种措施是将盐酸稀释;故答案为:将盐酸稀释。
9.前者是氯化铁,用氯化铜可使二者只有金属离子不同,消除阴离子的影响,使得到的实验结论更可靠
收集气体所需要的时间
氯酸钾自身受热分解很缓慢
高锰酸钾的分解产物对氯酸钾的分解起到了催化作用
【详解】
(1)①对分解也具有催化作用,为比较和对分解的效果,应该排除阴离子不同带来的干扰,所以应将硫酸铜改为氯化铜,答案为:前者是氯化铁,用氯化铜可使二者只有金属离子不同,消除阴离子的影响,使得到的实验结论更可靠;
②相同条件下,一定时间内收集气体体积越大反应速率越快,或者收集相同体积气体所用时间越短反应速率越快,答案为:收集气体所需要的时间;
(2)氯酸钾自身受热分解生成氧气速率较为缓慢,需要使用二氧化锰作为催化剂,高锰酸钾受热分解产生二氧化锰,可以作为氯酸钾反应的催化剂,所以反应速率先慢后快,答案为:氯酸钾自身受热分解很缓慢;高锰酸钾的分解产物对氯酸钾的分解起到了催化作用。
10. 放热 a 完全反应后不再放热,温度逐渐下降
【详解】
(1)镁条与盐酸反应生成氯化镁和氢气,反应的化学方程式为:Mg+2HCl═MgCl2+H2↑,离子方程式为,该反应为放热反应;
(2) 图中a、b、c、d四个点中,a点盐酸浓度最大,则产生氢气最快的为a点;
(3) 图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是完全反应后不再放热,温度逐渐降低;
1
一、单选题
1.对于反应C(S)+CO2(g) =2CO(g),下列措施可使反应速率增大的是( )
A.恒温恒容时通入稀有气体 B.恒温恒压下通入N2
C.增加碳的量 D.将炭块粉碎
2.把下列四种X溶液分别加入四个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃20mL3mol·L-1的X溶液
B.20℃30mL2mol·L-1的X溶液
C.20℃10mL4mol·L-1的X溶液
D.10℃10mL2mol·L-1的X溶液
3.汽车尾气含有NO、CO等多种污染物,已成为城市空气的主要污染源。一定条件下,在密闭容器中发生反应2NO+2CON2+2CO2。为了加快反应速率,下列措施不合理的是( )
A.使用高效催化剂
B.升高温度
C.保持容积不变,再通入一定量的CO
D.将容器的容积扩大到原来的2倍
4.在铁和稀硫酸的反应中,下列方法可以加快其反应速率的是( )
A.用铁钉代替铁粉
B.加入少量氯化钠溶液
C.用98%的浓硫酸代替稀硫酸
D.适当升高反应温度
5.少量锌粒与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤加NaCl溶液 ⑥滴几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.①⑤⑦ B.③⑦⑧ C.②④⑥ D.③⑥⑦⑧
6.某实验探究小组研究300K时的反应:,相关物质的数据如表所示。下列有关说法正确的是
t/min 0 2 4 6 8 10
0.16 0.14 0.12 0.10 0.08 0.08
0 0.03 0.06 0.09 0.12 0.12
A.Y表示G
B.4~6min,用E表示该反应的速率为0.01
C.X的浓度越大,反应速率越快
D.10min之后反应停止了
7.某小组拟探究反应条件对反应速率的影响。所用试剂有:5% 溶液、0.1mol/L 溶液、蒸馏水等。下列说法错误的是
物理量 序号 反应温度/℃ /mL /mL V(水) /mL /mL T /min
① 25℃ 5.0 0 3.0 x1 y1
② 25℃ 4.0 0 a x2 y2
③ 25℃ 5.0 1.0 b x3 y3
④ 25℃ 5.0 0.5 2.5 x4 y4
A.上述实验①②是探究H2O2浓度对化学反应速率的影响,则a可以为4.0
B.若b=2.0,则上述实验①③是探究催化剂Fe2(SO4)3对化学反应速率的影响
C.实验中可固定x1=x2=x3=x4,通过测定y1、y2、y3、y4的大小来比较反应速率的快慢
D.若用单位时间内产生O2的体积表示该反应的速率,则一定有如下关系:x3/y3
8.某课外实验小组测定了碳酸钙与稀盐酸反应过程中,生成CO2的浓度随时间的变化关系如下图所示。
(1)碳酸钙与稀盐酸反应的离子方程式是_______。
(2)内用CO2表示的平均反应速率是_______。
(3)比较CO2在、时平均反应速率的大小:υ(0~2)_______υ(2~4)(填“>”、“<”或“=”),说明该反应过程中_______热量,该反应中反应物的总能量_______(填“>”、“<”或“=”)生成物的总能量。
(4)欲减缓该反应的速率,可采取的一种措施是_______。
9.影响化学反应速率的因素有很多,某课外兴趣小组用实验的方法对其进行探究。
(1)实验一:已知对分解也具有催化作用,为比较和对分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题。
①甲装置:通过观察气泡产生的速率,比较二者的催化效果。但小组某同学提出将硫酸铜改为氯化铜更好,其理由可能是___________。
②通过乙装置也能比较二者的催化效果。同温同压下,均以生成40mL气体为准,其他可能影响实验的因素均已忽略。则实验中还需要测量的数据是___________。
(2)实验二:取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中前,B试管中产生气体的速率较慢且量少的原因可能为_______,后,B试管中产生气体的速率较快且量多的原因可能为___________。
10.传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量气压、浓度、pH、温度等而在化学实验研究中应用越来越广泛深入。
将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图2所示。
(1)镁条与盐酸反应的离子方程式为___________。该反应为___________ (填“吸热”或“放热”)反应。
(2)图2中a、b、c、d四个点中,产生氢气最快的为___________点。
(3)图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是___________。
《影响化学反应速率的因素》课后作业答案解析
一、单选题
1.对于反应C(S)+CO2(g) =2CO(g),下列措施可使反应速率增大的是( )
A.恒温恒容时通入稀有气体 B.恒温恒压下通入N2
C.增加碳的量 D.将炭块粉碎
【参考答案】D
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 气体的浓度不变,反应速率不变 L2
B 恒压,通入氮气,浓度减小,速率减小 L2
C 固体浓度不变,为直接判定 L1
D 增大表面积,为直接判定 L1
2.把下列四种X溶液分别加入四个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃20mL3mol·L-1的X溶液
B.20℃30mL2mol·L-1的X溶液
C.20℃10mL4mol·L-1的X溶液
D.10℃10mL2mol·L-1的X溶液
【参考答案】B
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 温度越高,反应速率越大 反应物浓度越大,反应速率越大 L1
B
C
D
3.汽车尾气含有NO、CO等多种污染物,已成为城市空气的主要污染源。一定条件下,在密闭容器中发生反应2NO+2CON2+2CO2。为了加快反应速率,下列措施不合理的是( )
A.使用高效催化剂
B.升高温度
C.保持容积不变,再通入一定量的CO
D.将容器的容积扩大到原来的2倍
【参考答案】D
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 使用催化剂可加快反应速率 L1
B 温度越高,反应速率越大 L1
C 反应物浓度越大,反应速率越大 L1
D 容积扩大,反应物浓度减小,反应速率变小 L1
4.在铁和稀硫酸的反应中,下列方法可以加快其反应速率的是( )
A.用铁钉代替铁粉
B.加入少量氯化钠溶液
C.用98%的浓硫酸代替稀硫酸
D.适当升高反应温度
【参考答案】D
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 增大表面积,速率加快 L1
B 氯化钠溶液不参与反应,原反应液被稀释,反应物浓度减小,反应速率变慢 L1
C 浓硫酸使铁钝化,改变反应过程 L2
D 温度越高,反应速率越大 L1
5.少量锌粒与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤加NaCl溶液 ⑥滴几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.①⑤⑦ B.③⑦⑧ C.②④⑥ D.③⑥⑦⑧
【参考答案】B
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 ①②④⑤ 反应物浓度减小,反应速率变慢 L1、L2
③ 反应物浓度增大,反应速率加快,但氢气产量增加 L2
⑥ 形成原电池,加快反应速率,且氢气产量不受影响 L2
⑦ 温度越高,反应速率越大,且氢气产量不受影响 L1
⑧ 盐酸浓度变大,而n(H+)未变,速率加快,产量不变 L2
6.某实验探究小组研究300K时的反应:,相关物质的数据如表所示。下列有关说法正确的是
t/min 0 2 4 6 8 10
0.16 0.14 0.12 0.10 0.08 0.08
0 0.03 0.06 0.09 0.12 0.12
A.Y表示G
B.4~6min,用E表示该反应的速率为0.01
C.X的浓度越大,反应速率越快
D.10min之后反应停止了
【参考答案】B
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 化学反应速率之比等于化学计量数之比 L2
B 反应速率的计算 L1
C X为反应物,浓度越大速率越快 L1
D 可逆反应的特征判断 L1
7.某小组拟探究反应条件对反应速率的影响。所用试剂有:5% 溶液、0.1mol/L 溶液、蒸馏水等。下列说法错误的是
物理量 序号 反应温度/℃ /mL /mL V(水) /mL /mL T /min
① 25℃ 5.0 0 3.0 x1 y1
② 25℃ 4.0 0 a x2 y2
③ 25℃ 5.0 1.0 b x3 y3
④ 25℃ 5.0 0.5 2.5 x4 y4
A.上述实验①②是探究H2O2浓度对化学反应速率的影响,则a可以为4.0
B.若b=2.0,则上述实验①③是探究催化剂Fe2(SO4)3对化学反应速率的影响
C.实验中可固定x1=x2=x3=x4,通过测定y1、y2、y3、y4的大小来比较反应速率的快慢
D.若用单位时间内产生O2的体积表示该反应的速率,则一定有如下关系:x3/y3
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 A 浓度对反应速率的影响,控制变量的方法 L2
B 催化剂对反应速率的影响,控制变量的方法 L2
C 实验观察对象与数据的选择 L2
D 催化剂浓度越大,反应速率越大,新概念的理解与应用 L3
二、填空题
8.某课外实验小组测定了碳酸钙与稀盐酸反应过程中,生成CO2的浓度随时间的变化关系如下图所示。
(1)碳酸钙与稀盐酸反应的离子方程式是_______。
(2)内用CO2表示的平均反应速率是_______。
(3)比较CO2在、时平均反应速率的大小:υ(0~2)_______υ(2~4)(填“>”、“<”或“=”),说明该反应过程中_______热量,该反应中反应物的总能量_______(填“>”、“<”或“=”)生成物的总能量。
(4)欲减缓该反应的速率,可采取的一种措施是_______。
【参考答案】 < 放出 > 将盐酸稀释
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 (1) 离子方程式的书写 L1
(2) 提取图中信息,反应速率的计算 L2
(3) 图示信息的提取及综合分析 L3
(4) 影响化学反应速率的因素 L1
9.影响化学反应速率的因素有很多,某课外兴趣小组用实验的方法对其进行探究。
(1)实验一:已知对分解也具有催化作用,为比较和对分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题。
①甲装置:通过观察气泡产生的速率,比较二者的催化效果。但小组某同学提出将硫酸铜改为氯化铜更好,其理由可能是___________。
②通过乙装置也能比较二者的催化效果。同温同压下,均以生成40mL气体为准,其他可能影响实验的因素均已忽略。则实验中还需要测量的数据是___________。
(2)实验二:取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中前,B试管中产生气体的速率较慢且量少的原因可能为_______,后,B试管中产生气体的速率较快且量多的原因可能为___________。
【参考答案】前者是氯化铁,用氯化铜可使二者只有金属离子不同,消除阴离子的影响,使得到的实验结论更可靠
收集气体所需要的时间
氯酸钾自身受热分解很缓慢
高锰酸钾的分解产物对氯酸钾的分解起到了催化作用
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 (1)① 控制变量 L2
(1)② 实验观察对象与数据的选择 L1
(2) 真实反应情境与数据的综合分析 L3
10.传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量气压、浓度、pH、温度等而在化学实验研究中应用越来越广泛深入。
将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图2所示。
(1)镁条与盐酸反应的离子方程式为___________。该反应为___________ (填“吸热”或“放热”)反应。
(2)图2中a、b、c、d四个点中,产生氢气最快的为___________点。
(3)图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是___________。
【参考答案】 放热 a 完全反应后不再放热,温度逐渐下降
【质量水平】
考点 细化内容 质量水平
化学反应速率的影响因素 (1) 离子方程式的书写、反应热的判断 L1
(1)② 图示信息的提取与分析 L2
(2) 反应真实情境的综合分析 L2
答案解析
1.D
【详解】
A.恒温恒容时通入稀有气体,参加反应的气体的浓度不变,反应速率不变,A错误;
B.恒温恒压下通入N2,体积增大,参加反应的气体的浓度减小,反应速率减小,B错误;
C. C 是固体,增加 C 的量,不影响反应速率,C错误;
D.将炭块粉碎增大接触面积,反应速率增大,D正确;
故选D。
2.B
【详解】
A.10℃20mL3mol·L-1的X溶液与盐酸混合稀释后,X的浓度为1.2mol/L;
B.20℃30mL2mol·L-1的X溶液与盐酸混合稀释后,X的浓度为1.2mol/L;
C.20℃10mL4mol·L-1的X溶液与盐酸混合稀释后,X的浓度为0.8mol/L;
D.10℃10mL2mol·L-1的X溶液与盐酸混合稀释后,X的浓度为0.4mol/L;
温度越高,反应速率越快,浓度越大,反应速率越快,对比四个选项可知B的温度最高,X的浓度最大,则反应最快,故B正确;
综上所述,答案为B。
3.D
【详解】
A.使用高效催化剂可以降低反应活化能,加快反应速率,A不符合题意;
B.升高温度可以提高活化分子百分数,加快反应速率,B不符合题意;
C.保持容积不变,再通入一定量的CO,反应物浓度增大,反应速率加快,C不符合题意;
D.将容器的容积扩大到原来的2倍,各物质的浓度减小,反应速率减慢,D符合题意;
综上所述答案为D。
4.D
【详解】
A.用铁钉代替铁粉,减小了固体与液体的接触面积,反应速率减慢,A错误;
B.加入少量氯化钠溶液,对稀硫酸进行了稀释,氢离子浓度减小,反应速率减慢,B错误;
C.常温下浓硫酸与铁发生钝化反应,钝化之后反应不能继续进行,C错误;
D.升高温度能加快铁和稀硫酸的反应速率,D正确;
答案为:D。
5.B
【详解】
①加水,稀释了盐酸的浓度,故反应速率变慢;
②加氢氧化钠,与盐酸反应,减少了盐酸的浓度,故反应速率变慢;
③加浓盐酸,氢离子浓度增大,反应速率加快,由于锌粒不足,则生成的氢气量不变;
④加CuO固体与盐酸反应生成氯化铜和水,氯化铜再与锌发生置换反应生成铜,构成原电池,反应速率加快,由于消耗锌影响氢气总量;
⑤加氯化钠溶液,相当于稀释盐酸浓度,故反应速率变慢;
⑥滴加硫酸铜溶液,锌把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的锌减少,故减少了产生氢气的量;
⑦温度升高,反应速率加快,且不影响氢气量;
⑧改用浓度大的盐酸,反应速率加快,且不影响氢气量。
综上,③⑦⑧符合题意,答案选B。
6.B
【详解】
A.由表中数据可知每个相同时间段,,由各物质的变化量之比等于化学计量数之比可知,X表示E、Y表示F,故A错误;
B.4~6min,用E表示该反应的速率为,故B正确;
C.由表可知,在反应达到平衡前,每间隔2min,,则X的浓度对反应速率没有影响,故C错误;
D.10min之后反应到达了平衡,化学平衡是动态平衡,不是反应停止了,故D错误;
故选B。
7.D
【详解】
A.实验①②中,温度相同,均未加,是探究浓度对化学反应速率的影响,其他条件不变,溶液总体积不变,a 为:5.0+3.0-4.0=4.0,故A正确;
B.b=2.0时,实验①③中,浓度相同,①中未使用催化剂,③中使用催化剂,是探究催化剂对化学反应速率的影响,故B正确;
C.实验中可以固定氧气体积相同,即,通过测定时间、、、的大小来比较反应速率的快慢,也可以固定时间相等,通过测定氧气体积的大小来比较反应速率的快慢,故C正确;
D.实验③④相比,③的催化剂较④多,但是④的温度较③高,两组实验速率关系不确定,可能大于、小于或等于,故D错误;
答案选D。
8. < 放出 > 将盐酸稀释
【详解】
(1)碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,其离子方程式是;故答案为:。
(2)内用CO2表示的平均反应速率是;故答案为:。
(3)CO2在时平均反应速率为,时平均反应速率为时平均反应速率为,υ(0~2) <υ(2~4),开始反应物浓度大,但反应速率没有2~4的反应速率大,说明是另外的在影响反应速率,从而说明该反应过程中放出热量,该反应中反应物的总能量>生成物的总能量;故答案为:<;放出;>。
(4)欲减缓该反应的速率,可以降低反应物浓度,由于碳酸钙是固体,因此可采取的一种措施是将盐酸稀释;故答案为:将盐酸稀释。
9.前者是氯化铁,用氯化铜可使二者只有金属离子不同,消除阴离子的影响,使得到的实验结论更可靠
收集气体所需要的时间
氯酸钾自身受热分解很缓慢
高锰酸钾的分解产物对氯酸钾的分解起到了催化作用
【详解】
(1)①对分解也具有催化作用,为比较和对分解的效果,应该排除阴离子不同带来的干扰,所以应将硫酸铜改为氯化铜,答案为:前者是氯化铁,用氯化铜可使二者只有金属离子不同,消除阴离子的影响,使得到的实验结论更可靠;
②相同条件下,一定时间内收集气体体积越大反应速率越快,或者收集相同体积气体所用时间越短反应速率越快,答案为:收集气体所需要的时间;
(2)氯酸钾自身受热分解生成氧气速率较为缓慢,需要使用二氧化锰作为催化剂,高锰酸钾受热分解产生二氧化锰,可以作为氯酸钾反应的催化剂,所以反应速率先慢后快,答案为:氯酸钾自身受热分解很缓慢;高锰酸钾的分解产物对氯酸钾的分解起到了催化作用。
10. 放热 a 完全反应后不再放热,温度逐渐下降
【详解】
(1)镁条与盐酸反应生成氯化镁和氢气,反应的化学方程式为:Mg+2HCl═MgCl2+H2↑,离子方程式为,该反应为放热反应;
(2) 图中a、b、c、d四个点中,a点盐酸浓度最大,则产生氢气最快的为a点;
(3) 图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是完全反应后不再放热,温度逐渐降低;
1
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
