人教版(2019)高中化学必修第一册《第1课时 电解质的电离》基础练(含答案)
文档属性
| 名称 | 人教版(2019)高中化学必修第一册《第1课时 电解质的电离》基础练(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 404.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-07 00:00:00 | ||
图片预览


文档简介
《电解质的电离》基础练
一、选择题
1.通入水中不能形成电解质溶液的气体是( )
A.HCl
B.NH3
C.CH4
D.CO2
2.下列状态的物质,既能导电又属于电解质的是( )
A熔融的KOH
B.KOH溶液
C.浓硫酸
D.KOH晶体
3.把下列四种物质分别加入到盛有100mL蒸馏水的烧杯中,不能使蒸馏水导电性发生明显变化的是( )
A.10gNaCl固体
B.10gNaOH固体
C.10gBaSO4固体
D.10gCu(NO3)2固体
4.关于酸、碱、盐的下列说法中错误的是( )
A.酸在水溶液中电离产生的阳离子全部是氢离子
B.碱在水溶液中电离产生的阴离子全部是氢氧根离子
C.盐在水溶液中电离一定有金属阳离子产生
D.酸和盐在水溶液中电离都可能有含氧酸根离子产生
5.下列说法中正确的是( )
A.氯化钠水溶液在电流的作用下电离出Na+和Cl-
B.硫酸钡虽难溶于水,但硫酸钡属于电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于电解质
D.硫酸钠在水中的电离方程式为Na2SO4══2Na++S6++4O2-
6.要使溶液中存在K+、Na+、H+、、、Cl-六种离子,则蒸馏水中至少溶解几种物质( )
A.两种
B.三种
C.四种
D.五种
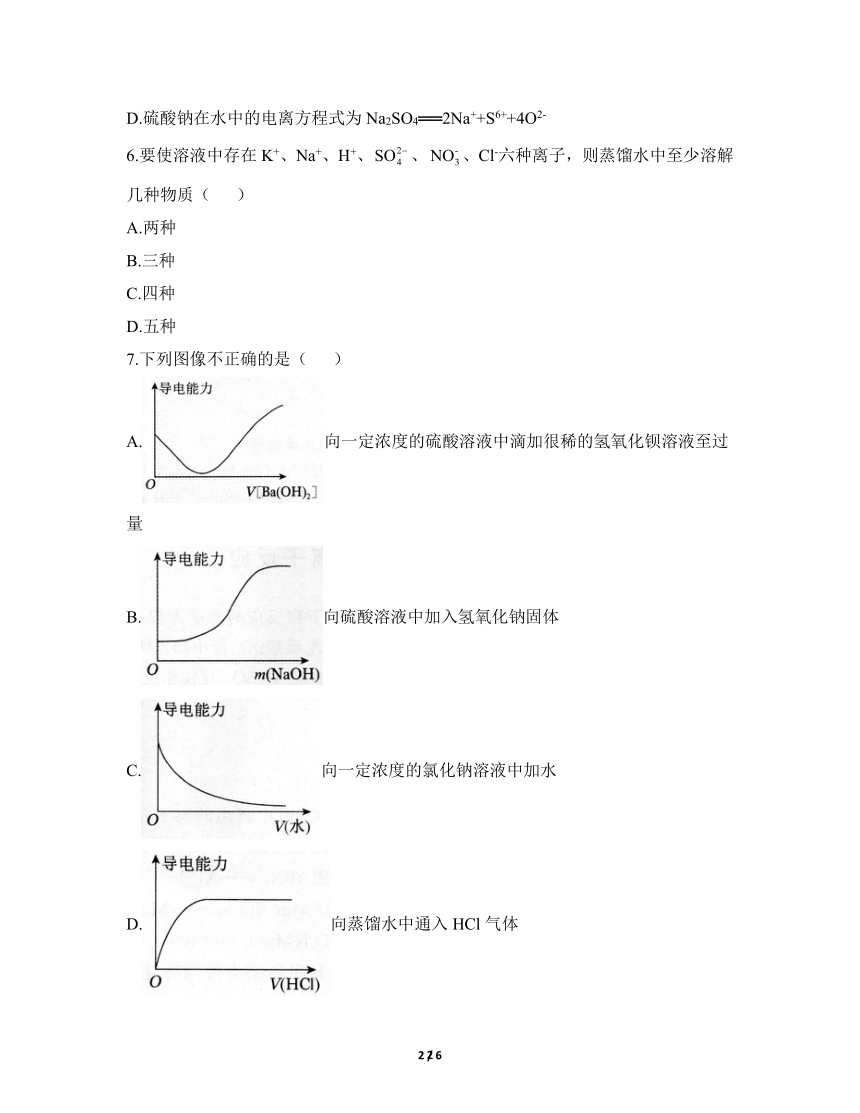
7.下列图像不正确的是( )
A.向一定浓度的硫酸溶液中滴加很稀的氢氧化钡溶液至过量
B.向硫酸溶液中加入氢氧化钠固体
C.向一定浓度的氯化钠溶液中加水
D.向蒸馏水中通入HCl气体
8.对电解质的叙述正确的是( )
A.溶于水后得到的溶液能导电的物质
B.熔融状态下能导电的物质
C.电解质必须通电才能发生电离
D.在水溶液中或熔融状态下能导电的化合物
二、填空题
9.写出下列物质在水溶液中的电离方程式。
(1)Fe2(SO4)3:____________________________________________________;
(2)CuCl2_________________________________________________________;
(3)KClO3:______________________________________________________;
(4)Na2CO3:_____________________________________________________;
(5)Ca(HCO3)2:__________________________________________________;
(6)KAl(SO)2:____________________________________________________;
10.以下都是中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH(酒精) ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2 ⑩NaOH
请按下列分类标准回答:
(1)属于电解质的是__________。(填序号,下同)
(2)溶于水能电离出H+的是__________;属于酸的是__________。
(3)属于难溶碱的是___________;属于难溶盐的是__________。
答案与解析
一、选择题
1.答案:C
解析:HCl气体通入水中时,在水分子的作用下,解离出自由移动的H+和Cl-得到HCl电解质溶液,A不符合题意;NH3通入水中时,与水分子反应生成NH3·H2O,进而电离出和OH-,可得到电解质溶液,B不符合题意;CH4本身不电离,又不与水反应生成电解质,通入水中得不到电解质溶液,C符合题意;CO2通入水中时,与水反应生成的H2CO3是电解质,可电离出H+与,D不符合题意,故选C。
2.答案:A
解析:KOH溶液、浓硫酸属于混合物,因此不属于电解质;KOH晶体属于电解质,但导电条件为溶于水或处于熔融状态,故A正确。
3.答案:C
解析:因为BaSO4固体难溶于水,不能使蒸馏水中的离子浓度发生明显变化,则导电性也就不会发生明显变化,故选C。
4.答案:C
解析:回归定义进行判断,在水溶液中电离产生的阳离子全部是离子的化合物一定是酸;在水溶液中电离产生的阴离子全部是氢氧根离子的化合物一定是碱;盐在水溶液中电离不一定有金属阳离子产生(如铵盐)。故选C。
5.答案:B
解析:氯化钠溶于水时即能电离出Na+和Cl-,电解质的电离不需要外加电流的作用,A错误;硫酸钡虽难溶于水,但溶于水的硫酸钡在水溶液中可以发生电离,属于电解质,B正确;二氧化碳溶于水生成的碳酸能电离而使水溶液导电,碳酸是电解质,而二氧化碳是非电解质,C错误;硫酸钠在水中的电离方程式应为,D错误。
6.答案:B
解析:因为水本身可电离出H+,则仅需将K+、Na+、、Cl-加入蒸馏水即可,由于阴离子数目大于阳离子数目,故最少加入物质的种类数与阴离子数相等,故B正确。
7.答案:A
解析:向H2SO4溶液中滴加Ba(OH)2溶液至过量,发生的反应为,所以溶液中的离子浓度先减小到接近0,后来Ba(OH)2溶液过量,离子浓度又增大,则溶液的导电能力先减小到0,后增大,但是加入的Ba(OH)2溶液很稀,离子的浓度很低,故溶液的导电性比原来硫酸的导电性要弱,A错误;向H2SO4溶液中加入NaOH固体,发生的反应为,可以看到刚开始时离子的浓度几乎不变,NaOH固体过量时离子的浓度才开始增大,所以溶液的导电能力开始不变,后增大,B正确;向一定浓度的氯化钠溶液中加水,溶液中的离子浓度不断减小,所以溶液的导电能力不断减弱,但不等于0,C正确;向蒸馏水中通入HCl气体,溶液中的离子浓度不断增大,直到达到饱和,此时溶液的浓度不再改变,所以导电能力先不断增大,后不变,D正确。故选A。
8.答案:D
解析:CO2溶入水中后得到的溶液能导电,是由于CO2与水反应生成电解质H2CO3,而CO2本身属于非电解质,A错误;金属在熔融状态下可以导电,但金属为单质,不属于电解质,B错误;电解质的电离条件是溶于水或熔融状态下,不需通电,C错误。故选D。
二、填空题
9.答案:(1)
(2)
(3)
(4)
(5)
(6)
10.答案:(1)②③⑤⑦⑧⑨⑩
(2)③⑤ ⑤
(3)⑨ ⑦⑧
解析:电离出的阳离子全部是H+的化合物是酸;电离出的阴离子全部是OH-的化合物是碱,注意记忆典型的酸、碱、盐的溶解性。
1
一、选择题
1.通入水中不能形成电解质溶液的气体是( )
A.HCl
B.NH3
C.CH4
D.CO2
2.下列状态的物质,既能导电又属于电解质的是( )
A熔融的KOH
B.KOH溶液
C.浓硫酸
D.KOH晶体
3.把下列四种物质分别加入到盛有100mL蒸馏水的烧杯中,不能使蒸馏水导电性发生明显变化的是( )
A.10gNaCl固体
B.10gNaOH固体
C.10gBaSO4固体
D.10gCu(NO3)2固体
4.关于酸、碱、盐的下列说法中错误的是( )
A.酸在水溶液中电离产生的阳离子全部是氢离子
B.碱在水溶液中电离产生的阴离子全部是氢氧根离子
C.盐在水溶液中电离一定有金属阳离子产生
D.酸和盐在水溶液中电离都可能有含氧酸根离子产生
5.下列说法中正确的是( )
A.氯化钠水溶液在电流的作用下电离出Na+和Cl-
B.硫酸钡虽难溶于水,但硫酸钡属于电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于电解质
D.硫酸钠在水中的电离方程式为Na2SO4══2Na++S6++4O2-
6.要使溶液中存在K+、Na+、H+、、、Cl-六种离子,则蒸馏水中至少溶解几种物质( )
A.两种
B.三种
C.四种
D.五种
7.下列图像不正确的是( )
A.向一定浓度的硫酸溶液中滴加很稀的氢氧化钡溶液至过量
B.向硫酸溶液中加入氢氧化钠固体
C.向一定浓度的氯化钠溶液中加水
D.向蒸馏水中通入HCl气体
8.对电解质的叙述正确的是( )
A.溶于水后得到的溶液能导电的物质
B.熔融状态下能导电的物质
C.电解质必须通电才能发生电离
D.在水溶液中或熔融状态下能导电的化合物
二、填空题
9.写出下列物质在水溶液中的电离方程式。
(1)Fe2(SO4)3:____________________________________________________;
(2)CuCl2_________________________________________________________;
(3)KClO3:______________________________________________________;
(4)Na2CO3:_____________________________________________________;
(5)Ca(HCO3)2:__________________________________________________;
(6)KAl(SO)2:____________________________________________________;
10.以下都是中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH(酒精) ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2 ⑩NaOH
请按下列分类标准回答:
(1)属于电解质的是__________。(填序号,下同)
(2)溶于水能电离出H+的是__________;属于酸的是__________。
(3)属于难溶碱的是___________;属于难溶盐的是__________。
答案与解析
一、选择题
1.答案:C
解析:HCl气体通入水中时,在水分子的作用下,解离出自由移动的H+和Cl-得到HCl电解质溶液,A不符合题意;NH3通入水中时,与水分子反应生成NH3·H2O,进而电离出和OH-,可得到电解质溶液,B不符合题意;CH4本身不电离,又不与水反应生成电解质,通入水中得不到电解质溶液,C符合题意;CO2通入水中时,与水反应生成的H2CO3是电解质,可电离出H+与,D不符合题意,故选C。
2.答案:A
解析:KOH溶液、浓硫酸属于混合物,因此不属于电解质;KOH晶体属于电解质,但导电条件为溶于水或处于熔融状态,故A正确。
3.答案:C
解析:因为BaSO4固体难溶于水,不能使蒸馏水中的离子浓度发生明显变化,则导电性也就不会发生明显变化,故选C。
4.答案:C
解析:回归定义进行判断,在水溶液中电离产生的阳离子全部是离子的化合物一定是酸;在水溶液中电离产生的阴离子全部是氢氧根离子的化合物一定是碱;盐在水溶液中电离不一定有金属阳离子产生(如铵盐)。故选C。
5.答案:B
解析:氯化钠溶于水时即能电离出Na+和Cl-,电解质的电离不需要外加电流的作用,A错误;硫酸钡虽难溶于水,但溶于水的硫酸钡在水溶液中可以发生电离,属于电解质,B正确;二氧化碳溶于水生成的碳酸能电离而使水溶液导电,碳酸是电解质,而二氧化碳是非电解质,C错误;硫酸钠在水中的电离方程式应为,D错误。
6.答案:B
解析:因为水本身可电离出H+,则仅需将K+、Na+、、Cl-加入蒸馏水即可,由于阴离子数目大于阳离子数目,故最少加入物质的种类数与阴离子数相等,故B正确。
7.答案:A
解析:向H2SO4溶液中滴加Ba(OH)2溶液至过量,发生的反应为,所以溶液中的离子浓度先减小到接近0,后来Ba(OH)2溶液过量,离子浓度又增大,则溶液的导电能力先减小到0,后增大,但是加入的Ba(OH)2溶液很稀,离子的浓度很低,故溶液的导电性比原来硫酸的导电性要弱,A错误;向H2SO4溶液中加入NaOH固体,发生的反应为,可以看到刚开始时离子的浓度几乎不变,NaOH固体过量时离子的浓度才开始增大,所以溶液的导电能力开始不变,后增大,B正确;向一定浓度的氯化钠溶液中加水,溶液中的离子浓度不断减小,所以溶液的导电能力不断减弱,但不等于0,C正确;向蒸馏水中通入HCl气体,溶液中的离子浓度不断增大,直到达到饱和,此时溶液的浓度不再改变,所以导电能力先不断增大,后不变,D正确。故选A。
8.答案:D
解析:CO2溶入水中后得到的溶液能导电,是由于CO2与水反应生成电解质H2CO3,而CO2本身属于非电解质,A错误;金属在熔融状态下可以导电,但金属为单质,不属于电解质,B错误;电解质的电离条件是溶于水或熔融状态下,不需通电,C错误。故选D。
二、填空题
9.答案:(1)
(2)
(3)
(4)
(5)
(6)
10.答案:(1)②③⑤⑦⑧⑨⑩
(2)③⑤ ⑤
(3)⑨ ⑦⑧
解析:电离出的阳离子全部是H+的化合物是酸;电离出的阴离子全部是OH-的化合物是碱,注意记忆典型的酸、碱、盐的溶解性。
1
