11.1.2 生活中常见的盐(2)【课件32页】-2022-2023学年九年级化学下册同步备课系列(人教版)
文档属性
| 名称 | 11.1.2 生活中常见的盐(2)【课件32页】-2022-2023学年九年级化学下册同步备课系列(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 76.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-09 00:00:00 | ||
图片预览









文档简介
(共32张PPT)
第十一单元 盐 化肥
课题1 生活中常见的盐
第2课时
碳酸钠、碳酸氢钠和碳酸钙的构成、性质及主要用途
1
本节重点
2
本节难点
探究碳酸盐与酸的反应,掌握碳酸根离子检验方法
3
初步认识复分解反应。
豪华酒店的地面
人民大会堂的柱子
同学们看了这么多图片,知道它们是用什么材料做成的吗?
天安门前的华表
大理石
——主要成分为碳酸钙(CaCO3)
碳酸钙 (CaCO3)
石灰石
大理石
主要成分是碳酸钙
难溶于水的白色固体
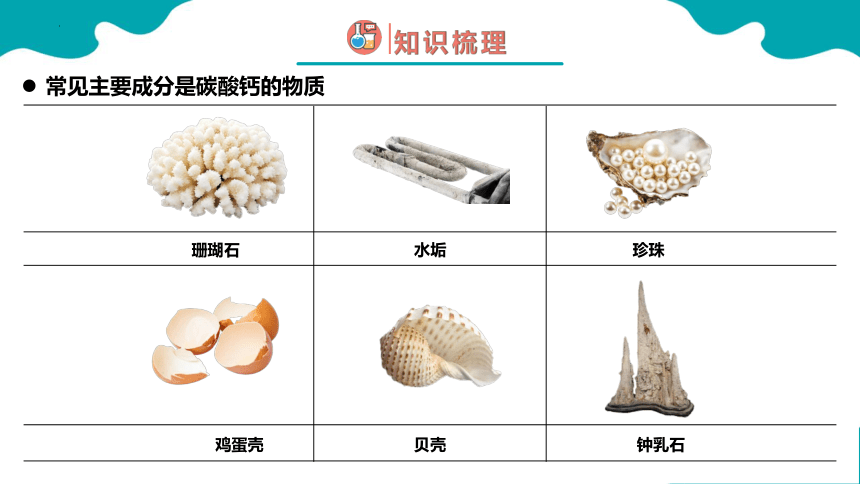
常见主要成分是碳酸钙的物质
珊瑚石
水垢
珍珠
贝壳
鸡蛋壳
钟乳石
碳酸钙的用途
建筑材料
摩擦剂
补钙剂
碳酸钠 (Na2CO3)
纯碱
苏打
易溶于水的白色粉末状固体
碳酸钠由钠离子和碳酸根离子构成,其构成中没有OH-,所以它不属于碱,属于盐。
碳酸钠俗称纯碱,但它并不是碱而是盐,这是为什么呢
俗名:
物理性质:
从上述实验中,可知:碳酸钠溶液遇到酚酞会变红,则其溶液呈碱性
向一定浓度的碳酸钠溶液中滴加适量的酚酞试剂会出现什么现象呢?
这就是碳酸钠为什么又叫纯碱的原因!
玻璃
造纸
纺织
洗涤剂
碳酸钠的用途
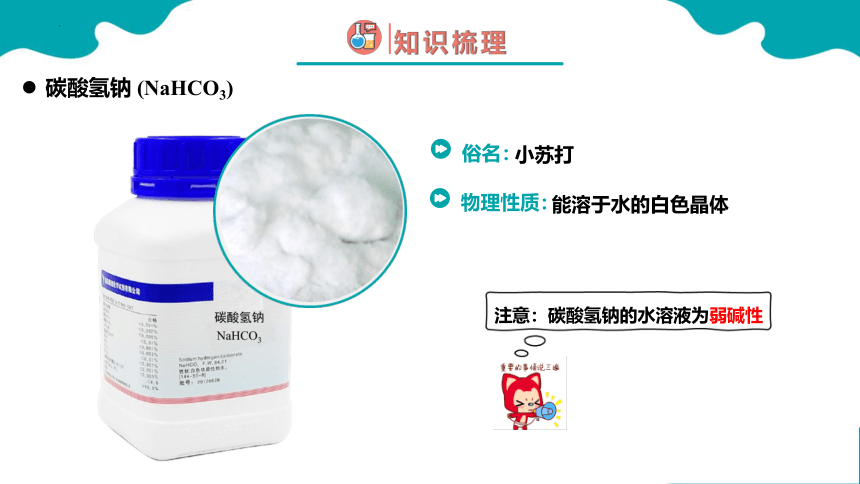
碳酸氢钠 (NaHCO3)
能溶于水的白色晶体
小苏打
注意:碳酸氢钠的水溶液为弱碱性
俗名:
物理性质:
碳酸氢钠的用途
发酵粉的主要成分之一
医疗上用于治疗胃酸过多症
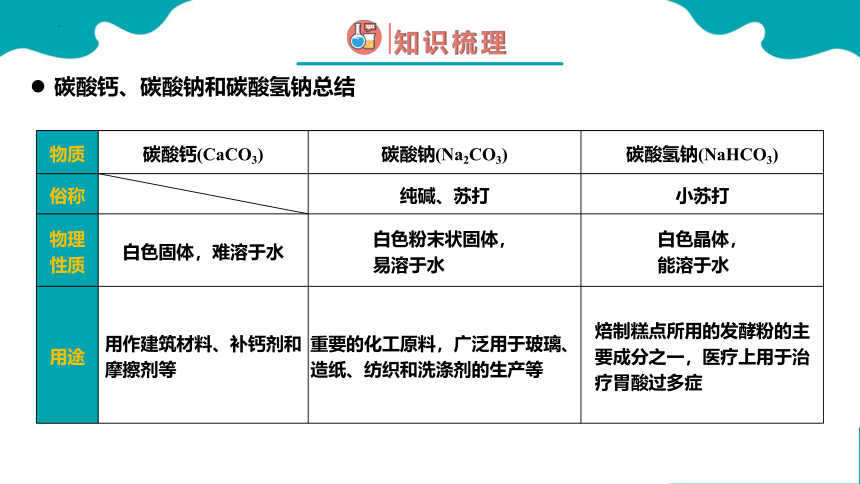
物质 碳酸钙(CaCO3) 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗称 纯碱、苏打 小苏打
物理性质 白色固体,难溶于水 白色粉末状固体, 易溶于水 白色晶体,
能溶于水
用途 用作建筑材料、补钙剂和摩擦剂等 重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产等 焙制糕点所用的发酵粉的主要成分之一,医疗上用于治疗胃酸过多症
碳酸钙、碳酸钠和碳酸氢钠总结
上述反应的化学反应方程式为:____________________________________。
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
比较碳酸钙与碳酸钠和碳酸氢钠的组成,根据上述反应,推断:
+ 2HCl
Na2CO3
NaHCO3
是否也能发生上述类似的反应。
实验探究——碳酸钠(或碳酸氢钠)与稀盐酸的反应
实验步骤
实验步骤:
向盛有0.5 g碳酸钠的试管里加入2 mL盐酸,迅速用带导管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象。
用碳酸氢钠代替碳酸钠进行上述实验,并分析现象。
碳酸钠与盐酸反应的装置
碳酸钠+盐酸 碳酸氢钠+盐酸
现象
分析
化学方程式
碳酸钠与盐酸反应生成二氧化碳、水、氯化钠
碳酸氢钠与盐酸反应生成二氧化碳、水、氯化钠
Na2CO3 + 2HCl
2NaCl + H2O + CO2↑
NaHCO3 + HCl
NaCl + H2O + CO2↑
迅速反应,生成大量气体,
试管中的澄清石灰水变浑浊
反应更迅速,生成气体更多,
试管中的澄清石灰水变浑浊
碳酸钠+盐酸
碳酸氢钠+盐酸
澄清石灰水
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
NaHCO3 + HCl NaCl + H2O + CO2↑
组成里含有CO (或HCO )的盐都能与盐酸反应生成CO2气体,利用此反应可以检验盐的组成中是否含有CO (或HCO )
2-
3
3
-
2-
3
3
-
稀盐酸和澄清石灰水
取适量的样品于试管中,向其中滴加适量稀盐酸,若有气泡产生且产生的气体能使澄清石灰水变浑浊,则证明该盐的样品中含有CO (或HCO )
2-
3
3
-
检验原理:
检验试剂:
检验方法:
CO (或HCO )的检验
2-
3
3
-
向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,观察并分析现象。
实验步骤:
碳酸钠与澄清石灰水反应的装置
实验探究——碳酸钠溶液与澄清石灰水反应
实验步骤
实验现象
实验分析
化学方程式
碳酸钠与氢氧化钙反应生成碳酸钙,碳酸钙难溶于水,故溶液中出现浑浊(产生白色沉淀)
溶液中出现浑浊(产生白色沉淀)
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
观察下列这些反应,它们有什么共同点吗?
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
NaHCO3 + HCl NaCl + H2O + CO2↑
Na2CO3 + Ca(OH)2 CaCO3↓ + 2NaOH
H2CO3
复分解反应
都发生在溶液中。
都是由两种化合物互相交换成分,生成另外两种化合物的反应。
共同点
在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应,这样的反应叫做复分解反应。
特点:
“互交换,价不变”
图示:
复分解反应
基本反应类型 反应物种类 生成物种类 反应表达式 实例
化合反应 两种或两种以上 一种 A+B+ →X
分解反应 一种 两种或两种以上 X→A+B+
置换反应 一种单质、一种化合物 一种单质、一种化合物 A+BC→B+AC
复分解反应 两种化合物 两种化合物 AB+CD→AD+CB
基本反应类型的比较
2Mg+O2
2MgO
点燃
2H2O2
2H2O+O2↑
MnO2
Zn+2HCl
ZnCl2+H2↑
NaOH+HCl
NaCl+H2O
欧内斯特·索尔维
E.Ernest Solvay 1838-1922
比利时工业化学家,1860年索尔维到其叔父的煤气厂工作,研究煤气废液的用途。他想从废液中提取碳酸铵,但实验失败。1861年他又用氨溶液、二氧化碳与食盐混合制成碳酸钠(称为氨碱法),但不知此反应已为前人发现过了。当年他获得比利时政府给他的专利,在布鲁塞尔开设一个小厂从事试验。1863年创办一个正式的制碱工厂,实现了氨碱法的工业化,使制碱生产实现了连续化,食盐的利用率也提高了很多。产品由于质量纯净,而被称为纯碱。
1.(2023春·黑龙江哈尔滨·九年级校考阶段练习)生活中下列做法不正确的是
A.用含有碳酸氢钠的药剂来治疗胃酸过多
B.用纯碱蒸馒头
C.用蒸馏的方法将硬水软化
D.生石灰可作袋装食品的干燥剂
【答案】C
【详解】A、碳酸氢钠能与盐酸反应生成氯化钠、二氧化碳和水,故可用含有碳酸氢钠的药剂来治疗胃酸过多,不符合题意;
B、纯碱是碳酸钠的俗称,碳酸钠能与发酵过程中产生的酸性物质反应生成二氧化碳,可用于蒸馒头,不符合题意;
C、可溶性钙、镁化合物在加热时,能形成沉淀,故生活中常用煮沸的方法降低水的硬度,实验室常用蒸馏的方法将硬水软化,符合题意;
D、生石灰是氧化钙的俗称,氧化钙能与水反应生成氢氧化钙,可用生石灰作袋装食品的干燥剂,不符合题意。
2.(2023春·江苏扬州·九年级阶段练习)下列为某同学的笔记,其中记录正确的是
A.单质只含有一种元素,所以含一种元素的物质都是单质
B.点燃可燃性气体有可能引发爆炸,所以点燃可燃性气体前一定要先检验气体纯度
C.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
D.碳酸盐与稀盐酸反应产生气体,则能与稀盐酸反应产生气体的物质一定是碳酸盐
【答案】B
【详解】A、单质是指只含一种元素的纯净物,含一种元素的物质不一定是单质,如红磷和白磷的混合物只含磷元素,该选项不正确;
C、酸与碱反应生成盐和水的反应为中和反应,只有盐和水生成的反应不一定是中和反应,如二氧化碳和氢氧化钠反应生成碳酸钠和水,但不属于中和反应,该选项不正确;
D、酸能与碳酸盐反应生成二氧化碳气体,能与活泼金属反应生成氢气,则能与能与稀盐酸反应产生气体的物质不一定是碳酸盐,该选项不正确。
3.(2023秋·重庆沙坪坝·九年级统考期末)在家学习期间,小李利用生活用品对教材中的课外实验进行探究,下列课外实验有错误的是
A.活性炭用于净水 B.铅笔芯有导电性
C.鸡蛋壳中含有碳酸盐 D.蜡烛中含有碳元素
【答案】A
【详解】A、活性炭疏松多孔有吸附性,可以除去水中的色素和异味,可用于净水,但细沙起到过滤作用,净化程度比活性炭低,应放在活性炭的上部,错误;
4.(2023·江苏淮安·统考一模)碳酸氢钠(NaHCO3)是焙制糕点所用发酵粉主要成分之一,下列有关说法正确的是
A.NaHCO3中的阳离子为Na+
B.NaHCO3中含有3个氧原子
C.NaHCO3中碳元素和氧元素的质量比为1:3
D.NaHCO3也可用于治疗胃酸过多
【答案】D
【详解】A、碳酸氢钠由钠离子和碳酸氢根离子构成,钠离子属于阳离子,不符合题意;
B、碳酸氢钠由钠离子和碳酸氢根离子构成,不含氧原子,不符合题意;
C、碳酸氢钠中碳元素和氧元素的质量比为:12:(16×3)=1:4,不符合题意;
D、碳酸氢钠能与盐酸反应生成氯化钠、二氧化碳和水,可用于治疗胃酸过多,符合题意。
5.(2022秋·广东中山·九年级统考期末)如图中,图1是泡沫灭火器,图II、II是灭火器原理示意图,以下说法错误的是
A.当碳酸钠溶液和浓盐酸接触时,立即产生大量二氧化碳气体
B.图Ⅲ的现象是:产生大量气泡,泡沫从导管口喷出
C.碳酸钠溶液可以用块状大理石代替
D.图书、档案失火时不使用泡沫灭火器灭火
【答案】C
【详解】C、灭火器需要在短时间内产生大量二氧化碳,而碳酸钙和盐酸反应时速率较慢,所以块状碳酸钙不适用于制造灭火器,故C错误;
6.(2022春·九年级课前预习)碳酸根或碳酸氢根离子的检验方法
检验原理:组成里含有 、 的盐都能与盐酸反应生成二氧化碳气体。
(1)检验试剂:_________、_______。
(2)检验方法
向待测液中加入稀盐酸有________,且该气体能使澄清石灰水变_______,则该物质中有 或 。
【答案】
(1) 稀盐酸 澄清的石灰水
(2) 无色无味气体放出 变浑浊
碳酸钠、碳酸氢钠和碳酸钙
碳酸根离子的检验
复分解反应
俗名
化学性质
用途
课题1
生活中常见的盐
第2课时
THANKS
谢谢聆听
第十一单元 盐 化肥
课题1 生活中常见的盐
第2课时
碳酸钠、碳酸氢钠和碳酸钙的构成、性质及主要用途
1
本节重点
2
本节难点
探究碳酸盐与酸的反应,掌握碳酸根离子检验方法
3
初步认识复分解反应。
豪华酒店的地面
人民大会堂的柱子
同学们看了这么多图片,知道它们是用什么材料做成的吗?
天安门前的华表
大理石
——主要成分为碳酸钙(CaCO3)
碳酸钙 (CaCO3)
石灰石
大理石
主要成分是碳酸钙
难溶于水的白色固体
常见主要成分是碳酸钙的物质
珊瑚石
水垢
珍珠
贝壳
鸡蛋壳
钟乳石
碳酸钙的用途
建筑材料
摩擦剂
补钙剂
碳酸钠 (Na2CO3)
纯碱
苏打
易溶于水的白色粉末状固体
碳酸钠由钠离子和碳酸根离子构成,其构成中没有OH-,所以它不属于碱,属于盐。
碳酸钠俗称纯碱,但它并不是碱而是盐,这是为什么呢
俗名:
物理性质:
从上述实验中,可知:碳酸钠溶液遇到酚酞会变红,则其溶液呈碱性
向一定浓度的碳酸钠溶液中滴加适量的酚酞试剂会出现什么现象呢?
这就是碳酸钠为什么又叫纯碱的原因!
玻璃
造纸
纺织
洗涤剂
碳酸钠的用途
碳酸氢钠 (NaHCO3)
能溶于水的白色晶体
小苏打
注意:碳酸氢钠的水溶液为弱碱性
俗名:
物理性质:
碳酸氢钠的用途
发酵粉的主要成分之一
医疗上用于治疗胃酸过多症
物质 碳酸钙(CaCO3) 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗称 纯碱、苏打 小苏打
物理性质 白色固体,难溶于水 白色粉末状固体, 易溶于水 白色晶体,
能溶于水
用途 用作建筑材料、补钙剂和摩擦剂等 重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产等 焙制糕点所用的发酵粉的主要成分之一,医疗上用于治疗胃酸过多症
碳酸钙、碳酸钠和碳酸氢钠总结
上述反应的化学反应方程式为:____________________________________。
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
比较碳酸钙与碳酸钠和碳酸氢钠的组成,根据上述反应,推断:
+ 2HCl
Na2CO3
NaHCO3
是否也能发生上述类似的反应。
实验探究——碳酸钠(或碳酸氢钠)与稀盐酸的反应
实验步骤
实验步骤:
向盛有0.5 g碳酸钠的试管里加入2 mL盐酸,迅速用带导管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象。
用碳酸氢钠代替碳酸钠进行上述实验,并分析现象。
碳酸钠与盐酸反应的装置
碳酸钠+盐酸 碳酸氢钠+盐酸
现象
分析
化学方程式
碳酸钠与盐酸反应生成二氧化碳、水、氯化钠
碳酸氢钠与盐酸反应生成二氧化碳、水、氯化钠
Na2CO3 + 2HCl
2NaCl + H2O + CO2↑
NaHCO3 + HCl
NaCl + H2O + CO2↑
迅速反应,生成大量气体,
试管中的澄清石灰水变浑浊
反应更迅速,生成气体更多,
试管中的澄清石灰水变浑浊
碳酸钠+盐酸
碳酸氢钠+盐酸
澄清石灰水
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
NaHCO3 + HCl NaCl + H2O + CO2↑
组成里含有CO (或HCO )的盐都能与盐酸反应生成CO2气体,利用此反应可以检验盐的组成中是否含有CO (或HCO )
2-
3
3
-
2-
3
3
-
稀盐酸和澄清石灰水
取适量的样品于试管中,向其中滴加适量稀盐酸,若有气泡产生且产生的气体能使澄清石灰水变浑浊,则证明该盐的样品中含有CO (或HCO )
2-
3
3
-
检验原理:
检验试剂:
检验方法:
CO (或HCO )的检验
2-
3
3
-
向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,观察并分析现象。
实验步骤:
碳酸钠与澄清石灰水反应的装置
实验探究——碳酸钠溶液与澄清石灰水反应
实验步骤
实验现象
实验分析
化学方程式
碳酸钠与氢氧化钙反应生成碳酸钙,碳酸钙难溶于水,故溶液中出现浑浊(产生白色沉淀)
溶液中出现浑浊(产生白色沉淀)
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
观察下列这些反应,它们有什么共同点吗?
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl 2NaCl + H2O + CO2↑
NaHCO3 + HCl NaCl + H2O + CO2↑
Na2CO3 + Ca(OH)2 CaCO3↓ + 2NaOH
H2CO3
复分解反应
都发生在溶液中。
都是由两种化合物互相交换成分,生成另外两种化合物的反应。
共同点
在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应,这样的反应叫做复分解反应。
特点:
“互交换,价不变”
图示:
复分解反应
基本反应类型 反应物种类 生成物种类 反应表达式 实例
化合反应 两种或两种以上 一种 A+B+ →X
分解反应 一种 两种或两种以上 X→A+B+
置换反应 一种单质、一种化合物 一种单质、一种化合物 A+BC→B+AC
复分解反应 两种化合物 两种化合物 AB+CD→AD+CB
基本反应类型的比较
2Mg+O2
2MgO
点燃
2H2O2
2H2O+O2↑
MnO2
Zn+2HCl
ZnCl2+H2↑
NaOH+HCl
NaCl+H2O
欧内斯特·索尔维
E.Ernest Solvay 1838-1922
比利时工业化学家,1860年索尔维到其叔父的煤气厂工作,研究煤气废液的用途。他想从废液中提取碳酸铵,但实验失败。1861年他又用氨溶液、二氧化碳与食盐混合制成碳酸钠(称为氨碱法),但不知此反应已为前人发现过了。当年他获得比利时政府给他的专利,在布鲁塞尔开设一个小厂从事试验。1863年创办一个正式的制碱工厂,实现了氨碱法的工业化,使制碱生产实现了连续化,食盐的利用率也提高了很多。产品由于质量纯净,而被称为纯碱。
1.(2023春·黑龙江哈尔滨·九年级校考阶段练习)生活中下列做法不正确的是
A.用含有碳酸氢钠的药剂来治疗胃酸过多
B.用纯碱蒸馒头
C.用蒸馏的方法将硬水软化
D.生石灰可作袋装食品的干燥剂
【答案】C
【详解】A、碳酸氢钠能与盐酸反应生成氯化钠、二氧化碳和水,故可用含有碳酸氢钠的药剂来治疗胃酸过多,不符合题意;
B、纯碱是碳酸钠的俗称,碳酸钠能与发酵过程中产生的酸性物质反应生成二氧化碳,可用于蒸馒头,不符合题意;
C、可溶性钙、镁化合物在加热时,能形成沉淀,故生活中常用煮沸的方法降低水的硬度,实验室常用蒸馏的方法将硬水软化,符合题意;
D、生石灰是氧化钙的俗称,氧化钙能与水反应生成氢氧化钙,可用生石灰作袋装食品的干燥剂,不符合题意。
2.(2023春·江苏扬州·九年级阶段练习)下列为某同学的笔记,其中记录正确的是
A.单质只含有一种元素,所以含一种元素的物质都是单质
B.点燃可燃性气体有可能引发爆炸,所以点燃可燃性气体前一定要先检验气体纯度
C.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
D.碳酸盐与稀盐酸反应产生气体,则能与稀盐酸反应产生气体的物质一定是碳酸盐
【答案】B
【详解】A、单质是指只含一种元素的纯净物,含一种元素的物质不一定是单质,如红磷和白磷的混合物只含磷元素,该选项不正确;
C、酸与碱反应生成盐和水的反应为中和反应,只有盐和水生成的反应不一定是中和反应,如二氧化碳和氢氧化钠反应生成碳酸钠和水,但不属于中和反应,该选项不正确;
D、酸能与碳酸盐反应生成二氧化碳气体,能与活泼金属反应生成氢气,则能与能与稀盐酸反应产生气体的物质不一定是碳酸盐,该选项不正确。
3.(2023秋·重庆沙坪坝·九年级统考期末)在家学习期间,小李利用生活用品对教材中的课外实验进行探究,下列课外实验有错误的是
A.活性炭用于净水 B.铅笔芯有导电性
C.鸡蛋壳中含有碳酸盐 D.蜡烛中含有碳元素
【答案】A
【详解】A、活性炭疏松多孔有吸附性,可以除去水中的色素和异味,可用于净水,但细沙起到过滤作用,净化程度比活性炭低,应放在活性炭的上部,错误;
4.(2023·江苏淮安·统考一模)碳酸氢钠(NaHCO3)是焙制糕点所用发酵粉主要成分之一,下列有关说法正确的是
A.NaHCO3中的阳离子为Na+
B.NaHCO3中含有3个氧原子
C.NaHCO3中碳元素和氧元素的质量比为1:3
D.NaHCO3也可用于治疗胃酸过多
【答案】D
【详解】A、碳酸氢钠由钠离子和碳酸氢根离子构成,钠离子属于阳离子,不符合题意;
B、碳酸氢钠由钠离子和碳酸氢根离子构成,不含氧原子,不符合题意;
C、碳酸氢钠中碳元素和氧元素的质量比为:12:(16×3)=1:4,不符合题意;
D、碳酸氢钠能与盐酸反应生成氯化钠、二氧化碳和水,可用于治疗胃酸过多,符合题意。
5.(2022秋·广东中山·九年级统考期末)如图中,图1是泡沫灭火器,图II、II是灭火器原理示意图,以下说法错误的是
A.当碳酸钠溶液和浓盐酸接触时,立即产生大量二氧化碳气体
B.图Ⅲ的现象是:产生大量气泡,泡沫从导管口喷出
C.碳酸钠溶液可以用块状大理石代替
D.图书、档案失火时不使用泡沫灭火器灭火
【答案】C
【详解】C、灭火器需要在短时间内产生大量二氧化碳,而碳酸钙和盐酸反应时速率较慢,所以块状碳酸钙不适用于制造灭火器,故C错误;
6.(2022春·九年级课前预习)碳酸根或碳酸氢根离子的检验方法
检验原理:组成里含有 、 的盐都能与盐酸反应生成二氧化碳气体。
(1)检验试剂:_________、_______。
(2)检验方法
向待测液中加入稀盐酸有________,且该气体能使澄清石灰水变_______,则该物质中有 或 。
【答案】
(1) 稀盐酸 澄清的石灰水
(2) 无色无味气体放出 变浑浊
碳酸钠、碳酸氢钠和碳酸钙
碳酸根离子的检验
复分解反应
俗名
化学性质
用途
课题1
生活中常见的盐
第2课时
THANKS
谢谢聆听
同课章节目录
