专题08 粗盐中可溶性杂质的去除(课件25页)-2023年中考化学二轮复习专项备考宝典(全国通用)
文档属性
| 名称 | 专题08 粗盐中可溶性杂质的去除(课件25页)-2023年中考化学二轮复习专项备考宝典(全国通用) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-09 23:06:05 | ||
图片预览



文档简介
(共21张PPT)
中考化学二轮复习
2023
专题08 粗盐中可溶性杂质的去除
专题考点了解粗盐提纯的方法和步骤01掌握离子除杂的思路和方法02掌握混合溶液中溶质的鉴别03CONTENTSwww.
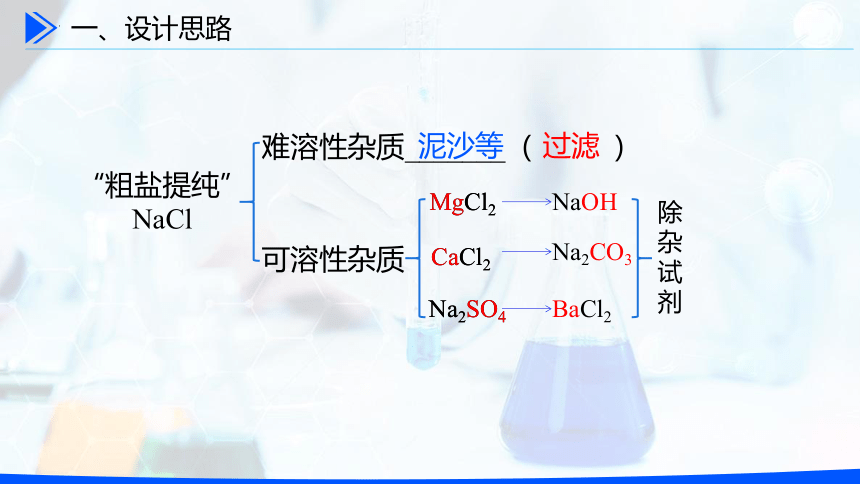
难溶性杂质_______( )
可溶性杂质
“粗盐提纯”
NaCl
MgCl2
CaCl2
Na2SO4
泥沙等
过滤
MgCl2
CaCl2
Na2SO4
NaOH
Na2CO3
BaCl2
除
杂
试
剂
一、设计思路
MgCl2+2NaOH=Mg(OH) 2↓+2NaCl
粗
盐
溶解
NaCl
MgCl2
CaCl2
Na2SO4
过量NaOH溶液
除去MgCl2
NaCl
NaOH
CaCl2
Na2SO4
BaCl2+Na2SO4=BaSO4↓+2NaCl
过量BaCl2溶液
除去Na2SO4
CaCl2+Na2CO3=CaCO3↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl
过量Na2CO3溶液
除去CaCl2和BaCl2
NaCl
NaOH
Na2CO3
过滤
滤液
滤渣
Mg(OH) 2↓
BaSO4↓
CaCO3↓
BaCO3↓
向滤液中加适量稀盐酸
除去NaOH和Na2CO3
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaCl
溶液
蒸发
精盐
操作①
操作②
操作③
NaCl
MgCl2
CaCl2
Na2SO4
NaCl
NaOH
CaCl2
Na2SO4
NaCl
NaOH
Na2CO3
NaCl
NaOH
BaCl2
CaCl2
NaCl
NaOH
BaCl2
CaCl2
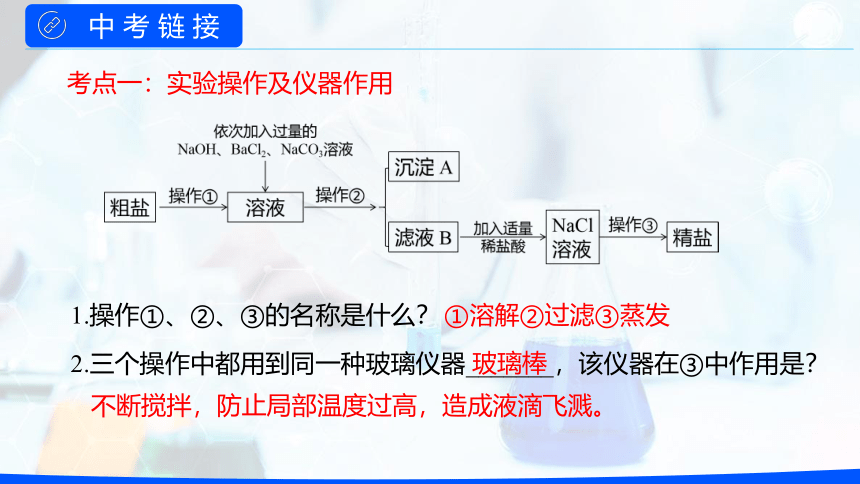
二、设计流程
1.操作①、②、③的名称是什么?
2.三个操作中都用到同一种玻璃仪器_______,该仪器在③中作用是?
考点一:实验操作及仪器作用
①溶解②过滤③蒸发
玻璃棒
不断搅拌,防止局部温度过高,造成液滴飞溅。
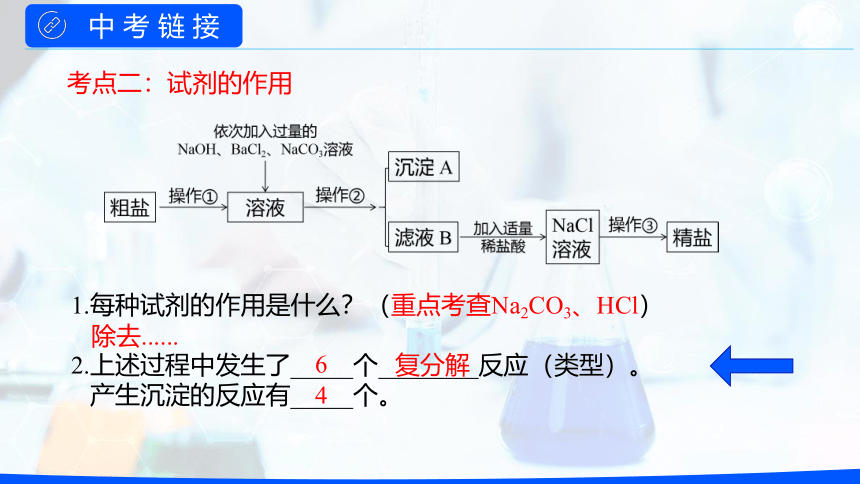
1.每种试剂的作用是什么?(重点考查Na2CO3、HCl)
2.上述过程中发生了_____个________反应(类型)。
产生沉淀的反应有_____个。
除去......
6
复分解
4
考点二:试剂的作用
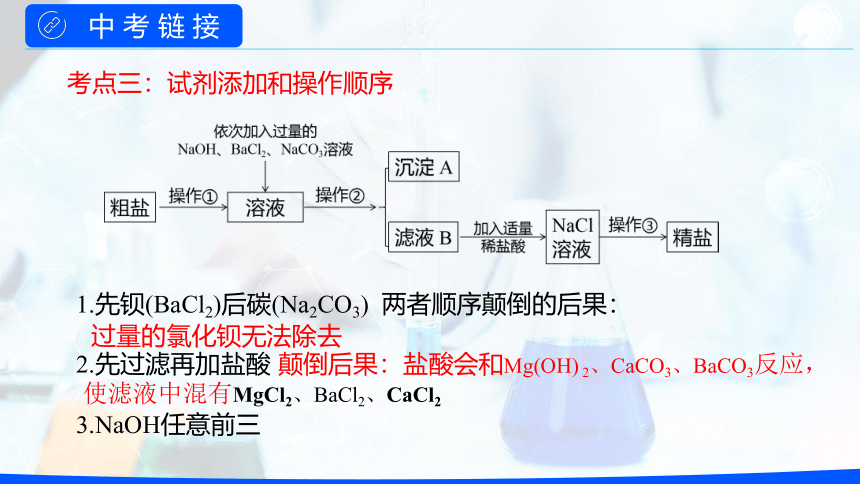
1.先钡(BaCl2)后碳(Na2CO3) 两者顺序颠倒的后果:
2.先过滤再加盐酸
3.NaOH任意前三
过量的氯化钡无法除去
颠倒后果:盐酸会和Mg(OH) 2、CaCO3、BaCO3反应,
使滤液中混有MgCl2、BaCl2、CaCl2
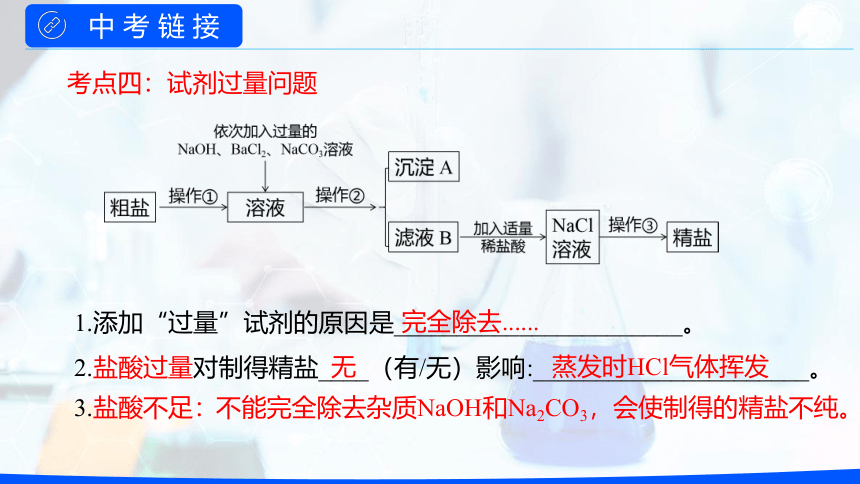
考点三:试剂添加和操作顺序
1.添加“过量”试剂的原因是_______________________。
2.盐酸过量对制得精盐____(有/无)影响:______________________。
完全除去......
无
蒸发时HCl气体挥发
3.盐酸不足:
不能完全除去杂质NaOH和Na2CO3,会使制得的精盐不纯。
考点四:试剂过量问题
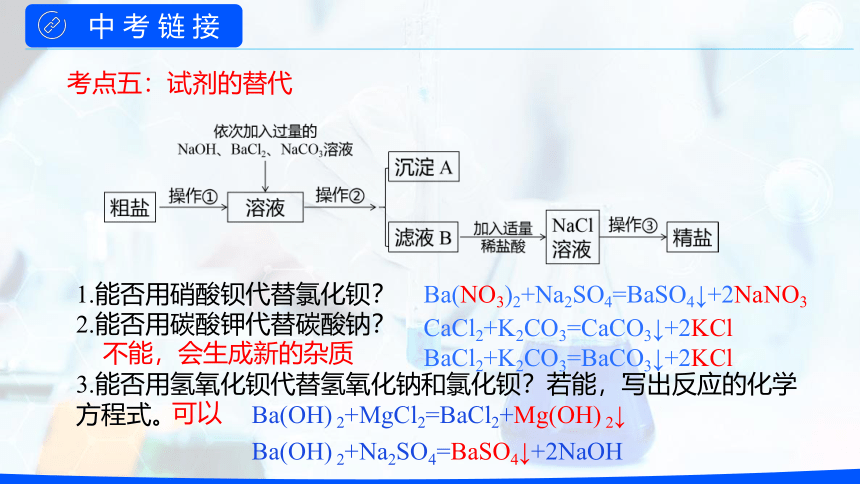
1.能否用硝酸钡代替氯化钡?
2.能否用碳酸钾代替碳酸钠?
3.能否用氢氧化钡代替氢氧化钠和氯化钡?若能,写出反应的化学方程式。
不能,会生成新的杂质
可以
Ba(OH) 2+MgCl2=BaCl2+Mg(OH) 2↓
Ba(OH) 2+Na2SO4=BaSO4↓+2NaOH
Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3
CaCl2+K2CO3=CaCO3↓+2KCl
BaCl2+K2CO3=BaCO3↓+2KCl
考点五:试剂的替代
Mg(OH) 2、BaSO4、CaCO3、BaCO3
溶质:NaCl、NaOH、Na2CO3
杂质:NaOH、Na2CO3
反应生成了氯化钠
1.过滤后的沉淀有哪些?(提示:根据除杂试剂去推断)
2.滤液中溶质有哪些?滤液中杂质有哪些?如何检验杂质成分?
3.最终得到精盐中的氯化钠可能比原粗盐中含有的氯化钠要多,原因?
考点六:溶质和固体成分的判断
1. “粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的NaOH、BaCl2、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
不断搅拌,防止局部温度过高,液滴飞溅
除去CaCl2和BaCl2
过滤后加入稀盐酸除去过量的NaOH和Na2CO3
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入Na2CO3溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充
2.食盐水中含有杂质CaCl2和Na2SO4,依次加入过量BaCl2和Na2CO3溶液后过滤,滤液中溶质为______________;过滤所用玻璃仪器有烧杯、玻璃棒和_______。
漏斗
Na2CO3和NaCl
3.除去食盐水中的CaCl2 和Na2SO4杂质的操作有:①加过量BaCl2溶液;②过滤;③加过量Na2CO3溶液;④蒸发结晶;⑤加适量盐酸。下列操作顺序正确的是( )
A.③①②⑤④ B.①⑤③②④
C.①③⑤④② D. ①③②⑤④
D
(1)以上操作合理的先后顺序为_____________(序号不重复使用)。
(2)请写出BaCl2溶液与Na2SO4溶液反应的化学方程式。
(3)上述试剂中Na2CO3不能用K2CO3代替,请说明原因。
①②⑤③④
/②①⑤③④
/②⑤①③④
BaCl2+Na2SO4=BaSO4↓+2NaCl
会生成新的杂质(KCl)
4.除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。[Mg(OH)2 、BaSO4、BaCO3难溶于水]
(1)以上操作中所发生的复分解反应共有____个。
(2)操作①、③、⑤要用到同一种玻璃仪器,该仪器在操作⑤中的作用是什么?
(3)请设计实验方案证明操作③所得溶液中含有NaOH。(写出实验步骤和现象)
6
不断搅拌,防止局部温度过高,液滴飞溅
5.为了除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。[提示:Mg(OH)2、BaSO4、BaCO3难溶于水;微溶物不形成沉淀;Na2CO3溶液呈碱性]
6.为除去粗盐水中的可溶性杂质MgSO4、CaCl2,设计以下方案:
①过滤用到的玻璃仪器有烧杯、玻璃棒和_______________。
②该过程中一共发生了______个复分解反应。
③写出加入Ba(OH)2溶液时反应的化学方程式。(提示:微溶物不形成沉淀)
④溶液X中含哪些杂质 请设计实验加以证明。(简要写出实验步骤和现象)
漏斗
5
MgSO4+Ba(OH)2=BaSO4↓+Mg(OH) 2↓
Na2CO3和NaOH
(1)溶解,过滤、蒸发操作中都要用到的一种玻璃仪器是 。
(2)写出一个加入Na2CO3溶液时所发生反应的化学方程式。
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含哪些杂质 (BaSO4不溶于水,也不溶于酸)
玻璃棒
CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2、MgCl2和BaCl2
7.为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。
8.氯化钠是生活中常见的盐,为除去某粗盐水中的MgSO4、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________(写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
玻璃棒
Na2CO3和NaOH
在溶液乙中加入适量稀盐酸
9.实验室除去粗食盐中难溶性杂质的主要实验步骤有:溶解、_______、蒸发;除去粗食盐水中的杂质CaCl2、 MgCl2、 Na2SO4,可依次加入过量NaOH、_______、Na2CO3溶液,分离出沉淀后,再加入适量盐酸,其作用是_____________________。
过滤
BaCl2
除去NaOH和Na2CO3
9.(2022·河南)食盐(主要成分是氯化钠)除可用作调味品外,还是一种重要 化工原料。晾晒海水所得的粗盐中含有不溶性杂质(泥沙)和可溶性杂质(CaCl2、MgCl2、Na2SO4)。下图是某化学小组在实验室对粗盐样品进行除杂、提纯的过程。
(3)
①溶解、过滤、蒸发操作中都需要用到的一种玻璃仪器为________(填“烧杯”、“漏斗” 或“玻璃棒”)。
玻璃棒
②固体甲中所含难溶性物质为 BaSO4、 、CaCO3 和 BaCO3。
③请设计实验验证溶液乙中所含的溶质。(简要叙述实验步骤及现象)
Mg(OH)2
取少许待测液于试管,加入足量的BaCl2(或CaCl2)溶液,有白色沉淀产生,静置,取上层清液滴加酚酞溶液,溶液变红,则溶液乙含有的杂质为Na2CO3、NaOH。
Have a rest
中考化学二轮复习
2023
专题08 粗盐中可溶性杂质的去除
专题考点了解粗盐提纯的方法和步骤01掌握离子除杂的思路和方法02掌握混合溶液中溶质的鉴别03CONTENTSwww.
难溶性杂质_______( )
可溶性杂质
“粗盐提纯”
NaCl
MgCl2
CaCl2
Na2SO4
泥沙等
过滤
MgCl2
CaCl2
Na2SO4
NaOH
Na2CO3
BaCl2
除
杂
试
剂
一、设计思路
MgCl2+2NaOH=Mg(OH) 2↓+2NaCl
粗
盐
溶解
NaCl
MgCl2
CaCl2
Na2SO4
过量NaOH溶液
除去MgCl2
NaCl
NaOH
CaCl2
Na2SO4
BaCl2+Na2SO4=BaSO4↓+2NaCl
过量BaCl2溶液
除去Na2SO4
CaCl2+Na2CO3=CaCO3↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl
过量Na2CO3溶液
除去CaCl2和BaCl2
NaCl
NaOH
Na2CO3
过滤
滤液
滤渣
Mg(OH) 2↓
BaSO4↓
CaCO3↓
BaCO3↓
向滤液中加适量稀盐酸
除去NaOH和Na2CO3
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaCl
溶液
蒸发
精盐
操作①
操作②
操作③
NaCl
MgCl2
CaCl2
Na2SO4
NaCl
NaOH
CaCl2
Na2SO4
NaCl
NaOH
Na2CO3
NaCl
NaOH
BaCl2
CaCl2
NaCl
NaOH
BaCl2
CaCl2
二、设计流程
1.操作①、②、③的名称是什么?
2.三个操作中都用到同一种玻璃仪器_______,该仪器在③中作用是?
考点一:实验操作及仪器作用
①溶解②过滤③蒸发
玻璃棒
不断搅拌,防止局部温度过高,造成液滴飞溅。
1.每种试剂的作用是什么?(重点考查Na2CO3、HCl)
2.上述过程中发生了_____个________反应(类型)。
产生沉淀的反应有_____个。
除去......
6
复分解
4
考点二:试剂的作用
1.先钡(BaCl2)后碳(Na2CO3) 两者顺序颠倒的后果:
2.先过滤再加盐酸
3.NaOH任意前三
过量的氯化钡无法除去
颠倒后果:盐酸会和Mg(OH) 2、CaCO3、BaCO3反应,
使滤液中混有MgCl2、BaCl2、CaCl2
考点三:试剂添加和操作顺序
1.添加“过量”试剂的原因是_______________________。
2.盐酸过量对制得精盐____(有/无)影响:______________________。
完全除去......
无
蒸发时HCl气体挥发
3.盐酸不足:
不能完全除去杂质NaOH和Na2CO3,会使制得的精盐不纯。
考点四:试剂过量问题
1.能否用硝酸钡代替氯化钡?
2.能否用碳酸钾代替碳酸钠?
3.能否用氢氧化钡代替氢氧化钠和氯化钡?若能,写出反应的化学方程式。
不能,会生成新的杂质
可以
Ba(OH) 2+MgCl2=BaCl2+Mg(OH) 2↓
Ba(OH) 2+Na2SO4=BaSO4↓+2NaOH
Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3
CaCl2+K2CO3=CaCO3↓+2KCl
BaCl2+K2CO3=BaCO3↓+2KCl
考点五:试剂的替代
Mg(OH) 2、BaSO4、CaCO3、BaCO3
溶质:NaCl、NaOH、Na2CO3
杂质:NaOH、Na2CO3
反应生成了氯化钠
1.过滤后的沉淀有哪些?(提示:根据除杂试剂去推断)
2.滤液中溶质有哪些?滤液中杂质有哪些?如何检验杂质成分?
3.最终得到精盐中的氯化钠可能比原粗盐中含有的氯化钠要多,原因?
考点六:溶质和固体成分的判断
1. “粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的NaOH、BaCl2、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
不断搅拌,防止局部温度过高,液滴飞溅
除去CaCl2和BaCl2
过滤后加入稀盐酸除去过量的NaOH和Na2CO3
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入Na2CO3溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充
2.食盐水中含有杂质CaCl2和Na2SO4,依次加入过量BaCl2和Na2CO3溶液后过滤,滤液中溶质为______________;过滤所用玻璃仪器有烧杯、玻璃棒和_______。
漏斗
Na2CO3和NaCl
3.除去食盐水中的CaCl2 和Na2SO4杂质的操作有:①加过量BaCl2溶液;②过滤;③加过量Na2CO3溶液;④蒸发结晶;⑤加适量盐酸。下列操作顺序正确的是( )
A.③①②⑤④ B.①⑤③②④
C.①③⑤④② D. ①③②⑤④
D
(1)以上操作合理的先后顺序为_____________(序号不重复使用)。
(2)请写出BaCl2溶液与Na2SO4溶液反应的化学方程式。
(3)上述试剂中Na2CO3不能用K2CO3代替,请说明原因。
①②⑤③④
/②①⑤③④
/②⑤①③④
BaCl2+Na2SO4=BaSO4↓+2NaCl
会生成新的杂质(KCl)
4.除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。[Mg(OH)2 、BaSO4、BaCO3难溶于水]
(1)以上操作中所发生的复分解反应共有____个。
(2)操作①、③、⑤要用到同一种玻璃仪器,该仪器在操作⑤中的作用是什么?
(3)请设计实验方案证明操作③所得溶液中含有NaOH。(写出实验步骤和现象)
6
不断搅拌,防止局部温度过高,液滴飞溅
5.为了除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。[提示:Mg(OH)2、BaSO4、BaCO3难溶于水;微溶物不形成沉淀;Na2CO3溶液呈碱性]
6.为除去粗盐水中的可溶性杂质MgSO4、CaCl2,设计以下方案:
①过滤用到的玻璃仪器有烧杯、玻璃棒和_______________。
②该过程中一共发生了______个复分解反应。
③写出加入Ba(OH)2溶液时反应的化学方程式。(提示:微溶物不形成沉淀)
④溶液X中含哪些杂质 请设计实验加以证明。(简要写出实验步骤和现象)
漏斗
5
MgSO4+Ba(OH)2=BaSO4↓+Mg(OH) 2↓
Na2CO3和NaOH
(1)溶解,过滤、蒸发操作中都要用到的一种玻璃仪器是 。
(2)写出一个加入Na2CO3溶液时所发生反应的化学方程式。
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含哪些杂质 (BaSO4不溶于水,也不溶于酸)
玻璃棒
CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2、MgCl2和BaCl2
7.为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。
8.氯化钠是生活中常见的盐,为除去某粗盐水中的MgSO4、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________(写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
玻璃棒
Na2CO3和NaOH
在溶液乙中加入适量稀盐酸
9.实验室除去粗食盐中难溶性杂质的主要实验步骤有:溶解、_______、蒸发;除去粗食盐水中的杂质CaCl2、 MgCl2、 Na2SO4,可依次加入过量NaOH、_______、Na2CO3溶液,分离出沉淀后,再加入适量盐酸,其作用是_____________________。
过滤
BaCl2
除去NaOH和Na2CO3
9.(2022·河南)食盐(主要成分是氯化钠)除可用作调味品外,还是一种重要 化工原料。晾晒海水所得的粗盐中含有不溶性杂质(泥沙)和可溶性杂质(CaCl2、MgCl2、Na2SO4)。下图是某化学小组在实验室对粗盐样品进行除杂、提纯的过程。
(3)
①溶解、过滤、蒸发操作中都需要用到的一种玻璃仪器为________(填“烧杯”、“漏斗” 或“玻璃棒”)。
玻璃棒
②固体甲中所含难溶性物质为 BaSO4、 、CaCO3 和 BaCO3。
③请设计实验验证溶液乙中所含的溶质。(简要叙述实验步骤及现象)
Mg(OH)2
取少许待测液于试管,加入足量的BaCl2(或CaCl2)溶液,有白色沉淀产生,静置,取上层清液滴加酚酞溶液,溶液变红,则溶液乙含有的杂质为Na2CO3、NaOH。
Have a rest
同课章节目录
