必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸›
文档属性
| 名称 | 必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸› |  | |
| 格式 | zip | ||
| 文件大小 | 259.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-05-18 15:42:54 | ||
图片预览







文档简介
(共27张PPT)
第四节
氨
硝酸
硫酸
德国物理化学家。是合成氨法的发明者。因发明用氮气和氢气直接合成氨的方法,
获1918年诺贝尔化学奖金
1918年诺贝尔化学奖
哈伯,F.
Fritz
Haber
1868~1934
1931年诺贝尔化学奖
柏吉斯,F?
Friedrich
Bergius
1884~1949
德国燃料化学家.
博施(Carl
lBosch),德国化学工程专家。
将哈伯的合成氨研究成果付诸实施于大规模的工业化生产,发展了哈伯的研究成果。他用了5年的时间,进行了上万次的试验,才确定了适合于合成氨用的催化剂。他研制建造了能耐高温和高压并能长期使用和操作简便的合成氨装置。
组卷网
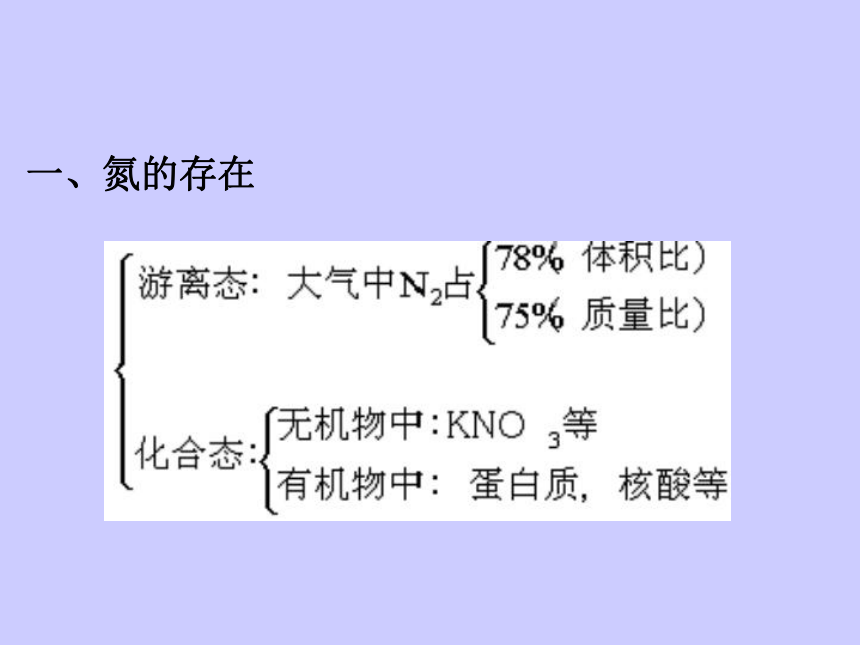
一、氮的存在
1.定义:将游离的氮(N2)转变为氮的化合物的过程
2.方法:
二、氮的固定
喷泉实验
烧杯里的液体由玻璃管进入烧瓶,形成美
丽的喷泉;烧瓶中的液体呈 ? 。
①氨气极易溶于水(1∶700)
。使烧瓶内
气压急剧下降。
②氨气水溶液呈 ? 。
红色
碱性
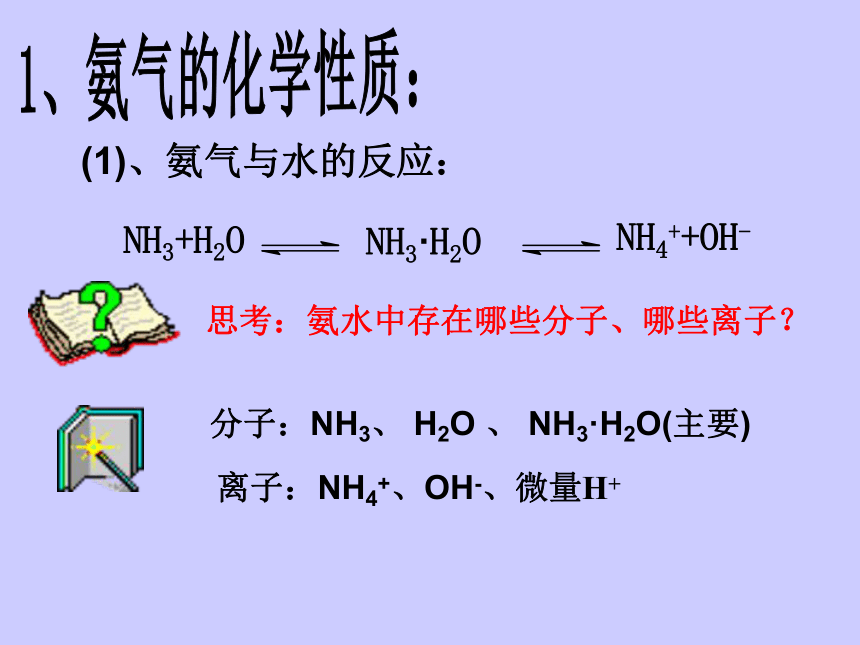
(1)、氨气与水的反应:
离子:NH4+、OH-、微量H+
氨水的性质
①弱电解质:
②易挥发,不稳定,易分解
保存:棕色试剂瓶、密封
⑵NH3与酸的反应
NH3
+
HCl
=
NH4Cl
(白烟)
现象:产生大量白烟
【实验】用玻璃棒蘸浓氨水,与蘸有浓盐酸的玻璃棒靠近,有何现象?为什么?
NH3+HNO3=NH4NO3
2NH3+H2SO4=(NH4)2SO4
4NH3+5O2
=
4NO+6H2O
催化剂
△
(3)
NH3
的还原性
-3
②铵盐受热易分解
NH4Cl
==
NH3
↑
+
HCl
↑
NH4HCO3
==
NH3↑
+
CO2↑+
H2O↑
△
△
一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
③铵盐与碱反应放出氨气
(NH4)2SO4
+
2NaOH
==
2NH3
↑+
Na2SO4
+
2H2O
△
实质:
NH4+
+
OH-
==
NH3
↑
+
H2O
△
2、铵盐
①铵盐都易溶于水
(3)装置:
固+固加热型
(4)收集:
向下排空气法
(5)验满:
湿润的红色石蕊试纸变蓝;
(常见唯一的碱性气体)
(与氧气的制取装置相同)
(6)尾气吸收:
稀硫酸溶液
(1)试剂:
氯化铵晶体、消石灰固体
(2)原理:
2NH4Cl+Ca(OH)2
=
CaCl2+2H2O+2NH3↑
3.氨的实验室制法
?棉花的作用:
防止空气对流,提高集气的速度和纯度。
?干燥氨气的常用试剂:
CaO、碱石灰等碱性干燥剂
注意:无水CaCl2不能干燥NH3(形成CaCl2·
8NH3)
?实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法
②浓氨水加生石灰法
(生石灰吸水、溶解时放热)
氨的用途
制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料
致冷剂
氨的用途
氨是制硝酸的重要原料,如果以氨气、空气、水为原料,如何实现由氨到硝酸的转化?
求助:
自救
互救
逃生
刺激性气味气体
液氨气化时吸收大量热
极易溶于水
比空气密度小
易液化
氨水溶液显碱性
依据性质
二、硫酸和硝酸的氧化性
酸的通性:
1)与指示剂作用
2)与活泼金属反应
3)与碱性氧化物反应
4)与碱反应
5)与某些盐反应
浓硫酸
浓H2SO4的物理性质
A.色态:无色、粘稠的油状液体
B.沸点:约338℃——难挥发酸(高沸点酸)
C.密度:1.84g/cm3——高密度酸
D.溶解性:跟水任意比互溶,溶解放出大量热。
[思考]
浓硫酸应如何稀释?
用于制易挥发
酸,如盐酸。
浓H2SO4的特性
吸水性
浓硫酸能够吸收现成的由水分子组成的水——物质本身含水。
应用:做干燥剂
不能干燥
碱性气体:NH3
还原性气体:H2S
脱水性(蔗糖炭化实验)
将有机物中H、O原子按2:1的比例脱去——物质本身不含水
A.与金属单质反应(实验4-9)
强氧化性
a)加热时,绝大多数金属(Au、Pt除外)
能被浓硫酸氧化。
△
Cu+2H2SO4(浓)=
CuSO4+SO2↑+2H2O
浓硫酸表现强氧化性、酸性
b)在常温下,使铝、铁等金属钝化。
钝化是因为形成了致密、坚固的氧化物薄膜,
应用:常温下,用Fe、Al制容器来盛装浓硫酸。
B.与非金属单质反应
2H2SO4(浓)+C
=
2H2O+2SO2↑+CO2↑
△
硫酸的用途
浓硝酸
(1)不稳定性:
密封于棕色瓶中,并放在阴暗处!
保存:
久置浓硝酸为什么呈黄色?
久置硝酸分解产生的NO2溶于溶液中,使得溶液变黄!
(2)强氧化性
稀硝酸和浓硝酸都有强氧化性
Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O
A.与金属(除Au、Pt外)反应:
HNO3的作用:
酸性、氧化性
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
硝酸的用途
B.与非金属反应
是重要的化工原料,也是化学实验室里必备的重要试剂。在工业上可用于制化肥、农药、炸药、染料、盐类等。
第四节
氨
硝酸
硫酸
德国物理化学家。是合成氨法的发明者。因发明用氮气和氢气直接合成氨的方法,
获1918年诺贝尔化学奖金
1918年诺贝尔化学奖
哈伯,F.
Fritz
Haber
1868~1934
1931年诺贝尔化学奖
柏吉斯,F?
Friedrich
Bergius
1884~1949
德国燃料化学家.
博施(Carl
lBosch),德国化学工程专家。
将哈伯的合成氨研究成果付诸实施于大规模的工业化生产,发展了哈伯的研究成果。他用了5年的时间,进行了上万次的试验,才确定了适合于合成氨用的催化剂。他研制建造了能耐高温和高压并能长期使用和操作简便的合成氨装置。
组卷网
一、氮的存在
1.定义:将游离的氮(N2)转变为氮的化合物的过程
2.方法:
二、氮的固定
喷泉实验
烧杯里的液体由玻璃管进入烧瓶,形成美
丽的喷泉;烧瓶中的液体呈 ? 。
①氨气极易溶于水(1∶700)
。使烧瓶内
气压急剧下降。
②氨气水溶液呈 ? 。
红色
碱性
(1)、氨气与水的反应:
离子:NH4+、OH-、微量H+
氨水的性质
①弱电解质:
②易挥发,不稳定,易分解
保存:棕色试剂瓶、密封
⑵NH3与酸的反应
NH3
+
HCl
=
NH4Cl
(白烟)
现象:产生大量白烟
【实验】用玻璃棒蘸浓氨水,与蘸有浓盐酸的玻璃棒靠近,有何现象?为什么?
NH3+HNO3=NH4NO3
2NH3+H2SO4=(NH4)2SO4
4NH3+5O2
=
4NO+6H2O
催化剂
△
(3)
NH3
的还原性
-3
②铵盐受热易分解
NH4Cl
==
NH3
↑
+
HCl
↑
NH4HCO3
==
NH3↑
+
CO2↑+
H2O↑
△
△
一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
③铵盐与碱反应放出氨气
(NH4)2SO4
+
2NaOH
==
2NH3
↑+
Na2SO4
+
2H2O
△
实质:
NH4+
+
OH-
==
NH3
↑
+
H2O
△
2、铵盐
①铵盐都易溶于水
(3)装置:
固+固加热型
(4)收集:
向下排空气法
(5)验满:
湿润的红色石蕊试纸变蓝;
(常见唯一的碱性气体)
(与氧气的制取装置相同)
(6)尾气吸收:
稀硫酸溶液
(1)试剂:
氯化铵晶体、消石灰固体
(2)原理:
2NH4Cl+Ca(OH)2
=
CaCl2+2H2O+2NH3↑
3.氨的实验室制法
?棉花的作用:
防止空气对流,提高集气的速度和纯度。
?干燥氨气的常用试剂:
CaO、碱石灰等碱性干燥剂
注意:无水CaCl2不能干燥NH3(形成CaCl2·
8NH3)
?实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法
②浓氨水加生石灰法
(生石灰吸水、溶解时放热)
氨的用途
制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料
致冷剂
氨的用途
氨是制硝酸的重要原料,如果以氨气、空气、水为原料,如何实现由氨到硝酸的转化?
求助:
自救
互救
逃生
刺激性气味气体
液氨气化时吸收大量热
极易溶于水
比空气密度小
易液化
氨水溶液显碱性
依据性质
二、硫酸和硝酸的氧化性
酸的通性:
1)与指示剂作用
2)与活泼金属反应
3)与碱性氧化物反应
4)与碱反应
5)与某些盐反应
浓硫酸
浓H2SO4的物理性质
A.色态:无色、粘稠的油状液体
B.沸点:约338℃——难挥发酸(高沸点酸)
C.密度:1.84g/cm3——高密度酸
D.溶解性:跟水任意比互溶,溶解放出大量热。
[思考]
浓硫酸应如何稀释?
用于制易挥发
酸,如盐酸。
浓H2SO4的特性
吸水性
浓硫酸能够吸收现成的由水分子组成的水——物质本身含水。
应用:做干燥剂
不能干燥
碱性气体:NH3
还原性气体:H2S
脱水性(蔗糖炭化实验)
将有机物中H、O原子按2:1的比例脱去——物质本身不含水
A.与金属单质反应(实验4-9)
强氧化性
a)加热时,绝大多数金属(Au、Pt除外)
能被浓硫酸氧化。
△
Cu+2H2SO4(浓)=
CuSO4+SO2↑+2H2O
浓硫酸表现强氧化性、酸性
b)在常温下,使铝、铁等金属钝化。
钝化是因为形成了致密、坚固的氧化物薄膜,
应用:常温下,用Fe、Al制容器来盛装浓硫酸。
B.与非金属单质反应
2H2SO4(浓)+C
=
2H2O+2SO2↑+CO2↑
△
硫酸的用途
浓硝酸
(1)不稳定性:
密封于棕色瓶中,并放在阴暗处!
保存:
久置浓硝酸为什么呈黄色?
久置硝酸分解产生的NO2溶于溶液中,使得溶液变黄!
(2)强氧化性
稀硝酸和浓硝酸都有强氧化性
Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O
A.与金属(除Au、Pt外)反应:
HNO3的作用:
酸性、氧化性
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
硝酸的用途
B.与非金属反应
是重要的化工原料,也是化学实验室里必备的重要试剂。在工业上可用于制化肥、农药、炸药、染料、盐类等。
