第二节 氨 铵盐
图片预览








文档简介
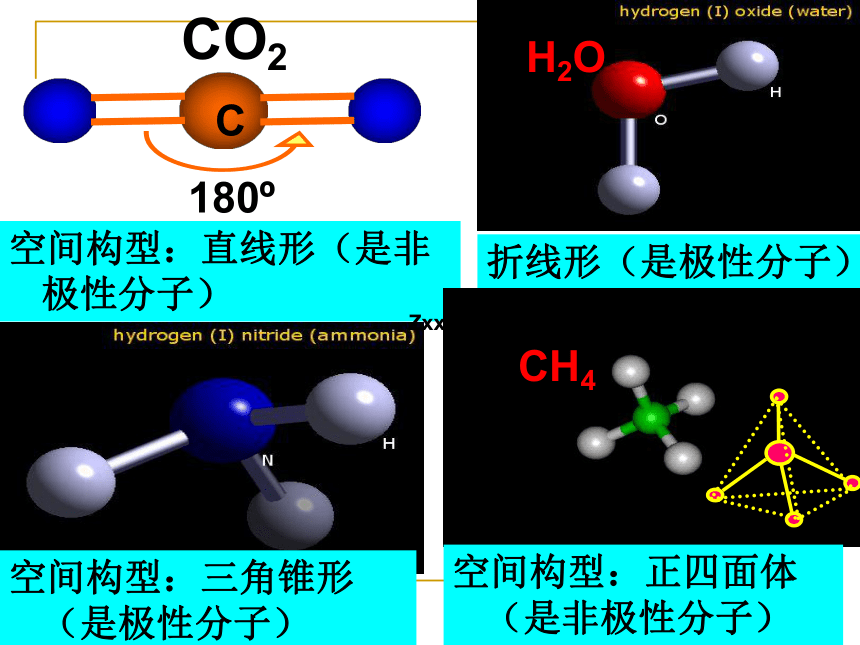
课件25张PPT。 历史上德国有位化学家叫哈伯,有人称他为天使,也有人称他为魔鬼。称他为天使是因为在1909年哈伯合成了氨,氨能合成化肥,进而使粮食增产,像天使一样给人类带来了丰收的喜悦;称他为魔鬼是第一世界大战时,哈伯已为德国建成了无数个合成氨工厂,氨能合成炸药,像魔鬼一样给人类带来了灾难和痛苦。同时,哈伯还是开毒气战先河的战争魔鬼。但不管怎样,人工合成氨的成功对工业、农业和科技的重大意义是不言而喻的,因此哈伯在1918年获得了诺贝尔化学奖,氨也被评为20世纪初的明星分子 。第二节 氨 铵盐氨气泄漏 2004年4月20日上午10时,杭州市一制冷车间液氨储存罐破裂,造成大量氨气泄露,整个厂区被一片白雾笼罩,厂区内寒气逼人。空气中弥漫着一股浓烈的刺激性气味,令人眼睛刺痛,连呼吸都感到困难。消防员赶到后,马上展开了救援工作……事故发生后,消防员向现场喷洒了大量的水。学科网1.物理性质颜色、状态:气味、毒性:一、氨水溶性:无色气体刺激性气味、有毒极易溶于水(1:700)密度:比空气小(致冷剂)2.氨的分子结构:电子式:结构式:三角锥形空间构型:化学式:NH3NH3为极性分子组卷网非极性分子:正负电荷重心重合的分子。极性分子:分子的极性正负电荷重心不重合的分子。一、概念:空间构型:直线形(是非极性分子)H2O折线形(是极性分子)空间构型:三角锥形(是极性分子)CH4空间构型:正四面体(是非极性分子) Zxxk非极性分子:正负电荷重心重合的分子。极性分子:分子的极性正负电荷重心不重合的分子。一、概念:三、分子极性的判断:X2型分子(如H2、O2、N2、Cl2等)XYn型分子,如CH4、CCl4(正四面体形)、
CO2、CS2(直线形)等XY型分子(如HCl、CO、NO等)XYn型分子,如H2O、H2S(折线形)
NH3、PH3(三角锥形)等二、键的极性与分子极性的关系练习: 分析下列分子中,键的极性和分子极性
(1)Cl2、H2 、 N2、HCl
(2)CO2、 H2O 、 NH3
(3)CH4、CCl4 、 CH3Cl请分析键的极性和分子的极性的关系以非极性键结合成的双原子分子都是非极性分子。 如:H2、O2、Cl2、N2等以极性键结合成的双原子分子都是极性分子。
如:HCl、CO、HBr等以极性键结合成的多原子分子可能是极性分子,也可能是非极性分子,这取决于分子中各键的空间排列。3.NH3化学性质(1)NH3和水反应 思考:做喷泉实验时
1.为什么烧瓶内会形成喷泉?
2.从胶头滴管里挤出的少量水有何作用?
3.烧杯的溶液为什么会变红?
4.实验中的现象说明氨具有哪些性质?
5.若将NH3换成CO2或O2,能做成喷泉实验吗?
如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开止水夹,烧杯中的液体b呈喷泉状喷出,则a、b可能是:( ?)
A、a为HCl气体,b为H2O
B、 a为CO2气体,b为浓NaOH溶液
C、a为Cl2气体,b为饱和NaCl溶液
D、a为Cl2气体,b为浓NaOH溶液abABD??练习:b探讨:若改为单孔塞,能否引发喷泉实验?如何能使NH3和水接触呢?(用热毛巾敷烧瓶,使导管中的空气排出,氨气与水即可接触,从而引发喷泉。)⑴ NH3与水的反应 ②氨水中的微粒:3种分子:H2O、NH3、 NH3·H2O3种离子:NH4+、OH- 、H+③氨水的溶质若写化学方程式,则用NH3·H2O表示氨水;若计算氨水浓度,则以溶入的NH3 的量计算。①氨气是一种 气体,能使湿润的红色的石蕊试纸____,这是氨气的检验方法之一。变蓝碱性3.NH3化学性质⑵ 氨与酸的反应NH3 + HCl ==NH4Cl3.NH3化学性质(大量白烟)(此为氨气检验方法之二)将氨气通入硝酸或硫酸中,写出反应的方程式:NH3 + HNO3 ==NH4NO32NH3 + H2SO4 ==(NH4)2SO4NH3 + HCl == NH4Cl实质:NH3 +H+ =NH4+利用该性质工业上可制氮肥氨和酸发生反应的过程:HNH3 + H+ = NH4+⑵ 氨与酸的反应NH3 + HCl ==NH4Cl3.NH3化学性质(大量白烟)(此为氨气检验方法之二)氨和酸反应实质:NH3 + H+ = NH4+思考:氨气是否与所有的酸反应都有白烟生成呢?结论:氨气与挥发性酸(盐酸、硝酸等)反应才有白烟生成⑵ 氨与酸的反应NH3 + HCl ==NH4Cl3.NH3化学性质(大量白烟)(此为氨气检验方法之二)氨和酸反应实质:NH3 + H+ = NH4+⑶氨与氧气的反应(氨的催化氧化,是工业制硝酸的基础)4.NH3的用途氨气用途制氮肥
铵盐有机合成
工业原料
制硝酸
致冷剂 二、铵盐:铵盐均为无色或白色晶体,易溶于水,属离子化合物2.化学性质NH4HCO3 NH3↑ + CO2 ↑+ H2O(NH4)2CO3 2NH3↑ + CO2 ↑+ H2ONH4Cl NH3↑ + HCl↑注意:铵盐分解不一定产生氨气1.物理性质1)不稳定性,受热易分解2)与强碱共热产生氨气NH4NO3+ NaOH NaNO3 + NH3 ↑+ H2O (NH4)2SO4 + 2NaOH Na2SO4+ 2NH3 ↑+ 2H2O 实质: NH4+ + OH- NH3 ↑ + H2O 3.铵盐(NH4+)的检验检验方法:1)先将其与强碱共热逸出NH3
2)用红色石蕊试纸或浓盐酸检验逸出的氨气4.氨气的实验室制法原理:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3 ↑+ 2H2O 装置:收集:干燥验满:(1)用湿润的红色石蕊试纸(变蓝)(2)蘸有浓盐酸的玻璃棒接近瓶口 (产生白烟)工业合成氨:N2 + 3H2 2NH3 :用碱石灰(CaO 与NaOH固体混合物)只能用向下排空气法收集用氯化铵固体与消石灰混合加热吸收:用浸湿的棉花团棉花的作用: 防止氨与空气对流,使收集到的氨气尽量纯净;浸有水或稀硫酸的棉花可防止氨气逸出,避免污染大气。思考题实验室中其余的制氨气的方法:①加热浓氨水法②浓氨水加生石灰或NaOH固体法
CO2、CS2(直线形)等XY型分子(如HCl、CO、NO等)XYn型分子,如H2O、H2S(折线形)
NH3、PH3(三角锥形)等二、键的极性与分子极性的关系练习: 分析下列分子中,键的极性和分子极性
(1)Cl2、H2 、 N2、HCl
(2)CO2、 H2O 、 NH3
(3)CH4、CCl4 、 CH3Cl请分析键的极性和分子的极性的关系以非极性键结合成的双原子分子都是非极性分子。 如:H2、O2、Cl2、N2等以极性键结合成的双原子分子都是极性分子。
如:HCl、CO、HBr等以极性键结合成的多原子分子可能是极性分子,也可能是非极性分子,这取决于分子中各键的空间排列。3.NH3化学性质(1)NH3和水反应 思考:做喷泉实验时
1.为什么烧瓶内会形成喷泉?
2.从胶头滴管里挤出的少量水有何作用?
3.烧杯的溶液为什么会变红?
4.实验中的现象说明氨具有哪些性质?
5.若将NH3换成CO2或O2,能做成喷泉实验吗?
如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开止水夹,烧杯中的液体b呈喷泉状喷出,则a、b可能是:( ?)
A、a为HCl气体,b为H2O
B、 a为CO2气体,b为浓NaOH溶液
C、a为Cl2气体,b为饱和NaCl溶液
D、a为Cl2气体,b为浓NaOH溶液abABD??练习:b探讨:若改为单孔塞,能否引发喷泉实验?如何能使NH3和水接触呢?(用热毛巾敷烧瓶,使导管中的空气排出,氨气与水即可接触,从而引发喷泉。)⑴ NH3与水的反应 ②氨水中的微粒:3种分子:H2O、NH3、 NH3·H2O3种离子:NH4+、OH- 、H+③氨水的溶质若写化学方程式,则用NH3·H2O表示氨水;若计算氨水浓度,则以溶入的NH3 的量计算。①氨气是一种 气体,能使湿润的红色的石蕊试纸____,这是氨气的检验方法之一。变蓝碱性3.NH3化学性质⑵ 氨与酸的反应NH3 + HCl ==NH4Cl3.NH3化学性质(大量白烟)(此为氨气检验方法之二)将氨气通入硝酸或硫酸中,写出反应的方程式:NH3 + HNO3 ==NH4NO32NH3 + H2SO4 ==(NH4)2SO4NH3 + HCl == NH4Cl实质:NH3 +H+ =NH4+利用该性质工业上可制氮肥氨和酸发生反应的过程:HNH3 + H+ = NH4+⑵ 氨与酸的反应NH3 + HCl ==NH4Cl3.NH3化学性质(大量白烟)(此为氨气检验方法之二)氨和酸反应实质:NH3 + H+ = NH4+思考:氨气是否与所有的酸反应都有白烟生成呢?结论:氨气与挥发性酸(盐酸、硝酸等)反应才有白烟生成⑵ 氨与酸的反应NH3 + HCl ==NH4Cl3.NH3化学性质(大量白烟)(此为氨气检验方法之二)氨和酸反应实质:NH3 + H+ = NH4+⑶氨与氧气的反应(氨的催化氧化,是工业制硝酸的基础)4.NH3的用途氨气用途制氮肥
铵盐有机合成
工业原料
制硝酸
致冷剂 二、铵盐:铵盐均为无色或白色晶体,易溶于水,属离子化合物2.化学性质NH4HCO3 NH3↑ + CO2 ↑+ H2O(NH4)2CO3 2NH3↑ + CO2 ↑+ H2ONH4Cl NH3↑ + HCl↑注意:铵盐分解不一定产生氨气1.物理性质1)不稳定性,受热易分解2)与强碱共热产生氨气NH4NO3+ NaOH NaNO3 + NH3 ↑+ H2O (NH4)2SO4 + 2NaOH Na2SO4+ 2NH3 ↑+ 2H2O 实质: NH4+ + OH- NH3 ↑ + H2O 3.铵盐(NH4+)的检验检验方法:1)先将其与强碱共热逸出NH3
2)用红色石蕊试纸或浓盐酸检验逸出的氨气4.氨气的实验室制法原理:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3 ↑+ 2H2O 装置:收集:干燥验满:(1)用湿润的红色石蕊试纸(变蓝)(2)蘸有浓盐酸的玻璃棒接近瓶口 (产生白烟)工业合成氨:N2 + 3H2 2NH3 :用碱石灰(CaO 与NaOH固体混合物)只能用向下排空气法收集用氯化铵固体与消石灰混合加热吸收:用浸湿的棉花团棉花的作用: 防止氨与空气对流,使收集到的氨气尽量纯净;浸有水或稀硫酸的棉花可防止氨气逸出,避免污染大气。思考题实验室中其余的制氨气的方法:①加热浓氨水法②浓氨水加生石灰或NaOH固体法
同课章节目录
