人教版必修二 6.2.1 化学反应速率 课件(共14张PPT)
文档属性
| 名称 | 人教版必修二 6.2.1 化学反应速率 课件(共14张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-09 18:24:19 | ||
图片预览



文档简介
(共14张PPT)
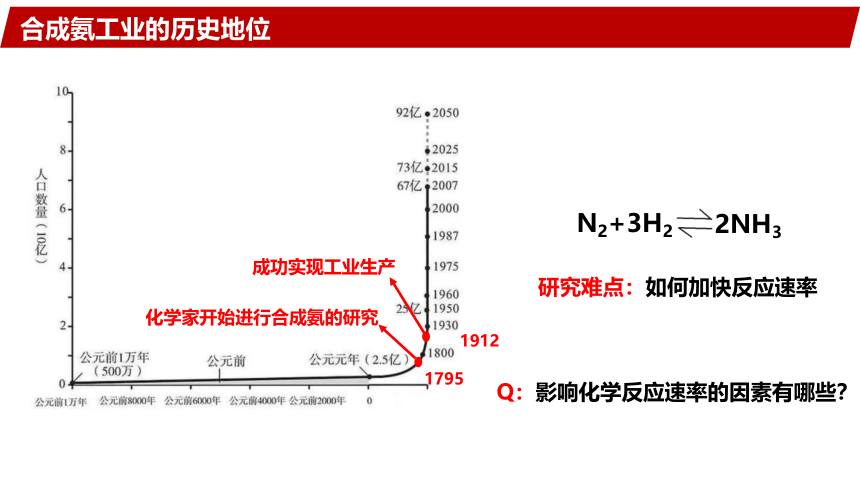
合成氨工业中的化学反应速率问题
化学家开始进行合成氨的研究
研究难点:如何加快反应速率
成功实现工业生产
1795
1912
N2+3H2
2NH3
合成氨工业的历史地位
Q:影响化学反应速率的因素有哪些?
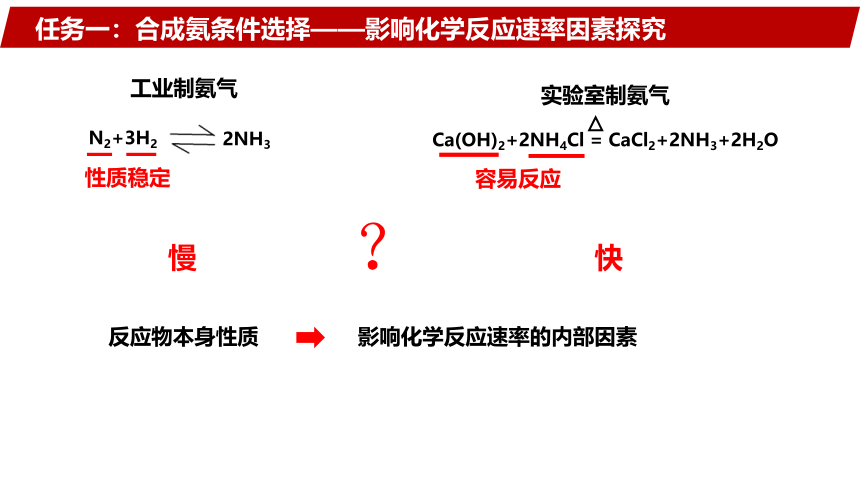
任务一:合成氨条件选择——影响化学反应速率因素探究
实验室制氨气
Ca(OH)2+2NH4Cl = CaCl2+2NH3+2H2O
N2+3H2
2NH3
工业制氨气
快
慢
反应物本身性质
?
性质稳定
容易反应
影响化学反应速率的内部因素
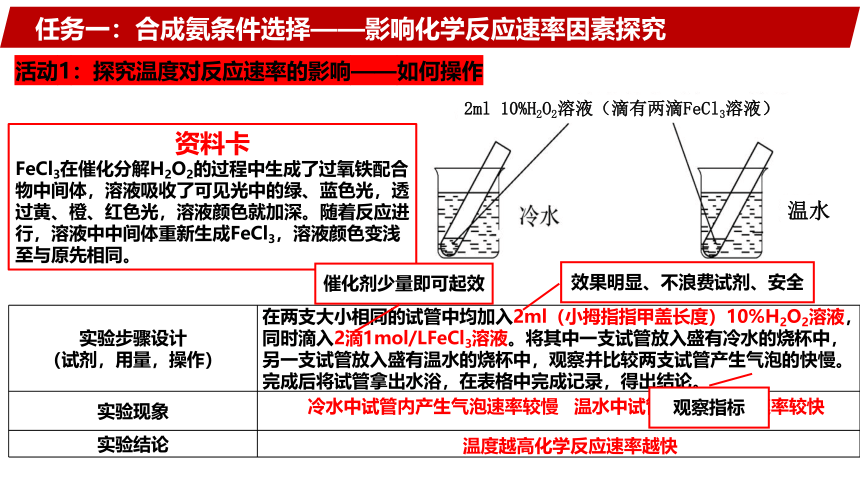
实验步骤设计 (试剂,用量,操作) 在两支大小相同的试管中均加入2ml(小拇指指甲盖长度)10%H2O2溶液,同时滴入2滴1mol/LFeCl3溶液。将其中一支试管放入盛有冷水的烧杯中,另一支试管放入盛有温水的烧杯中,观察并比较两支试管产生气泡的快慢。
完成后将试管拿出水浴,在表格中完成记录,得出结论。
实验现象
实验结论
任务一:合成氨条件选择——影响化学反应速率因素探究
活动1:探究温度对反应速率的影响——如何操作
冷水中试管内产生气泡速率较慢
温水中试管内产生气泡速率较快
温度越高化学反应速率越快
资料卡
FeCl3在催化分解H2O2的过程中生成了过氧铁配合物中间体,溶液吸收了可见光中的绿、蓝色光,透过黄、橙、红色光,溶液颜色就加深。随着反应进行,溶液中中间体重新生成FeCl3,溶液颜色变浅至与原先相同。
效果明显、不浪费试剂、安全
催化剂少量即可起效
观察指标
2ml 10%H2O2溶液(滴有两滴FeCl3溶液)
温水
实验步骤设计 (试剂,用量,操作) 在两支大小相同的试管中均加入2ml10%H2O2溶液,同时滴入2滴1mol/LFeCl3溶液。将其中一支试管放入盛有冷水的烧杯中,另一支试管放入盛有温水的烧杯中,观察并比较两支试管产生气泡的快慢。 在表格中完成记录,得出结论。
实验现象
实验结论
冷水组
温水组
任务一:合成氨条件选择——影响化学反应速率因素探究
活动1:探究温度对反应速率的影响——如何操作
冷水中试管内产生气泡速率较慢
温水中试管内产生气泡速率较快
比较两组实验设计时的异同
2ml5%H2O2溶液
2ml5%H2O2溶液
2滴1mol/LFeCl3溶液
2滴1mol/LFeCl3溶液
放入盛有冷水的烧杯中
放入盛有温水的烧杯中
温度不同
反应物浓度、催化剂均相同
控制变量法
多变量问题
改变其中某一变量
控制其他变量不变
其他条件相同时
温度越高化学反应速率越快
?
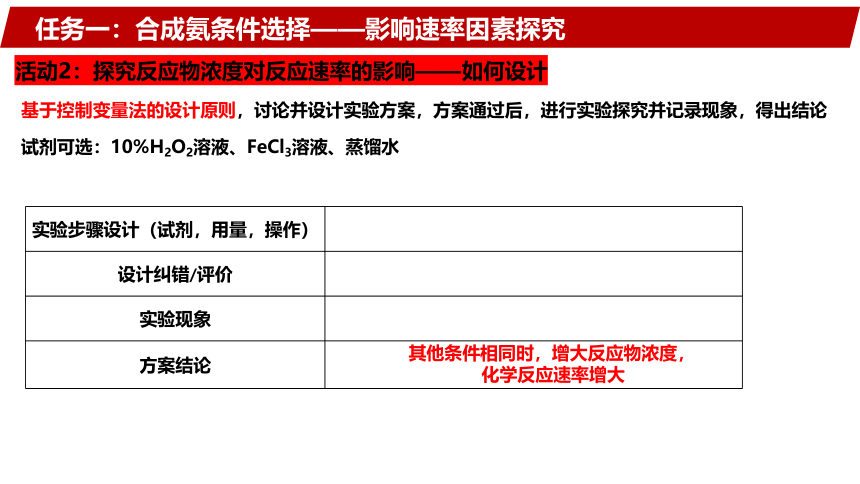
任务一:合成氨条件选择——影响速率因素探究
活动2:探究反应物浓度对反应速率的影响——如何设计
基于控制变量法的设计原则,讨论并设计实验方案,方案通过后,进行实验探究并记录现象,得出结论
实验步骤设计(试剂,用量,操作)
设计纠错/评价
实验现象
方案结论
其他条件相同时,增大反应物浓度,
化学反应速率增大
试剂可选:10%H2O2溶液、FeCl3溶液、蒸馏水
任务一:合成氨条件选择——影响化学反应速率因素探究
实验步骤:在极限体积为18ml的针筒与普通针筒中,排净空气后,分别注入3ml滴
有酚酞的0.1mol/L的氢氧化钠溶液,再分别往针筒中注入常压下30ml的
SO2气体,比较两针筒内溶液褪色快慢。
活动3:探究压强对反应速率的影响——如何理解
合成氨重大突破
以楔而不舍的精神,经过不断的实验和计算,哈伯终于在 1909 年取得了鼓舞人心的成果。
这就是在 600℃的高温、200 个大气压和锇为催化剂的条件下,能得到产率约为 8%的合成氨。
因此获得1918年诺贝尔化学奖。
实验结论:
对于气体参与的反应来说,其他条件相同时,增大压强,反应速率增大
NaOH+SO2=NaHSO3(SO2过量)
减小容器体积
相当于增大气体反应物浓度
Q:若将哈伯的方法工业化,如何更低成本地使反应速率更快?
任务一:合成氨条件选择——影响化学反应速率因素探究
合成氨工业化
1908年~1913年,卡尔·博施改进哈伯首创的高压合成氨催化方法,他利用氧化铁型催化剂,
使合成氨生产工业化,化学上称为“哈伯——博施法”,因此获得1931年诺贝尔化学奖。
对催化剂的研究是当代化学一个极具魅力和应用前景的重要课题
任务一:合成氨条件选择——影响化学反应速率因素探究
活动4:寻找双氧水分解的更优催化剂——如何研究
查阅资料确定可能性
实验
催化剂效果评价
CuCl2可做某些反应催化剂
与FeCl3催化效果定量比较
实验过程:在两支Y型管一侧分别滴加2滴同浓度浓FeCl3溶液与CuCl2溶液,另一侧
分别滴加1滴10%H2O2溶液,Y型管上方连接相对压强传感器,倾斜Y
型管,混合两溶液,观察相对压强传感器传输出的相对压强变化
实验结论: 同浓度的浓CuCl2溶液对双氧水分解的催化效果优于FeCl3溶液
一般方法:
任务二:合成氨工艺评价——化学反应速率定量表征
中国合成氨产量已连续多年稳居全球第一
合成氨的生产速率是衡量合成氨工艺水平的一项重要指标
年产量
任务二:合成氨工艺评价——化学反应速率定量表征
Q:上图怎么表示该反应快慢呢?
单位时间内压强的变化
单位时间内反应物 的减少量或者生成物 的增加量
单位时间内O2的增加
单位时间内H2O2减少
化学反应速率
v=——
△c
△t
斜率
2H2O2=2H2O+O2
→
浓度、质量、物质的量等
浓度
浓度
单位时间内反应物的减少量或者生成物的增加量
时间/s
相对压强/kPa
任务三:合成氨装置—多因素影响下的速率变化与调控
Q:为何A、B、C三段速率不同?
一个化学反应的速率由多个因素共同决定,在反应进行过程中各因素的影响程度也在
不断变化
能力提升
A
B
C
时间/s
相对压强/kPa
任务三:合成氨装置—多因素影响下的速率变化与调控
能力提升
浓度控制
温度控制
压强控制
谢谢
合成氨工业中的化学反应速率问题
化学家开始进行合成氨的研究
研究难点:如何加快反应速率
成功实现工业生产
1795
1912
N2+3H2
2NH3
合成氨工业的历史地位
Q:影响化学反应速率的因素有哪些?
任务一:合成氨条件选择——影响化学反应速率因素探究
实验室制氨气
Ca(OH)2+2NH4Cl = CaCl2+2NH3+2H2O
N2+3H2
2NH3
工业制氨气
快
慢
反应物本身性质
?
性质稳定
容易反应
影响化学反应速率的内部因素
实验步骤设计 (试剂,用量,操作) 在两支大小相同的试管中均加入2ml(小拇指指甲盖长度)10%H2O2溶液,同时滴入2滴1mol/LFeCl3溶液。将其中一支试管放入盛有冷水的烧杯中,另一支试管放入盛有温水的烧杯中,观察并比较两支试管产生气泡的快慢。
完成后将试管拿出水浴,在表格中完成记录,得出结论。
实验现象
实验结论
任务一:合成氨条件选择——影响化学反应速率因素探究
活动1:探究温度对反应速率的影响——如何操作
冷水中试管内产生气泡速率较慢
温水中试管内产生气泡速率较快
温度越高化学反应速率越快
资料卡
FeCl3在催化分解H2O2的过程中生成了过氧铁配合物中间体,溶液吸收了可见光中的绿、蓝色光,透过黄、橙、红色光,溶液颜色就加深。随着反应进行,溶液中中间体重新生成FeCl3,溶液颜色变浅至与原先相同。
效果明显、不浪费试剂、安全
催化剂少量即可起效
观察指标
2ml 10%H2O2溶液(滴有两滴FeCl3溶液)
温水
实验步骤设计 (试剂,用量,操作) 在两支大小相同的试管中均加入2ml10%H2O2溶液,同时滴入2滴1mol/LFeCl3溶液。将其中一支试管放入盛有冷水的烧杯中,另一支试管放入盛有温水的烧杯中,观察并比较两支试管产生气泡的快慢。 在表格中完成记录,得出结论。
实验现象
实验结论
冷水组
温水组
任务一:合成氨条件选择——影响化学反应速率因素探究
活动1:探究温度对反应速率的影响——如何操作
冷水中试管内产生气泡速率较慢
温水中试管内产生气泡速率较快
比较两组实验设计时的异同
2ml5%H2O2溶液
2ml5%H2O2溶液
2滴1mol/LFeCl3溶液
2滴1mol/LFeCl3溶液
放入盛有冷水的烧杯中
放入盛有温水的烧杯中
温度不同
反应物浓度、催化剂均相同
控制变量法
多变量问题
改变其中某一变量
控制其他变量不变
其他条件相同时
温度越高化学反应速率越快
?
任务一:合成氨条件选择——影响速率因素探究
活动2:探究反应物浓度对反应速率的影响——如何设计
基于控制变量法的设计原则,讨论并设计实验方案,方案通过后,进行实验探究并记录现象,得出结论
实验步骤设计(试剂,用量,操作)
设计纠错/评价
实验现象
方案结论
其他条件相同时,增大反应物浓度,
化学反应速率增大
试剂可选:10%H2O2溶液、FeCl3溶液、蒸馏水
任务一:合成氨条件选择——影响化学反应速率因素探究
实验步骤:在极限体积为18ml的针筒与普通针筒中,排净空气后,分别注入3ml滴
有酚酞的0.1mol/L的氢氧化钠溶液,再分别往针筒中注入常压下30ml的
SO2气体,比较两针筒内溶液褪色快慢。
活动3:探究压强对反应速率的影响——如何理解
合成氨重大突破
以楔而不舍的精神,经过不断的实验和计算,哈伯终于在 1909 年取得了鼓舞人心的成果。
这就是在 600℃的高温、200 个大气压和锇为催化剂的条件下,能得到产率约为 8%的合成氨。
因此获得1918年诺贝尔化学奖。
实验结论:
对于气体参与的反应来说,其他条件相同时,增大压强,反应速率增大
NaOH+SO2=NaHSO3(SO2过量)
减小容器体积
相当于增大气体反应物浓度
Q:若将哈伯的方法工业化,如何更低成本地使反应速率更快?
任务一:合成氨条件选择——影响化学反应速率因素探究
合成氨工业化
1908年~1913年,卡尔·博施改进哈伯首创的高压合成氨催化方法,他利用氧化铁型催化剂,
使合成氨生产工业化,化学上称为“哈伯——博施法”,因此获得1931年诺贝尔化学奖。
对催化剂的研究是当代化学一个极具魅力和应用前景的重要课题
任务一:合成氨条件选择——影响化学反应速率因素探究
活动4:寻找双氧水分解的更优催化剂——如何研究
查阅资料确定可能性
实验
催化剂效果评价
CuCl2可做某些反应催化剂
与FeCl3催化效果定量比较
实验过程:在两支Y型管一侧分别滴加2滴同浓度浓FeCl3溶液与CuCl2溶液,另一侧
分别滴加1滴10%H2O2溶液,Y型管上方连接相对压强传感器,倾斜Y
型管,混合两溶液,观察相对压强传感器传输出的相对压强变化
实验结论: 同浓度的浓CuCl2溶液对双氧水分解的催化效果优于FeCl3溶液
一般方法:
任务二:合成氨工艺评价——化学反应速率定量表征
中国合成氨产量已连续多年稳居全球第一
合成氨的生产速率是衡量合成氨工艺水平的一项重要指标
年产量
任务二:合成氨工艺评价——化学反应速率定量表征
Q:上图怎么表示该反应快慢呢?
单位时间内压强的变化
单位时间内反应物 的减少量或者生成物 的增加量
单位时间内O2的增加
单位时间内H2O2减少
化学反应速率
v=——
△c
△t
斜率
2H2O2=2H2O+O2
→
浓度、质量、物质的量等
浓度
浓度
单位时间内反应物的减少量或者生成物的增加量
时间/s
相对压强/kPa
任务三:合成氨装置—多因素影响下的速率变化与调控
Q:为何A、B、C三段速率不同?
一个化学反应的速率由多个因素共同决定,在反应进行过程中各因素的影响程度也在
不断变化
能力提升
A
B
C
时间/s
相对压强/kPa
任务三:合成氨装置—多因素影响下的速率变化与调控
能力提升
浓度控制
温度控制
压强控制
谢谢
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
