人教版必修二 7.2.1 乙烯 课件(共18张PPT)
文档属性
| 名称 | 人教版必修二 7.2.1 乙烯 课件(共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-09 18:25:27 | ||
图片预览




文档简介
(共18张PPT)
化学2第七章第二节第一课时——
乙烯
颜色 状态 气味 密度 溶解性
思考1:实验室制乙烯用什么方法收集?
学习任务一 乙烯的物理性质
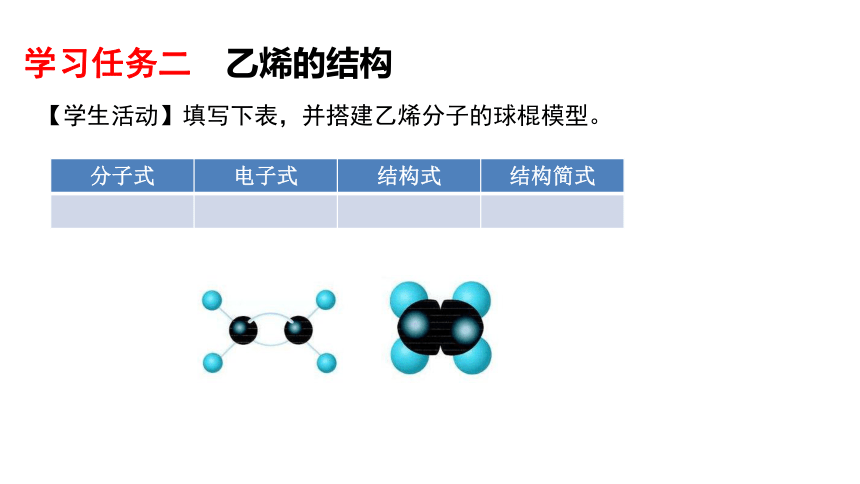
学习任务二 乙烯的结构
分子式 电子式 结构式 结构简式
【学生活动】填写下表,并搭建乙烯分子的球棍模型。
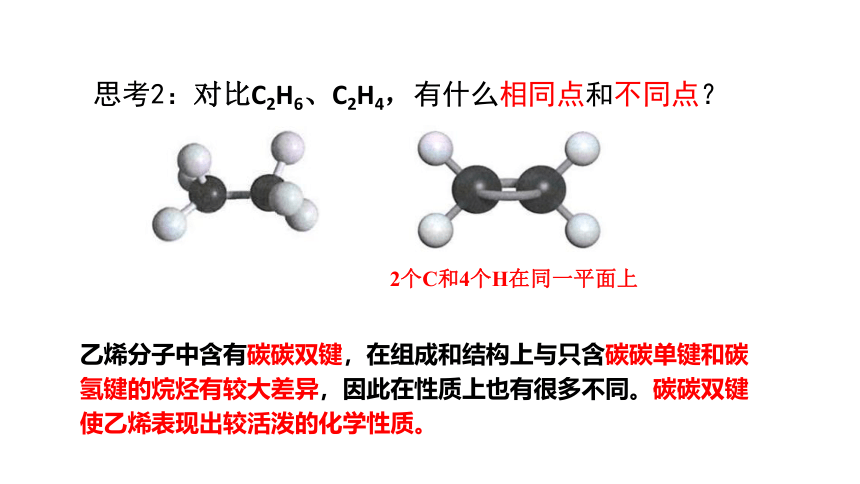
思考2:对比C2H6、C2H4,有什么相同点和不同点?
乙烯分子中含有碳碳双键,在组成和结构上与只含碳碳单键和碳氢键的烷烃有较大差异,因此在性质上也有很多不同。碳碳双键使乙烯表现出较活泼的化学性质。
2个C和4个H在同一平面上
乙烯在空气中燃烧,火焰明亮且伴有黑烟。
C2H4 + 3O2 2CO2 + 2H2O
点燃
思考3:为什么火焰明亮?伴有黑烟?
产生黑烟是因为含碳量高,燃烧不充分;火焰明亮是碳微粒受灼热而发光。
学习任务三 乙烯的反应
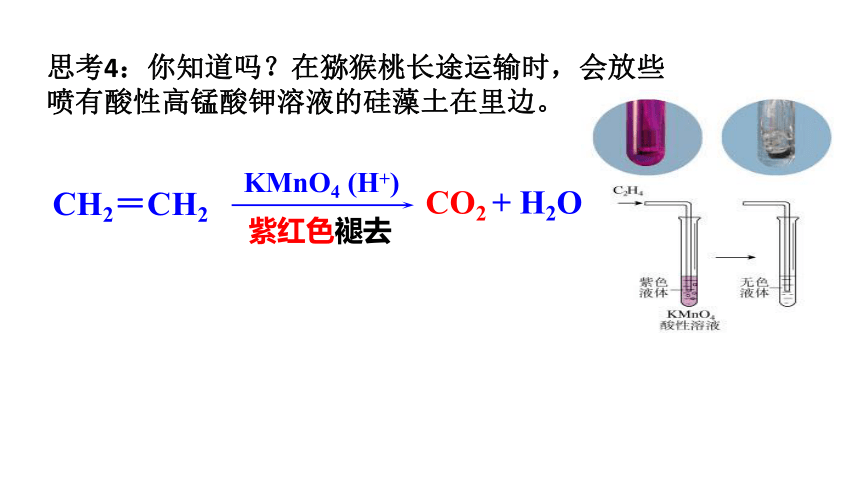
思考4:你知道吗?在猕猴桃长途运输时,会放些喷有酸性高锰酸钾溶液的硅藻土在里边。
CH2=CH2
CO2 + H2O
KMnO4 (H+)
紫红色褪去
学习评价一
1.如何鉴别C2H6、C2H4 ?
能否用上述方法除去C2H6中的C2H4 ?
乙烯与溴反应的产物可做谷物和水果等的杀菌剂、杀虫剂。
CH2=CH2+Br2 → CH2-CH2
Br Br
CH2=CH2+Br2 → CH2=CH+HBr
Br
?
有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
C=C
H
H
H
H
+Br Br
H H
H H
Br
C
C
Br
1,2 – 二溴乙烷
在一定条件下(催化剂、加热),乙烯还可以与Cl2、 H2、HCl 、H2O等物质发生加成反应。
CH2=CH2 + H2 CH3CH3
催化剂
△
CH2=CH2 + HCl CH3CH2Cl
催化剂
△
CH2=CH2 + H2O CH3CH2OH
催化剂
加热、加压
学习评价二
CH2=CH2+CH2=CH2+CH2=CH2+......
思考5:乙烯分子间是否会发生加成反应
单体
聚合度
链节
n CH2=CH2
[ CH2—CH2 ]n
催化剂
由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应叫做聚合反应。乙烯的聚合反应同时也是加成反应,这样的反应又被称为加聚反应。
生活中处处有乙烯
乙烯
结构
物理性质
化学性质
用途
1.氧化反应
2.加成反应
3.加聚反应
分子式
电子式
结构式
结构简式
球棍模型
空间填充模型
催熟剂
石油化工原料
无色稍有气味气体
密度比空气略小
难溶于水
C2H4+3O2→2CO2+2H2O
KMnO4 (H+)褪色
CH2=CH2+Br2→ CH2BrCH2Br
n CH2=CH2 → [CH2-CH2]n
点燃
催化剂
课堂小结
1.如何鉴别C2H6、C2H4 ?
2.如何除去C2H6中的C2H4 ?
学习评价三
3. 实验室制取氯乙烷,采取CH3CH3与Cl2取代反应,还是采用CH2=CH2与HCl加成反应?
4. CH2=CH—CH3与HCl在一定条件下发生加成反应的方程式。
Better Chem. better life!
化学2第七章第二节第一课时——
乙烯
颜色 状态 气味 密度 溶解性
思考1:实验室制乙烯用什么方法收集?
学习任务一 乙烯的物理性质
学习任务二 乙烯的结构
分子式 电子式 结构式 结构简式
【学生活动】填写下表,并搭建乙烯分子的球棍模型。
思考2:对比C2H6、C2H4,有什么相同点和不同点?
乙烯分子中含有碳碳双键,在组成和结构上与只含碳碳单键和碳氢键的烷烃有较大差异,因此在性质上也有很多不同。碳碳双键使乙烯表现出较活泼的化学性质。
2个C和4个H在同一平面上
乙烯在空气中燃烧,火焰明亮且伴有黑烟。
C2H4 + 3O2 2CO2 + 2H2O
点燃
思考3:为什么火焰明亮?伴有黑烟?
产生黑烟是因为含碳量高,燃烧不充分;火焰明亮是碳微粒受灼热而发光。
学习任务三 乙烯的反应
思考4:你知道吗?在猕猴桃长途运输时,会放些喷有酸性高锰酸钾溶液的硅藻土在里边。
CH2=CH2
CO2 + H2O
KMnO4 (H+)
紫红色褪去
学习评价一
1.如何鉴别C2H6、C2H4 ?
能否用上述方法除去C2H6中的C2H4 ?
乙烯与溴反应的产物可做谷物和水果等的杀菌剂、杀虫剂。
CH2=CH2+Br2 → CH2-CH2
Br Br
CH2=CH2+Br2 → CH2=CH+HBr
Br
?
有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
C=C
H
H
H
H
+Br Br
H H
H H
Br
C
C
Br
1,2 – 二溴乙烷
在一定条件下(催化剂、加热),乙烯还可以与Cl2、 H2、HCl 、H2O等物质发生加成反应。
CH2=CH2 + H2 CH3CH3
催化剂
△
CH2=CH2 + HCl CH3CH2Cl
催化剂
△
CH2=CH2 + H2O CH3CH2OH
催化剂
加热、加压
学习评价二
CH2=CH2+CH2=CH2+CH2=CH2+......
思考5:乙烯分子间是否会发生加成反应
单体
聚合度
链节
n CH2=CH2
[ CH2—CH2 ]n
催化剂
由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应叫做聚合反应。乙烯的聚合反应同时也是加成反应,这样的反应又被称为加聚反应。
生活中处处有乙烯
乙烯
结构
物理性质
化学性质
用途
1.氧化反应
2.加成反应
3.加聚反应
分子式
电子式
结构式
结构简式
球棍模型
空间填充模型
催熟剂
石油化工原料
无色稍有气味气体
密度比空气略小
难溶于水
C2H4+3O2→2CO2+2H2O
KMnO4 (H+)褪色
CH2=CH2+Br2→ CH2BrCH2Br
n CH2=CH2 → [CH2-CH2]n
点燃
催化剂
课堂小结
1.如何鉴别C2H6、C2H4 ?
2.如何除去C2H6中的C2H4 ?
学习评价三
3. 实验室制取氯乙烷,采取CH3CH3与Cl2取代反应,还是采用CH2=CH2与HCl加成反应?
4. CH2=CH—CH3与HCl在一定条件下发生加成反应的方程式。
Better Chem. better life!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
