人教版选修一 4.2.1 电解原理 课件(共25张PPT)
文档属性
| 名称 | 人教版选修一 4.2.1 电解原理 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-09 18:28:29 | ||
图片预览




文档简介
(共25张PPT)
第四章 第二节 电解池
选择性必修1
第一课时电解原理
1.知道电解的基本原理,会判断一般电解反应产物;
2.能说出电解、电解池及形成条件;
3.能正确书写电极反应式和电解的总化学方程式;
4. 明确原电池与电解池的区别和联系。
学习
目标
电解池:把电能转变为化学能的装置。
知识回顾
原电池:把化学能变为电能转的装置。
引入新课
一、电解原理
实验4-2 在U型管中注入质量分数为25%的CuCl2溶液中 ,插入两根石墨棒作电极材料,把湿润的碘化钾淀粉试纸放在与直流电源正极相连的石墨棒附近,接通直流电源,观察U形管内的现象与试纸颜色的变化。
CuCl2溶液
石墨棒
石墨棒
一、电解原理
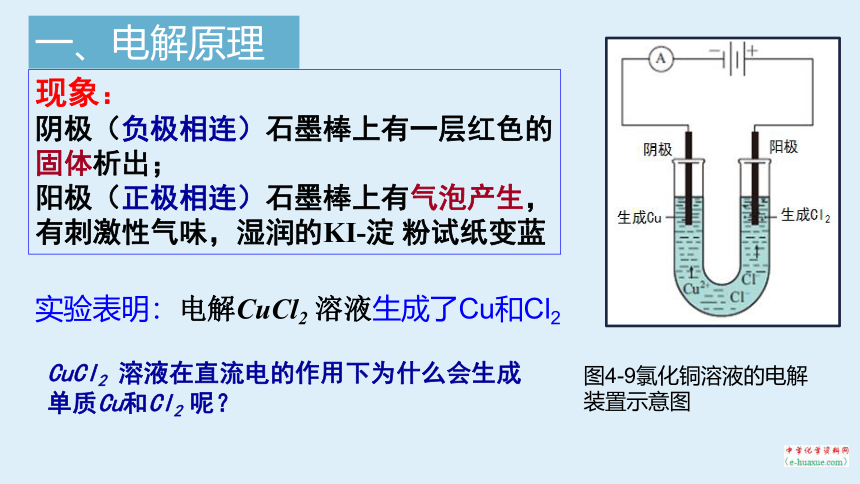
图4-9氯化铜溶液的电解装置示意图
现象:
阴极(负极相连)石墨棒上有一层红色的固体析出;
阳极(正极相连)石墨棒上有气泡产生,有刺激性气味,湿润的KI-淀 粉试纸变蓝
实验表明:电解CuCl2 溶液生成了Cu和Cl2
CuCl2 溶液在直流电的作用下为什么会生成单质Cu和Cl2 呢?
实验分析
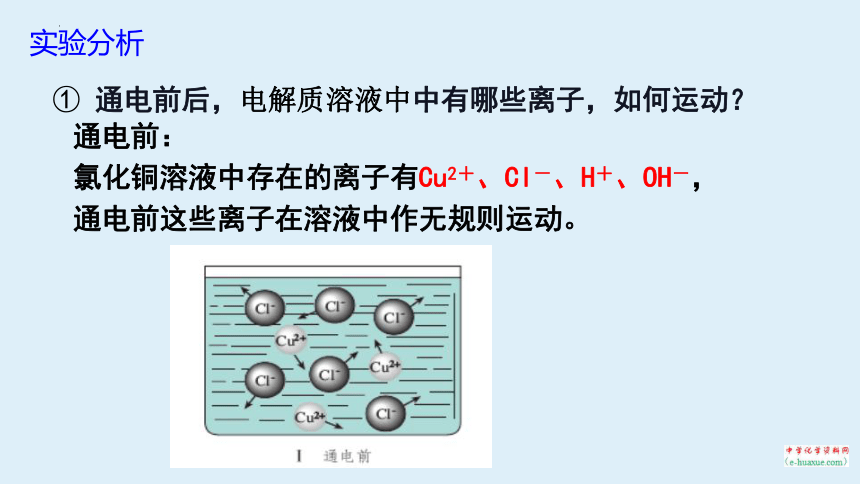
① 通电前后,电解质溶液中中有哪些离子,如何运动?
通电前:
氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,
通电前这些离子在溶液中作无规则运动。
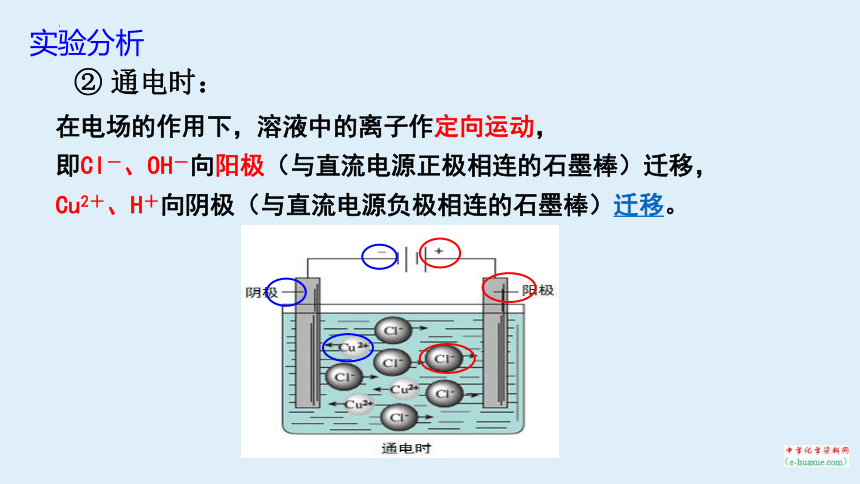
② 通电时:
实验分析
在电场的作用下,溶液中的离子作定向运动,
即Cl-、OH-向阳极(与直流电源正极相连的石墨棒)迁移,
Cu2+、H+向阴极(与直流电源负极相连的石墨棒)迁移。
一、电解原理
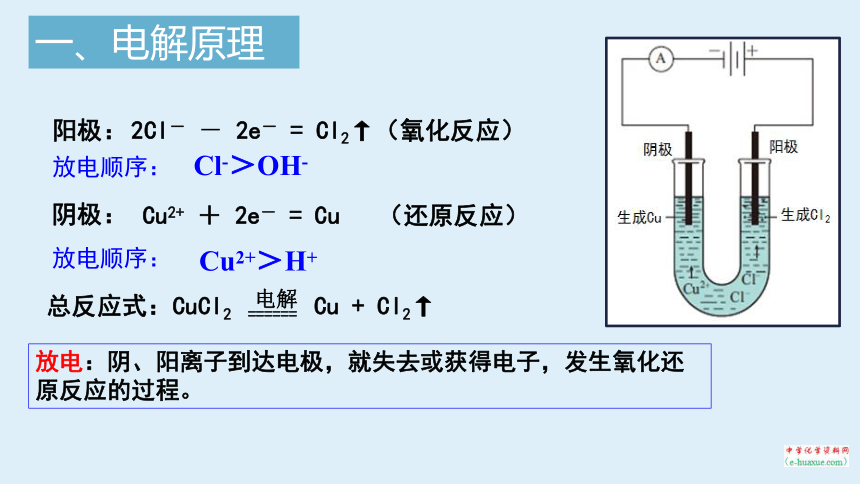
阳极:
阴极:
2Cl- - 2e- = Cl2↑(氧化反应)
Cu2+ + 2e- = Cu (还原反应)
总反应式:CuCl2 ====== Cu + Cl2↑
电解
放电:阴、阳离子到达电极,就失去或获得电子,发生氧化还原反应的过程。
Cl->OH-
Cu2+>H+
放电顺序:
放电顺序:
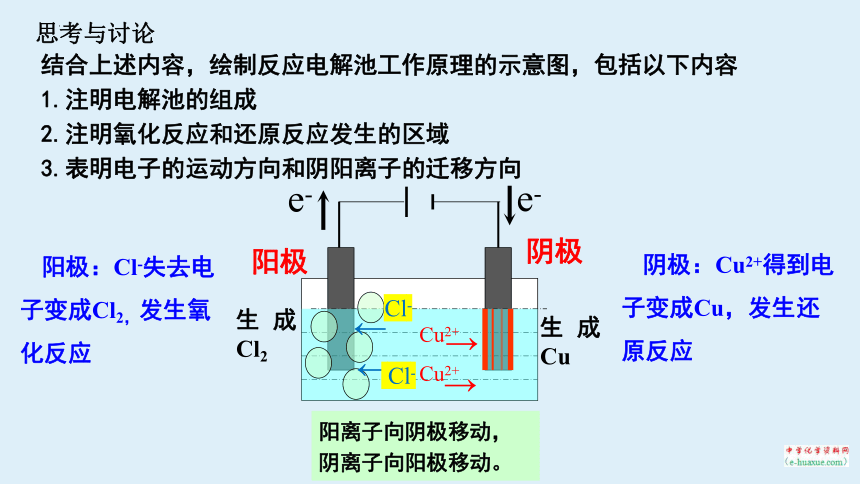
思考与讨论
结合上述内容,绘制反应电解池工作原理的示意图,包括以下内容
1.注明电解池的组成
2.注明氧化反应和还原反应发生的区域
3.表明电子的运动方向和阴阳离子的迁移方向
生成 Cl2
e-
生成 Cu
阳极
阴极
Cu2+
→
→
Cu2+
←
←
Cl-
Cl-
e-
阴极:Cu2+得到电子变成Cu,发生还原反应
阳极:Cl-失去电子变成Cl2,发生氧化反应
阳离子向阴极移动,
阴离子向阳极移动。
使电流通过电解质溶液(或熔融电解质)而在阴阳两极引起氧化还原反应的过程。
1.电解:
2.电解池(槽):
(1)外加直流电源
(2)有两个电极:
(3)电解质溶液或熔化的电解质
把电能转化为化学能的装置.
4.构成条件:
3.放电:
离子在电极上得、失电子,发生氧化还原的过程。
一、电解原理
(4)形成闭合回路
与电源负极相连的电极为阴极
与电源正极相连的电极为阳极
还原反应
氧化反应
阴极
阳极
阳氧阴还
阳极→阴极
(注:电子只在外电路定向移动,不能从溶液中移动)
5.电子流向:
阳离子移向阴极, 阴离子移向阳极.
7.电极种类:
6.离子移动方向:
惰性(铂、金、石墨):
活性(除铂、金外的金属):
导电、参与电极反应
阴极:
一般只导电,不参与反应
阳极:
仅导电,不参与反应
8.电解质离子放电顺序(阴阳极为惰性电极)
① 阴极:溶液中的阳离子得电子,发生还原反应。
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
得到电子,由易到难
② 阳极:溶液中的阴离子失电子,发生氧化反应。
活性电极>S2->I->Fe2+>Br->Cl->OH->含氧酸根(SO42-、NO3-、CO32-)>F-
失去电子,由易到难
若金属做阳极,则金属(金、铂除外)优先失电子,不是溶液中的阴离子失电子
阴极最常用的放电顺序:Ag+>Fe3+>Cu2+>H+
阳极常见放电顺序:活性电极>Cl- >OH-
1.判断阴、阳极方法:
2.分析电解质溶液中的全部离子并分为阴、阳两组
提示:不要忘记水溶液中的H+和OH-,不要把H+、OH-误加到熔融电解质中。
二、电解反应方程式书写的方法分析
3.阴、阳两极的放电顺序
(1)阴极(与电极材料无关):电极只导电,溶液中的阳离子放电
阴极最常用的放电顺序:Ag+>Fe3+>Cu2+>H+
常见的阴极产物有Ag、Cu、H2
Ag++e-=Ag
Cu2++2e-=Cu
2H++2e-=H2 ↑或 2H2O+2e-=H2↑+2OH-
Fe3++e-=Fe2+
(2)阳极(与电极材料有关):
①活性电极:
Fe、Cu、Ag 电极直接失去电子
反应式:M-ne-=Mn+
Fe-2e- =Fe2+
Cu-2e- =Cu2+
Ag-e- =Ag+
②惰性电极:
Pt、石墨 溶液中的阴离子放电
阳极常见放电顺序:活性电极>Cl- >OH-
2Cl--2e-=Cl2
4OH-- 4e- =2H2O + O2↑ 或 2H2O- 4e-=4H++O2↑
4.分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
5.最后写出电解反应的总化学方程式或离子方程式。
书写反应的总离子方程式时,要注意:若参与电极反应的H+(或OH-)是由水电离出来的,用水的分子式表示。
总结:看电极→找离子→分阴阳→排顺序→写反应
注意:
①若H+、OH-由水电离,则总反应中需将其变成H2O
②所有总反应的条件均为电解
练一练
写出用铜做电极电解H2SO4溶液的电极反应式
阳极 :
阴极 :
Cu - 2e– =Cu2+
2H+ + 2e– =H2↑
总 :
Cu + 2H+ === Cu2+ + H2↑
电解
电解
Cu + 2H2SO4 === CuSO4 + H2↑
借助电解,可以使非自发的氧化还原反应进行
练一练
1.用惰性电极电解NaOH溶液
阳极:______________________________________;
阴极:______________________________________。
2.用惰性电极电解H2SO4溶液
阳极:______________________________________;
阴极:______________________________________。
4H+ + 4e– =2H2↑
电解水型
4OH--4e-=O2↑+2H2O
4H+ + 4e- = 2H2↑
4OH--4e-=O2↑+2H2O
练一练
3.用惰性电极电解HCl溶液
阳极:______________________________________;
阴极:______________________________________。
4.用惰性电极电解CuCl2溶液
阳极:______________________________________;
阴极:______________________________________。
电解电解质型
2Cl- -2e-=Cl2↑
2H+ +2e- =H2↑
2Cl- - 2e-= Cl2↑
Cu2++2e- = Cu
练一练
5.用惰性电极电解NaCl溶液
阳极:______________________________________;
阴极:______________________________________。
2Cl--2e-==Cl2↑
或2H2O+2e-==H2↑+2OH-
6.用惰性电极电解CuSO4溶液
阳极:______________________________________;
阴极:______________________________________。
或2H2O - 4e–= O2 ↑+4H+
放氢生碱型
放氧生酸型
2Cu2++4e- =2Cu
4OH- - 4e- = O2↑+2H2O
2H++2e- = H2↑
电解 类型 举 例 电极反应 溶液PH 变化 溶液复原方法
物质类别 实例
阳极: 阴极:
阳极: 阴极:
阳极: 阴极:
含氧酸
H2SO4
强碱
NaOH
活泼金属的含氧酸盐
Na2SO4
无氧酸
HCl
减小
增大
不变
H2O
增大
HCl
不活泼金属的无氧酸盐
CuCl2
减少
CuCl2
9.电解规律(惰性电极)
4OH--4e-=O2↑+2H2O
4H+ + 4e- = 2H2↑
2Cl- -2e-=Cl2↑
2H+ +2e- =H2↑
2Cl- - 2e-= Cl2↑
Cu2++2e- = Cu
电解水型
电解电解质本身型
电解 类型 举 例 电极反应 溶液PH 变化 溶液复原方法
物质类别 实例
阳极: 阴极:
阳极: 阴极:
活泼金属的无氧酸盐
NaCl
增大
HCl
不活泼金属的含氧酸盐
CuSO4
减小
CuO
9.电解规律(惰性电极)
放氢生碱型
放氧生酸酸型
2Cl- - 2e- = Cl2↑
2H++2e- = H2↑
4OH- - 4e- = O2↑+2H2O
2Cu2++4e- =2Cu
1.右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的
A
课后练习
2. 根据金属活动顺序表,Cu不能发生如下反应:
Cu + 2H2O=Cu(OH)2↓+ H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四种电极材料和电解液中,能实现该反应最为恰当的是( )
A B C D
阳极 石墨 Cu Cu Cu
阴极 石墨 石墨 Fe Pt
电解液 CuSO4溶液 Na2SO4溶液 H2SO4溶液 H2O
B
3.用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是( )
A.AgNO3 B.Na2SO4
C.CuCl2 D.KCl
C
第四章 第二节 电解池
选择性必修1
第一课时电解原理
1.知道电解的基本原理,会判断一般电解反应产物;
2.能说出电解、电解池及形成条件;
3.能正确书写电极反应式和电解的总化学方程式;
4. 明确原电池与电解池的区别和联系。
学习
目标
电解池:把电能转变为化学能的装置。
知识回顾
原电池:把化学能变为电能转的装置。
引入新课
一、电解原理
实验4-2 在U型管中注入质量分数为25%的CuCl2溶液中 ,插入两根石墨棒作电极材料,把湿润的碘化钾淀粉试纸放在与直流电源正极相连的石墨棒附近,接通直流电源,观察U形管内的现象与试纸颜色的变化。
CuCl2溶液
石墨棒
石墨棒
一、电解原理
图4-9氯化铜溶液的电解装置示意图
现象:
阴极(负极相连)石墨棒上有一层红色的固体析出;
阳极(正极相连)石墨棒上有气泡产生,有刺激性气味,湿润的KI-淀 粉试纸变蓝
实验表明:电解CuCl2 溶液生成了Cu和Cl2
CuCl2 溶液在直流电的作用下为什么会生成单质Cu和Cl2 呢?
实验分析
① 通电前后,电解质溶液中中有哪些离子,如何运动?
通电前:
氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,
通电前这些离子在溶液中作无规则运动。
② 通电时:
实验分析
在电场的作用下,溶液中的离子作定向运动,
即Cl-、OH-向阳极(与直流电源正极相连的石墨棒)迁移,
Cu2+、H+向阴极(与直流电源负极相连的石墨棒)迁移。
一、电解原理
阳极:
阴极:
2Cl- - 2e- = Cl2↑(氧化反应)
Cu2+ + 2e- = Cu (还原反应)
总反应式:CuCl2 ====== Cu + Cl2↑
电解
放电:阴、阳离子到达电极,就失去或获得电子,发生氧化还原反应的过程。
Cl->OH-
Cu2+>H+
放电顺序:
放电顺序:
思考与讨论
结合上述内容,绘制反应电解池工作原理的示意图,包括以下内容
1.注明电解池的组成
2.注明氧化反应和还原反应发生的区域
3.表明电子的运动方向和阴阳离子的迁移方向
生成 Cl2
e-
生成 Cu
阳极
阴极
Cu2+
→
→
Cu2+
←
←
Cl-
Cl-
e-
阴极:Cu2+得到电子变成Cu,发生还原反应
阳极:Cl-失去电子变成Cl2,发生氧化反应
阳离子向阴极移动,
阴离子向阳极移动。
使电流通过电解质溶液(或熔融电解质)而在阴阳两极引起氧化还原反应的过程。
1.电解:
2.电解池(槽):
(1)外加直流电源
(2)有两个电极:
(3)电解质溶液或熔化的电解质
把电能转化为化学能的装置.
4.构成条件:
3.放电:
离子在电极上得、失电子,发生氧化还原的过程。
一、电解原理
(4)形成闭合回路
与电源负极相连的电极为阴极
与电源正极相连的电极为阳极
还原反应
氧化反应
阴极
阳极
阳氧阴还
阳极→阴极
(注:电子只在外电路定向移动,不能从溶液中移动)
5.电子流向:
阳离子移向阴极, 阴离子移向阳极.
7.电极种类:
6.离子移动方向:
惰性(铂、金、石墨):
活性(除铂、金外的金属):
导电、参与电极反应
阴极:
一般只导电,不参与反应
阳极:
仅导电,不参与反应
8.电解质离子放电顺序(阴阳极为惰性电极)
① 阴极:溶液中的阳离子得电子,发生还原反应。
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
得到电子,由易到难
② 阳极:溶液中的阴离子失电子,发生氧化反应。
活性电极>S2->I->Fe2+>Br->Cl->OH->含氧酸根(SO42-、NO3-、CO32-)>F-
失去电子,由易到难
若金属做阳极,则金属(金、铂除外)优先失电子,不是溶液中的阴离子失电子
阴极最常用的放电顺序:Ag+>Fe3+>Cu2+>H+
阳极常见放电顺序:活性电极>Cl- >OH-
1.判断阴、阳极方法:
2.分析电解质溶液中的全部离子并分为阴、阳两组
提示:不要忘记水溶液中的H+和OH-,不要把H+、OH-误加到熔融电解质中。
二、电解反应方程式书写的方法分析
3.阴、阳两极的放电顺序
(1)阴极(与电极材料无关):电极只导电,溶液中的阳离子放电
阴极最常用的放电顺序:Ag+>Fe3+>Cu2+>H+
常见的阴极产物有Ag、Cu、H2
Ag++e-=Ag
Cu2++2e-=Cu
2H++2e-=H2 ↑或 2H2O+2e-=H2↑+2OH-
Fe3++e-=Fe2+
(2)阳极(与电极材料有关):
①活性电极:
Fe、Cu、Ag 电极直接失去电子
反应式:M-ne-=Mn+
Fe-2e- =Fe2+
Cu-2e- =Cu2+
Ag-e- =Ag+
②惰性电极:
Pt、石墨 溶液中的阴离子放电
阳极常见放电顺序:活性电极>Cl- >OH-
2Cl--2e-=Cl2
4OH-- 4e- =2H2O + O2↑ 或 2H2O- 4e-=4H++O2↑
4.分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
5.最后写出电解反应的总化学方程式或离子方程式。
书写反应的总离子方程式时,要注意:若参与电极反应的H+(或OH-)是由水电离出来的,用水的分子式表示。
总结:看电极→找离子→分阴阳→排顺序→写反应
注意:
①若H+、OH-由水电离,则总反应中需将其变成H2O
②所有总反应的条件均为电解
练一练
写出用铜做电极电解H2SO4溶液的电极反应式
阳极 :
阴极 :
Cu - 2e– =Cu2+
2H+ + 2e– =H2↑
总 :
Cu + 2H+ === Cu2+ + H2↑
电解
电解
Cu + 2H2SO4 === CuSO4 + H2↑
借助电解,可以使非自发的氧化还原反应进行
练一练
1.用惰性电极电解NaOH溶液
阳极:______________________________________;
阴极:______________________________________。
2.用惰性电极电解H2SO4溶液
阳极:______________________________________;
阴极:______________________________________。
4H+ + 4e– =2H2↑
电解水型
4OH--4e-=O2↑+2H2O
4H+ + 4e- = 2H2↑
4OH--4e-=O2↑+2H2O
练一练
3.用惰性电极电解HCl溶液
阳极:______________________________________;
阴极:______________________________________。
4.用惰性电极电解CuCl2溶液
阳极:______________________________________;
阴极:______________________________________。
电解电解质型
2Cl- -2e-=Cl2↑
2H+ +2e- =H2↑
2Cl- - 2e-= Cl2↑
Cu2++2e- = Cu
练一练
5.用惰性电极电解NaCl溶液
阳极:______________________________________;
阴极:______________________________________。
2Cl--2e-==Cl2↑
或2H2O+2e-==H2↑+2OH-
6.用惰性电极电解CuSO4溶液
阳极:______________________________________;
阴极:______________________________________。
或2H2O - 4e–= O2 ↑+4H+
放氢生碱型
放氧生酸型
2Cu2++4e- =2Cu
4OH- - 4e- = O2↑+2H2O
2H++2e- = H2↑
电解 类型 举 例 电极反应 溶液PH 变化 溶液复原方法
物质类别 实例
阳极: 阴极:
阳极: 阴极:
阳极: 阴极:
含氧酸
H2SO4
强碱
NaOH
活泼金属的含氧酸盐
Na2SO4
无氧酸
HCl
减小
增大
不变
H2O
增大
HCl
不活泼金属的无氧酸盐
CuCl2
减少
CuCl2
9.电解规律(惰性电极)
4OH--4e-=O2↑+2H2O
4H+ + 4e- = 2H2↑
2Cl- -2e-=Cl2↑
2H+ +2e- =H2↑
2Cl- - 2e-= Cl2↑
Cu2++2e- = Cu
电解水型
电解电解质本身型
电解 类型 举 例 电极反应 溶液PH 变化 溶液复原方法
物质类别 实例
阳极: 阴极:
阳极: 阴极:
活泼金属的无氧酸盐
NaCl
增大
HCl
不活泼金属的含氧酸盐
CuSO4
减小
CuO
9.电解规律(惰性电极)
放氢生碱型
放氧生酸酸型
2Cl- - 2e- = Cl2↑
2H++2e- = H2↑
4OH- - 4e- = O2↑+2H2O
2Cu2++4e- =2Cu
1.右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的
A
课后练习
2. 根据金属活动顺序表,Cu不能发生如下反应:
Cu + 2H2O=Cu(OH)2↓+ H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四种电极材料和电解液中,能实现该反应最为恰当的是( )
A B C D
阳极 石墨 Cu Cu Cu
阴极 石墨 石墨 Fe Pt
电解液 CuSO4溶液 Na2SO4溶液 H2SO4溶液 H2O
B
3.用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是( )
A.AgNO3 B.Na2SO4
C.CuCl2 D.KCl
C
