人教版选修三 1.2.1 分离提纯 课件(共30张PPT)
文档属性
| 名称 | 人教版选修三 1.2.1 分离提纯 课件(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 51.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-09 18:31:08 | ||
图片预览




文档简介
(共30张PPT)
该作品属于《WJ化学研究院》原创,如有需要请
通过wj-chem@与我联系

选择性必修三 第一章 第二节 研究有机化合物的一般方法
第1课时 有机化合物的分离与提纯
WJ化学研究院
第一章
Institute of Chemistry
2023
李时珍在《本草纲目》中记载,槟榔有“下水肿、通关节、健脾调中、治心痛积聚”等诸多病症。
槟榔是我国的四大南药之一
如果你是化学家,你该如何来研究槟榔中的有机化合物?一般的步骤和方法是什么?
有机物(粗品)
新课引入
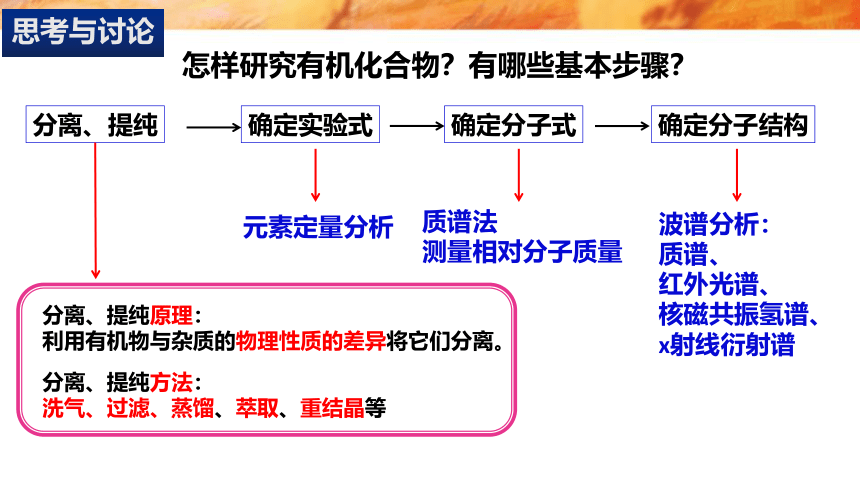
怎样研究有机化合物?有哪些基本步骤?
分离、提纯
确定实验式
确定分子式
确定分子结构
元素定量分析
质谱法
测量相对分子质量
波谱分析:
质谱、
红外光谱、
核磁共振氢谱、x射线衍射谱
分离、提纯原理:
利用有机物与杂质的物理性质的差异将它们分离。
分离、提纯方法:
洗气、过滤、蒸馏、萃取、重结晶等
思考与讨论
二、分离提纯的常用方法
原创:WJ化学研究院
邮箱wj-chem@
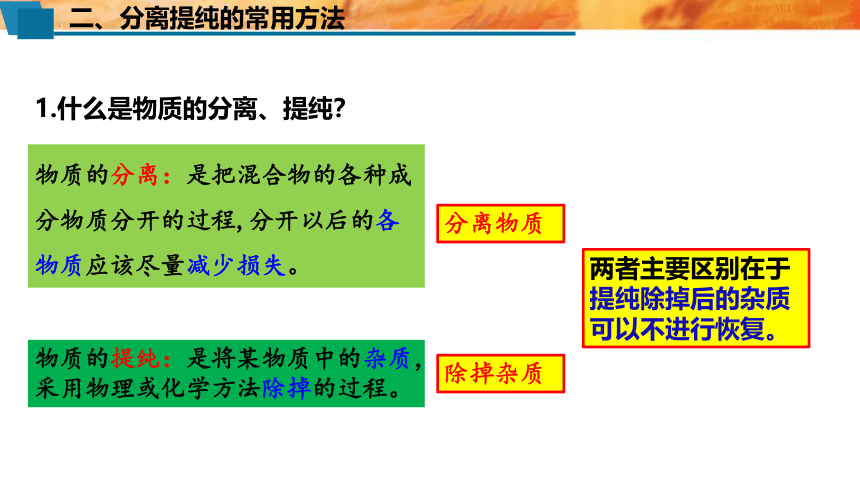
1.什么是物质的分离、提纯?
物质的分离:是把混合物的各种成分物质分开的过程,分开以后的各物质应该尽量减少损失。
物质的提纯:是将某物质中的杂质,采用物理或化学方法除掉的过程。
两者主要区别在于提纯除掉后的杂质可以不进行恢复。
分离物质
除掉杂质
二、分离提纯的常用方法
原创:WJ化学研究院
邮箱wj-chem@
2.分离、提纯物质的方法有哪些?
思考与讨论2: 下列物质中的杂质(括号中是杂质)可以用什么方法除去
(1)乙醇(水) (2)KNO3(NaCl ) (3)乙酸乙酯(乙醇)
(4)甲烷(乙烯) (5)NaCl(泥沙) (6)碘(水)
分离、提纯的方法:
物理方法:溶解、过滤、重结晶、升华、蒸发、蒸馏、萃取、分液、液化、汽化、渗析、盐析、洗气等。
化学方法:加热分解、氧化还原转化、生成沉淀、酸碱中和、络合、水解、化学方法洗气等。
杂转纯,杂变沉,
化为气,溶剂分
二、分离提纯的常用方法
原创:WJ化学研究院
邮箱wj-chem@
不增不减易分离易复原
3.分离提纯的总原则是什么?
不减少被提纯的物质
被提纯物质和杂质易分离
被提纯物质易恢复原状态
有机物的分离提纯:
蒸馏(分馏)法、萃取分液法、结晶(重结晶)法等
4.除杂操作“四注意”?
除杂试剂要过量;
过量试剂需除去;
选择的途径要最佳;
除去多种杂质时要考虑加入试剂的先后顺序。
三、蒸馏
原创:WJ化学研究院
邮箱wj-chem@
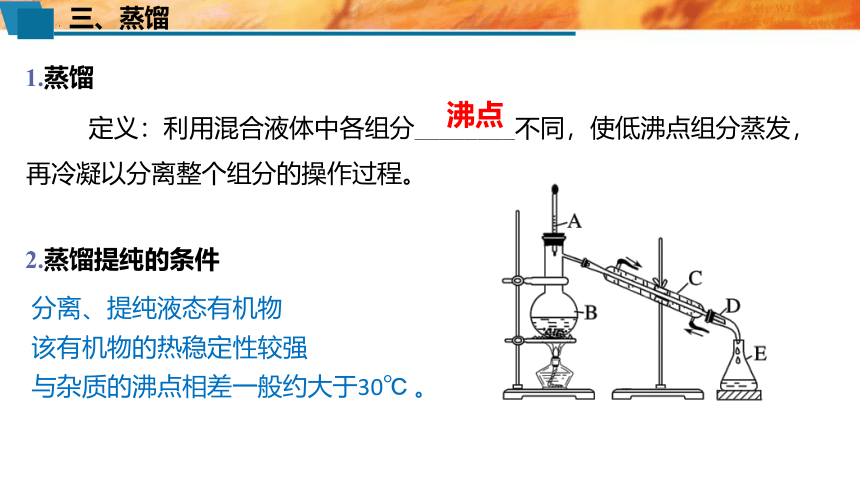
定义:利用混合液体中各组分________不同,使低沸点组分蒸发,再冷凝以分离整个组分的操作过程。
沸点
1.蒸馏
2.蒸馏提纯的条件
分离、提纯液态有机物
该有机物的热稳定性较强
与杂质的沸点相差一般约大于30℃ 。
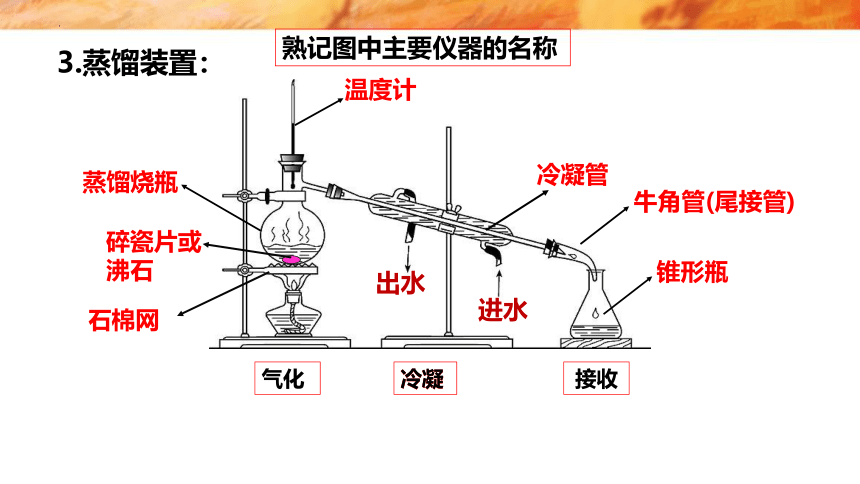
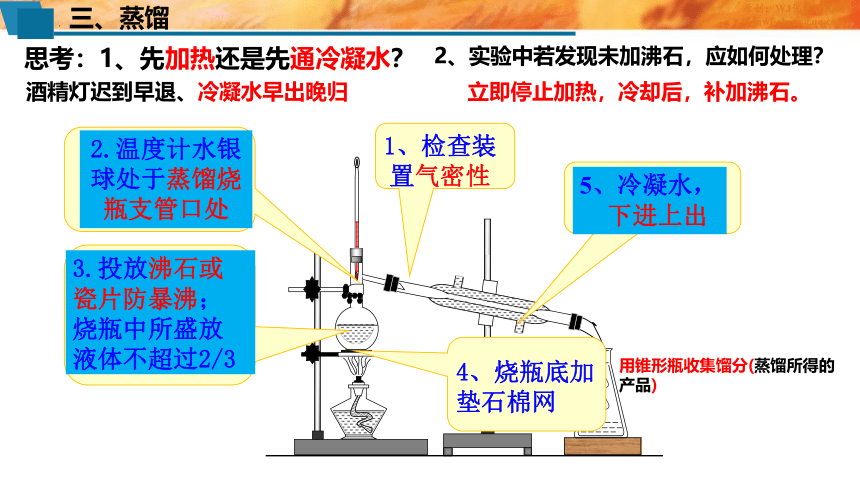
冷凝管
蒸馏烧瓶
锥形瓶
温度计
碎瓷片或沸石
进水
出水
3.蒸馏装置:
牛角管(尾接管)
石棉网
熟记图中主要仪器的名称
气化
冷凝
冷凝
接收
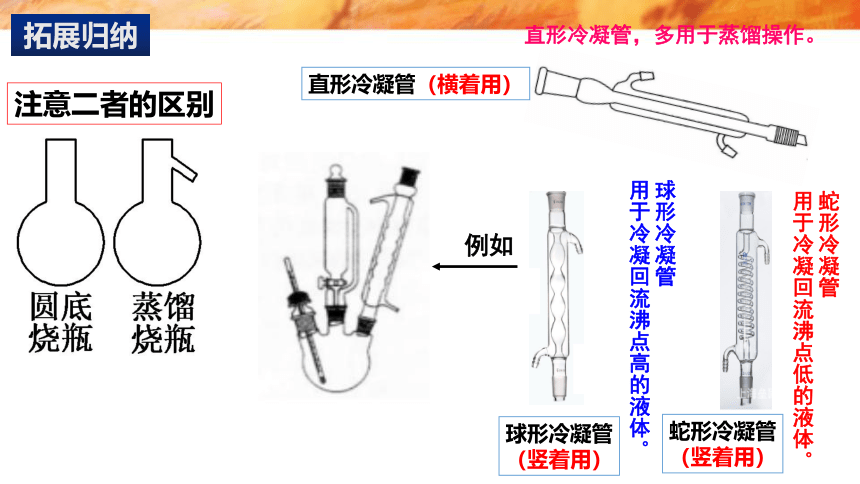
球形冷凝管
用于冷凝回流沸点高的液体。
蛇形冷凝管
用于冷凝回流沸点低的液体。
直形冷凝管,多用于蒸馏操作。
直形冷凝管(横着用)
球形冷凝管
(竖着用)
蛇形冷凝管
(竖着用)
例如
注意二者的区别
拓展归纳
2、实验中若发现未加沸石,应如何处理?
三、蒸馏
原创:WJ化学研究院
邮箱wj-chem@
2.温度计水银球处于蒸馏烧瓶支管口处
5、冷凝水,
下进上出
3.投放沸石或瓷片防暴沸;烧瓶中所盛放液体不超过2/3
4、烧瓶底加垫石棉网
1、检查装置气密性
用锥形瓶收集馏分(蒸馏所得的产品)
思考:1、先加热还是先通冷凝水?
立即停止加热,冷却后,补加沸石。
酒精灯迟到早退、冷凝水早出晚归
三、蒸馏
原创:WJ化学研究院
邮箱wj-chem@
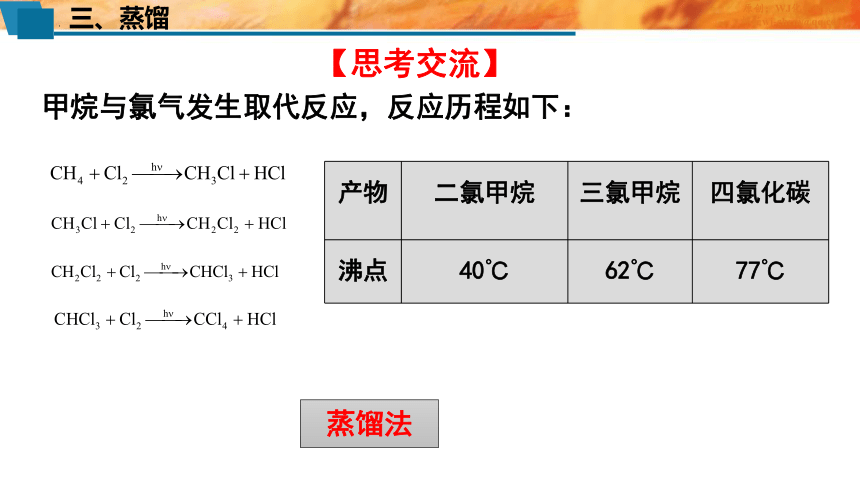
【思考交流】
甲烷与氯气发生取代反应,反应历程如下:
产物 二氯甲烷 三氯甲烷 四氯化碳
沸点 40℃ 62℃ 77℃
蒸馏法
四、萃取
原创:WJ化学研究院
邮箱wj-chem@
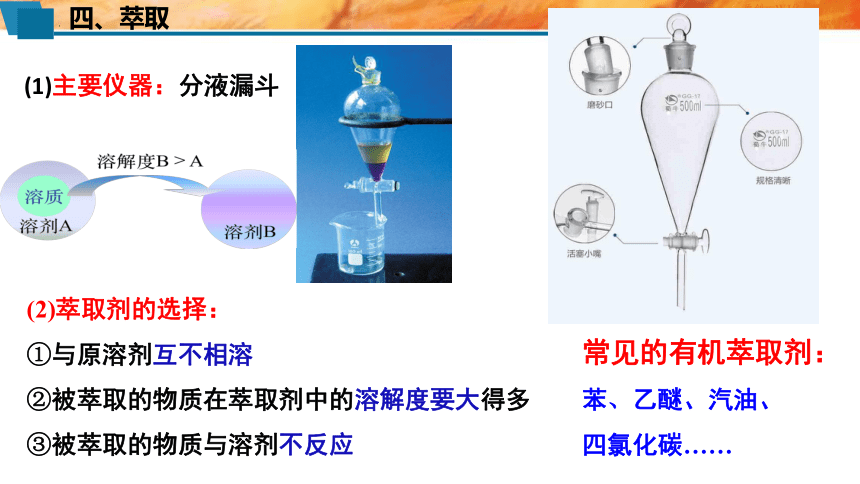
(1)主要仪器:分液漏斗
(2)萃取剂的选择:
①与原溶剂互不相溶
②被萃取的物质在萃取剂中的溶解度要大得多
③被萃取的物质与溶剂不反应
常见的有机萃取剂:
苯、乙醚、汽油、
四氯化碳……
3.萃取装置和操作:
分液漏斗(梨形)
烧杯
主要仪器
分液:
将两种互不相溶(分层)的液体混合物进行分离的操作
注意:分液和萃取是两个不同的操作方法,
分液可以单独进行,
但萃取之后一般要进行分液。
铁架台
(带铁圈)
振荡排气
静置分层
分液
检漏、装液
→
→
→
步骤:
思考:分液后应如何分离碘的四氯化碳有机溶液?
(已知:四氯化碳沸点:76.8 ℃ 碘单质沸点:184.35 ℃)
蒸馏
瓶塞(玻璃塞): 凹槽、小孔
分液漏斗:可将上下两层液体分离。
注意事项:
1.分液漏斗内液体的总体积不超过容积的2/3.
2.分液漏斗下端尖嘴部分紧靠烧杯内壁。
3.分液时应打开上口的玻璃塞或使塞上的凹槽对准漏斗口上的小孔,使液体能够顺利滴下;
4.下层液体从下口放出,及时关闭下口活塞;
上层液体从上口倒出。
可以用分液漏斗分离的一组液体混和物是
A.苯和甲苯 B.乙醇和水
C.苯和水 D.溴和四氯化碳
C
比水轻(上层):
所有的烃(己烷、苯、汽油等)
酯类(乙酸乙酯、油脂等)
比水重(上层):
硝基苯
溴苯、
CCl4、氯仿(CHCl3)、CH2Cl2、
乙醚
密度小于水
密度大于水
对点训练
固-液萃取:
用溶剂从固体物质中溶解出待分离组分的的过程。
例如:
用水浸取甜菜中的糖类;
用酒精浸取黄豆中的豆油以提高产量
(用有机溶剂从固体物质中溶解出有机物)。
专用仪器设备
拓展延伸
四、萃取分液
原创:WJ化学研究院
邮箱wj-chem@
分液
(1)原理
互不相溶的两种液体分开
(2)适用范围
液体互不相溶
(3)注意事项
分液时,记住下层的为密度大的液体,从下面放出.上层的为密度相对小的液体,从上面倒出.
萃取与分液有什么区别
提示:
(1)分液和萃取是两个不同的操作方法,分液可以单独进行,但萃取之后
一般要进行分液。
(2)分液是将两种互不相溶的液体混合物进行分离的操作。
2.提纯原理:
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
3.溶剂要求:
(1)选择适当的溶剂,要求杂质在此溶剂中溶解度很小或很大
(2)被提纯的有机物在此溶剂中的溶解度受温度影响较大,能够进行冷却结晶。
(3)溶剂毒性小,容易获得,不与被提纯物质反应。
提示:如果重结晶所得的晶体纯度不能达到要求,
可以再次重结晶以提高纯度。
1.适用范围:
(1) 固体混合物(可溶);
(2)溶解度随温度变化的程度不同
溶解度很大,留在滤液里
溶解度很小,留在滤渣里
使固体物质从溶液中以晶体状态析出的过程。
三、重结晶
加热溶解
趁热过滤
冷却结晶
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
加热溶解
冷却,结晶,过滤,洗涤,干燥
趁热过滤
重结晶法提纯苯甲酸
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
所需仪器:
酒精灯、三脚架、石棉网、
烧杯、玻璃棒、
铁架台(带铁圈)、普通漏斗
资料卡片:
1、苯甲酸为无色晶体。
2、熔点122℃,沸点249℃。
3、微溶于水,易溶于乙醇、乙醚等有机溶剂。
4.苯甲酸在水中的溶解度如下:
典例分析
五、重结晶
原创:WJ化学研究院
邮箱wj-chem@
主要仪器用品:
铁架台(带铁圈)、酒精灯、石棉网、普通漏斗、烧杯、玻璃棒、
1、溶解粗苯甲酸时加热的作用是什么?
2、趁热过滤的目的是什么?
3、实验操作中多次使用了玻璃棒,分别起到哪些作用?
4、如何检验提纯后的苯甲酸中氯化钠已被除净?
5、在重结晶过程中进行热过滤后,要用少量热溶剂冲洗几遍,其目的是什么
6、在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其洗涤的目的是什么?为什么要用冷溶剂?
7、温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
增大苯甲酸在水中的溶解度
温度高,苯甲酸不易析出
溶解时加速溶解、过滤和洗涤时引流
取最后一次洗涤液少许与试管中,加入硝酸银溶液后,无明显现象,说明氯化钠已经除净。
洗涤不溶性固体表面的可溶性有机物。
洗涤除去晶体表面附着的可溶性杂质;
用冷溶剂洗涤可降低洗涤过程中晶体的损耗。
温度过低,杂质的溶解度也会降低,部分杂质不会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
1.重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
2.溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
原理:泥沙难溶于水,氯化钠易溶于水,苯甲酸在水中的溶解度受
温度影响较大。
步骤:加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤,
洗涤,干燥。
加热作用:
促进苯甲酸溶解。
趁热过滤目的:
除去泥沙,并防止苯甲酸晶体低温析出。
思考与讨论
4.如何检验提纯后的苯甲酸中氯化钠已被除净?
3.实验中多次使用了玻璃棒,分别起到哪些作用?
(1)溶解时搅拌,加快溶解速度;
(2)过滤、洗涤时引流;
(3)干燥时用于转移晶体。
用适量蒸馏水洗涤过滤器中的苯甲酸晶体,
取少量最后一次洗涤液于试管中,加入HNO3酸化的AgNO3溶液,
若无白色沉淀生成,证明NaCl已经被除净。
5.洗涤沉淀或晶体的方法:
思考与讨论
向漏斗内加蒸馏水至浸没沉淀,待水自然流出后,重复操作两至三次,直至晶体被洗净。
五、重结晶
原创:WJ化学研究院
邮箱wj-chem@
蒸发结晶
降温结晶
两种方法的操作过程有什么区别?
结晶的两种方法
溶解度随温度变化大的
溶解度随温度变化小的(蒸发溶剂)
利用多次结晶的方法进一步提纯物质的过程,叫重结晶。
五、重结晶
原创:WJ化学研究院
邮箱wj-chem@
2.根据右图信息,下列实验的步骤是什么?
(1)提纯KNO3、NaCl (少量)混合物中KNO3
(2)提纯NaCl、KNO3 (少量)混合物中NaCl
溶解,蒸发结晶,趁热过滤,这样首先析出的是NaCl,少量的KNO3仍残留在热的溶液中
溶解,蒸发浓缩,冷却结晶,过滤得到KNO3晶体,杂质NaCl留在滤液中。
六、色谱法
原创:WJ化学研究院
邮箱wj-chem@
4、色谱法:阅读P.16
利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法叫色谱法。
色谱法是化学家分离、提纯有机物不可缺少的方法。
常用的吸附剂:碳酸钙、硅胶、氧化铝、活性炭等。
根据物质在两相(气—液、液—液等)间溶解性或吸附能力不同,分为纸上色谱法、薄层色谱法、气相色谱法、液相色谱法等。
六、色谱法
原创:WJ化学研究院
邮箱wj-chem@
蒸馏
萃取
重结
晶
分离
提纯
提纯固体有机物
提纯液体有机物
利用有机物与杂质在某种溶剂中溶解度不同
【归纳总结】
分离提纯的常见流程:
线路一:萃取----分液----蒸馏(适用于两个互溶的有机液体)
线路二:加热溶解----趁热过滤----冷却结晶----重结晶过滤---洗涤--干燥(适用于待提纯物溶解度受温度影响大的)
线路三:加热浓缩---蒸发结晶---过滤---洗涤--干燥
(适用于待提纯物溶解度受温度影响小的)
六、色谱法
原创:WJ化学研究院
邮箱wj-chem@
方 法 适用条件 主要仪器
玻璃漏斗、玻璃棒、烧杯
重结晶
蒸馏
固体有机物溶解度随温度的变化较大
分离各组分沸点不同的液态混合物
蒸馏瓶、冷凝管、尾接管、锥形瓶
过滤
分离固体和液体互不相溶的固液混合物
玻璃漏斗、玻璃棒、烧杯
七、课堂练习
原创:WJ化学研究院
邮箱wj-chem@
(1) 分离和提纯都只利用物质的物理性质,不利用物质的化学性质。( )
×
(2) 蒸馏时,冷却水从下口进,从上口出。( )
√
(3) 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出。( )
√
(4) 可用酒精萃取碘水中的碘。( )
×
(5) 在组装蒸馏装置时,温度计的水银球应处于蒸馏烧瓶的支管口处。( )
√
(6) 萃取、分液前需对分液漏斗检漏。( )
√
原创:WJ化学研究院
邮箱wj-chem@
1.分离、提纯的常用方法
方法 目的 主要仪器 实例
蒸馏 分离、提纯沸点相差较大的液态混合物 蒸馏烧瓶、冷凝管、酒精灯 分离乙酸和乙醇
萃取 将溶质从一种溶剂中转移到另一种溶剂中 分液漏斗 用四氯化碳将碘水中的碘提取出来
分液 分离互不相溶的液态混合物 分液漏斗 分离汽油和水
重结晶 利用温度对溶解度的影响提纯物质 烧杯、漏斗、酒精灯(蒸发皿) 提纯苯甲酸
洗气 分离、提纯气体混合物 洗气瓶 除去甲烷中的乙烯
盐析 溶液与胶体的分离 — 分离鸡蛋清中的蛋白质
八、知识总结
原创:WJ化学研究院
邮箱wj-chem@
2.如何选择分离方法
八、知识总结
该作品属于《WJ化学研究院》原创,如有需要请
通过wj-chem@与我联系

选择性必修三 第一章 第二节 研究有机化合物的一般方法
第1课时 有机化合物的分离与提纯
WJ化学研究院
第一章
Institute of Chemistry
2023
李时珍在《本草纲目》中记载,槟榔有“下水肿、通关节、健脾调中、治心痛积聚”等诸多病症。
槟榔是我国的四大南药之一
如果你是化学家,你该如何来研究槟榔中的有机化合物?一般的步骤和方法是什么?
有机物(粗品)
新课引入
怎样研究有机化合物?有哪些基本步骤?
分离、提纯
确定实验式
确定分子式
确定分子结构
元素定量分析
质谱法
测量相对分子质量
波谱分析:
质谱、
红外光谱、
核磁共振氢谱、x射线衍射谱
分离、提纯原理:
利用有机物与杂质的物理性质的差异将它们分离。
分离、提纯方法:
洗气、过滤、蒸馏、萃取、重结晶等
思考与讨论
二、分离提纯的常用方法
原创:WJ化学研究院
邮箱wj-chem@
1.什么是物质的分离、提纯?
物质的分离:是把混合物的各种成分物质分开的过程,分开以后的各物质应该尽量减少损失。
物质的提纯:是将某物质中的杂质,采用物理或化学方法除掉的过程。
两者主要区别在于提纯除掉后的杂质可以不进行恢复。
分离物质
除掉杂质
二、分离提纯的常用方法
原创:WJ化学研究院
邮箱wj-chem@
2.分离、提纯物质的方法有哪些?
思考与讨论2: 下列物质中的杂质(括号中是杂质)可以用什么方法除去
(1)乙醇(水) (2)KNO3(NaCl ) (3)乙酸乙酯(乙醇)
(4)甲烷(乙烯) (5)NaCl(泥沙) (6)碘(水)
分离、提纯的方法:
物理方法:溶解、过滤、重结晶、升华、蒸发、蒸馏、萃取、分液、液化、汽化、渗析、盐析、洗气等。
化学方法:加热分解、氧化还原转化、生成沉淀、酸碱中和、络合、水解、化学方法洗气等。
杂转纯,杂变沉,
化为气,溶剂分
二、分离提纯的常用方法
原创:WJ化学研究院
邮箱wj-chem@
不增不减易分离易复原
3.分离提纯的总原则是什么?
不减少被提纯的物质
被提纯物质和杂质易分离
被提纯物质易恢复原状态
有机物的分离提纯:
蒸馏(分馏)法、萃取分液法、结晶(重结晶)法等
4.除杂操作“四注意”?
除杂试剂要过量;
过量试剂需除去;
选择的途径要最佳;
除去多种杂质时要考虑加入试剂的先后顺序。
三、蒸馏
原创:WJ化学研究院
邮箱wj-chem@
定义:利用混合液体中各组分________不同,使低沸点组分蒸发,再冷凝以分离整个组分的操作过程。
沸点
1.蒸馏
2.蒸馏提纯的条件
分离、提纯液态有机物
该有机物的热稳定性较强
与杂质的沸点相差一般约大于30℃ 。
冷凝管
蒸馏烧瓶
锥形瓶
温度计
碎瓷片或沸石
进水
出水
3.蒸馏装置:
牛角管(尾接管)
石棉网
熟记图中主要仪器的名称
气化
冷凝
冷凝
接收
球形冷凝管
用于冷凝回流沸点高的液体。
蛇形冷凝管
用于冷凝回流沸点低的液体。
直形冷凝管,多用于蒸馏操作。
直形冷凝管(横着用)
球形冷凝管
(竖着用)
蛇形冷凝管
(竖着用)
例如
注意二者的区别
拓展归纳
2、实验中若发现未加沸石,应如何处理?
三、蒸馏
原创:WJ化学研究院
邮箱wj-chem@
2.温度计水银球处于蒸馏烧瓶支管口处
5、冷凝水,
下进上出
3.投放沸石或瓷片防暴沸;烧瓶中所盛放液体不超过2/3
4、烧瓶底加垫石棉网
1、检查装置气密性
用锥形瓶收集馏分(蒸馏所得的产品)
思考:1、先加热还是先通冷凝水?
立即停止加热,冷却后,补加沸石。
酒精灯迟到早退、冷凝水早出晚归
三、蒸馏
原创:WJ化学研究院
邮箱wj-chem@
【思考交流】
甲烷与氯气发生取代反应,反应历程如下:
产物 二氯甲烷 三氯甲烷 四氯化碳
沸点 40℃ 62℃ 77℃
蒸馏法
四、萃取
原创:WJ化学研究院
邮箱wj-chem@
(1)主要仪器:分液漏斗
(2)萃取剂的选择:
①与原溶剂互不相溶
②被萃取的物质在萃取剂中的溶解度要大得多
③被萃取的物质与溶剂不反应
常见的有机萃取剂:
苯、乙醚、汽油、
四氯化碳……
3.萃取装置和操作:
分液漏斗(梨形)
烧杯
主要仪器
分液:
将两种互不相溶(分层)的液体混合物进行分离的操作
注意:分液和萃取是两个不同的操作方法,
分液可以单独进行,
但萃取之后一般要进行分液。
铁架台
(带铁圈)
振荡排气
静置分层
分液
检漏、装液
→
→
→
步骤:
思考:分液后应如何分离碘的四氯化碳有机溶液?
(已知:四氯化碳沸点:76.8 ℃ 碘单质沸点:184.35 ℃)
蒸馏
瓶塞(玻璃塞): 凹槽、小孔
分液漏斗:可将上下两层液体分离。
注意事项:
1.分液漏斗内液体的总体积不超过容积的2/3.
2.分液漏斗下端尖嘴部分紧靠烧杯内壁。
3.分液时应打开上口的玻璃塞或使塞上的凹槽对准漏斗口上的小孔,使液体能够顺利滴下;
4.下层液体从下口放出,及时关闭下口活塞;
上层液体从上口倒出。
可以用分液漏斗分离的一组液体混和物是
A.苯和甲苯 B.乙醇和水
C.苯和水 D.溴和四氯化碳
C
比水轻(上层):
所有的烃(己烷、苯、汽油等)
酯类(乙酸乙酯、油脂等)
比水重(上层):
硝基苯
溴苯、
CCl4、氯仿(CHCl3)、CH2Cl2、
乙醚
密度小于水
密度大于水
对点训练
固-液萃取:
用溶剂从固体物质中溶解出待分离组分的的过程。
例如:
用水浸取甜菜中的糖类;
用酒精浸取黄豆中的豆油以提高产量
(用有机溶剂从固体物质中溶解出有机物)。
专用仪器设备
拓展延伸
四、萃取分液
原创:WJ化学研究院
邮箱wj-chem@
分液
(1)原理
互不相溶的两种液体分开
(2)适用范围
液体互不相溶
(3)注意事项
分液时,记住下层的为密度大的液体,从下面放出.上层的为密度相对小的液体,从上面倒出.
萃取与分液有什么区别
提示:
(1)分液和萃取是两个不同的操作方法,分液可以单独进行,但萃取之后
一般要进行分液。
(2)分液是将两种互不相溶的液体混合物进行分离的操作。
2.提纯原理:
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
3.溶剂要求:
(1)选择适当的溶剂,要求杂质在此溶剂中溶解度很小或很大
(2)被提纯的有机物在此溶剂中的溶解度受温度影响较大,能够进行冷却结晶。
(3)溶剂毒性小,容易获得,不与被提纯物质反应。
提示:如果重结晶所得的晶体纯度不能达到要求,
可以再次重结晶以提高纯度。
1.适用范围:
(1) 固体混合物(可溶);
(2)溶解度随温度变化的程度不同
溶解度很大,留在滤液里
溶解度很小,留在滤渣里
使固体物质从溶液中以晶体状态析出的过程。
三、重结晶
加热溶解
趁热过滤
冷却结晶
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
加热溶解
冷却,结晶,过滤,洗涤,干燥
趁热过滤
重结晶法提纯苯甲酸
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
所需仪器:
酒精灯、三脚架、石棉网、
烧杯、玻璃棒、
铁架台(带铁圈)、普通漏斗
资料卡片:
1、苯甲酸为无色晶体。
2、熔点122℃,沸点249℃。
3、微溶于水,易溶于乙醇、乙醚等有机溶剂。
4.苯甲酸在水中的溶解度如下:
典例分析
五、重结晶
原创:WJ化学研究院
邮箱wj-chem@
主要仪器用品:
铁架台(带铁圈)、酒精灯、石棉网、普通漏斗、烧杯、玻璃棒、
1、溶解粗苯甲酸时加热的作用是什么?
2、趁热过滤的目的是什么?
3、实验操作中多次使用了玻璃棒,分别起到哪些作用?
4、如何检验提纯后的苯甲酸中氯化钠已被除净?
5、在重结晶过程中进行热过滤后,要用少量热溶剂冲洗几遍,其目的是什么
6、在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其洗涤的目的是什么?为什么要用冷溶剂?
7、温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
增大苯甲酸在水中的溶解度
温度高,苯甲酸不易析出
溶解时加速溶解、过滤和洗涤时引流
取最后一次洗涤液少许与试管中,加入硝酸银溶液后,无明显现象,说明氯化钠已经除净。
洗涤不溶性固体表面的可溶性有机物。
洗涤除去晶体表面附着的可溶性杂质;
用冷溶剂洗涤可降低洗涤过程中晶体的损耗。
温度过低,杂质的溶解度也会降低,部分杂质不会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
1.重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
2.溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
原理:泥沙难溶于水,氯化钠易溶于水,苯甲酸在水中的溶解度受
温度影响较大。
步骤:加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤,
洗涤,干燥。
加热作用:
促进苯甲酸溶解。
趁热过滤目的:
除去泥沙,并防止苯甲酸晶体低温析出。
思考与讨论
4.如何检验提纯后的苯甲酸中氯化钠已被除净?
3.实验中多次使用了玻璃棒,分别起到哪些作用?
(1)溶解时搅拌,加快溶解速度;
(2)过滤、洗涤时引流;
(3)干燥时用于转移晶体。
用适量蒸馏水洗涤过滤器中的苯甲酸晶体,
取少量最后一次洗涤液于试管中,加入HNO3酸化的AgNO3溶液,
若无白色沉淀生成,证明NaCl已经被除净。
5.洗涤沉淀或晶体的方法:
思考与讨论
向漏斗内加蒸馏水至浸没沉淀,待水自然流出后,重复操作两至三次,直至晶体被洗净。
五、重结晶
原创:WJ化学研究院
邮箱wj-chem@
蒸发结晶
降温结晶
两种方法的操作过程有什么区别?
结晶的两种方法
溶解度随温度变化大的
溶解度随温度变化小的(蒸发溶剂)
利用多次结晶的方法进一步提纯物质的过程,叫重结晶。
五、重结晶
原创:WJ化学研究院
邮箱wj-chem@
2.根据右图信息,下列实验的步骤是什么?
(1)提纯KNO3、NaCl (少量)混合物中KNO3
(2)提纯NaCl、KNO3 (少量)混合物中NaCl
溶解,蒸发结晶,趁热过滤,这样首先析出的是NaCl,少量的KNO3仍残留在热的溶液中
溶解,蒸发浓缩,冷却结晶,过滤得到KNO3晶体,杂质NaCl留在滤液中。
六、色谱法
原创:WJ化学研究院
邮箱wj-chem@
4、色谱法:阅读P.16
利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法叫色谱法。
色谱法是化学家分离、提纯有机物不可缺少的方法。
常用的吸附剂:碳酸钙、硅胶、氧化铝、活性炭等。
根据物质在两相(气—液、液—液等)间溶解性或吸附能力不同,分为纸上色谱法、薄层色谱法、气相色谱法、液相色谱法等。
六、色谱法
原创:WJ化学研究院
邮箱wj-chem@
蒸馏
萃取
重结
晶
分离
提纯
提纯固体有机物
提纯液体有机物
利用有机物与杂质在某种溶剂中溶解度不同
【归纳总结】
分离提纯的常见流程:
线路一:萃取----分液----蒸馏(适用于两个互溶的有机液体)
线路二:加热溶解----趁热过滤----冷却结晶----重结晶过滤---洗涤--干燥(适用于待提纯物溶解度受温度影响大的)
线路三:加热浓缩---蒸发结晶---过滤---洗涤--干燥
(适用于待提纯物溶解度受温度影响小的)
六、色谱法
原创:WJ化学研究院
邮箱wj-chem@
方 法 适用条件 主要仪器
玻璃漏斗、玻璃棒、烧杯
重结晶
蒸馏
固体有机物溶解度随温度的变化较大
分离各组分沸点不同的液态混合物
蒸馏瓶、冷凝管、尾接管、锥形瓶
过滤
分离固体和液体互不相溶的固液混合物
玻璃漏斗、玻璃棒、烧杯
七、课堂练习
原创:WJ化学研究院
邮箱wj-chem@
(1) 分离和提纯都只利用物质的物理性质,不利用物质的化学性质。( )
×
(2) 蒸馏时,冷却水从下口进,从上口出。( )
√
(3) 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出。( )
√
(4) 可用酒精萃取碘水中的碘。( )
×
(5) 在组装蒸馏装置时,温度计的水银球应处于蒸馏烧瓶的支管口处。( )
√
(6) 萃取、分液前需对分液漏斗检漏。( )
√
原创:WJ化学研究院
邮箱wj-chem@
1.分离、提纯的常用方法
方法 目的 主要仪器 实例
蒸馏 分离、提纯沸点相差较大的液态混合物 蒸馏烧瓶、冷凝管、酒精灯 分离乙酸和乙醇
萃取 将溶质从一种溶剂中转移到另一种溶剂中 分液漏斗 用四氯化碳将碘水中的碘提取出来
分液 分离互不相溶的液态混合物 分液漏斗 分离汽油和水
重结晶 利用温度对溶解度的影响提纯物质 烧杯、漏斗、酒精灯(蒸发皿) 提纯苯甲酸
洗气 分离、提纯气体混合物 洗气瓶 除去甲烷中的乙烯
盐析 溶液与胶体的分离 — 分离鸡蛋清中的蛋白质
八、知识总结
原创:WJ化学研究院
邮箱wj-chem@
2.如何选择分离方法
八、知识总结
