人教版选修二 3.3 金属晶体与离子晶体 课件(共14张PPT)
文档属性
| 名称 | 人教版选修二 3.3 金属晶体与离子晶体 课件(共14张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 17:17:03 | ||
图片预览




文档简介
(共14张PPT)
第三节 金属晶体与离子晶体
(第2课时)
《物质结构与性质》
(1) 钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示
①判断晶体的类型。
②解释熔点变化的原因。
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
任务一:温故知新
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
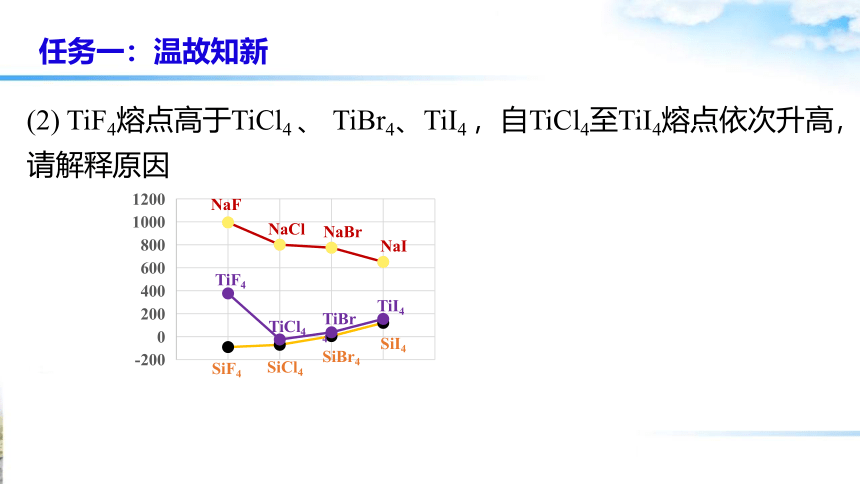
(2) TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因
TiF4
TiCl4
TiBr4
TiI4
任务一:温故知新
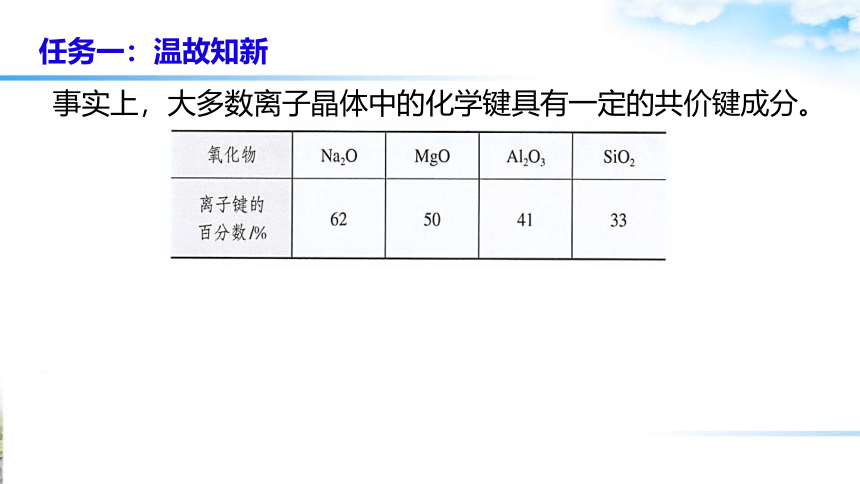
事实上,大多数离子晶体中的化学键具有一定的共价键成分。
任务一:温故知新
类型比较 分子晶体 原子晶体 金属晶体 离子晶体
构成粒子 分子 原子 金属阳离子和自由电子 阴、阳离子
粒子间的相互作用力 分子间作用力 共价键 金属键 离子键
硬度 较小 很大 有的很大,有的很小 较大
熔、沸点 较低 很高 有的很高,有的很低 较高
溶解性 相似相溶 难溶于任何溶剂 常见溶剂难溶 大多易溶于水等极性溶剂
导电、传热性 一般不导电,溶于水后有的导电 一般不具有导电性 电和热的良导体 晶体不导电,水溶液或熔融态导电
任务二:四类典型晶体的比较
过渡晶体
离子键、共价键、金属键等都是化学键的典型模型,但是,原子间形成的化学键往往是介于典型模型之间的过渡状态,由于微粒间的作用存在键型过渡,即使组成简单的的晶体,也可能介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,形成过渡晶体。
任务三:过渡晶体与混合型晶体
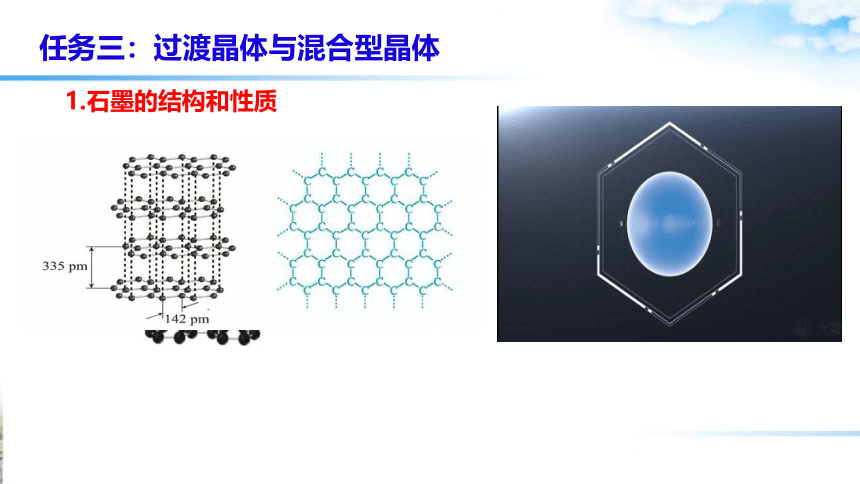
1.石墨的结构和性质
任务三:过渡晶体与混合型晶体
思考与交流1: 分析石墨晶体的构成微粒及微粒间相互作用,并解释石墨具有导电性和润滑性的原因。
任务三:过渡晶体与混合型晶体
混合型晶体
晶体类型:石墨晶体中,既有共价键,又有金属键和范德华力,属于混合型晶体
性质:熔点很高、质软、易导电等
混合型晶体既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体
任务三:过渡晶体与混合型晶体
随
堂
练
习
1.下列关于过渡晶体的说法正确的是
A.石墨属于过渡晶体
B.SiO2属于过渡晶体,但当作共价晶体来处理
C.绝大多数含有离子键的晶体都是典型的离子晶体
D.Na2O晶体中离子键的百分数为100%
√
2.碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,下列说法错误的是
A.在石墨烯晶体中,每个C原子连接3个六元环
B.在石墨烯晶体中,碳原子个数与碳碳键数目之比为1∶1
C.在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接12个六元环
D.在金刚石晶体中,六元环中最多有4个C原子在同一平面
√
随
堂
练
习
4.下列数据是对应物质的熔点(℃):
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-170 2 073 920 801 1 291 190 -51 1 723
据此做出的下列判断错误的是
A.铝的化合物的晶体中有的不是分子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
√
随
堂
练
习
纳米晶体是晶体颗粒尺寸在纳米(10-9m)量级的晶体。纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
仅以熔点为例,当晶体颗粒小至纳米量级,熔点会下降。例如,金属铅的晶粒大小与熔点的关系
晶体颗粒小于200 nm时,晶粒越小,金属铅的熔点越低。因此,我们通常说纯物质有固定的熔点,但当纯物质晶体的颗粒小于200 nm(或者250 nm)时,其熔点会发生变化。
纳米晶体为什么会有不同于大块晶体的特性呢 主要原因是晶体的表面积增大。
3. 纳米晶体
知识拓展
本课学习已结束, 请完成相应作业!
《物质结构与性质》
第三节 金属晶体与离子晶体
(第2课时)
《物质结构与性质》
(1) 钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示
①判断晶体的类型。
②解释熔点变化的原因。
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
任务一:温故知新
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
(2) TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因
TiF4
TiCl4
TiBr4
TiI4
任务一:温故知新
事实上,大多数离子晶体中的化学键具有一定的共价键成分。
任务一:温故知新
类型比较 分子晶体 原子晶体 金属晶体 离子晶体
构成粒子 分子 原子 金属阳离子和自由电子 阴、阳离子
粒子间的相互作用力 分子间作用力 共价键 金属键 离子键
硬度 较小 很大 有的很大,有的很小 较大
熔、沸点 较低 很高 有的很高,有的很低 较高
溶解性 相似相溶 难溶于任何溶剂 常见溶剂难溶 大多易溶于水等极性溶剂
导电、传热性 一般不导电,溶于水后有的导电 一般不具有导电性 电和热的良导体 晶体不导电,水溶液或熔融态导电
任务二:四类典型晶体的比较
过渡晶体
离子键、共价键、金属键等都是化学键的典型模型,但是,原子间形成的化学键往往是介于典型模型之间的过渡状态,由于微粒间的作用存在键型过渡,即使组成简单的的晶体,也可能介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,形成过渡晶体。
任务三:过渡晶体与混合型晶体
1.石墨的结构和性质
任务三:过渡晶体与混合型晶体
思考与交流1: 分析石墨晶体的构成微粒及微粒间相互作用,并解释石墨具有导电性和润滑性的原因。
任务三:过渡晶体与混合型晶体
混合型晶体
晶体类型:石墨晶体中,既有共价键,又有金属键和范德华力,属于混合型晶体
性质:熔点很高、质软、易导电等
混合型晶体既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体
任务三:过渡晶体与混合型晶体
随
堂
练
习
1.下列关于过渡晶体的说法正确的是
A.石墨属于过渡晶体
B.SiO2属于过渡晶体,但当作共价晶体来处理
C.绝大多数含有离子键的晶体都是典型的离子晶体
D.Na2O晶体中离子键的百分数为100%
√
2.碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,下列说法错误的是
A.在石墨烯晶体中,每个C原子连接3个六元环
B.在石墨烯晶体中,碳原子个数与碳碳键数目之比为1∶1
C.在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接12个六元环
D.在金刚石晶体中,六元环中最多有4个C原子在同一平面
√
随
堂
练
习
4.下列数据是对应物质的熔点(℃):
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-170 2 073 920 801 1 291 190 -51 1 723
据此做出的下列判断错误的是
A.铝的化合物的晶体中有的不是分子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
√
随
堂
练
习
纳米晶体是晶体颗粒尺寸在纳米(10-9m)量级的晶体。纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
仅以熔点为例,当晶体颗粒小至纳米量级,熔点会下降。例如,金属铅的晶粒大小与熔点的关系
晶体颗粒小于200 nm时,晶粒越小,金属铅的熔点越低。因此,我们通常说纯物质有固定的熔点,但当纯物质晶体的颗粒小于200 nm(或者250 nm)时,其熔点会发生变化。
纳米晶体为什么会有不同于大块晶体的特性呢 主要原因是晶体的表面积增大。
3. 纳米晶体
知识拓展
本课学习已结束, 请完成相应作业!
《物质结构与性质》
