人教版选修三 1.2.2 分子式的确定 课件(共22张ppt)
文档属性
| 名称 | 人教版选修三 1.2.2 分子式的确定 课件(共22张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 00:00:00 | ||
图片预览





文档简介
有机物实验式、分子式和分子结构的确定
第一章 第二节
第2课时
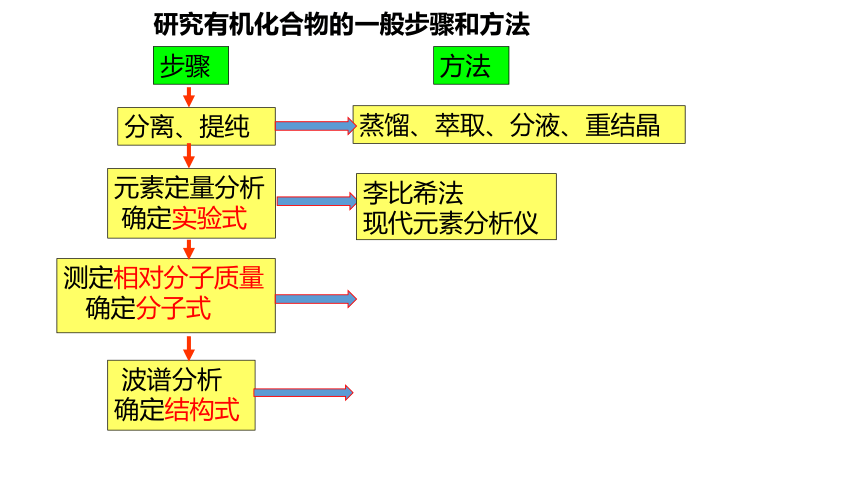
分离、提纯
步骤
方法
蒸馏、萃取、分液、重结晶
测定相对分子质量
确定分子式
波谱分析
确定结构式
元素定量分析
确定实验式
研究有机化合物的一般步骤和方法
李比希法
现代元素分析仪
定量分析:
用化学方法鉴定有机物所含元素。
1.原理:将一定量的有机化合物燃烧,转化为简单的无机化合物(C-CO2,H-H2O)并通过测定无机物的质量,计算出该有机化合物分子内各元素原子的最简整数比,确定实验式(也称最简式)
定性分析:
鉴定分子内各元素原子的质量分数。
元素分析
一、确定实验式—元素分析
2、元素分析方法:
①李比希元素分析法
②现代元素分析仪
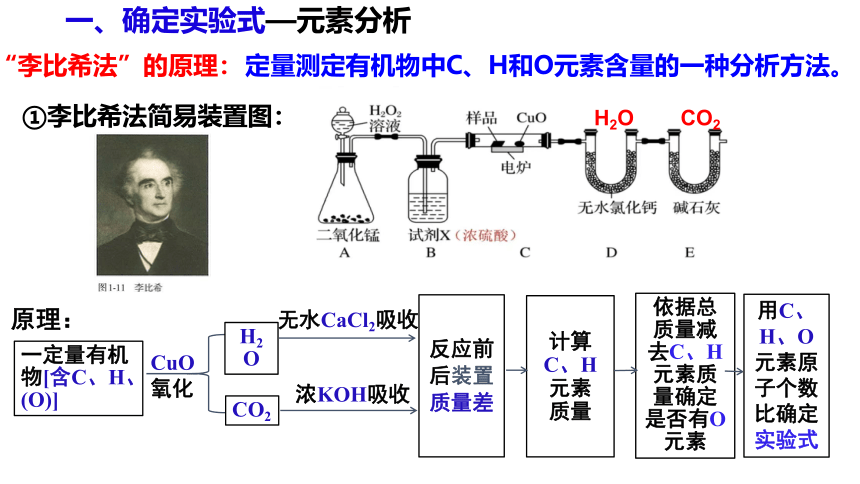
①李比希法简易装置图:
原理:
一定量有机物[含C、H、(O)]
CuO
氧化
H2O
CO2
无水CaCl2吸收
浓KOH吸收
反应前后装置质量差
计算
C、H
元素
质量
用C、H、O元素原子个数比确定实验式
依据总质量减去C、H元素质量确定是否有O元素
“李比希法”的原理:
定量测定有机物中C、H和O元素含量的一种分析方法。
H2O
CO2
一、确定实验式—元素分析
一、确定实验式—元素分析
一、确定实验式—元素分析
:可以直接测出有机物中各元素原子的质量分数
②现代元素分析仪
“快、狠、准 ”
元素定量分析方法②:
一、确定实验式—元素分析
求有机物的实验式:
【例题】某含C、H、O三种元素的未知物A,经燃烧分析实验测定A中碳的质量分数为52.16%,氢的质量分数为13.14%,求A的实验式。
解:
(1)氧的质量分数为:
100%- 52.16%-13.14%
= 34.70%
(2)各元素原子个数比:
N(C):N(H):N(O)
=
=
2 :6 :1
A的实验式为:
C2H6O
[课本P17]
一、确定实验式—元素分析
3g某有机化合物在足量氧气中完全燃烧,生成4.4g CO2和1.8g H2O。下列说法不正确的是( )
A.该有机化合物中只含有碳元素和氢元素
B.该有机化合物中一定含有氧元素
C.该有机化合物的分子式可能是C2H4O2
D.该有机化合物分子中碳原子数与氢原子数之比一定是1∶2
A
同步练习1
该有机物中C、H两种元素质量和并不等于有机物总质量,
说明该有机物中还含有O元素
一、确定实验式—元素分析
定量分析方法一:
燃烧法
有机物
CO2→m(C)
H2O→m(H)
氧化
若m(C)+ m(H)=
m(有机物)
m(有机物)
若m(C)+ m(H)<
只含C、H
含C、H、O
[李比希元素分析法]
最简式(实验式)的求法:
一、确定实验式—元素分析
练习2:5.8 g某有机物完全燃烧,生成CO2 13.2 g , H2O 5.4 g 。
(1)试求该未知物A的实验式?
(2)若要确定它的分子式,还需要什么条件?
相对分子质量
一、确定实验式—元素分析
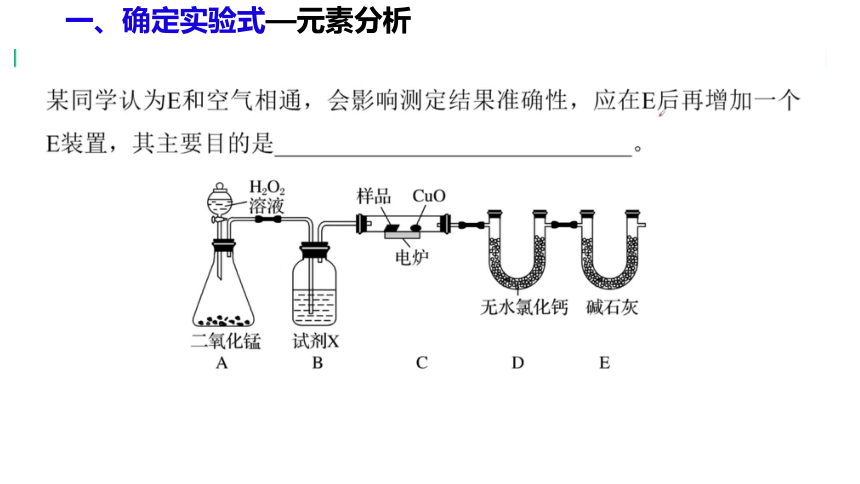
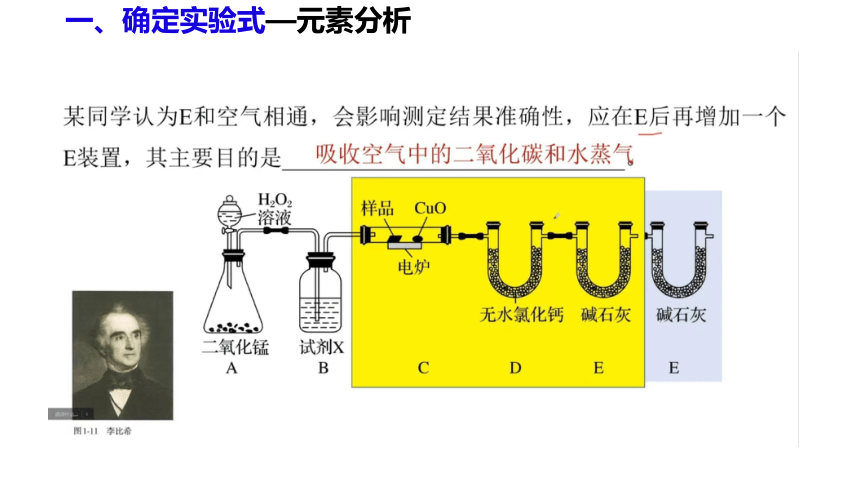
(1)产生的O2按从左到右方向流动,所选装置各导管的连接
顺序是____________________________________________;
(2)C装置中浓硫酸的作用是________________________;
(3)D装置中MnO2的作用是__________________________;
(4)燃烧管中CuO的作用是_______________________________;
g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a)
吸收水分,得到干燥的O2
催化剂,加快生成O2的速率
使有机物充分氧化生成CO2和H2O
练3、电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物组成,如图装置是用燃烧法确定有机物分子式的常用装置。
一、确定实验式—元素分析
(5)样品经充分反应后,测得A管质量增加8.8 g,B管质量增加5.4 g,消耗氧气6.72 L(标准状况下),则该有机物分子的实验式为 _______;
(6)要确定该有机物的分子式,还要知道_____________。
C2H6O
相对分子质量
练3、电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物组成,如图装置是用燃烧法确定有机物分子式的常用装置。
实验式:表示化合物分子中所含元素的原子数目最简整数比的式子。
分子式:表示化合物所含元素的原子种类及数目的式子,表示物质的真实组成。
一、确定实验式—元素分析
分离、提纯
步骤
方法
蒸馏、萃取、分液、重结晶
测定相对分子质量
确定分子式
波谱分析
确定结构式
元素定量分析
确定实验式
研究有机化合物的一般步骤和方法
李比希法
现代元素分析仪
质谱法
→确定相对分子质量
列式计算下列有机物的相对分子质量:
试归纳求有机物相对分子质量的方法。
思考:回顾所学知识,有哪些方法可以求相对分子质量?
28
(4)3.2g某饱和一元醇与足量金属钠反应得到1.12L(标况)氢气。
(1)标准状况下0.56g某气态烃的体积为448ml;
(2)某有机物在相同状况下对空气的相对密度为4;
(3)某有机物的蒸气密度是相同状况下氢气密度的14倍;
29×4=116
14×2=28
2R—OH + 2Na → 2R—ONa + H2↑
32
二、确定分子式—测定相对分子质量
(1)定义法:M = m / n
(5) 质谱法——测定相对分子质量。
(3)标况下有机物蒸气的密度为ρ g/L
(2)根据有机物蒸气的相对密度D
D = ????????????????
?
= ????????????????
?
M = 22.4L/mol× ρ g/L
(4)利用各类有机物的分子通式及相应的化学反应方程式
思考:回顾所学知识,有哪些方法可以求相对分子质量?
二、确定分子式—测定相对分子质量
有机物分子式的推算
例:已知某烃w(C)=80%,相对分子质量为30,求分子式。
N(C)
N(H)
=
80%
12
20%
1
:
1
3
=
该分子实验式为CH3
结合其相对分子质量30,可知其分子式为:C2H6
特殊方法:
若有机物的实验式中H已达饱和,则该有机物的实验式就是分子式。(如:CH4、CH3Cl、C2H6O等)
部分特殊组成的实验式如:CH3 当n=2时即达饱和,在不知相对分子质量时也可求得
——实验式法
[例1]某烃含氢元素的质量分数为17.2%,求此烃的实验式。你能推测该烃的分子式吗?
【问题解决实例】
[解答]由于烃只含碳、氢两种元素,则碳元素
的质量分数为(100-17.2)%=82.8%。
则该烃中各元素原子个数之比为:
该烃的实验式: C2H5
若设该烃有n个C2H5,
分子式为C4H10,达到饱和。
n=2时,
所以,该烃的分子式为C4H10
例. 5.8g某有机物完全燃烧,生成13.2gCO2,5.4g H2O .该有机物含有哪些元素?能否求出其分子式和结构式?
[解]:先确定5.8g该有机物中各组成元素的质量:
因m(C)=13.2g×12/44=3.6g ,m(H)=5.4g×2/18=0.6g, 则m(O)= 5.8g- 3.6g -0.6g = 1.6g
N(C) : N(H) : N(O) = : :
1.6g
3. 6g
0.6g
12
1
16
= 3 :6 :1
则该未知物A的实验式为C3H6O
再确定该有机物中各元素的原子数之比:
有机物分子式的推算
——燃烧法
[例2]:燃烧某有机物A 1.50g,生成1.12L(标况)CO2和0.05mol H2O。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。
【问题解决实例】
【解答】∵
∴实验式CH2O即为分子式。
又因该有机物的相对分子质量
则,实验式为:CH2O
有机物分子式的推算
——燃烧通式法
燃烧通式:
CxHy OZ+ (x+y/4-z/2) O2 xCO2 + y/2 H2O
1
x
y/2
该有机物的相对分子质量
所以,有机物A 1.50g,合0.05mol
0.05mol
0.05mol
0.05mol
X=1
y=2
又CH2 OZ分子量为30
Z=1
∴有机物A分子式:CH2O。
【解答】
[例2]:燃烧某有机物A 1.50g,生成1.12L(标况)CO2和0.05mol H2O。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。
1.列式计算下列有机物的相对分子质量:
(1) 某有机物A的蒸气密度是相同状况下氢气密度的 14倍;
(2) 某有机物在相同状况下对空气的相对密度为2;
(3) 标准状况下0.56g某气态烃的体积为44.8ml;
(4) 3.2g某饱和一元醇与足量金属钠反应得到1.12L(标况)氢气。
28
58
280
32
2.常温下,10mL某气态烃A和80mL氧气(过量)混合,点燃,使其充分燃烧后恢复到原状况,残留气体体积为65 mL。
(1)若A为烷烃,则A的分子式为__________。
(2)若A为烯烃,则A的分子式为__________。
(3)若A为炔烃,则A的分子式为__________。
C2H6
C3H6
C4H6
课堂检测
第一章 第二节
第2课时
分离、提纯
步骤
方法
蒸馏、萃取、分液、重结晶
测定相对分子质量
确定分子式
波谱分析
确定结构式
元素定量分析
确定实验式
研究有机化合物的一般步骤和方法
李比希法
现代元素分析仪
定量分析:
用化学方法鉴定有机物所含元素。
1.原理:将一定量的有机化合物燃烧,转化为简单的无机化合物(C-CO2,H-H2O)并通过测定无机物的质量,计算出该有机化合物分子内各元素原子的最简整数比,确定实验式(也称最简式)
定性分析:
鉴定分子内各元素原子的质量分数。
元素分析
一、确定实验式—元素分析
2、元素分析方法:
①李比希元素分析法
②现代元素分析仪
①李比希法简易装置图:
原理:
一定量有机物[含C、H、(O)]
CuO
氧化
H2O
CO2
无水CaCl2吸收
浓KOH吸收
反应前后装置质量差
计算
C、H
元素
质量
用C、H、O元素原子个数比确定实验式
依据总质量减去C、H元素质量确定是否有O元素
“李比希法”的原理:
定量测定有机物中C、H和O元素含量的一种分析方法。
H2O
CO2
一、确定实验式—元素分析
一、确定实验式—元素分析
一、确定实验式—元素分析
:可以直接测出有机物中各元素原子的质量分数
②现代元素分析仪
“快、狠、准 ”
元素定量分析方法②:
一、确定实验式—元素分析
求有机物的实验式:
【例题】某含C、H、O三种元素的未知物A,经燃烧分析实验测定A中碳的质量分数为52.16%,氢的质量分数为13.14%,求A的实验式。
解:
(1)氧的质量分数为:
100%- 52.16%-13.14%
= 34.70%
(2)各元素原子个数比:
N(C):N(H):N(O)
=
=
2 :6 :1
A的实验式为:
C2H6O
[课本P17]
一、确定实验式—元素分析
3g某有机化合物在足量氧气中完全燃烧,生成4.4g CO2和1.8g H2O。下列说法不正确的是( )
A.该有机化合物中只含有碳元素和氢元素
B.该有机化合物中一定含有氧元素
C.该有机化合物的分子式可能是C2H4O2
D.该有机化合物分子中碳原子数与氢原子数之比一定是1∶2
A
同步练习1
该有机物中C、H两种元素质量和并不等于有机物总质量,
说明该有机物中还含有O元素
一、确定实验式—元素分析
定量分析方法一:
燃烧法
有机物
CO2→m(C)
H2O→m(H)
氧化
若m(C)+ m(H)=
m(有机物)
m(有机物)
若m(C)+ m(H)<
只含C、H
含C、H、O
[李比希元素分析法]
最简式(实验式)的求法:
一、确定实验式—元素分析
练习2:5.8 g某有机物完全燃烧,生成CO2 13.2 g , H2O 5.4 g 。
(1)试求该未知物A的实验式?
(2)若要确定它的分子式,还需要什么条件?
相对分子质量
一、确定实验式—元素分析
(1)产生的O2按从左到右方向流动,所选装置各导管的连接
顺序是____________________________________________;
(2)C装置中浓硫酸的作用是________________________;
(3)D装置中MnO2的作用是__________________________;
(4)燃烧管中CuO的作用是_______________________________;
g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a)
吸收水分,得到干燥的O2
催化剂,加快生成O2的速率
使有机物充分氧化生成CO2和H2O
练3、电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物组成,如图装置是用燃烧法确定有机物分子式的常用装置。
一、确定实验式—元素分析
(5)样品经充分反应后,测得A管质量增加8.8 g,B管质量增加5.4 g,消耗氧气6.72 L(标准状况下),则该有机物分子的实验式为 _______;
(6)要确定该有机物的分子式,还要知道_____________。
C2H6O
相对分子质量
练3、电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物组成,如图装置是用燃烧法确定有机物分子式的常用装置。
实验式:表示化合物分子中所含元素的原子数目最简整数比的式子。
分子式:表示化合物所含元素的原子种类及数目的式子,表示物质的真实组成。
一、确定实验式—元素分析
分离、提纯
步骤
方法
蒸馏、萃取、分液、重结晶
测定相对分子质量
确定分子式
波谱分析
确定结构式
元素定量分析
确定实验式
研究有机化合物的一般步骤和方法
李比希法
现代元素分析仪
质谱法
→确定相对分子质量
列式计算下列有机物的相对分子质量:
试归纳求有机物相对分子质量的方法。
思考:回顾所学知识,有哪些方法可以求相对分子质量?
28
(4)3.2g某饱和一元醇与足量金属钠反应得到1.12L(标况)氢气。
(1)标准状况下0.56g某气态烃的体积为448ml;
(2)某有机物在相同状况下对空气的相对密度为4;
(3)某有机物的蒸气密度是相同状况下氢气密度的14倍;
29×4=116
14×2=28
2R—OH + 2Na → 2R—ONa + H2↑
32
二、确定分子式—测定相对分子质量
(1)定义法:M = m / n
(5) 质谱法——测定相对分子质量。
(3)标况下有机物蒸气的密度为ρ g/L
(2)根据有机物蒸气的相对密度D
D = ????????????????
?
= ????????????????
?
M = 22.4L/mol× ρ g/L
(4)利用各类有机物的分子通式及相应的化学反应方程式
思考:回顾所学知识,有哪些方法可以求相对分子质量?
二、确定分子式—测定相对分子质量
有机物分子式的推算
例:已知某烃w(C)=80%,相对分子质量为30,求分子式。
N(C)
N(H)
=
80%
12
20%
1
:
1
3
=
该分子实验式为CH3
结合其相对分子质量30,可知其分子式为:C2H6
特殊方法:
若有机物的实验式中H已达饱和,则该有机物的实验式就是分子式。(如:CH4、CH3Cl、C2H6O等)
部分特殊组成的实验式如:CH3 当n=2时即达饱和,在不知相对分子质量时也可求得
——实验式法
[例1]某烃含氢元素的质量分数为17.2%,求此烃的实验式。你能推测该烃的分子式吗?
【问题解决实例】
[解答]由于烃只含碳、氢两种元素,则碳元素
的质量分数为(100-17.2)%=82.8%。
则该烃中各元素原子个数之比为:
该烃的实验式: C2H5
若设该烃有n个C2H5,
分子式为C4H10,达到饱和。
n=2时,
所以,该烃的分子式为C4H10
例. 5.8g某有机物完全燃烧,生成13.2gCO2,5.4g H2O .该有机物含有哪些元素?能否求出其分子式和结构式?
[解]:先确定5.8g该有机物中各组成元素的质量:
因m(C)=13.2g×12/44=3.6g ,m(H)=5.4g×2/18=0.6g, 则m(O)= 5.8g- 3.6g -0.6g = 1.6g
N(C) : N(H) : N(O) = : :
1.6g
3. 6g
0.6g
12
1
16
= 3 :6 :1
则该未知物A的实验式为C3H6O
再确定该有机物中各元素的原子数之比:
有机物分子式的推算
——燃烧法
[例2]:燃烧某有机物A 1.50g,生成1.12L(标况)CO2和0.05mol H2O。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。
【问题解决实例】
【解答】∵
∴实验式CH2O即为分子式。
又因该有机物的相对分子质量
则,实验式为:CH2O
有机物分子式的推算
——燃烧通式法
燃烧通式:
CxHy OZ+ (x+y/4-z/2) O2 xCO2 + y/2 H2O
1
x
y/2
该有机物的相对分子质量
所以,有机物A 1.50g,合0.05mol
0.05mol
0.05mol
0.05mol
X=1
y=2
又CH2 OZ分子量为30
Z=1
∴有机物A分子式:CH2O。
【解答】
[例2]:燃烧某有机物A 1.50g,生成1.12L(标况)CO2和0.05mol H2O。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。
1.列式计算下列有机物的相对分子质量:
(1) 某有机物A的蒸气密度是相同状况下氢气密度的 14倍;
(2) 某有机物在相同状况下对空气的相对密度为2;
(3) 标准状况下0.56g某气态烃的体积为44.8ml;
(4) 3.2g某饱和一元醇与足量金属钠反应得到1.12L(标况)氢气。
28
58
280
32
2.常温下,10mL某气态烃A和80mL氧气(过量)混合,点燃,使其充分燃烧后恢复到原状况,残留气体体积为65 mL。
(1)若A为烷烃,则A的分子式为__________。
(2)若A为烯烃,则A的分子式为__________。
(3)若A为炔烃,则A的分子式为__________。
C2H6
C3H6
C4H6
课堂检测
