2.2.1氯的重要化合物(课件)(共31张PPT)高一化学人教版必修一
文档属性
| 名称 | 2.2.1氯的重要化合物(课件)(共31张PPT)高一化学人教版必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 16:11:03 | ||
图片预览









文档简介
(共31张PPT)
第二章 海水中的重要元素—钠和氯
第二节 氯及其化合物
学习目标
1、能说出氯元素在自然界的存在形式及主要物理性质。
2、能写出氯气与金属单质、水、碱反应的化学方程式或离子方程式;能从氧化还原反应的角度认识燃烧现象的本质。能设计简单实验检验Cl 。
3、能通过学习氯气的实验室制法,知道实验室制取氯气的一般步骤。
4、能依据氯元素价态的变化说明氯及其化合物的转化;能解释氯及其化合物在生产、生活中应用的原理。
氯的存在及用途——氯的存在
氯是一种重要的“成盐元素”
在自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。
海水
盐湖
盐矿
氯的存在及用途——氯的用途
氯气的用途:是一种重要的化工原料
大量用于制造盐酸、有机溶剂、农药、染料和药品等
盐酸
有机溶剂
农药
药品
染料
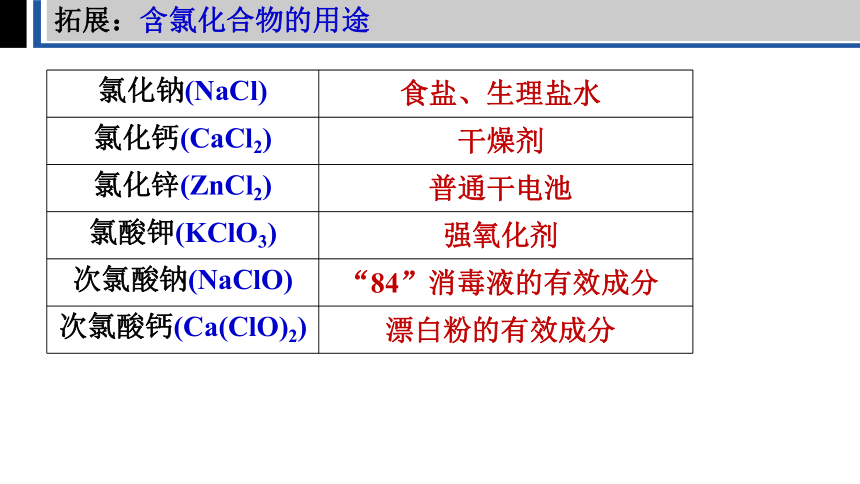
拓展:含氯化合物的用途
氯化钠(NaCl)
氯化钙(CaCl2)
氯化锌(ZnCl2)
氯酸钾(KClO3)
次氯酸钠(NaClO)
次氯酸钙(Ca(ClO)2)
食盐、生理盐水
干燥剂
普通干电池
强氧化剂
“84”消毒液的有效成分
漂白粉的有效成分
氯气的发现和确认
科学史话:氯气的发现和确认
1774年瑞典化学家舍勒发现氯气,但他受当时流行学说 ( 燃素说 ) 的影响,未能确认这种气体,直到1810 年英国化学家戴维以大量的实验事实为依据确认其为一种新元素,并将这种元素命名为chlorine,有绿色的意思,中文译名曾成“绿气”,后改为“氯气”。
舍勒
戴维
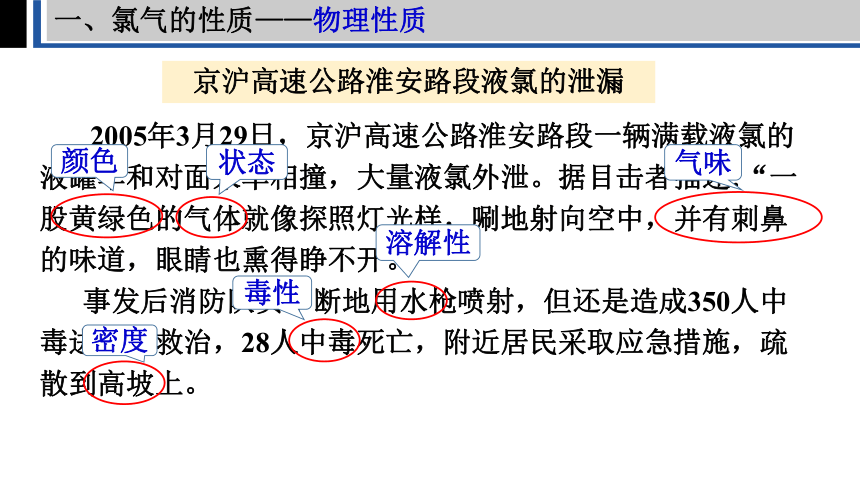
一、氯气的性质——物理性质
京沪高速公路淮安路段液氯的泄漏
2005年3月29日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞,大量液氯外泄。据目击者描述:“一股黄绿色的气体就像探照灯光样,唰地射向空中,并有刺鼻的味道,眼睛也熏得睁不开。
事发后消防队员不断地用水枪喷射,但还是造成350人中毒进医院救治,28人中毒死亡,附近居民采取应急措施,疏散到高坡上。
颜色
状态
气味
溶解性
毒性
密度
一、氯气的性质
1、氯气的物理性质
色态 气味 密度 水溶性 毒性 沸点
黄绿色气体
刺激性气味
比空
气大
可溶于水
(1:2)
有毒
34.6℃
易液化
液氯
实验室闻气体的方法
一扇
二飘
三闻
在瓶口轻轻扇动
使极少量气体飘入鼻孔
仔细辨别气味
一、氯气的性质
2、氯气的化学性质
氯气表现出 性
强氧化
常见化合价: 1、0、+1、+5、+7
易得e
+17
2
7
8
Cl
+17
2
8
Cl
8
一、氯气的性质
2、氯气的化学性质
(1) 与金属的反应:
氯气能与大多数金属化合,生产金属氯化物。如钠、铁、铜等都能与氯气在加热条件下发生反应。
一、氯气的性质
(1) 与金属的反应:
金属 现象 化学方程式
钠
铁
铜
黄色火焰,产生白烟。
2Na+Cl2 === 2NaCl
点燃
产生棕褐色的烟,
溶于水得棕黄色溶液
2Fe+3Cl2 === 2FeCl3
点燃
产生棕黄色的烟,
溶于水后溶液呈蓝绿色
Cu+Cl2 === CuCl2
点燃
一、氯气的性质
温馨提示:
(1) 氯气具有强氧化性,因此氯气与变价金属反应时,均生成高价态的金属氯化物;且与用量无关。
(2) 常温下,干燥的Cl2与Fe不反应,故工业上常用钢瓶贮运液氯。
储存液氯的钢瓶
练、列各化合物不能由单质直接化合制取的是( )
A. FeCl3 B. CuCl2 C. AlCl3 D. FeCl2
一、氯气的性质
实验2-7:氯气与氢气的反应
(2) 与非金属的反应
(能与大多数非金属单质反应)
实验装置 实验操作 实验现象 实验结论
在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察现象。
纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,瓶口有白雾
H2+Cl2===2HCl
点燃
一、氯气的性质
温馨提示:
(1) H2与Cl2混合,在强光照射下可能会发生爆炸。
(2) 实际工业生产可利用H2在Cl2中燃烧的反应制备盐酸。
(3) 对燃烧的新认识:可燃物与氧化剂(如O2、Cl2、CO2等)在一定条件下发生的发光、发热的剧烈反应都可以称为燃烧。(即燃烧不一定要有O2参与)
一、氯气的性质
有时当我们打开自来水时,会闻到一股轻微的刺激性的气味?你知道这是什么原因吗?
目前,很多自来水厂用氯气来杀菌、消毒,偶尔闻到的刺激性气味就是多余的氯气
一、氯气的性质
(3) 与水的反应
在25℃时,1体积的水可溶解2体积的氯气,氯气的水溶液称为氯水。
新
制
氯
水
思考:
(1) 新制的氯水为什么呈浅黄绿色?
(2) 氯气溶于水为什么能杀菌、消毒?
一、氯气的性质
在常温下、溶于水中的部分氯气与水发生反应
思考:(1) 新制的氯水为什么呈浅黄绿色?
(2) 氯气溶于水为什么能杀菌、消毒?
Cl2 + H2O = HCl + HClO
(次氯酸)
结论:(1) 新制的氯水中因含有Cl2呈浅黄绿色。
(2) HClO具有强氧化性,能杀死水中的病菌,起到消毒的作用
思考:氯气与水的反应是氧化还原反应吗?若是请分析氧化剂、还原剂分别是什么?
一、氯气的性质
Cl2 + H2O = HCl + HClO
0 1 +1
得到e ,被还原
失去e ,被氧化
氧化剂:
还原剂:
氧化产物:
还原产物:
Cl2
Cl2
HClO
HCl
一、氯气的性质
实验2-8:氯水的漂白性
实验操作
实验现象
实验结论 有色布条不褪色
有色布条褪色
有色鲜花褪色
干燥的Cl2无漂白作用,
在有H2O存在的条件下, Cl2有漂白作用。
HClO
一、氯气的性质
小结:次氯酸的性质
HClO
弱酸性
不稳定性
强氧化性
比碳酸的酸性弱
光照
2HClO === 2HCl+O2↑
实验室中氯水需现用现配,置于棕色试剂瓶中密封保存
有漂白性(作棉、麻和纸张的漂白剂)
有杀菌、消毒作用
一、氯气的性质
分析:新制氯水的成分
(1) 反应原理
Cl2 + H2O H+ + Cl + HClO
HClO H+ + ClO
H2O H+ + OH
(2) 新制氯水的成分
三分子:_________________
四离子:______________________
Cl2、HClO、H2O
H+、Cl 、ClO 、 OH
一、氯气的性质
(3) 在不同的反应中,新制氯水中起作用的成分不同
新制氯水
Cl2
Cl
HClO
H+
HClO
强氧化性
能氧化I 、S2 、Fe2+等
生成沉淀
加入AgNO3溶液产生白色沉淀
不稳定性
光照下有气泡产生
漂白性
使有色布条或品红溶液褪色
酸性
加活泼金属、碳酸盐产生气泡
使紫色石蕊溶液先变红(H+)后褪色(HClO)
一、氯气的性质
(4) 新制氯水与久置氯水的区别
光照氯水,浅黄绿色逐渐褪去,溶液的酸性逐渐增强(HClO→HCl),久置氯水的氯水即为盐酸。
一、氯气的性质
思考与交流:在Cl2与H2O反应原理的基础上,如果把Cl2通入NaOH溶液中,能否发生反应?
Cl2 + H2O = HCl + HClO
HCl + NaOH = NaCl + H2O
HClO + NaOH = NaClO + H2O
Cl2 + 2NaOH = NaCl + NaClO + H2O
氯气 + 碱 = 氯化物 + 次氯酸盐 + 水
一、氯气的性质
(4) 与碱的反应
① Cl2与NaOH溶液反应
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2 + 2OH = Cl + ClO + H2O
离子方程式:
此反应的应用
a、工业上制取以NaClO为有效成分的漂白液
1984年北京地坛医院的前身北京第一传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,经北京市卫生局组织专家鉴定,授予应用成果二等奖,定名为“84”肝炎洗消液,后更名为“84消毒液”。
一、氯气的性质
(4) 与碱的反应
① Cl2与NaOH溶液反应
Cl2+2NaOH=NaCl+NaClO+H2O
离子方程式:Cl2 + 2OH = Cl + ClO + H2O
此反应的应用
a、工业上制取以NaClO为有效成分的漂白液
b、可吸收尾气中的有毒气体Cl2
拓展:3Cl2 + 6OH = 5Cl + ClO3 + 3H2O
一、氯气的性质
(4)与碱的反应
② Cl2与石灰乳反应
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Cl2+Ca(OH)2=Ca2++Cl +ClO +H2O
离子方程式:
此反应的应用:
工业上制取以Ca(ClO)2为有效成分的漂白粉、漂粉精
一、氯气的性质
漂白液、漂白粉、漂粉精有什么不同
漂白液:次氯酸钠的水溶液;
漂白粉:氯化钙与次氯酸钙的混合物,
漂粉精:与漂白粉的成分一样,只是有效成分次氯酸钙的含量更高一些
漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的漂白剂,又可作游泳池等场所的消毒剂。
漂白液、漂白粉、漂粉精的漂白原理
家用漂白、消毒:
NaClO + CO2 + H2O = NaCO3 + HClO
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
工业漂白:Ca(ClO)2 + 2HCl = CaCl2 + 2HClO
原理:在酸性条件下生成有漂白、消毒作用的次氯酸
漂白粉的有效成分:
CaCl2和Ca(ClO)2
Ca(ClO)2
漂白粉的主要成分:
一、氯气的性质
漂白液、漂白粉、漂粉精的漂白原理
家用漂白、消毒:
NaClO+CO2+H2O=NaCO3+HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
工业漂白:Ca(ClO)2+2HCl=CaCl2+2HClO
原理:在酸性条件下生成有漂白、消毒作用的次氯酸
结论:漂白粉放置在空气中会失效
保存:
避光密封存放于干燥处
一、氯气的性质
温馨提示:
(1) NaClO、Ca(ClO)2在没有酸存在的条件下,也具有强的氧化性,能氧化I 、S2 、SO32 、 Fe2+等,因此在溶液中ClO 与这些离子都不能大量共存。
(2) 洁厕灵(含HCl)不能与“84”消毒液同时使用。
Cl + ClO + 2H+ = Cl2↑ + H2O
离子方程式:____________________________
一、氯气的性质
第二章 海水中的重要元素—钠和氯
第二节 氯及其化合物
学习目标
1、能说出氯元素在自然界的存在形式及主要物理性质。
2、能写出氯气与金属单质、水、碱反应的化学方程式或离子方程式;能从氧化还原反应的角度认识燃烧现象的本质。能设计简单实验检验Cl 。
3、能通过学习氯气的实验室制法,知道实验室制取氯气的一般步骤。
4、能依据氯元素价态的变化说明氯及其化合物的转化;能解释氯及其化合物在生产、生活中应用的原理。
氯的存在及用途——氯的存在
氯是一种重要的“成盐元素”
在自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。
海水
盐湖
盐矿
氯的存在及用途——氯的用途
氯气的用途:是一种重要的化工原料
大量用于制造盐酸、有机溶剂、农药、染料和药品等
盐酸
有机溶剂
农药
药品
染料
拓展:含氯化合物的用途
氯化钠(NaCl)
氯化钙(CaCl2)
氯化锌(ZnCl2)
氯酸钾(KClO3)
次氯酸钠(NaClO)
次氯酸钙(Ca(ClO)2)
食盐、生理盐水
干燥剂
普通干电池
强氧化剂
“84”消毒液的有效成分
漂白粉的有效成分
氯气的发现和确认
科学史话:氯气的发现和确认
1774年瑞典化学家舍勒发现氯气,但他受当时流行学说 ( 燃素说 ) 的影响,未能确认这种气体,直到1810 年英国化学家戴维以大量的实验事实为依据确认其为一种新元素,并将这种元素命名为chlorine,有绿色的意思,中文译名曾成“绿气”,后改为“氯气”。
舍勒
戴维
一、氯气的性质——物理性质
京沪高速公路淮安路段液氯的泄漏
2005年3月29日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞,大量液氯外泄。据目击者描述:“一股黄绿色的气体就像探照灯光样,唰地射向空中,并有刺鼻的味道,眼睛也熏得睁不开。
事发后消防队员不断地用水枪喷射,但还是造成350人中毒进医院救治,28人中毒死亡,附近居民采取应急措施,疏散到高坡上。
颜色
状态
气味
溶解性
毒性
密度
一、氯气的性质
1、氯气的物理性质
色态 气味 密度 水溶性 毒性 沸点
黄绿色气体
刺激性气味
比空
气大
可溶于水
(1:2)
有毒
34.6℃
易液化
液氯
实验室闻气体的方法
一扇
二飘
三闻
在瓶口轻轻扇动
使极少量气体飘入鼻孔
仔细辨别气味
一、氯气的性质
2、氯气的化学性质
氯气表现出 性
强氧化
常见化合价: 1、0、+1、+5、+7
易得e
+17
2
7
8
Cl
+17
2
8
Cl
8
一、氯气的性质
2、氯气的化学性质
(1) 与金属的反应:
氯气能与大多数金属化合,生产金属氯化物。如钠、铁、铜等都能与氯气在加热条件下发生反应。
一、氯气的性质
(1) 与金属的反应:
金属 现象 化学方程式
钠
铁
铜
黄色火焰,产生白烟。
2Na+Cl2 === 2NaCl
点燃
产生棕褐色的烟,
溶于水得棕黄色溶液
2Fe+3Cl2 === 2FeCl3
点燃
产生棕黄色的烟,
溶于水后溶液呈蓝绿色
Cu+Cl2 === CuCl2
点燃
一、氯气的性质
温馨提示:
(1) 氯气具有强氧化性,因此氯气与变价金属反应时,均生成高价态的金属氯化物;且与用量无关。
(2) 常温下,干燥的Cl2与Fe不反应,故工业上常用钢瓶贮运液氯。
储存液氯的钢瓶
练、列各化合物不能由单质直接化合制取的是( )
A. FeCl3 B. CuCl2 C. AlCl3 D. FeCl2
一、氯气的性质
实验2-7:氯气与氢气的反应
(2) 与非金属的反应
(能与大多数非金属单质反应)
实验装置 实验操作 实验现象 实验结论
在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察现象。
纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,瓶口有白雾
H2+Cl2===2HCl
点燃
一、氯气的性质
温馨提示:
(1) H2与Cl2混合,在强光照射下可能会发生爆炸。
(2) 实际工业生产可利用H2在Cl2中燃烧的反应制备盐酸。
(3) 对燃烧的新认识:可燃物与氧化剂(如O2、Cl2、CO2等)在一定条件下发生的发光、发热的剧烈反应都可以称为燃烧。(即燃烧不一定要有O2参与)
一、氯气的性质
有时当我们打开自来水时,会闻到一股轻微的刺激性的气味?你知道这是什么原因吗?
目前,很多自来水厂用氯气来杀菌、消毒,偶尔闻到的刺激性气味就是多余的氯气
一、氯气的性质
(3) 与水的反应
在25℃时,1体积的水可溶解2体积的氯气,氯气的水溶液称为氯水。
新
制
氯
水
思考:
(1) 新制的氯水为什么呈浅黄绿色?
(2) 氯气溶于水为什么能杀菌、消毒?
一、氯气的性质
在常温下、溶于水中的部分氯气与水发生反应
思考:(1) 新制的氯水为什么呈浅黄绿色?
(2) 氯气溶于水为什么能杀菌、消毒?
Cl2 + H2O = HCl + HClO
(次氯酸)
结论:(1) 新制的氯水中因含有Cl2呈浅黄绿色。
(2) HClO具有强氧化性,能杀死水中的病菌,起到消毒的作用
思考:氯气与水的反应是氧化还原反应吗?若是请分析氧化剂、还原剂分别是什么?
一、氯气的性质
Cl2 + H2O = HCl + HClO
0 1 +1
得到e ,被还原
失去e ,被氧化
氧化剂:
还原剂:
氧化产物:
还原产物:
Cl2
Cl2
HClO
HCl
一、氯气的性质
实验2-8:氯水的漂白性
实验操作
实验现象
实验结论 有色布条不褪色
有色布条褪色
有色鲜花褪色
干燥的Cl2无漂白作用,
在有H2O存在的条件下, Cl2有漂白作用。
HClO
一、氯气的性质
小结:次氯酸的性质
HClO
弱酸性
不稳定性
强氧化性
比碳酸的酸性弱
光照
2HClO === 2HCl+O2↑
实验室中氯水需现用现配,置于棕色试剂瓶中密封保存
有漂白性(作棉、麻和纸张的漂白剂)
有杀菌、消毒作用
一、氯气的性质
分析:新制氯水的成分
(1) 反应原理
Cl2 + H2O H+ + Cl + HClO
HClO H+ + ClO
H2O H+ + OH
(2) 新制氯水的成分
三分子:_________________
四离子:______________________
Cl2、HClO、H2O
H+、Cl 、ClO 、 OH
一、氯气的性质
(3) 在不同的反应中,新制氯水中起作用的成分不同
新制氯水
Cl2
Cl
HClO
H+
HClO
强氧化性
能氧化I 、S2 、Fe2+等
生成沉淀
加入AgNO3溶液产生白色沉淀
不稳定性
光照下有气泡产生
漂白性
使有色布条或品红溶液褪色
酸性
加活泼金属、碳酸盐产生气泡
使紫色石蕊溶液先变红(H+)后褪色(HClO)
一、氯气的性质
(4) 新制氯水与久置氯水的区别
光照氯水,浅黄绿色逐渐褪去,溶液的酸性逐渐增强(HClO→HCl),久置氯水的氯水即为盐酸。
一、氯气的性质
思考与交流:在Cl2与H2O反应原理的基础上,如果把Cl2通入NaOH溶液中,能否发生反应?
Cl2 + H2O = HCl + HClO
HCl + NaOH = NaCl + H2O
HClO + NaOH = NaClO + H2O
Cl2 + 2NaOH = NaCl + NaClO + H2O
氯气 + 碱 = 氯化物 + 次氯酸盐 + 水
一、氯气的性质
(4) 与碱的反应
① Cl2与NaOH溶液反应
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2 + 2OH = Cl + ClO + H2O
离子方程式:
此反应的应用
a、工业上制取以NaClO为有效成分的漂白液
1984年北京地坛医院的前身北京第一传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,经北京市卫生局组织专家鉴定,授予应用成果二等奖,定名为“84”肝炎洗消液,后更名为“84消毒液”。
一、氯气的性质
(4) 与碱的反应
① Cl2与NaOH溶液反应
Cl2+2NaOH=NaCl+NaClO+H2O
离子方程式:Cl2 + 2OH = Cl + ClO + H2O
此反应的应用
a、工业上制取以NaClO为有效成分的漂白液
b、可吸收尾气中的有毒气体Cl2
拓展:3Cl2 + 6OH = 5Cl + ClO3 + 3H2O
一、氯气的性质
(4)与碱的反应
② Cl2与石灰乳反应
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Cl2+Ca(OH)2=Ca2++Cl +ClO +H2O
离子方程式:
此反应的应用:
工业上制取以Ca(ClO)2为有效成分的漂白粉、漂粉精
一、氯气的性质
漂白液、漂白粉、漂粉精有什么不同
漂白液:次氯酸钠的水溶液;
漂白粉:氯化钙与次氯酸钙的混合物,
漂粉精:与漂白粉的成分一样,只是有效成分次氯酸钙的含量更高一些
漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的漂白剂,又可作游泳池等场所的消毒剂。
漂白液、漂白粉、漂粉精的漂白原理
家用漂白、消毒:
NaClO + CO2 + H2O = NaCO3 + HClO
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
工业漂白:Ca(ClO)2 + 2HCl = CaCl2 + 2HClO
原理:在酸性条件下生成有漂白、消毒作用的次氯酸
漂白粉的有效成分:
CaCl2和Ca(ClO)2
Ca(ClO)2
漂白粉的主要成分:
一、氯气的性质
漂白液、漂白粉、漂粉精的漂白原理
家用漂白、消毒:
NaClO+CO2+H2O=NaCO3+HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
工业漂白:Ca(ClO)2+2HCl=CaCl2+2HClO
原理:在酸性条件下生成有漂白、消毒作用的次氯酸
结论:漂白粉放置在空气中会失效
保存:
避光密封存放于干燥处
一、氯气的性质
温馨提示:
(1) NaClO、Ca(ClO)2在没有酸存在的条件下,也具有强的氧化性,能氧化I 、S2 、SO32 、 Fe2+等,因此在溶液中ClO 与这些离子都不能大量共存。
(2) 洁厕灵(含HCl)不能与“84”消毒液同时使用。
Cl + ClO + 2H+ = Cl2↑ + H2O
离子方程式:____________________________
一、氯气的性质
