2.2.2氯的重要化合物(课件)(共19张PPT)高一化学人教版必修一
文档属性
| 名称 | 2.2.2氯的重要化合物(课件)(共19张PPT)高一化学人教版必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 16:12:04 | ||
图片预览



文档简介
(共19张PPT)
第二章 海水中的重要元素—钠和氯
第二节 氯及其化合物
1、反应原理:
实验室中,通常用二氧化锰(软锰矿的主要成分)与浓盐酸反应来制取氯气。
MnO2 + 4HCl(浓) == MnCl2 + Cl2↑ + 2H2O
离子方程式:
MnO2 + 4H+ + 2Cl == Mn2+ + Cl2↑ + 2H2O
温馨提示:
(1) 随着反应的消耗,浓盐酸会逐渐变稀,反应会停止。
(2) 氧化剂:_______;还原剂:______;
氧化产物:_____;还原产物:_______。
(3) HCl在反应中所表现出来的性质:_____________
MnO2
HCl
Cl2
MnCl2
还原性、酸性
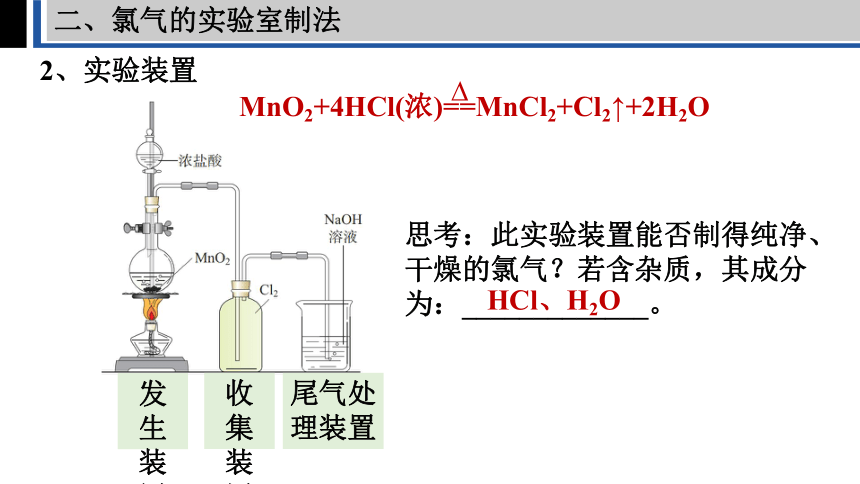
二、氯气的实验室制法
2、实验装置
思考:此实验装置能否制得纯净、干燥的氯气?若含杂质,其成分为:_____________。
发生装置
收集装置
尾气处理装置
MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
HCl、H2O
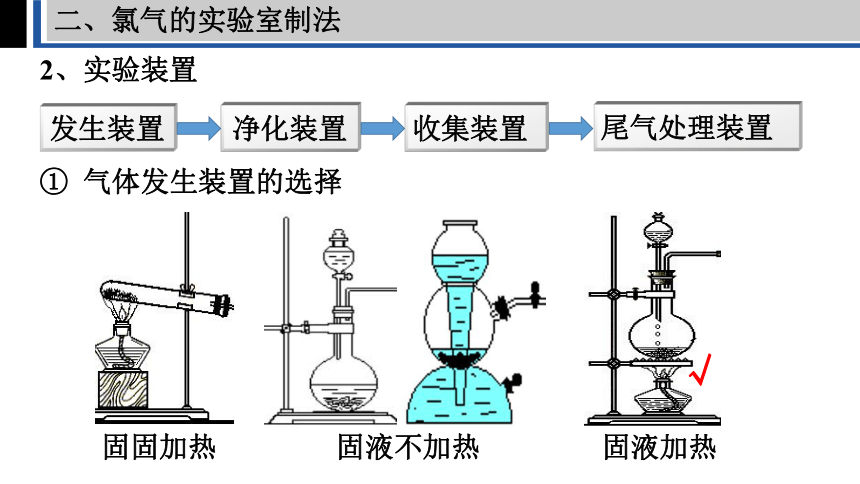
二、氯气的实验室制法
2、实验装置
发生装置
净化装置
收集装置
尾气处理装置
① 气体发生装置的选择
固固加热
固液不加热
固液加热
√
二、氯气的实验室制法
① 气体发生装置的选择
思考:在滴加浓盐酸的过程中,发现浓盐酸的流速越来越慢,请问是什么原因引起的?如何改进该实验?
用一根乳胶管将分液漏斗的上口和烧瓶连接起来,起到平衡气压便于液体顺利流下的作用。
乳胶管
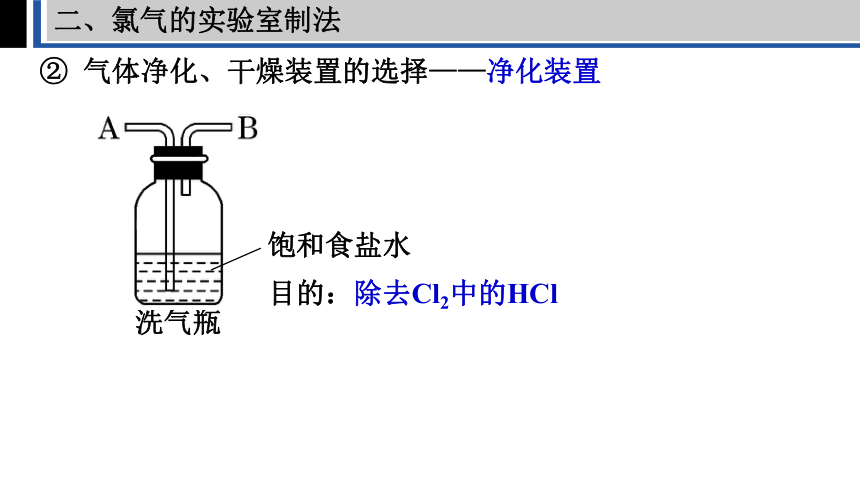
二、氯气的实验室制法
② 气体净化、干燥装置的选择——净化装置
洗气瓶
饱和食盐水
目的:除去Cl2中的HCl
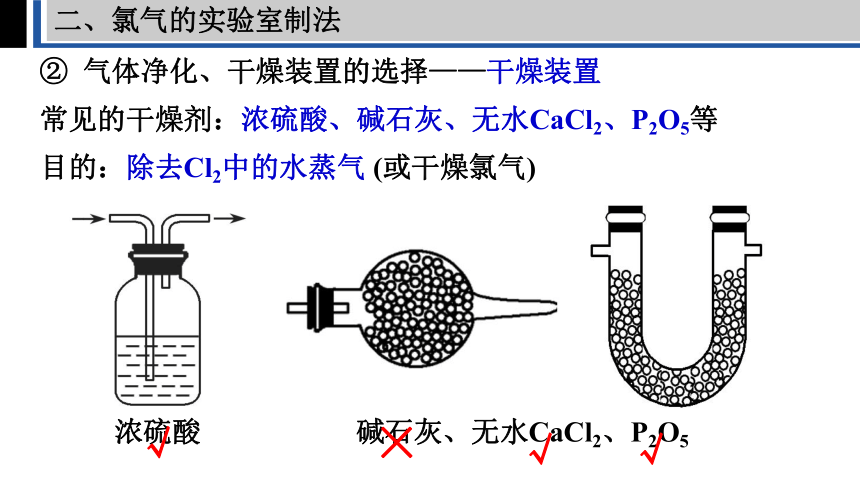
二、氯气的实验室制法
② 气体净化、干燥装置的选择——干燥装置
常见的干燥剂:浓硫酸、碱石灰、无水CaCl2、P2O5等
浓硫酸
碱石灰、无水CaCl2、P2O5
√
√
√
×
目的:除去Cl2中的水蒸气 (或干燥氯气)
二、氯气的实验室制法
③ 气体收集装置的选择
排水法 排空气法
√
收集方法:向上排空气法或排饱和食盐水法
√
二、氯气的实验室制法
④ 尾气处理装置的选择
燃烧式 吸收式 收集式
二、氯气的实验室制法
拓展:尾气处理装置——防倒吸
肚容式 倒立漏斗式 安全瓶 隔离式
由于Cl2与NaOH溶液反应不是特别快,因此装置中的导管可以直接伸入液面下,不必采取防倒吸装置。
二、氯气的实验室制法
发生装置 净化装置 净化装置 收集装置 尾气处理
2、实验装置
二、氯气的实验室制法
归纳与整理:
(1) 饱和食盐水的作用
(2) 浓硫酸的作用
(3) 饱和食盐水与浓硫酸的位置
能否对调?
(4) 如何检验氯气已收集满?
(5) 能否用澄清石灰水代替NaOH溶液?
湿润的淀粉碘化钾试纸
原理:Cl2+2I =2Cl +I2
二、氯气的实验室制法
拓展:实验室制取氯气的简易方法
从原理上分析,可寻找其它强氧化剂来代替二氧化锰,如KMnO4、K2Cr2O7、KClO3、NaClO、Ca(ClO)2等的氧化性均强于MnO2,都能够达到目的,且不需要加热。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
K2Cr2O7 +14HCl(浓)= 2KCl+2CrCl3+5Cl2↑+7H2O
KClO3 + 6HCl(浓)= KCl + 3Cl2↑+3H2O
NaClO + 2HCl(浓)= NaCl + Cl2↑ + H2O
Ca(ClO)2 + 4HCl(浓) = CaCl2 + 2Cl2↑+2H2O
氧化剂 还原剂 盐 氯气 水
拓展:氯气的工业制法
2NaCl + 2H2O === 2NaOH + H2↑ + Cl2↑
通电
氯气的工业制法:
电解饱和食盐水
实验2-9:在三支试管中分别加入2 ~ 3 mL 稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
观察现象 解释或离子方程式
加AgNO3溶液 加稀硝酸 稀盐酸
NaCl溶液
Na2CO3 溶液
产生白色沉淀
沉淀不溶解
产生白色沉淀
产生白色沉淀
沉淀不溶解
沉淀溶解
并产生气体
Ag+ + Cl =AgCl ↓
Ag+ + Cl =AgCl ↓
2Ag+ + CO32 =Ag2CO3↓
Ag2CO3 + 2H+=
2Ag + + H2O + CO2↑
三、氯离子的检验
1、氯离子的检验试剂:
2、氯离子的检验一般步骤
AgNO3溶液、稀硝酸
待测液
适量稀硝酸酸化
AgNO3溶液
若产生白色沉淀,则可判断溶液中含有Cl
温馨提示:
(1) 稀硝酸与AgNO3溶液的添加顺序对检验无影响;也可直接加硝酸酸化的硝酸银溶液。
(2) Ag2SO4不溶于水、可溶于稀硝酸。
Ag2SO4+HNO3=AgHSO4+AgNO3
三、氯离子的检验
第二节、氯及其化合物
(2020·国Ⅲ)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是________。a中的试剂为________。
(2)b中采用的加热方式是________。
c中化学反应的离子方程式是_______,
采用冰水浴冷却的目的是____________。
(3)d的作用是________,可选用试剂________(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
第二节、氯及其化合物
(2020·国Ⅲ)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
(4)反应结束后,取出b中试管,经冷却结晶,_________,_________,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显________色。可知该条件下KClO3的氧化能力______ NaClO(填“大于”或“小于”)。
氢化物 单质 氧化物 酸 盐
氯元素
化合价
物质类别
0
1
+1
+3
+4
+5
+7
HCl
NaCl
Cl2
HClO
NaClO
NaClO2
ClO2
NaClO3
Cl2O7
HClO4
NaClO4
整理与归纳:氯及其化合物“价—类”二维图
第二章 海水中的重要元素—钠和氯
第二节 氯及其化合物
1、反应原理:
实验室中,通常用二氧化锰(软锰矿的主要成分)与浓盐酸反应来制取氯气。
MnO2 + 4HCl(浓) == MnCl2 + Cl2↑ + 2H2O
离子方程式:
MnO2 + 4H+ + 2Cl == Mn2+ + Cl2↑ + 2H2O
温馨提示:
(1) 随着反应的消耗,浓盐酸会逐渐变稀,反应会停止。
(2) 氧化剂:_______;还原剂:______;
氧化产物:_____;还原产物:_______。
(3) HCl在反应中所表现出来的性质:_____________
MnO2
HCl
Cl2
MnCl2
还原性、酸性
二、氯气的实验室制法
2、实验装置
思考:此实验装置能否制得纯净、干燥的氯气?若含杂质,其成分为:_____________。
发生装置
收集装置
尾气处理装置
MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
HCl、H2O
二、氯气的实验室制法
2、实验装置
发生装置
净化装置
收集装置
尾气处理装置
① 气体发生装置的选择
固固加热
固液不加热
固液加热
√
二、氯气的实验室制法
① 气体发生装置的选择
思考:在滴加浓盐酸的过程中,发现浓盐酸的流速越来越慢,请问是什么原因引起的?如何改进该实验?
用一根乳胶管将分液漏斗的上口和烧瓶连接起来,起到平衡气压便于液体顺利流下的作用。
乳胶管
二、氯气的实验室制法
② 气体净化、干燥装置的选择——净化装置
洗气瓶
饱和食盐水
目的:除去Cl2中的HCl
二、氯气的实验室制法
② 气体净化、干燥装置的选择——干燥装置
常见的干燥剂:浓硫酸、碱石灰、无水CaCl2、P2O5等
浓硫酸
碱石灰、无水CaCl2、P2O5
√
√
√
×
目的:除去Cl2中的水蒸气 (或干燥氯气)
二、氯气的实验室制法
③ 气体收集装置的选择
排水法 排空气法
√
收集方法:向上排空气法或排饱和食盐水法
√
二、氯气的实验室制法
④ 尾气处理装置的选择
燃烧式 吸收式 收集式
二、氯气的实验室制法
拓展:尾气处理装置——防倒吸
肚容式 倒立漏斗式 安全瓶 隔离式
由于Cl2与NaOH溶液反应不是特别快,因此装置中的导管可以直接伸入液面下,不必采取防倒吸装置。
二、氯气的实验室制法
发生装置 净化装置 净化装置 收集装置 尾气处理
2、实验装置
二、氯气的实验室制法
归纳与整理:
(1) 饱和食盐水的作用
(2) 浓硫酸的作用
(3) 饱和食盐水与浓硫酸的位置
能否对调?
(4) 如何检验氯气已收集满?
(5) 能否用澄清石灰水代替NaOH溶液?
湿润的淀粉碘化钾试纸
原理:Cl2+2I =2Cl +I2
二、氯气的实验室制法
拓展:实验室制取氯气的简易方法
从原理上分析,可寻找其它强氧化剂来代替二氧化锰,如KMnO4、K2Cr2O7、KClO3、NaClO、Ca(ClO)2等的氧化性均强于MnO2,都能够达到目的,且不需要加热。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
K2Cr2O7 +14HCl(浓)= 2KCl+2CrCl3+5Cl2↑+7H2O
KClO3 + 6HCl(浓)= KCl + 3Cl2↑+3H2O
NaClO + 2HCl(浓)= NaCl + Cl2↑ + H2O
Ca(ClO)2 + 4HCl(浓) = CaCl2 + 2Cl2↑+2H2O
氧化剂 还原剂 盐 氯气 水
拓展:氯气的工业制法
2NaCl + 2H2O === 2NaOH + H2↑ + Cl2↑
通电
氯气的工业制法:
电解饱和食盐水
实验2-9:在三支试管中分别加入2 ~ 3 mL 稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
观察现象 解释或离子方程式
加AgNO3溶液 加稀硝酸 稀盐酸
NaCl溶液
Na2CO3 溶液
产生白色沉淀
沉淀不溶解
产生白色沉淀
产生白色沉淀
沉淀不溶解
沉淀溶解
并产生气体
Ag+ + Cl =AgCl ↓
Ag+ + Cl =AgCl ↓
2Ag+ + CO32 =Ag2CO3↓
Ag2CO3 + 2H+=
2Ag + + H2O + CO2↑
三、氯离子的检验
1、氯离子的检验试剂:
2、氯离子的检验一般步骤
AgNO3溶液、稀硝酸
待测液
适量稀硝酸酸化
AgNO3溶液
若产生白色沉淀,则可判断溶液中含有Cl
温馨提示:
(1) 稀硝酸与AgNO3溶液的添加顺序对检验无影响;也可直接加硝酸酸化的硝酸银溶液。
(2) Ag2SO4不溶于水、可溶于稀硝酸。
Ag2SO4+HNO3=AgHSO4+AgNO3
三、氯离子的检验
第二节、氯及其化合物
(2020·国Ⅲ)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是________。a中的试剂为________。
(2)b中采用的加热方式是________。
c中化学反应的离子方程式是_______,
采用冰水浴冷却的目的是____________。
(3)d的作用是________,可选用试剂________(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
第二节、氯及其化合物
(2020·国Ⅲ)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
(4)反应结束后,取出b中试管,经冷却结晶,_________,_________,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显________色。可知该条件下KClO3的氧化能力______ NaClO(填“大于”或“小于”)。
氢化物 单质 氧化物 酸 盐
氯元素
化合价
物质类别
0
1
+1
+3
+4
+5
+7
HCl
NaCl
Cl2
HClO
NaClO
NaClO2
ClO2
NaClO3
Cl2O7
HClO4
NaClO4
整理与归纳:氯及其化合物“价—类”二维图
