6.1.1 化学反应与热能-高一化学课件(共30张PPT)(人教版2019必修第二册)
文档属性
| 名称 | 6.1.1 化学反应与热能-高一化学课件(共30张PPT)(人教版2019必修第二册) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-11 08:37:01 | ||
图片预览











文档简介
(共30张PPT)
化学反应与能量变化
化学反应的速率与限度
现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随有能量变化,时人类获取能量的重要途径。
为了更好地利用化学反应中的物质和能量变化,在化学研究和工业生产中还需要关注化学反应的快慢和程度。能量、速度与限度时认识研究化学反应的重要视角。
1.认识物质具有能量;
2.认识吸热反应和放热反应;
3.了解化学反应体系能量改变与化学键的断裂和形成有关;
4.知道化学反应可以实现化学能与其他能量形式的转化;
5.体会提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。
【课标解读】
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等),都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。
原始社会人均耗能 农业社会人均耗能 现代社会人均耗能
8×103kJ/d 5×104kJ/d 1×106kJ/d
化学燃料的燃烧会释放大量的热。
除此之外,其他化学反应也都伴随着能量的变化吗?
【实验6-1】
在一支试管中加入2mL 2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
【实验现象】
1.镁条溶解、有气泡产生;
2.温度计示数:
3.手触摸试管的感知:
【实验结论】
【反应原理】
+Q
升高
变烫
镁与盐酸反应放出热量。
Mg+2HCl=MgCl2+H2↑
【实验6-2】
将20gBa(OH)2·8H2O晶体研细后与10gNH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯壁下部,试着用手拿起烧杯。观察现象。
【实验现象】
1.气体的气味:
2.温度计示数:
3.手触摸烧杯的感知:
4.木片与烧杯:
5.烧杯内产物状态:
有刺激性
下降
变凉
粘在了一起
【实验结论】
【反应原理】
呈糊状
Ba(OH)2·8H2O与NH4Cl反应,有NH3放出,且该反应吸热
Ba(OH)2 8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
Q+
上述的两个实验中,反应前后的温度变化,说明化学反应的过程中伴随有能量的释放或吸收。
通过大量的实验证实:所有的化学反应均有热效应,即化学反应的过程均有能量的释放或吸收。
【温馨提示】实验成功的关键是在短时间内反应充分进行,使体系温度快速降低,使木片上的水凝固。
实验中要注意几点:
①将Ba(OH)2·8H2O晶体研磨成粉末,以便与NH4Cl晶体充分接触;
②一定要在晶体混合后立即用玻璃棒快速搅拌混合物,以使它们很快反应;
③注意氨气对空气的污染,在烧杯上方放置多孔塑料板,板上放置浸有稀硫酸的棉花。
组织建设
第一节 化学反应与能量变化
(第1课时 化学反应与热能)
第六章 化学反应与能量
一、化学反应与热能
1.两条基本的自然定律
(1)质量守恒定律:物质可以发生转化,但是总质量保持不变。
(2)能量守恒定律:一种能量可以转化为另一种能量,总能量保持不变。
2.吸热反应和放热反应
(1)把释放热量的化学反应叫做放热反应
(2)把吸收热量的化学反应叫做吸热反应
【小结】根据能量变化情况角度,将化学反应分为:
(1)放热(能)反应
(2)吸热(能)反应
【归纳总结】
常见的放热反应和吸热反应(阅读教材P33)
【放热反应】
燃料的燃烧(与O2的反应)
中和反应
活泼金属与水或酸的反应
大部分化合反应(如生石灰和水)
物质的缓慢氧化
【吸热反应】
C+CO2
H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
大部分分解反应
持续加热的反应(如高温)
【小试牛刀】下列变化中属于吸热反应的是( )
①液态水汽化;②将胆矾加热变为白色粉末;③苛性钠固体溶于水;④氯酸钾分解制氧气;⑤生石灰跟水反应生成熟石灰;⑥浓硫酸溶于水。
A.①④ B.②④ C.③⑤ D.④⑥
B
【温馨提示】放热反应和吸热反应必须是化学反应
【再来一刀】下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应;②放热反应在常温下一定很容易发生;③工业合成氨是可逆反应,正反应是放热反应则逆反应是吸热反应;④镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能
A.只有③ B.只有①② C.①②③④ D.②③④
A
【能力提升】
1.放热反应不一定容易发生如工业合成氨,吸热反应也不一定必须加热,如Ba(OH)2 8H2O 和 NH4Cl ;
2.在可逆反应中,如果正反应为吸热,则逆反应为放热。
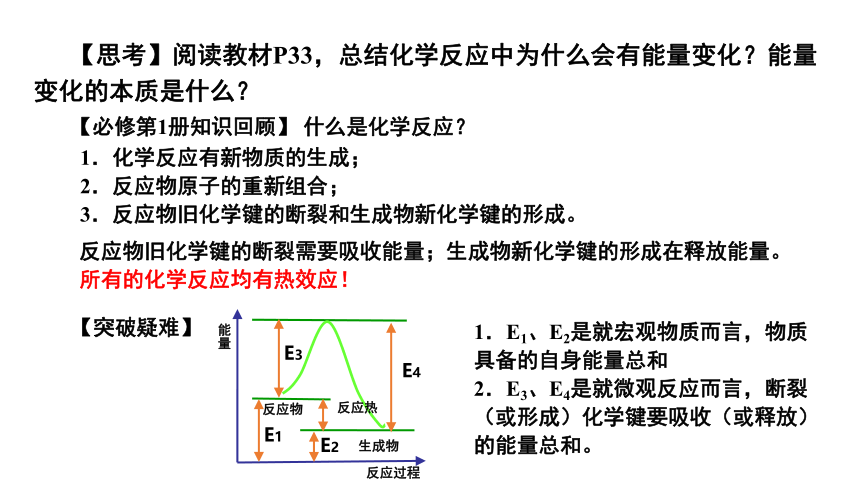
【思考】阅读教材P33,总结化学反应中为什么会有能量变化?能量变化的本质是什么?
【必修第1册知识回顾】 什么是化学反应?
1.化学反应有新物质的生成;
2.反应物原子的重新组合;
3.反应物旧化学键的断裂和生成物新化学键的形成。
反应物旧化学键的断裂需要吸收能量;生成物新化学键的形成在释放能量。
所有的化学反应均有热效应!
能量
反应过程
生成物
反应物
E3
E4
反应热
E1
E2
【突破疑难】
1.E1、E2是就宏观物质而言,物质具备的自身能量总和
2.E3、E4是就微观反应而言,断裂(或形成)化学键要吸收(或释放)的能量总和。
以H2+Cl2=2HCl反应为例探究化学反应中能量变化:
①该反应过程中共吸收 kJ能量,共放出 kJ能量。
②该反应 (填“放出”或“吸收”) kJ热量,为 反应。
679
862
放出
183
放热
(1)化学反应中能量变化的原因(微观探析):
①化学反应过程(物质变化):
E1>E2,反应吸收能量(吸热反应);
有外加的能量“储存”在生成物中
E1<E2,反应释放能量(放热反应)。
有能量从反应物中释放出来
②化学反应中能量变化的原因:
化学键的断裂与形成是化学反应中能量变化的主要原因。
3.化学反应中能量变化的原因
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物断键吸收的总能量与生成物成键放出的总能量能量的相对大小。
①看图讨论
水由高处向低处流要释放能量(势能转换为动能)
【类比于化学反应】
反应物的总能量>生成物的总能量
即:化学反应放出能量
(2)化学反应中能量的决定因素(宏观辨识):
化学反应中能量变化决定于反应物的总能量和生成物总能量的相对大小。
②看图讨论
将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为势能)
【类比于化学反应】
反应物的总能量<生成物的总能量
即:化学反应吸收能量
①反应物的总能量高
生成物的总能量低
②生成物的总能量高
反应物的总能量低
放出能量
吸收能量
①放热反应:反应物的总能量高于生成物的总能量
②吸热反应:反应物的总能量低于生成物的总能量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
【小试牛刀】化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是
( )
A.该反应是吸热反应
B.断裂1 mol A-A键和1 mol B-B键能放出x kJ能量
C.断裂2 mol A-B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
C
【再来一刀】一定条件下,石墨转化为金刚石要吸收能量。在该条件下,下列结论正确的是( )
A.金刚石比石墨稳定
B.等质量的金刚石和石墨完全燃烧释放的热量相同
C.金刚石转化为石墨是吸热反应
D.1molC(金刚石)比1molC(石墨)的总能量高
D
【方法点拨】稳定性物质的判断方法:
①物质能量越低越稳定;
②破坏化学键需要的能量越大越稳定;
③放热反应放出热量越大,生成物稳定。
4.化学反应中能量的利用情况和节能减排的意义
阅读课本教材第34~35页,思考与交流下列有关问题:
(1)现阶段人类获取热能的主要途径是什么?使用最多的常规能源有哪些?
(2)从我国能源消费总量和构成角度,了解我国能源利用存在哪些问题?
(3)节能减排的几种常见措施?
物质的燃烧。使用最多的常规能源是化石燃料(煤、石油和天然气)
①储量有限,短期内不可再生。
②影响环境:煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
①燃料燃烧阶段:提高燃料的燃烧效率。
②能量利用阶段:提高能源的利用率。
③开发使用新能源,目前人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等。
地热能
【小试牛刀】在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,对合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请完成下列问题:
(1)矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能源时期。下列不属于化石能源的是____(填字母,下同)。
A.石油 B.煤 C.天然气 D.生物质能
(2)下列对能源的看法合理的是_______。
A.化石能源属于不可再生能源,只会越用越少
B.生物质能是一种可再生能源,有广泛的前景
C.太阳能、氢能、核能、地热能都属于新能源
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约型社会
D
ABCD
放热反应
吸热反应
1.常见的吸、放热反应
2.化学反应中能量变化的原因
3.化学反应中能量的利用情况和节能减排的意义
1.下列有关新能源的说法不正确的是( )
A.绿色植物通过光合作用,将光能转化为化学能
B.风能、太阳能是清洁能源
C.氢能还未进入实用阶段的主要原因是其燃烧所放热量低于相同质量的矿物燃料
D.共享单车利用太阳能发电完成卫星定位,有利于节能环保
C
2.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。此现象说明了( )
A.该反应是吸热反应 B.铁粉与硫粉在常温下可以发生反应
C.该反应是放热反应 D.硫化亚铁的总能量高于铁粉和硫粉的总能量
C
3.氢气在氯气中燃烧时发出苍白色火焰,在反应过程中,破坏1 mol氢气中的化学键吸收的能量为a kJ,破坏1 mol氯气中的化学键吸收的能量为b kJ,形成1 mol HCl中的化学键释放的能量为c kJ,下列关系中正确的是( )
A.b>c B.a+b>2c C.a+b<c D.a+b<2c
D
4.根据日常生活和回忆已学化学反应,对下列变化按吸热或放热的标准分类:
①钠投入水中;②煅烧石灰石制生石灰;③食物腐烂;④炸药爆炸;⑤氢气在氯气中燃烧;⑥生石灰与水作用制熟石灰;⑦碳与水蒸气制取水煤气(CO和H2);⑧硫酸与氢氧化钠的中和反应;⑨氦气球受热爆炸
(1)属于放热反应的有:_____________(填序号,下同)。
(2)属于吸热反应的有:_____。
①③④⑤⑥⑧
②⑦
5.除了用手触摸和温度计测量外还可以借助其他方法感知温度的变化,如在探究过氧化钠与水反应为放热反应时,可采取如下两种方法:
(1)Ⅰ、Ⅱ装置能说明反应为放热反应的事实是:__________________
____________________________________________________________。
(2)产生上述现象的原因是:
_________________________________________________________。
滴入水后,Ⅰ中U形管
Ⅱ烧杯中导管口有气泡冒出
过氧化钠与水反应放热,锥形瓶内气体温度升高,气压增大
右侧液面下降左侧液面上升
6.已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如图所示。根据图示回答下列问题:
(1)该反应中反应物所具有的总能量______(填“高于”或“低于”)生成物的总能量。
(2)1 mol NO(g)分子中化学键断裂时要吸收____ kJ能量。
(3)断裂1 mol N≡N吸收的能量x值为______。
低于
632
946
化学反应与能量变化
化学反应的速率与限度
现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随有能量变化,时人类获取能量的重要途径。
为了更好地利用化学反应中的物质和能量变化,在化学研究和工业生产中还需要关注化学反应的快慢和程度。能量、速度与限度时认识研究化学反应的重要视角。
1.认识物质具有能量;
2.认识吸热反应和放热反应;
3.了解化学反应体系能量改变与化学键的断裂和形成有关;
4.知道化学反应可以实现化学能与其他能量形式的转化;
5.体会提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。
【课标解读】
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等),都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。
原始社会人均耗能 农业社会人均耗能 现代社会人均耗能
8×103kJ/d 5×104kJ/d 1×106kJ/d
化学燃料的燃烧会释放大量的热。
除此之外,其他化学反应也都伴随着能量的变化吗?
【实验6-1】
在一支试管中加入2mL 2mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
【实验现象】
1.镁条溶解、有气泡产生;
2.温度计示数:
3.手触摸试管的感知:
【实验结论】
【反应原理】
+Q
升高
变烫
镁与盐酸反应放出热量。
Mg+2HCl=MgCl2+H2↑
【实验6-2】
将20gBa(OH)2·8H2O晶体研细后与10gNH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯壁下部,试着用手拿起烧杯。观察现象。
【实验现象】
1.气体的气味:
2.温度计示数:
3.手触摸烧杯的感知:
4.木片与烧杯:
5.烧杯内产物状态:
有刺激性
下降
变凉
粘在了一起
【实验结论】
【反应原理】
呈糊状
Ba(OH)2·8H2O与NH4Cl反应,有NH3放出,且该反应吸热
Ba(OH)2 8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
Q+
上述的两个实验中,反应前后的温度变化,说明化学反应的过程中伴随有能量的释放或吸收。
通过大量的实验证实:所有的化学反应均有热效应,即化学反应的过程均有能量的释放或吸收。
【温馨提示】实验成功的关键是在短时间内反应充分进行,使体系温度快速降低,使木片上的水凝固。
实验中要注意几点:
①将Ba(OH)2·8H2O晶体研磨成粉末,以便与NH4Cl晶体充分接触;
②一定要在晶体混合后立即用玻璃棒快速搅拌混合物,以使它们很快反应;
③注意氨气对空气的污染,在烧杯上方放置多孔塑料板,板上放置浸有稀硫酸的棉花。
组织建设
第一节 化学反应与能量变化
(第1课时 化学反应与热能)
第六章 化学反应与能量
一、化学反应与热能
1.两条基本的自然定律
(1)质量守恒定律:物质可以发生转化,但是总质量保持不变。
(2)能量守恒定律:一种能量可以转化为另一种能量,总能量保持不变。
2.吸热反应和放热反应
(1)把释放热量的化学反应叫做放热反应
(2)把吸收热量的化学反应叫做吸热反应
【小结】根据能量变化情况角度,将化学反应分为:
(1)放热(能)反应
(2)吸热(能)反应
【归纳总结】
常见的放热反应和吸热反应(阅读教材P33)
【放热反应】
燃料的燃烧(与O2的反应)
中和反应
活泼金属与水或酸的反应
大部分化合反应(如生石灰和水)
物质的缓慢氧化
【吸热反应】
C+CO2
H2+CuO
C+H2O
Ba(OH)2.8H2O+NH4Cl
CaCO3高温分解
大部分分解反应
持续加热的反应(如高温)
【小试牛刀】下列变化中属于吸热反应的是( )
①液态水汽化;②将胆矾加热变为白色粉末;③苛性钠固体溶于水;④氯酸钾分解制氧气;⑤生石灰跟水反应生成熟石灰;⑥浓硫酸溶于水。
A.①④ B.②④ C.③⑤ D.④⑥
B
【温馨提示】放热反应和吸热反应必须是化学反应
【再来一刀】下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应;②放热反应在常温下一定很容易发生;③工业合成氨是可逆反应,正反应是放热反应则逆反应是吸热反应;④镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能
A.只有③ B.只有①② C.①②③④ D.②③④
A
【能力提升】
1.放热反应不一定容易发生如工业合成氨,吸热反应也不一定必须加热,如Ba(OH)2 8H2O 和 NH4Cl ;
2.在可逆反应中,如果正反应为吸热,则逆反应为放热。
【思考】阅读教材P33,总结化学反应中为什么会有能量变化?能量变化的本质是什么?
【必修第1册知识回顾】 什么是化学反应?
1.化学反应有新物质的生成;
2.反应物原子的重新组合;
3.反应物旧化学键的断裂和生成物新化学键的形成。
反应物旧化学键的断裂需要吸收能量;生成物新化学键的形成在释放能量。
所有的化学反应均有热效应!
能量
反应过程
生成物
反应物
E3
E4
反应热
E1
E2
【突破疑难】
1.E1、E2是就宏观物质而言,物质具备的自身能量总和
2.E3、E4是就微观反应而言,断裂(或形成)化学键要吸收(或释放)的能量总和。
以H2+Cl2=2HCl反应为例探究化学反应中能量变化:
①该反应过程中共吸收 kJ能量,共放出 kJ能量。
②该反应 (填“放出”或“吸收”) kJ热量,为 反应。
679
862
放出
183
放热
(1)化学反应中能量变化的原因(微观探析):
①化学反应过程(物质变化):
E1>E2,反应吸收能量(吸热反应);
有外加的能量“储存”在生成物中
E1<E2,反应释放能量(放热反应)。
有能量从反应物中释放出来
②化学反应中能量变化的原因:
化学键的断裂与形成是化学反应中能量变化的主要原因。
3.化学反应中能量变化的原因
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物断键吸收的总能量与生成物成键放出的总能量能量的相对大小。
①看图讨论
水由高处向低处流要释放能量(势能转换为动能)
【类比于化学反应】
反应物的总能量>生成物的总能量
即:化学反应放出能量
(2)化学反应中能量的决定因素(宏观辨识):
化学反应中能量变化决定于反应物的总能量和生成物总能量的相对大小。
②看图讨论
将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为势能)
【类比于化学反应】
反应物的总能量<生成物的总能量
即:化学反应吸收能量
①反应物的总能量高
生成物的总能量低
②生成物的总能量高
反应物的总能量低
放出能量
吸收能量
①放热反应:反应物的总能量高于生成物的总能量
②吸热反应:反应物的总能量低于生成物的总能量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
【小试牛刀】化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是
( )
A.该反应是吸热反应
B.断裂1 mol A-A键和1 mol B-B键能放出x kJ能量
C.断裂2 mol A-B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
C
【再来一刀】一定条件下,石墨转化为金刚石要吸收能量。在该条件下,下列结论正确的是( )
A.金刚石比石墨稳定
B.等质量的金刚石和石墨完全燃烧释放的热量相同
C.金刚石转化为石墨是吸热反应
D.1molC(金刚石)比1molC(石墨)的总能量高
D
【方法点拨】稳定性物质的判断方法:
①物质能量越低越稳定;
②破坏化学键需要的能量越大越稳定;
③放热反应放出热量越大,生成物稳定。
4.化学反应中能量的利用情况和节能减排的意义
阅读课本教材第34~35页,思考与交流下列有关问题:
(1)现阶段人类获取热能的主要途径是什么?使用最多的常规能源有哪些?
(2)从我国能源消费总量和构成角度,了解我国能源利用存在哪些问题?
(3)节能减排的几种常见措施?
物质的燃烧。使用最多的常规能源是化石燃料(煤、石油和天然气)
①储量有限,短期内不可再生。
②影响环境:煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
①燃料燃烧阶段:提高燃料的燃烧效率。
②能量利用阶段:提高能源的利用率。
③开发使用新能源,目前人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等。
地热能
【小试牛刀】在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,对合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展不可缺少的因素。请完成下列问题:
(1)矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能源时期。下列不属于化石能源的是____(填字母,下同)。
A.石油 B.煤 C.天然气 D.生物质能
(2)下列对能源的看法合理的是_______。
A.化石能源属于不可再生能源,只会越用越少
B.生物质能是一种可再生能源,有广泛的前景
C.太阳能、氢能、核能、地热能都属于新能源
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约型社会
D
ABCD
放热反应
吸热反应
1.常见的吸、放热反应
2.化学反应中能量变化的原因
3.化学反应中能量的利用情况和节能减排的意义
1.下列有关新能源的说法不正确的是( )
A.绿色植物通过光合作用,将光能转化为化学能
B.风能、太阳能是清洁能源
C.氢能还未进入实用阶段的主要原因是其燃烧所放热量低于相同质量的矿物燃料
D.共享单车利用太阳能发电完成卫星定位,有利于节能环保
C
2.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。此现象说明了( )
A.该反应是吸热反应 B.铁粉与硫粉在常温下可以发生反应
C.该反应是放热反应 D.硫化亚铁的总能量高于铁粉和硫粉的总能量
C
3.氢气在氯气中燃烧时发出苍白色火焰,在反应过程中,破坏1 mol氢气中的化学键吸收的能量为a kJ,破坏1 mol氯气中的化学键吸收的能量为b kJ,形成1 mol HCl中的化学键释放的能量为c kJ,下列关系中正确的是( )
A.b>c B.a+b>2c C.a+b<c D.a+b<2c
D
4.根据日常生活和回忆已学化学反应,对下列变化按吸热或放热的标准分类:
①钠投入水中;②煅烧石灰石制生石灰;③食物腐烂;④炸药爆炸;⑤氢气在氯气中燃烧;⑥生石灰与水作用制熟石灰;⑦碳与水蒸气制取水煤气(CO和H2);⑧硫酸与氢氧化钠的中和反应;⑨氦气球受热爆炸
(1)属于放热反应的有:_____________(填序号,下同)。
(2)属于吸热反应的有:_____。
①③④⑤⑥⑧
②⑦
5.除了用手触摸和温度计测量外还可以借助其他方法感知温度的变化,如在探究过氧化钠与水反应为放热反应时,可采取如下两种方法:
(1)Ⅰ、Ⅱ装置能说明反应为放热反应的事实是:__________________
____________________________________________________________。
(2)产生上述现象的原因是:
_________________________________________________________。
滴入水后,Ⅰ中U形管
Ⅱ烧杯中导管口有气泡冒出
过氧化钠与水反应放热,锥形瓶内气体温度升高,气压增大
右侧液面下降左侧液面上升
6.已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如图所示。根据图示回答下列问题:
(1)该反应中反应物所具有的总能量______(填“高于”或“低于”)生成物的总能量。
(2)1 mol NO(g)分子中化学键断裂时要吸收____ kJ能量。
(3)断裂1 mol N≡N吸收的能量x值为______。
低于
632
946
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
