3.4.1 配合物与超分子(共47张PPT)高二化学(人教版2019选择性必修2)
文档属性
| 名称 | 3.4.1 配合物与超分子(共47张PPT)高二化学(人教版2019选择性必修2) |  | |
| 格式 | pptx | ||
| 文件大小 | 120.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 16:19:45 | ||
图片预览








文档简介
(共47张PPT)
第四节 配合物与超分子
第1课时
第三章 晶体结构与性质
本节重点
本节难点
2
1
配位键、配合物的概念,配合物的制备
配位化合物的成键特征
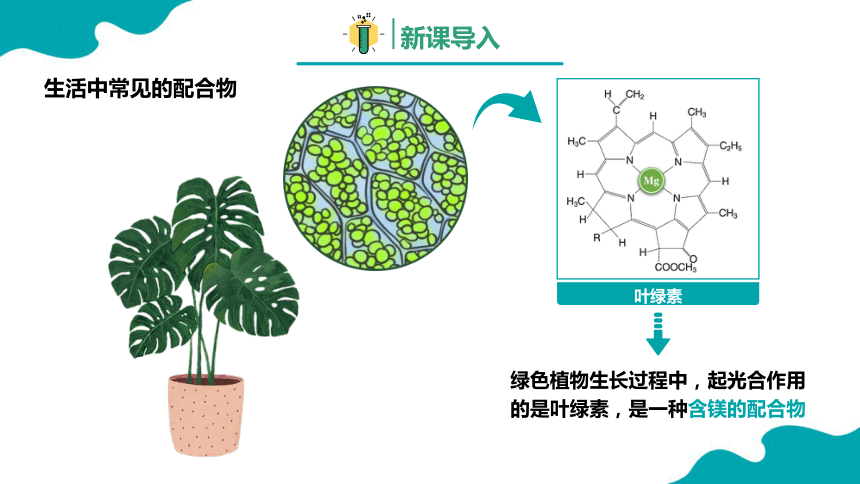
叶绿素
绿色植物生长过程中,起光合作用的是叶绿素,是一种含镁的配合物
生活中常见的配合物
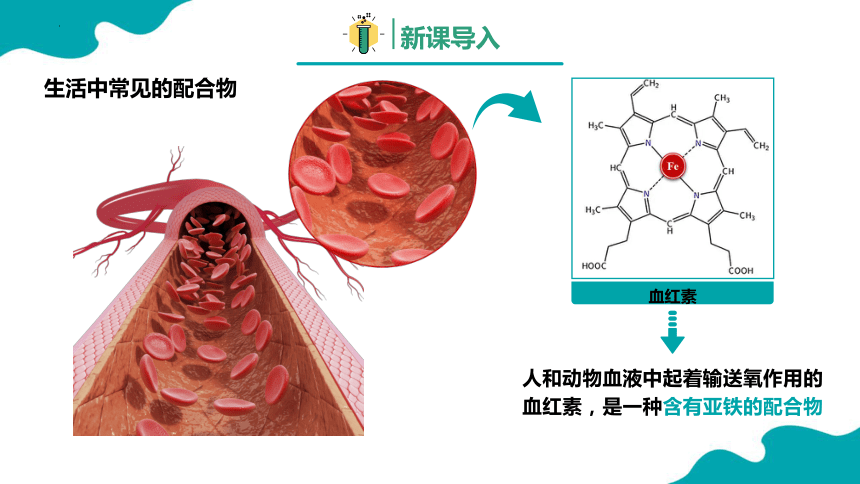
血红素
人和动物血液中起着输送氧作用的血红素,是一种含有亚铁的配合物
生活中常见的配合物
维生素B12
生活中常见的配合物
维生素B12(含钴的配合物)是一种需要肠道分泌物帮助才能被吸收的维生素
那么,这种配合物是如何形成的呢?
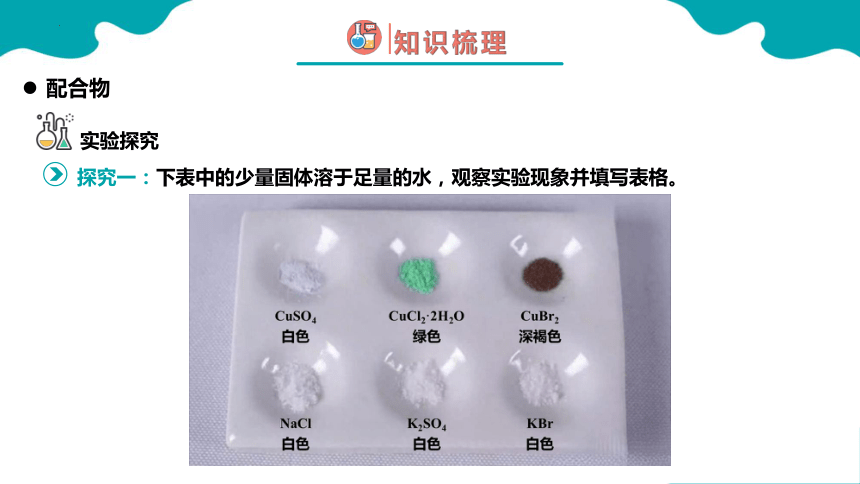
配合物
实验探究
探究一:下表中的少量固体溶于足量的水,观察实验现象并填写表格。
配合物
实验探究
探究一:下表中的少量固体溶于足量的水,观察实验现象并填写表格。
配合物
实验探究
探究一:下表中的少量固体溶于足量的水,观察实验现象并填写表格。
固体 ①CuSO4 ②CuCl2·2H2O ③CuBr2 ④NaCl ⑤K2SO4 ⑥KBr
白色 绿色 深褐色 白色 白色 白色
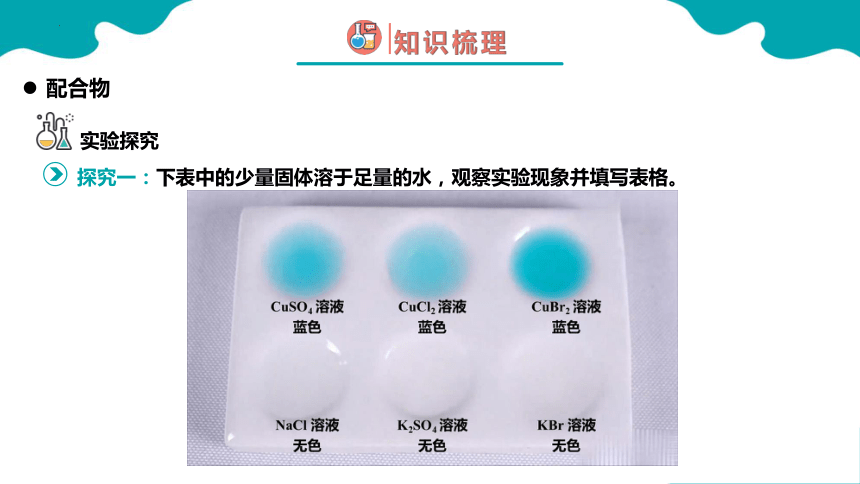
哪些溶液呈天蓝色
实验说明什么离子呈天蓝色,什么离子没有颜色
SO42- 、Cl-、Br-没有颜色;
固态二价铜盐不一定显蓝色,Cu2+在水溶液中常显蓝色;
Cu2+与水结合显蓝色
配合物
实验探究
探究二:观察下列两种铜盐的颜色,请解释原因。
绿偏蓝
CuCl2·2H2O晶体
CuSO4·5H2O晶体
蓝色
Cu2+与H2O结合显蓝色,它们是怎么结合的?
O
H
H
配合物
4H2O
配体
孤电子对
中心离子
具有空轨道
配位键
Cu2+
Cu2+
OH2
H2O
H2O
H2O
Cu2+
四水合铜离子
Cu(H2O) 4
2+
Cu
OH2
H2O
H2O
H2O
2+
配合物
配体
配位键
配离子
中心离子
配位数=4
含有配位键的化合物称为配位化合物,简称配合物
Cu(H2O) 4
2+
4
【例1】硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝 色溶液。
①[Ni(NH3)6]SO4的中心离子是_______, 配体是_________,配位数是_______。
Ni2+
6
NH3
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为 ,提供孤电子对的成键原子是 。
配位键
N
配合物
配位键
概念:
由一个原子单方面提供_____________,而另一个原子提供_____________而形成的化学键,即“电子对给予—接受”键。
孤电子对
空轨道
提供
表示方法:
配位键常用A—B表示,其中A是_______孤电子对的原子,叫给予体,B是接受孤电子对的原子,叫接受体。
例如:
配合物
配位键
形成条件
形成配位键的一方(如A)是能够提供孤电子对的原子,另一方(如B)是具有能够接受孤电子对的空轨道的原子。
①孤电子对:分子或离子中,没有跟其他原子共用的电子对就是孤电子对。
NH3、H2O、HF分子中中心原子分别有1、2、3对孤电子对。
例如:
含有孤电子对的微粒:分子如CO、NH3、H2O等,离子如Cl-、CN-、NO2-等
配合物
配位键
形成条件
形成配位键的一方(如A)是能够提供孤电子对的原子,另一方(如B)是具有能够接受孤电子对的空轨道的原子。
②含有空轨道的微粒:过渡金属的原子或离子。
一般来说,多数过渡金属的原子或离子形成配位键的数目基本上是固定的,
例如:
Ag+形成2个配位键,Cu2+形成4个配位键等。
硫酸四氨合铜的形成实验
常见配合物的形成实验
配合物
实验步骤:向盛有4 mL 0.1 mol/L CuSO4溶液的试管里滴加几滴1 mol/L氨水,首先形成难溶物,继续添加氨水并振荡试管,观察实验现象;再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁,观察实验现象。
实验步骤:
硫酸四氨合铜的形成实验
常见配合物的形成实验
配合物
实验现象:
滴加氨水后,试管中首先出现________________,氨水过量后沉淀逐渐_______,得到深蓝色的透明溶液,滴加乙醇后析出深蓝色晶体
蓝色沉淀
溶解
加入
氨水
蓝色沉淀
继续加
入氨水
蓝色沉淀溶解
加入
乙醇
深蓝色晶体
硫酸四氨合铜的形成实验
常见配合物的形成实验
配合物
有关离子方程式:
Cu2++2NH3·H2O=== Cu(OH)2↓+ 2NH4+
加入氨水
Cu(OH)2+4NH3=== [Cu(NH3)4]2++2OH-
继续加入氨水
[Cu(NH3)4]2++ 2SO42- +H2O =====[Cu(NH3)4]SO4·H2O↓
乙醇
加入乙醇
硫酸四氨合铜的形成实验
常见配合物的形成实验
配合物
实验分析:
Cu
NH3
NH3
H3N
NH3
2+
2-
SO4
硫酸四氨合铜
中心离子:Cu2+
配位数:4
NH3的N给出孤电子对
Cu2+接受电子对
[Cu(NH3)4]2+
N
H
H
H
配体
回想一下,如何检验Fe3+
思考:Fe3+与SCN-如何反应?
硫氰化铁配离子的形成实验
常见配合物的形成实验
实验步骤:向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液,观察实验现象。
配合物
FeCl3溶液
KSCN溶液
硫氰化铁配离子的形成实验
常见配合物的形成实验
配合物
实验现象:
溶液变为_____
红色
FeCl3溶液
加入KSCN溶液
硫氰化铁配离子的形成实验
常见配合物的形成实验
配合物
SCN-作为配体与Fe3+配位,显红色,用于检验Fe3+
实验分析及有关离子方程式:
…………
Fe3+ + SCN- Fe(SCN)2+
Fe(SCN)2+ + SCN- Fe(SCN)2 +
Fe(SCN)5 + SCN- Fe(SCN) 6 +
三价铁离子跟硫氰酸根离子(SCN-)形成配离子的颜色,而Fe2+跟SCN-不显红色
硫氰化铁配离子的颜色
二氨合银离子的形成实验
常见配合物的形成实验
配合物
实验步骤:向盛有少量 0.1 mol/L NaCl 溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1 mol/L氨水,振荡,观察实验现象。
NaCl
溶液
加入
氨水
二氨合银离子的形成实验
常见配合物的形成实验
配合物
实验现象:
滴加AgNO3溶液后,试管中出现_________,再滴加氨水后沉淀_____,溶液呈______。
白色沉淀
溶解
无色
二氨合银离子的形成实验
常见配合物的形成实验
配合物
有关离子方程式:
加入AgNO3溶液
Ag++Cl-===AgCl↓
继续加入氨水
AgCl+2NH3===[Ag(NH3)2]++Cl-
实验分析:
二氨合银离子的形成实验
常见配合物的形成实验
配合物
二氨合银离子
Ag
NH3
H3N
+
配体:
中心离子:
配位数:
NH3
Ag+
2
配合物
配合物
概念
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 结合形成的化合物称为配位化合物,简称配合物。
配位键
例如:
Cu
NH3
NH3
H3N
NH3
2+
2-
SO4
硫酸四氨合铜
氢氧化二氨合银
Ag
NH3
H3N
+
OH-
配合物
配合物
组成
配合物[Cu(NH3)4]SO4的组成如下图所示:
①中心原子:
___________________________的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。
提供空轨道接受孤电子对
②配体:
_______________的阴离子或分子,如Cl-、NH3、H2O等。配体中____________________的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O中的O原子等。
提供孤电子对
直接同中心原子配位
③配位数:直接与中心原子形成的 的数目。如[Fe(CN)6]4-中Fe2+的配位数为 。
配位键
6
配合物
配合物的形成对性质的影响
对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
例如:Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
蓝色沉淀溶解
加入氨水
配合物
配合物的形成对性质的影响
颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
例如:Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色
FeCl3溶液
加入KSCN溶液
配合物
配合物的形成对性质的影响
稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
例如:血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
【例1】下列化合物属于配合物的是( )
A.Cu2(OH)2SO4 B.NH4Cl C.[Zn(NH3)4]SO4 D.KAl(SO4)2
【例2】 0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01 mol AgCl沉淀,此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O D.[Cr(H2O)3Cl3]·3H2O
C
C
1893年,瑞士化学家维尔纳总结了前人(法国化学家塔萨厄尔)的理论,首次提出了现代的配位键、配位数和配位化合物结构等一系列基本概念,成功解释了很多配合物的电导性质、异构现象及磁性。自此,配位化学才有了本质上的发展。维尔纳也被称为“配位化学之父”,并因此获得了 1913 年的诺贝尔化学奖。
配位化学之父
维尔纳·冯·西门子
(Ernst Werner von Siemens)
1.下列不能形成配位键的组合是( )
A.Ag+、NH3 B.H2O、H+
C.Co3+、CO D.Ag+、H+
D
2.若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )
A.X、Y只能是分子
B.X、Y只能是离子
C.若X提供空轨道,则Y至少要提供一对孤电子对
D.一定是X提供空轨道,Y提供孤电子对
C
3.下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中一定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成
配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等
领域都有广泛的应用
B
4.下列物质:①H3O+ ②[B(OH)4]- ③CH3COO- ④NH3 ⑤CH4中存在配位键的是( )
A.①② B.①③ C.④⑤ D.②④
A
5.向盛有硫酸铜溶液的试管中滴加浓氨水,先生成难溶物,继续滴加浓氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.反应后的溶液中Cu2+的浓度增加了
D.在配离子[Cu(NH3)4]2+中,Cu2+提供孤电子对,NH3提供空轨道
B
6.某物质的结构如图所示:
下列有关该物质的分析中正确的是( )
A.该物质分子中不存在σ键
B.该物质的分子内只存在共价键和配位键两种作用力
C.该物质是一种配合物,其中Ni原子为中心原子
D.该物质的分子中C、N、O原子均存在孤电子对
C
6.Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键________________。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有_____(填字母)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
AC
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3===[Cu(NH3)4]2++2OH-。其原因是
__________________________________________________________。
过氧化氢为氧化剂,将Cu氧化为Cu2+,氨分子与Cu2+形成配位键
配合物
成键特征
配位键
概念
配合物的制备
概念
表示方法
形成条件
组成
配合物的形成对性质的影响
第四节
配合物与超分子
第1课时
THANKS
谢谢聆听
第四节 配合物与超分子
第1课时
第三章 晶体结构与性质
本节重点
本节难点
2
1
配位键、配合物的概念,配合物的制备
配位化合物的成键特征
叶绿素
绿色植物生长过程中,起光合作用的是叶绿素,是一种含镁的配合物
生活中常见的配合物
血红素
人和动物血液中起着输送氧作用的血红素,是一种含有亚铁的配合物
生活中常见的配合物
维生素B12
生活中常见的配合物
维生素B12(含钴的配合物)是一种需要肠道分泌物帮助才能被吸收的维生素
那么,这种配合物是如何形成的呢?
配合物
实验探究
探究一:下表中的少量固体溶于足量的水,观察实验现象并填写表格。
配合物
实验探究
探究一:下表中的少量固体溶于足量的水,观察实验现象并填写表格。
配合物
实验探究
探究一:下表中的少量固体溶于足量的水,观察实验现象并填写表格。
固体 ①CuSO4 ②CuCl2·2H2O ③CuBr2 ④NaCl ⑤K2SO4 ⑥KBr
白色 绿色 深褐色 白色 白色 白色
哪些溶液呈天蓝色
实验说明什么离子呈天蓝色,什么离子没有颜色
SO42- 、Cl-、Br-没有颜色;
固态二价铜盐不一定显蓝色,Cu2+在水溶液中常显蓝色;
Cu2+与水结合显蓝色
配合物
实验探究
探究二:观察下列两种铜盐的颜色,请解释原因。
绿偏蓝
CuCl2·2H2O晶体
CuSO4·5H2O晶体
蓝色
Cu2+与H2O结合显蓝色,它们是怎么结合的?
O
H
H
配合物
4H2O
配体
孤电子对
中心离子
具有空轨道
配位键
Cu2+
Cu2+
OH2
H2O
H2O
H2O
Cu2+
四水合铜离子
Cu(H2O) 4
2+
Cu
OH2
H2O
H2O
H2O
2+
配合物
配体
配位键
配离子
中心离子
配位数=4
含有配位键的化合物称为配位化合物,简称配合物
Cu(H2O) 4
2+
4
【例1】硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝 色溶液。
①[Ni(NH3)6]SO4的中心离子是_______, 配体是_________,配位数是_______。
Ni2+
6
NH3
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为 ,提供孤电子对的成键原子是 。
配位键
N
配合物
配位键
概念:
由一个原子单方面提供_____________,而另一个原子提供_____________而形成的化学键,即“电子对给予—接受”键。
孤电子对
空轨道
提供
表示方法:
配位键常用A—B表示,其中A是_______孤电子对的原子,叫给予体,B是接受孤电子对的原子,叫接受体。
例如:
配合物
配位键
形成条件
形成配位键的一方(如A)是能够提供孤电子对的原子,另一方(如B)是具有能够接受孤电子对的空轨道的原子。
①孤电子对:分子或离子中,没有跟其他原子共用的电子对就是孤电子对。
NH3、H2O、HF分子中中心原子分别有1、2、3对孤电子对。
例如:
含有孤电子对的微粒:分子如CO、NH3、H2O等,离子如Cl-、CN-、NO2-等
配合物
配位键
形成条件
形成配位键的一方(如A)是能够提供孤电子对的原子,另一方(如B)是具有能够接受孤电子对的空轨道的原子。
②含有空轨道的微粒:过渡金属的原子或离子。
一般来说,多数过渡金属的原子或离子形成配位键的数目基本上是固定的,
例如:
Ag+形成2个配位键,Cu2+形成4个配位键等。
硫酸四氨合铜的形成实验
常见配合物的形成实验
配合物
实验步骤:向盛有4 mL 0.1 mol/L CuSO4溶液的试管里滴加几滴1 mol/L氨水,首先形成难溶物,继续添加氨水并振荡试管,观察实验现象;再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁,观察实验现象。
实验步骤:
硫酸四氨合铜的形成实验
常见配合物的形成实验
配合物
实验现象:
滴加氨水后,试管中首先出现________________,氨水过量后沉淀逐渐_______,得到深蓝色的透明溶液,滴加乙醇后析出深蓝色晶体
蓝色沉淀
溶解
加入
氨水
蓝色沉淀
继续加
入氨水
蓝色沉淀溶解
加入
乙醇
深蓝色晶体
硫酸四氨合铜的形成实验
常见配合物的形成实验
配合物
有关离子方程式:
Cu2++2NH3·H2O=== Cu(OH)2↓+ 2NH4+
加入氨水
Cu(OH)2+4NH3=== [Cu(NH3)4]2++2OH-
继续加入氨水
[Cu(NH3)4]2++ 2SO42- +H2O =====[Cu(NH3)4]SO4·H2O↓
乙醇
加入乙醇
硫酸四氨合铜的形成实验
常见配合物的形成实验
配合物
实验分析:
Cu
NH3
NH3
H3N
NH3
2+
2-
SO4
硫酸四氨合铜
中心离子:Cu2+
配位数:4
NH3的N给出孤电子对
Cu2+接受电子对
[Cu(NH3)4]2+
N
H
H
H
配体
回想一下,如何检验Fe3+
思考:Fe3+与SCN-如何反应?
硫氰化铁配离子的形成实验
常见配合物的形成实验
实验步骤:向盛有少量0.1 mol/L FeCl3溶液(或任何含Fe3+的溶液)的试管中滴加1滴0.1 mol/L硫氰化钾(KSCN)溶液,观察实验现象。
配合物
FeCl3溶液
KSCN溶液
硫氰化铁配离子的形成实验
常见配合物的形成实验
配合物
实验现象:
溶液变为_____
红色
FeCl3溶液
加入KSCN溶液
硫氰化铁配离子的形成实验
常见配合物的形成实验
配合物
SCN-作为配体与Fe3+配位,显红色,用于检验Fe3+
实验分析及有关离子方程式:
…………
Fe3+ + SCN- Fe(SCN)2+
Fe(SCN)2+ + SCN- Fe(SCN)2 +
Fe(SCN)5 + SCN- Fe(SCN) 6 +
三价铁离子跟硫氰酸根离子(SCN-)形成配离子的颜色,而Fe2+跟SCN-不显红色
硫氰化铁配离子的颜色
二氨合银离子的形成实验
常见配合物的形成实验
配合物
实验步骤:向盛有少量 0.1 mol/L NaCl 溶液的试管里滴几滴0.1 mol/L AgNO3溶液,产生难溶于水的白色的AgCl沉淀,再滴入1 mol/L氨水,振荡,观察实验现象。
NaCl
溶液
加入
氨水
二氨合银离子的形成实验
常见配合物的形成实验
配合物
实验现象:
滴加AgNO3溶液后,试管中出现_________,再滴加氨水后沉淀_____,溶液呈______。
白色沉淀
溶解
无色
二氨合银离子的形成实验
常见配合物的形成实验
配合物
有关离子方程式:
加入AgNO3溶液
Ag++Cl-===AgCl↓
继续加入氨水
AgCl+2NH3===[Ag(NH3)2]++Cl-
实验分析:
二氨合银离子的形成实验
常见配合物的形成实验
配合物
二氨合银离子
Ag
NH3
H3N
+
配体:
中心离子:
配位数:
NH3
Ag+
2
配合物
配合物
概念
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 结合形成的化合物称为配位化合物,简称配合物。
配位键
例如:
Cu
NH3
NH3
H3N
NH3
2+
2-
SO4
硫酸四氨合铜
氢氧化二氨合银
Ag
NH3
H3N
+
OH-
配合物
配合物
组成
配合物[Cu(NH3)4]SO4的组成如下图所示:
①中心原子:
___________________________的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。
提供空轨道接受孤电子对
②配体:
_______________的阴离子或分子,如Cl-、NH3、H2O等。配体中____________________的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O中的O原子等。
提供孤电子对
直接同中心原子配位
③配位数:直接与中心原子形成的 的数目。如[Fe(CN)6]4-中Fe2+的配位数为 。
配位键
6
配合物
配合物的形成对性质的影响
对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
例如:Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
蓝色沉淀溶解
加入氨水
配合物
配合物的形成对性质的影响
颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
例如:Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色
FeCl3溶液
加入KSCN溶液
配合物
配合物的形成对性质的影响
稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
例如:血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
【例1】下列化合物属于配合物的是( )
A.Cu2(OH)2SO4 B.NH4Cl C.[Zn(NH3)4]SO4 D.KAl(SO4)2
【例2】 0.01 mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01 mol AgCl沉淀,此氯化铬最可能是( )
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O D.[Cr(H2O)3Cl3]·3H2O
C
C
1893年,瑞士化学家维尔纳总结了前人(法国化学家塔萨厄尔)的理论,首次提出了现代的配位键、配位数和配位化合物结构等一系列基本概念,成功解释了很多配合物的电导性质、异构现象及磁性。自此,配位化学才有了本质上的发展。维尔纳也被称为“配位化学之父”,并因此获得了 1913 年的诺贝尔化学奖。
配位化学之父
维尔纳·冯·西门子
(Ernst Werner von Siemens)
1.下列不能形成配位键的组合是( )
A.Ag+、NH3 B.H2O、H+
C.Co3+、CO D.Ag+、H+
D
2.若X、Y两种粒子之间可形成配位键,则下列说法正确的是( )
A.X、Y只能是分子
B.X、Y只能是离子
C.若X提供空轨道,则Y至少要提供一对孤电子对
D.一定是X提供空轨道,Y提供孤电子对
C
3.下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中一定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成
配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等
领域都有广泛的应用
B
4.下列物质:①H3O+ ②[B(OH)4]- ③CH3COO- ④NH3 ⑤CH4中存在配位键的是( )
A.①② B.①③ C.④⑤ D.②④
A
5.向盛有硫酸铜溶液的试管中滴加浓氨水,先生成难溶物,继续滴加浓氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.反应后的溶液中Cu2+的浓度增加了
D.在配离子[Cu(NH3)4]2+中,Cu2+提供孤电子对,NH3提供空轨道
B
6.某物质的结构如图所示:
下列有关该物质的分析中正确的是( )
A.该物质分子中不存在σ键
B.该物质的分子内只存在共价键和配位键两种作用力
C.该物质是一种配合物,其中Ni原子为中心原子
D.该物质的分子中C、N、O原子均存在孤电子对
C
6.Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键________________。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有_____(填字母)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
AC
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:Cu+H2O2+4NH3===[Cu(NH3)4]2++2OH-。其原因是
__________________________________________________________。
过氧化氢为氧化剂,将Cu氧化为Cu2+,氨分子与Cu2+形成配位键
配合物
成键特征
配位键
概念
配合物的制备
概念
表示方法
形成条件
组成
配合物的形成对性质的影响
第四节
配合物与超分子
第1课时
THANKS
谢谢聆听
