7.1.1 有机物中碳原子的成键特点(共29张PPT)-高一化学课件(人教版2019必修第二册)
文档属性
| 名称 | 7.1.1 有机物中碳原子的成键特点(共29张PPT)-高一化学课件(人教版2019必修第二册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 16:21:23 | ||
图片预览





文档简介
(共29张PPT)
第一节 认识有机化合物
有机化合物中碳原子成键特点
硅是无机非金属材料的主角,也是构成岩石与许多矿物的基本元素;而它的同族元素——碳在地壳中的含量并不高,质量分数只占0.087%,但是它的化合物,尤其是有机化合物,不仅数量众多,而且分布很广;有机化合物不仅构成了生机勃勃的生命世界,也是燃料、材料、食品和药物的主要来源。
目前,人们在自然界发现和人工合成的物质已超过1亿种,其中绝大多数都是有机化合物,而且新的有机化合物仍在源源不断地被发现或合成出来。
思考与讨论
有机化合物是生命产生的物质基础,所有的生命体都含有机化合物。因此,早期科学家认为,有机化合物只能由动植物有机体内提取和分离。
1828年,维勒偶然发现典型的无机化合物氰酸铵(NH4CNO)通过加热可以直接转变为动物排泄物——有机化合物尿素(NH2CONH2)。
从提取分离的时代,进入人工合成的时代,有机化学的发展进入了快车道
有机物种类繁多。在初中,我们已经学习过一些简单的有机物,那么,哪些物质属于有机物呢?其组成元素有哪些?有机物和无机物又有何区别呢?它们的结构和性质具有哪些特点呢?
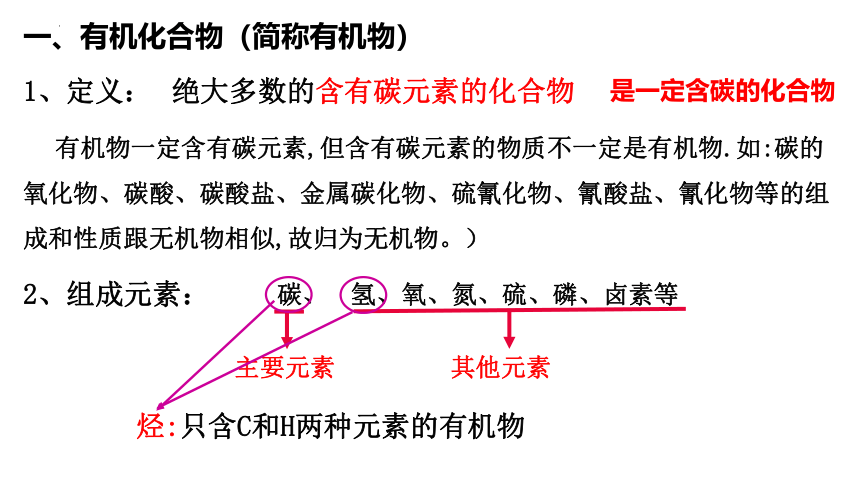
一、有机化合物(简称有机物)
1、定义:
绝大多数的含有碳元素的化合物
有机物一定含有碳元素,但含有碳元素的物质不一定是有机物.如:碳的氧化物、碳酸、碳酸盐、金属碳化物、硫氰化物、氰酸盐、氰化物等的组成和性质跟无机物相似,故归为无机物。)
2、组成元素:
碳、
氢、氧、氮、硫、磷、卤素等
主要元素
其他元素
烃:只含C和H两种元素的有机物
是一定含碳的化合物
种类繁多
大多数难溶于水,易溶于有机溶剂
大多数为非电解质、不易导电
大多数为共价化合物,熔沸点较低
大多数易燃、受热易分解
多数有机反应复杂,速率慢,需加热或催化剂,常伴有副反应发生
有机化学方程式书写时用“→”表示,不用“=”。
3、有机物的特点:
二、有机物中碳原子的结构和成键特点
P60
阅读课本P60-61页,了解有机物中碳原子的成键特点
天然气的主要成分是甲烷,甲烷是最简单的有机化合物,由碳氢两种元素组成。
甲烷的分子式为CH4,甲烷分子中的碳原子以最外层的4个电子与4个氢原子的电子形成4个C—H共价键。
甲烷的电子式为:
甲烷的结构式为:
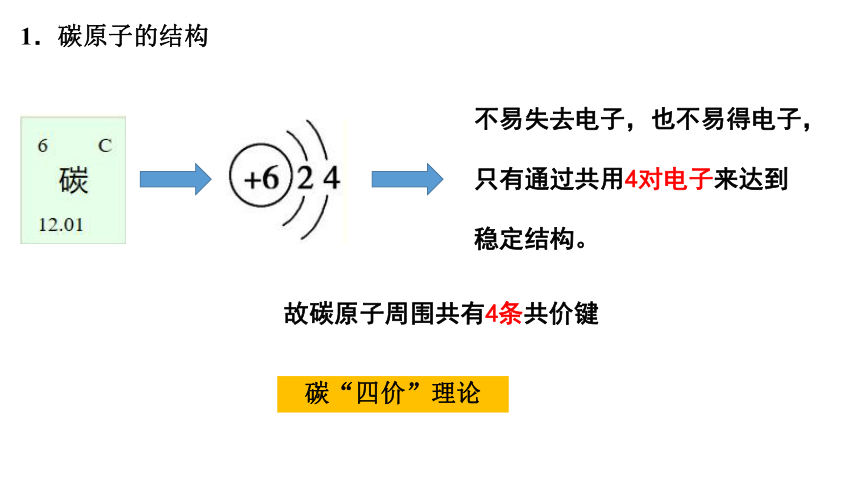
不易失去电子,也不易得电子,只有通过共用4对电子来达到稳定结构。
故碳原子周围共有4条共价键
碳“四价”理论
1.碳原子的结构
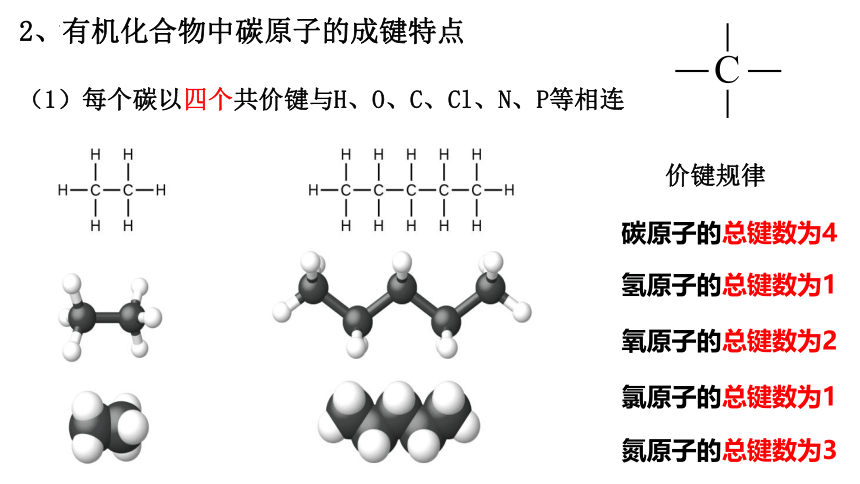
2、有机化合物中碳原子的成键特点
(1)每个碳以四个共价键与H、O、C、Cl、N、P等相连
碳原子的总键数为4
氢原子的总键数为1
氧原子的总键数为2
氯原子的总键数为1
氮原子的总键数为3
C
价键规律
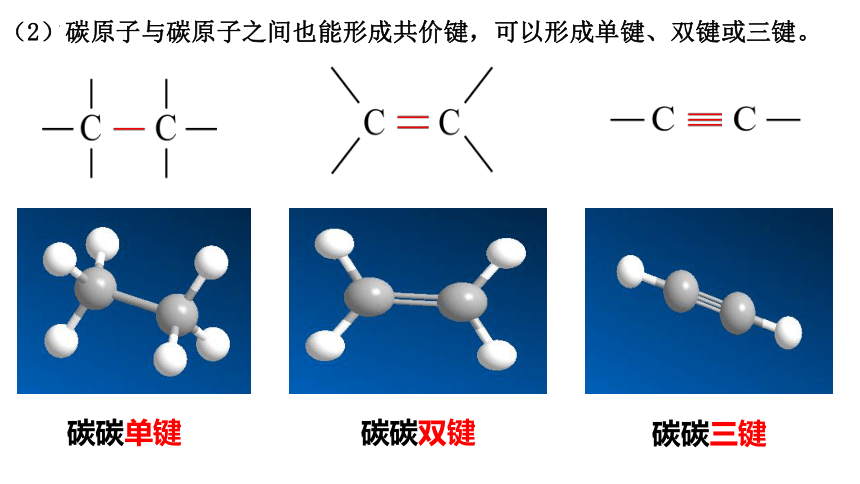
(2)碳原子与碳原子之间也能形成共价键,可以形成单键、双键或三键。
碳碳单键
碳碳双键
碳碳三键
(3)多个碳原子之间可以结合成碳链,也可以结合成碳环,构成有机物链状或环状的碳骨架
链状--直链
链状--支链
环状结构
不带支链的直链结构
环状结构
(1)呈直链状的有机物分子不能理解成所有的碳原子都处在同一条直线上,如果有机物分子链状碳骨架结构中仅存在碳碳单键,则含3个及以上碳原子的分子呈锯齿状。
(2)链状碳骨架结构中的碳原子最少是1个,环状碳骨架结构中的碳原子最少是3个(构成环)。
(3)碳骨架结构中,碳原子余下的价键可以与氢原子或氧原子等结合,从而使碳原子最外层达到8电子稳定结构。
特别提醒
【思考与讨论p61】
(1)根据碳原子的4价键原则,可将下图中碳原子的价键用氢原子补齐,试在各模型的下面写出各物质的分子式。
C4H10
C4H10
C4H8
C4H8
C4H8
C4H6
C4H6
C4H8
C4H8
(2)根据(1)中各物质的分子式,用序号填空。分子式相同的物质有:
①和②;
③和④、⑤、⑧、⑨;
⑥和⑦。
(3)请结合下图显示的4个碳原子相互结合的几种方式,分析以碳为骨架的有机物种类繁多的原因。
①每个碳原子最外层含4个电子,可以和碳原子及其它原子形成4个共价键;
②碳原子可以与H、Cl等原子形成共价键,C原子间可形成单键、双键和三键;
③碳原子间可以连成碳链、碳环等碳骨架;
④有机物中碳原子数目可能只含有一个或几个或成千上万个。
【资料卡片】
使用模型研究物质结构
将微观的分子结构通过模型呈现出来,便于我们了解分子中原子的结合方式与空间位置关系,获取更多的结构信息。随着现代信息技术的发展,除了实物模型,还可以通过计算机对物质的结构进行模拟和计算。这是人们探索物质结构的重要方法,也是学习化学的直观工具。
有机化合物中碳原子的成键特点
(1) 键的个数
每个碳原子形成4个共价键(4对共用电子对)
(2) 成键的类型
(3) 碳骨架形式
碳原子之间可构成链状结构,也可构成环状结构。
碳原子不仅可以与其他原子形成共价键,而且碳原子与碳原子之间也能形成共价键,可以形成单键、双键或三键。
课堂小结
1.判断正误(正确的打“√”,错误的打“×”)
(1)含有碳元素的物质一定是有机物。 ( )
(2)大多数有机物的熔沸点较低。 ( )
(3)有机物都不溶于水。 ( )
提示:碳单质、碳的氧化物和碳酸盐等都不属于有机物。
提示:大多数有机物都是由分子构成,熔沸点比较低。
提示:多数有机物水溶性较差,但是部分有机物(如乙醇、乙酸等)易溶于水。
×
×
√
(4)碳原子最外层有4个电子,可以形成4个共价键( )
(5)碳原子能与其他原子形成4个共价键,且碳原子之间也能相互成键
( )
(6)在有机化合物中,碳原子间所成的骨架只能为直链状( )
(7)在有机化合物中,碳原子间只能形成单键( )
(8)有机化合物种类繁多的原因之一与碳原子间的成键方式及碳骨架不同有关( )
√
√
√
×
×
2. 在人类已知化合物中,品种最多的是( )
A、过渡元素的化合物 B、第ⅡA族的化合物
C、第ⅢA族的化合物 D、第ⅣA族的化合物
D
3.下列物质中属于有机物的是( )
①乙醇 ②食盐 ③二氧化碳 ④甲烷 ⑤蔗糖⑥水 ⑦一氧化碳 ⑧碳酸钙 ⑨乙酸A.①②④⑤⑨ B.①④⑤⑨
C.①③④⑤⑦⑧⑨ D.①④⑤⑥
B
4.有机物分子中的碳原子与其他原子的结合方式是( )
A.通过两个共价键
B.通过非极性键
C.形成四对共用电子对
D.通过离子键和共价键
解析:碳原子核外最外层有四个电子,在反应中不易得或失电子,则在形成有机物时与其他原子可形成四对共用电子对,故C正确。
C
5.碳原子的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是( )
解析: 在有机物的分子结构中,1个C要连有4个键,其中碳碳双键属于2个键,碳碳三键属于3个键,C—H往往省略掉。所以,当给出的结构中,如果1个C周围的键少于4个,则要由C—H键补足至4个;如果多于4个,则一定不合理。故选C。
C
6.已知碳原子可以成4个价键,氢原子可以成1个价键,氧原子可以成2个价键,下列分子式或结构简式书写正确的是( )
A.CH3 B.C2H6
C. D.
解析: 据信息,碳原子可以形成4个共价键,因此一个碳原子可以结合4个H原子,A错误;碳和碳之间形成一个价键,剩余价键和H原子结合,故B项正确;C项及D项中,碳原子所成价键超过了4个,故错误。
B
7.有机物种类繁多的原因是 ( )
A.碳元素在地壳中的含量大,且属于非金属
B.碳原子间能以共价键结合,形成多种链状和环状结构C.碳元素所形成的化合物性质稳定,且共价键键能大D.碳原子中质子数和中子数相等
B
解析:有机物分子中碳原子间能以共价键结合形成4个共价键,而且可以形成链状或环状等结构,是导致有机物种类繁多的原因,B正确。
8.下图是表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合。p61
(1)碳原子间所成的化学键全是碳碳单键的有_____________(填字母,下同),含有碳碳双键的有________,含有碳碳三键的有______。
A、C、H、J
B、E、F
D、G
(2)碳骨架为链状的有_______________________,为环状的有_______,含有支链的有________。
A、B、C、D、E、F、G
H、J
C、F、J
表示方法(以甲烷为例) 含义
分子式:
最简式(实验式):
电子式:
有机化合物组成和结构的表示方法
CH4
CH4
用元素符号表示物质分子组成的式子
表示物质组成的各元素原子最简整数比的式子
用“ ”或“×”等符号代替电子,表示原子最外层电子成键情况的式子
表示方法(以甲烷为例) 含义
结构式:
结构简式:
有机化合物组成和结构的表示方法
CH4
结构式的简便写法,着重突出结构特点
③表示分子中原子的结合或排列顺序的式子,但不表示空间结构
②具有分子式所能表示的意义,能反映分子的结构
①用短线表示成键的共用电子对
表示方法(以甲烷为例) 含义
球棍模型:
空间填充模型:
有机化合物组成和结构的表示方法
小球表示原子,短棍表示化学键,展示了空间结构
表明了原子的相对大小和空间相对位置
第一节 认识有机化合物
有机化合物中碳原子成键特点
硅是无机非金属材料的主角,也是构成岩石与许多矿物的基本元素;而它的同族元素——碳在地壳中的含量并不高,质量分数只占0.087%,但是它的化合物,尤其是有机化合物,不仅数量众多,而且分布很广;有机化合物不仅构成了生机勃勃的生命世界,也是燃料、材料、食品和药物的主要来源。
目前,人们在自然界发现和人工合成的物质已超过1亿种,其中绝大多数都是有机化合物,而且新的有机化合物仍在源源不断地被发现或合成出来。
思考与讨论
有机化合物是生命产生的物质基础,所有的生命体都含有机化合物。因此,早期科学家认为,有机化合物只能由动植物有机体内提取和分离。
1828年,维勒偶然发现典型的无机化合物氰酸铵(NH4CNO)通过加热可以直接转变为动物排泄物——有机化合物尿素(NH2CONH2)。
从提取分离的时代,进入人工合成的时代,有机化学的发展进入了快车道
有机物种类繁多。在初中,我们已经学习过一些简单的有机物,那么,哪些物质属于有机物呢?其组成元素有哪些?有机物和无机物又有何区别呢?它们的结构和性质具有哪些特点呢?
一、有机化合物(简称有机物)
1、定义:
绝大多数的含有碳元素的化合物
有机物一定含有碳元素,但含有碳元素的物质不一定是有机物.如:碳的氧化物、碳酸、碳酸盐、金属碳化物、硫氰化物、氰酸盐、氰化物等的组成和性质跟无机物相似,故归为无机物。)
2、组成元素:
碳、
氢、氧、氮、硫、磷、卤素等
主要元素
其他元素
烃:只含C和H两种元素的有机物
是一定含碳的化合物
种类繁多
大多数难溶于水,易溶于有机溶剂
大多数为非电解质、不易导电
大多数为共价化合物,熔沸点较低
大多数易燃、受热易分解
多数有机反应复杂,速率慢,需加热或催化剂,常伴有副反应发生
有机化学方程式书写时用“→”表示,不用“=”。
3、有机物的特点:
二、有机物中碳原子的结构和成键特点
P60
阅读课本P60-61页,了解有机物中碳原子的成键特点
天然气的主要成分是甲烷,甲烷是最简单的有机化合物,由碳氢两种元素组成。
甲烷的分子式为CH4,甲烷分子中的碳原子以最外层的4个电子与4个氢原子的电子形成4个C—H共价键。
甲烷的电子式为:
甲烷的结构式为:
不易失去电子,也不易得电子,只有通过共用4对电子来达到稳定结构。
故碳原子周围共有4条共价键
碳“四价”理论
1.碳原子的结构
2、有机化合物中碳原子的成键特点
(1)每个碳以四个共价键与H、O、C、Cl、N、P等相连
碳原子的总键数为4
氢原子的总键数为1
氧原子的总键数为2
氯原子的总键数为1
氮原子的总键数为3
C
价键规律
(2)碳原子与碳原子之间也能形成共价键,可以形成单键、双键或三键。
碳碳单键
碳碳双键
碳碳三键
(3)多个碳原子之间可以结合成碳链,也可以结合成碳环,构成有机物链状或环状的碳骨架
链状--直链
链状--支链
环状结构
不带支链的直链结构
环状结构
(1)呈直链状的有机物分子不能理解成所有的碳原子都处在同一条直线上,如果有机物分子链状碳骨架结构中仅存在碳碳单键,则含3个及以上碳原子的分子呈锯齿状。
(2)链状碳骨架结构中的碳原子最少是1个,环状碳骨架结构中的碳原子最少是3个(构成环)。
(3)碳骨架结构中,碳原子余下的价键可以与氢原子或氧原子等结合,从而使碳原子最外层达到8电子稳定结构。
特别提醒
【思考与讨论p61】
(1)根据碳原子的4价键原则,可将下图中碳原子的价键用氢原子补齐,试在各模型的下面写出各物质的分子式。
C4H10
C4H10
C4H8
C4H8
C4H8
C4H6
C4H6
C4H8
C4H8
(2)根据(1)中各物质的分子式,用序号填空。分子式相同的物质有:
①和②;
③和④、⑤、⑧、⑨;
⑥和⑦。
(3)请结合下图显示的4个碳原子相互结合的几种方式,分析以碳为骨架的有机物种类繁多的原因。
①每个碳原子最外层含4个电子,可以和碳原子及其它原子形成4个共价键;
②碳原子可以与H、Cl等原子形成共价键,C原子间可形成单键、双键和三键;
③碳原子间可以连成碳链、碳环等碳骨架;
④有机物中碳原子数目可能只含有一个或几个或成千上万个。
【资料卡片】
使用模型研究物质结构
将微观的分子结构通过模型呈现出来,便于我们了解分子中原子的结合方式与空间位置关系,获取更多的结构信息。随着现代信息技术的发展,除了实物模型,还可以通过计算机对物质的结构进行模拟和计算。这是人们探索物质结构的重要方法,也是学习化学的直观工具。
有机化合物中碳原子的成键特点
(1) 键的个数
每个碳原子形成4个共价键(4对共用电子对)
(2) 成键的类型
(3) 碳骨架形式
碳原子之间可构成链状结构,也可构成环状结构。
碳原子不仅可以与其他原子形成共价键,而且碳原子与碳原子之间也能形成共价键,可以形成单键、双键或三键。
课堂小结
1.判断正误(正确的打“√”,错误的打“×”)
(1)含有碳元素的物质一定是有机物。 ( )
(2)大多数有机物的熔沸点较低。 ( )
(3)有机物都不溶于水。 ( )
提示:碳单质、碳的氧化物和碳酸盐等都不属于有机物。
提示:大多数有机物都是由分子构成,熔沸点比较低。
提示:多数有机物水溶性较差,但是部分有机物(如乙醇、乙酸等)易溶于水。
×
×
√
(4)碳原子最外层有4个电子,可以形成4个共价键( )
(5)碳原子能与其他原子形成4个共价键,且碳原子之间也能相互成键
( )
(6)在有机化合物中,碳原子间所成的骨架只能为直链状( )
(7)在有机化合物中,碳原子间只能形成单键( )
(8)有机化合物种类繁多的原因之一与碳原子间的成键方式及碳骨架不同有关( )
√
√
√
×
×
2. 在人类已知化合物中,品种最多的是( )
A、过渡元素的化合物 B、第ⅡA族的化合物
C、第ⅢA族的化合物 D、第ⅣA族的化合物
D
3.下列物质中属于有机物的是( )
①乙醇 ②食盐 ③二氧化碳 ④甲烷 ⑤蔗糖⑥水 ⑦一氧化碳 ⑧碳酸钙 ⑨乙酸A.①②④⑤⑨ B.①④⑤⑨
C.①③④⑤⑦⑧⑨ D.①④⑤⑥
B
4.有机物分子中的碳原子与其他原子的结合方式是( )
A.通过两个共价键
B.通过非极性键
C.形成四对共用电子对
D.通过离子键和共价键
解析:碳原子核外最外层有四个电子,在反应中不易得或失电子,则在形成有机物时与其他原子可形成四对共用电子对,故C正确。
C
5.碳原子的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是( )
解析: 在有机物的分子结构中,1个C要连有4个键,其中碳碳双键属于2个键,碳碳三键属于3个键,C—H往往省略掉。所以,当给出的结构中,如果1个C周围的键少于4个,则要由C—H键补足至4个;如果多于4个,则一定不合理。故选C。
C
6.已知碳原子可以成4个价键,氢原子可以成1个价键,氧原子可以成2个价键,下列分子式或结构简式书写正确的是( )
A.CH3 B.C2H6
C. D.
解析: 据信息,碳原子可以形成4个共价键,因此一个碳原子可以结合4个H原子,A错误;碳和碳之间形成一个价键,剩余价键和H原子结合,故B项正确;C项及D项中,碳原子所成价键超过了4个,故错误。
B
7.有机物种类繁多的原因是 ( )
A.碳元素在地壳中的含量大,且属于非金属
B.碳原子间能以共价键结合,形成多种链状和环状结构C.碳元素所形成的化合物性质稳定,且共价键键能大D.碳原子中质子数和中子数相等
B
解析:有机物分子中碳原子间能以共价键结合形成4个共价键,而且可以形成链状或环状等结构,是导致有机物种类繁多的原因,B正确。
8.下图是表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合。p61
(1)碳原子间所成的化学键全是碳碳单键的有_____________(填字母,下同),含有碳碳双键的有________,含有碳碳三键的有______。
A、C、H、J
B、E、F
D、G
(2)碳骨架为链状的有_______________________,为环状的有_______,含有支链的有________。
A、B、C、D、E、F、G
H、J
C、F、J
表示方法(以甲烷为例) 含义
分子式:
最简式(实验式):
电子式:
有机化合物组成和结构的表示方法
CH4
CH4
用元素符号表示物质分子组成的式子
表示物质组成的各元素原子最简整数比的式子
用“ ”或“×”等符号代替电子,表示原子最外层电子成键情况的式子
表示方法(以甲烷为例) 含义
结构式:
结构简式:
有机化合物组成和结构的表示方法
CH4
结构式的简便写法,着重突出结构特点
③表示分子中原子的结合或排列顺序的式子,但不表示空间结构
②具有分子式所能表示的意义,能反映分子的结构
①用短线表示成键的共用电子对
表示方法(以甲烷为例) 含义
球棍模型:
空间填充模型:
有机化合物组成和结构的表示方法
小球表示原子,短棍表示化学键,展示了空间结构
表明了原子的相对大小和空间相对位置
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
