7.1.2 烷烃的结构和命名(共29张PPT)-高一化学课件(人教版2019必修第二册)
文档属性
| 名称 | 7.1.2 烷烃的结构和命名(共29张PPT)-高一化学课件(人教版2019必修第二册) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 16:22:12 | ||
图片预览







文档简介
(共29张PPT)
第一节 认识有机化合物
烷烃的结构和命名
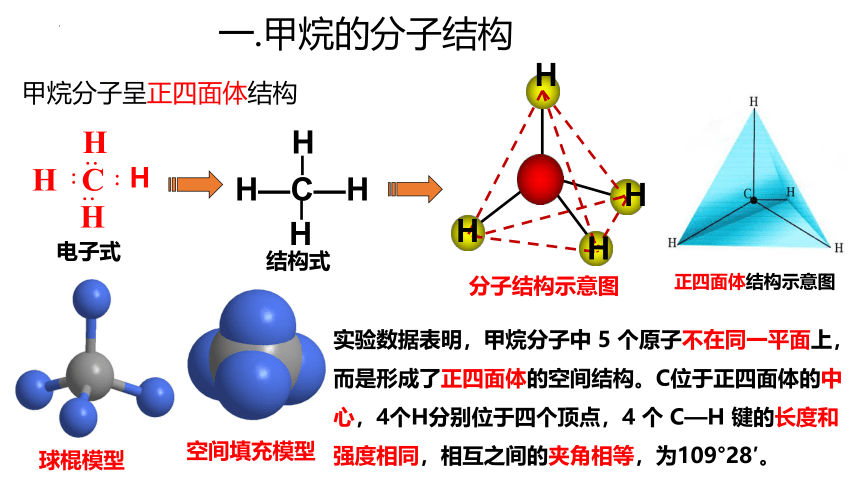
一.甲烷的分子结构
甲烷分子呈正四面体结构
电子式
﹕
H C
﹕
﹕
﹕
H
H
H
结构式
H—C—H
H
H
分子结构示意图
H
H
H
H
正四面体结构示意图
球棍模型
空间填充模型
实验数据表明,甲烷分子中 5 个原子不在同一平面上,而是形成了正四面体的空间结构。C位于正四面体的中心,4个H分别位于四个顶点,4 个 C—H 键的长度和强度相同,相互之间的夹角相等,为109°28′。
【思考与讨论p62】
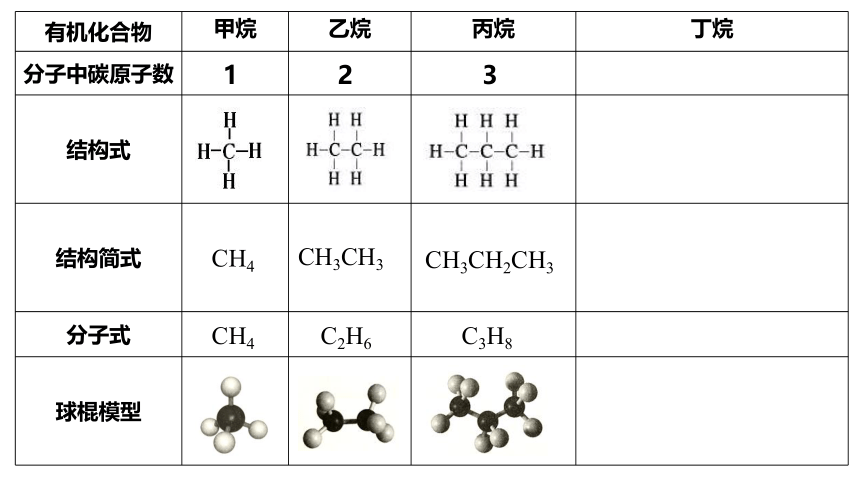
(1) 与甲烷结构相似的有机化合物还有很多,随着分子中碳原子数的增加,还有乙烷、丙烷、丁烷等一系列有机化合物。请根据碳原子的成键规律和下表提供的信息,写出丁烷的结构式和乙烷、丙烷、丁烷的分子式,并由此归纳这类有机化合物分子式的通式。
有机化合物 甲烷 乙烷 丙烷 丁烷
分子中碳原子数
结构式
结构简式
分子式
球棍模型
1
2
3
CH4
CH3CH3
CH3CH2CH3
CH4
C2H6
C3H8
【思考与讨论p62】
(2) 与同学交流,比较大家写出的丁烷的结构式是否相同,思考产生这种现象的可能原因。
有机化合物 甲烷 乙烷 丙烷 丁烷
分子中碳原子数
结构式
结构简式
分子式
球棍模型
1
2
3
4
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2 CH3
CH3 - CH-CH3
CH3
CH4
C2H6
C3H8
C4H10
(3)结合下图中的分子结构模型,总结这类有机化合物的组成和分子结构特点。
②C原子都形成4个共价键;形成四面体结构。
③碳链可以转动(呈锯齿形)
①以上各有机物分子中,原子间均以共价单键结合,每个碳原子的化合价都已充分利用,都达到“饱和”。
这样的烃叫做饱和烃,又叫烷烃。
1.烷烃的概念
只含有碳和氢两种元素,分子中的碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”。这样的一类有机化合物称为饱和烃,也称为烷烃。
注意:当碳原子与4个原子以单键相连时,碳原子与周围的4个原子都以四面体取向成键,因此,链状烷烃中碳碳结合成链状,链状不是“直线状”,而是呈锯齿状,链上还可分出支链,如图所示:
正丁烷
异丁烷
二.烷烃
2.烷烃的结构特点:
①烷烃分子中每个碳原子与4个原子相连,对于烷烃的任意一个碳原子来说,它周围的4个原子以它为中心构成四面体。
②链状烷烃为开链式结构,可以是直链,也可带支链。碳原子数≥3的链状烷烃分子中的碳链均非直线型,为锯齿形。
③烷烃中C-H单键和C-C单键都可以旋转。
饱和烃(烷烃)
链状烷烃
环状烷烃
直链
支链
结构的要点:
以C为中心四面体构型
链状烃为非直线型(空间折线)
C-C(可旋转)
饱和烃
单键、饱和、链状
(1)分子式:
(3)结构式:
3、烷烃的表示方法
用元素符号和数字的组合表示物质分子组成的式子。如CH4、C2H6、C3H8、C4H10 ……
用短线来表示原子间的共用电子对
H C C H
H H
H H
(2)电子式:
用小黑点等符号代替电子,表示原子最外层电子成键情况的式子
(4)结构简式:
(省略与合并)
省略C H键,把同一碳原子上的H合并
CH3 CH2 CH2 CH CH3
CH3
再简化:
省略横线上C C键
CH3CH2CH2CHCH3
CH3
CH3(CH2)2CH(CH3)CH3
【注意】省略单键,但双键、三键不能省略
如CH3CH=CH2
为了书写方便,有机物还常用结构简式表示。
常用的
或者:将支链括起来,
写在连接它的C原子后面
或:CH3(CH2)2CH(CH3)2
【思考与讨论p61】
根据碳原子的4价键原则,可将下图中碳原子的价键用氢原子补齐,试在各模型的下面写出各物质的结构简式。
CH3CH2CH2CH3
CH3CH(CH3)2
CH3CH2CH=CH2
CH3CH=CHCH3
(CH3)2C=CH2
CH3CH2C≡CH
CH3C≡CCH3
(5)球棍模型:
用球和棍表示原子间的结合方式
(6)空间填充模型:
用大小不同的小球表示原子间的连接方式
甲烷 CH4 CH4
乙烷 C2H6 CH3CH3
丙烷 C3H8 CH3CH2CH3
丁烷 C4H10 CH3CH2CH2CH3
戊烷 C5H12 CH3(CH2)3CH3
癸烷 C10H22 CH3(CH2)8CH3
十七烷 C17H36 CH3(CH2)15CH3
[思考与讨论] 分析这些式子,可以发现什么?
4.烷烃的通式:
CnH2n+2 ( n≥1 n为正整数)
结构上相似,在分子组成上相差一个或若干个-CH2-原子团
甲烷是含氢量最高的烃
[思考]某烷烃的相对分子质量是156,试写出该烷烃的分子式.
符合此通式的一定是烷烃
5.烷烃的命名——习惯命名法
(1)分子中碳原子数不多于10时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,后面加“烷”,称为某烷,如C4H10称为丁烷。
(2)分子中碳原子数在10以上时,以汉字表示碳原子数,后面加“烷”,称为某烷,如C15H32称为十五烷。
(3)对于碳原子数相同而结构不同的烷烃,一般在烷烃名称前面加正、异、新来区别。
CH3CH2CH2CH2CH3
正戊烷
无支链
CH3CHCH2CH3
CH3
异戊烷
带一支链
CH3
CH3CCH3
CH3
新戊烷
带两支链
【思考与讨论】
正戊烷、异戊烷、新戊烷的分子式、分子结构是否相同?它们是否为同一种物质?
CH3CH2CH2CH2CH3
CH3CHCH2CH3
CH3
CH3
CH3CCH3
CH3
正戊烷
无支链
异戊烷
带一支链
新戊烷
带两支链
它们的分子式相同(C5H12),但分子结构不同,属于不同的分子。
小结 烷烃的组成与结构特点
(5)氢偶数;烷烃分子中的氢原子数一定是偶数。
(1)单键:烷烃分子里只有两种化学键:碳碳单键和碳氢键。每个碳原子都以四个共价单键与其他碳原子或氢原子相连接。
(2)饱和:烷烃是饱和烃,碳原子数一定的烷烃分子中氢原子数已达到最多,其他含有相同碳原子数的烃分子中的氢原子数都比烷烃少。
(3)通式:烷烃的通式为CnH2n+2(n为正整数),符合该通式的烃一定是烷烃。
(4)骨架:碳碳结合成链状,链状不是“直线状”,而是呈锯齿状,链上还可分出支链,碳链可以旋转.如图所示。
1.判断正误(正确的打“√”,错误的打“×”)
(1)碳原子可以跟多数非金属元素原子形成共价键。( )
(2)烷烃分子结构中均为单键。( )
(3)甲烷的结构式为 ,空间构型为正方形。 ( )
(4)烷烃的所有原子一定不在同一平面上。( )
(5)分子中含有8个碳原子的链状烷烃的分子式为C8H16。( )
√
√
√
×
×
2.下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况( )
D
解析: 这几种形式都可表示甲烷分子,其中分子结构示意图、球棍模型及空间充填模型均能反映甲烷分子的空间构型,但空间充填模型更能形象地表达出甲烷分子中H、C原子的位置及所占比例。电子式只反映出原子的最外层电子的成键情况。
3.甲烷分子中的碳原子与氢原子的结合方式是( )
A.形成四对共用电子对B.通过非极性键
C.通过两个共价键 D.通过离子键和共价键
A
解析:甲烷分子中碳原子和4个氢原子共用4个电子对,形成4个C—H极性共价键,A项正确,B、C、D三项均不正确。
4.以下结构表示的物质中是烷烃的是( )
A.CH3OH
B.CH2===CH2
C
解析: 烷烃是只有碳碳单键和碳氢键的链烃。A中含氧不属于烃;B中含碳碳双键,D中含环状结构,只有C属于烷烃。
5.下列说法正确的是( )
A.有机物种类繁多的主要原因是有机物分子结构十分复杂B.烃类分子中的碳原子与氢原子是通过非极性键结合的
C.同分异构现象的广泛存在是造成有机物种类繁多的唯一原因D.烷烃的结构特点是碳原子之间通过单键连接成链状,剩余价键均与氢原子结合
D
解析: 有机物种类繁多的主要原因是碳原子能与其他原子形成四个共价键,且碳原子之间也能互相成键,A项只是其中的一个原因,并不是主要原因,A错误。碳原子与氢原子之间形成极性键,B错误。同分异构现象的广泛存在是造成有机物种类繁多的重要原因,但不是唯一原因,C错误。
6.下列关于链状烷烃的说法正确的有( )
①在链状烷烃分子中,所有的化学键都是单键 ②分子组成上满足通式CnH2n+2(n≥1) ③分子组成上满足CnH2n+2(n≥1)的有机物都是链状烷烃 ④丙烷分子中所有的碳原子均在同一条直线上 ⑤链状烷烃中所有原子可能共平面 ⑥碳原子间以单键结合,碳原子剩余价键全部与氢原子结合的有机物一定是链状烷烃
A.3个 B.4个 C.5个 D.6个
A
7. 某烷烃含有200个H原子,那么该烃的分子式是( )
A、C99H200 B、C98H200
C、C97H200 D、C100H200
A
8. 写出下列烷烃的分子式:
(1)含有38个碳原子的烷烃的分子式
(2)含有38个氢原子的烷烃的分子式
(3)相对分子量为128的烷烃的分子式
9. 试写出辛烷、壬烷、癸烷的分子式?
C8H18、 C9H20、 C10H22
10. 下列物质中是否属于烷烃?
CH3-CH2-CH2-CH2-CH3
CH2=CH2
第一节 认识有机化合物
烷烃的结构和命名
一.甲烷的分子结构
甲烷分子呈正四面体结构
电子式
﹕
H C
﹕
﹕
﹕
H
H
H
结构式
H—C—H
H
H
分子结构示意图
H
H
H
H
正四面体结构示意图
球棍模型
空间填充模型
实验数据表明,甲烷分子中 5 个原子不在同一平面上,而是形成了正四面体的空间结构。C位于正四面体的中心,4个H分别位于四个顶点,4 个 C—H 键的长度和强度相同,相互之间的夹角相等,为109°28′。
【思考与讨论p62】
(1) 与甲烷结构相似的有机化合物还有很多,随着分子中碳原子数的增加,还有乙烷、丙烷、丁烷等一系列有机化合物。请根据碳原子的成键规律和下表提供的信息,写出丁烷的结构式和乙烷、丙烷、丁烷的分子式,并由此归纳这类有机化合物分子式的通式。
有机化合物 甲烷 乙烷 丙烷 丁烷
分子中碳原子数
结构式
结构简式
分子式
球棍模型
1
2
3
CH4
CH3CH3
CH3CH2CH3
CH4
C2H6
C3H8
【思考与讨论p62】
(2) 与同学交流,比较大家写出的丁烷的结构式是否相同,思考产生这种现象的可能原因。
有机化合物 甲烷 乙烷 丙烷 丁烷
分子中碳原子数
结构式
结构简式
分子式
球棍模型
1
2
3
4
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2 CH3
CH3 - CH-CH3
CH3
CH4
C2H6
C3H8
C4H10
(3)结合下图中的分子结构模型,总结这类有机化合物的组成和分子结构特点。
②C原子都形成4个共价键;形成四面体结构。
③碳链可以转动(呈锯齿形)
①以上各有机物分子中,原子间均以共价单键结合,每个碳原子的化合价都已充分利用,都达到“饱和”。
这样的烃叫做饱和烃,又叫烷烃。
1.烷烃的概念
只含有碳和氢两种元素,分子中的碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”。这样的一类有机化合物称为饱和烃,也称为烷烃。
注意:当碳原子与4个原子以单键相连时,碳原子与周围的4个原子都以四面体取向成键,因此,链状烷烃中碳碳结合成链状,链状不是“直线状”,而是呈锯齿状,链上还可分出支链,如图所示:
正丁烷
异丁烷
二.烷烃
2.烷烃的结构特点:
①烷烃分子中每个碳原子与4个原子相连,对于烷烃的任意一个碳原子来说,它周围的4个原子以它为中心构成四面体。
②链状烷烃为开链式结构,可以是直链,也可带支链。碳原子数≥3的链状烷烃分子中的碳链均非直线型,为锯齿形。
③烷烃中C-H单键和C-C单键都可以旋转。
饱和烃(烷烃)
链状烷烃
环状烷烃
直链
支链
结构的要点:
以C为中心四面体构型
链状烃为非直线型(空间折线)
C-C(可旋转)
饱和烃
单键、饱和、链状
(1)分子式:
(3)结构式:
3、烷烃的表示方法
用元素符号和数字的组合表示物质分子组成的式子。如CH4、C2H6、C3H8、C4H10 ……
用短线来表示原子间的共用电子对
H C C H
H H
H H
(2)电子式:
用小黑点等符号代替电子,表示原子最外层电子成键情况的式子
(4)结构简式:
(省略与合并)
省略C H键,把同一碳原子上的H合并
CH3 CH2 CH2 CH CH3
CH3
再简化:
省略横线上C C键
CH3CH2CH2CHCH3
CH3
CH3(CH2)2CH(CH3)CH3
【注意】省略单键,但双键、三键不能省略
如CH3CH=CH2
为了书写方便,有机物还常用结构简式表示。
常用的
或者:将支链括起来,
写在连接它的C原子后面
或:CH3(CH2)2CH(CH3)2
【思考与讨论p61】
根据碳原子的4价键原则,可将下图中碳原子的价键用氢原子补齐,试在各模型的下面写出各物质的结构简式。
CH3CH2CH2CH3
CH3CH(CH3)2
CH3CH2CH=CH2
CH3CH=CHCH3
(CH3)2C=CH2
CH3CH2C≡CH
CH3C≡CCH3
(5)球棍模型:
用球和棍表示原子间的结合方式
(6)空间填充模型:
用大小不同的小球表示原子间的连接方式
甲烷 CH4 CH4
乙烷 C2H6 CH3CH3
丙烷 C3H8 CH3CH2CH3
丁烷 C4H10 CH3CH2CH2CH3
戊烷 C5H12 CH3(CH2)3CH3
癸烷 C10H22 CH3(CH2)8CH3
十七烷 C17H36 CH3(CH2)15CH3
[思考与讨论] 分析这些式子,可以发现什么?
4.烷烃的通式:
CnH2n+2 ( n≥1 n为正整数)
结构上相似,在分子组成上相差一个或若干个-CH2-原子团
甲烷是含氢量最高的烃
[思考]某烷烃的相对分子质量是156,试写出该烷烃的分子式.
符合此通式的一定是烷烃
5.烷烃的命名——习惯命名法
(1)分子中碳原子数不多于10时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,后面加“烷”,称为某烷,如C4H10称为丁烷。
(2)分子中碳原子数在10以上时,以汉字表示碳原子数,后面加“烷”,称为某烷,如C15H32称为十五烷。
(3)对于碳原子数相同而结构不同的烷烃,一般在烷烃名称前面加正、异、新来区别。
CH3CH2CH2CH2CH3
正戊烷
无支链
CH3CHCH2CH3
CH3
异戊烷
带一支链
CH3
CH3CCH3
CH3
新戊烷
带两支链
【思考与讨论】
正戊烷、异戊烷、新戊烷的分子式、分子结构是否相同?它们是否为同一种物质?
CH3CH2CH2CH2CH3
CH3CHCH2CH3
CH3
CH3
CH3CCH3
CH3
正戊烷
无支链
异戊烷
带一支链
新戊烷
带两支链
它们的分子式相同(C5H12),但分子结构不同,属于不同的分子。
小结 烷烃的组成与结构特点
(5)氢偶数;烷烃分子中的氢原子数一定是偶数。
(1)单键:烷烃分子里只有两种化学键:碳碳单键和碳氢键。每个碳原子都以四个共价单键与其他碳原子或氢原子相连接。
(2)饱和:烷烃是饱和烃,碳原子数一定的烷烃分子中氢原子数已达到最多,其他含有相同碳原子数的烃分子中的氢原子数都比烷烃少。
(3)通式:烷烃的通式为CnH2n+2(n为正整数),符合该通式的烃一定是烷烃。
(4)骨架:碳碳结合成链状,链状不是“直线状”,而是呈锯齿状,链上还可分出支链,碳链可以旋转.如图所示。
1.判断正误(正确的打“√”,错误的打“×”)
(1)碳原子可以跟多数非金属元素原子形成共价键。( )
(2)烷烃分子结构中均为单键。( )
(3)甲烷的结构式为 ,空间构型为正方形。 ( )
(4)烷烃的所有原子一定不在同一平面上。( )
(5)分子中含有8个碳原子的链状烷烃的分子式为C8H16。( )
√
√
√
×
×
2.下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况( )
D
解析: 这几种形式都可表示甲烷分子,其中分子结构示意图、球棍模型及空间充填模型均能反映甲烷分子的空间构型,但空间充填模型更能形象地表达出甲烷分子中H、C原子的位置及所占比例。电子式只反映出原子的最外层电子的成键情况。
3.甲烷分子中的碳原子与氢原子的结合方式是( )
A.形成四对共用电子对B.通过非极性键
C.通过两个共价键 D.通过离子键和共价键
A
解析:甲烷分子中碳原子和4个氢原子共用4个电子对,形成4个C—H极性共价键,A项正确,B、C、D三项均不正确。
4.以下结构表示的物质中是烷烃的是( )
A.CH3OH
B.CH2===CH2
C
解析: 烷烃是只有碳碳单键和碳氢键的链烃。A中含氧不属于烃;B中含碳碳双键,D中含环状结构,只有C属于烷烃。
5.下列说法正确的是( )
A.有机物种类繁多的主要原因是有机物分子结构十分复杂B.烃类分子中的碳原子与氢原子是通过非极性键结合的
C.同分异构现象的广泛存在是造成有机物种类繁多的唯一原因D.烷烃的结构特点是碳原子之间通过单键连接成链状,剩余价键均与氢原子结合
D
解析: 有机物种类繁多的主要原因是碳原子能与其他原子形成四个共价键,且碳原子之间也能互相成键,A项只是其中的一个原因,并不是主要原因,A错误。碳原子与氢原子之间形成极性键,B错误。同分异构现象的广泛存在是造成有机物种类繁多的重要原因,但不是唯一原因,C错误。
6.下列关于链状烷烃的说法正确的有( )
①在链状烷烃分子中,所有的化学键都是单键 ②分子组成上满足通式CnH2n+2(n≥1) ③分子组成上满足CnH2n+2(n≥1)的有机物都是链状烷烃 ④丙烷分子中所有的碳原子均在同一条直线上 ⑤链状烷烃中所有原子可能共平面 ⑥碳原子间以单键结合,碳原子剩余价键全部与氢原子结合的有机物一定是链状烷烃
A.3个 B.4个 C.5个 D.6个
A
7. 某烷烃含有200个H原子,那么该烃的分子式是( )
A、C99H200 B、C98H200
C、C97H200 D、C100H200
A
8. 写出下列烷烃的分子式:
(1)含有38个碳原子的烷烃的分子式
(2)含有38个氢原子的烷烃的分子式
(3)相对分子量为128的烷烃的分子式
9. 试写出辛烷、壬烷、癸烷的分子式?
C8H18、 C9H20、 C10H22
10. 下列物质中是否属于烷烃?
CH3-CH2-CH2-CH2-CH3
CH2=CH2
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
