认识和调控化学反应(复习课件)(共35张PPT)高一化学(人教版2019必修第二册)
文档属性
| 名称 | 认识和调控化学反应(复习课件)(共35张PPT)高一化学(人教版2019必修第二册) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 16:26:14 | ||
图片预览











文档简介
(共35张PPT)
认识与调控化学反应
知识整理与素养检测
化
学
反
应
根据反应物和生成物的类别
以及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
根据
反应
中是
否有
电子
转移
氧化
还原
反应
非氧化还原反应
实质:
有电子转移(得失或偏移)
特征:
反应前后元素的化合价有变化
概念
及其
相互
关系
反
应
物
氧化剂
还原剂
有氧化性
得电子
化合价降低
有还原性
失电子
化合价升高
根据反应中是
否有离子参加
离子
反应
分子
反应
定义:
有离子参加的一类反应
离子
方程式
定义:
用实际参加反应的离子符号
来表示离子反应的式子
意义:
不仅表示一定物质间的某个反应,
而且表示所有同一类型的离子反应
发生还原反应
发生氧化反应
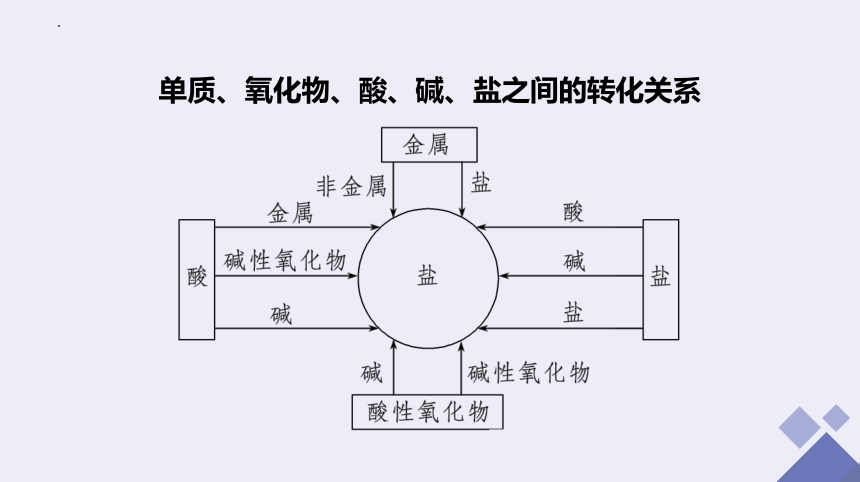
单质、氧化物、酸、碱、盐之间的转化关系
1.(2021·聊城高一检测)物质间的转化体现了化学核心素养之一——变化观念。下列物质之间的转化不能一步实现的是
A.Na2CO3―→NaOH B.CaCO3―→CaO
C.NaCl―→NaNO3 D.CuO―→Cu(OH)2
√
Na2CO3与Ba(OH)2、Ca(OH)2等反应可一步生成NaOH;CaCO3受热分解生成CaO;NaCl与AgNO3反应可生成NaNO3。
2.下列变化,能通过加盐酸一步反应实现的是
①AgNO3→HNO3 ②Fe2O3→FeCl2 ③Cu→CuCl2
④Cu(OH)2→CuCl2 ⑤Fe→FeCl3
A.①② B.②④
C.①④ D.③⑤
√
3.敞口放置的氢氧化钠溶液发生部分变质,要除去变质生成的Na2CO3可以选择适量的
A.Ca(OH)2溶液 B.稀盐酸
C.CaCl2溶液 D.Ca(NO3)2溶液
√
Na2CO3与Ca(OH)2溶液发生反应:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,过滤除去CaCO3后可得NaOH溶液。
4.试管内壁附着下列物质,不能用稀盐酸浸泡而除去的是
A.盛石灰水后留下的白色固体
B.氯化铁溶液和氢氧化钠溶液反应后留下的红褐色固体
C.用足量氢气还原氧化铜留下的红色物质
D.用足量CO还原氧化铁后留下的黑色物质
√
A项,露置的石灰水会和空气中的CO2反应生成难溶物CaCO3,CaCO3能与稀盐酸反应而被除去:CaCO3+2HCl===CaCl2+H2O+CO2↑;
B项,红褐色固体是难溶于水的Fe(OH)3,能与稀盐酸反应而被除去:Fe(OH)3+3HCl===FeCl3+3H2O;
C项,生成的红色物质是铜,Cu在金属活动性顺序中位于H后,不能与稀盐酸反应;
D项,生成的黑色物质是铁,Fe的金属活动性较强,能与稀盐酸反应而被除去:Fe+2HCl===FeCl2+H2↑。
1.判断下列反应的离子方程式的正误。
①稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑( )
②稀硫酸与氢氧化钡溶液混合: +Ba2+===BaSO4↓( )
③稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3( )
④氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O( )
⑤氢氧化铜和稀盐酸反应:OH-+H+===H2O( )
⑥镁和硝酸银溶液反应:Mg+Ag+===Mg2++Ag( )
⑦碳酸氢钠溶液与稀H2SO4反应: +2H+===H2O+CO2↑( )
⑧向澄清的石灰水中通过量CO2:Ca2++2OH-+CO2===CaCO3↓+H2O( )
×
√
×
×
×
×
×
×
Cu的活泼性小于H的活泼性,Cu不能和稀硫酸反应生成H2,故①错误;
反应生成的H2CO3不稳定,分解成CO2和水,故③错误;
Fe2O3为金属氧化物,在离子方程式中不能拆分为离子,故④正确;
Cu(OH)2在离子反应中不能拆分为离子,应为Cu(OH)2+2H+===Cu2++2H2O,故⑤错误;
电荷不守恒,应为Mg+2Ag+===2Ag+Mg2+,故⑥错误。
2.(2022·安徽高一开学考试)常温下,下列各组离子可以大量共存的是
√
Cu2+、Mg2+与OH-反应均生成沉淀,不能大量共存,A不选;
3.下列各组中的离子,能在溶液中大量共存的是
√
A项中的OH-与H+不能大量共存;
返回
1.海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂二氧化硫发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是
A.溴发生了还原反应
B.二氧化硫在反应中被还原
C.溴在反应中失去电子
D.该反应既是化合反应又是氧化还原反应
√
2.铬能慢慢地溶于稀盐酸得到蓝色溶液,若通入空气则溶液颜色变绿,发生的反应有①Cr+2HCl===CrCl2+H2↑、②4CrCl2+4HCl+O2===
4CrCl3+2H2O。下列叙述正确的是
A.反应①②均属于置换反应
B.HCl在反应①②中均发生还原反应
C.反应①中HCl被氧化
D.溶液颜色由蓝变绿是因为Cr2+发生了氧化反应
√
3.下列反应中,电子转移的方向和数目均正确的是
√
化学反应与热能
大
于
小
于
Q吸
Q放
E反
E生
Q放
Q吸
E生
E反
能量变化的计算公式有两个均可用:
(1)生成物能量之和 - 反应物能量之和=E生 - E反 > 0 吸热反应
(2)生成物能量之和 - 反应物能量之和=E生 - E反 < 0 放热反应
(3)反应物键能总和 - 生成物键能总和=Q吸-Q放< 0 放热反应
(4)反应物键能总和 - 生成物键能总和=Q吸-Q放> 0 吸热反应
1. 化学反应A2+B2===2AB的能量变化如图所示,
则下列说法正确的是( )
A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
C
2. 根据如图的能量图,下列说法正确的是( )
D
A.A2(g)+B2(g)===2AB(g)是一个放热反应
B.2 mol AB(l)总能量大于1 mol A2(g)和1 mol B2(g)能量之和
C.1 mol A2(g)和1 mol B2(g)的物质能量之和为a kJ
D.AB(g)物质能量更高,更不稳定
原电池
电极
正极
负极
电子流出(失电子)的一极
电极材料:
较活泼金属
电极材料:
电子流入(得电子)的一极
较不活泼金属或碳棒
电极
反应
负极:
正极:
电解质溶液中的阳离子得电子,发生还原反应
电极本身失电子,发生氧化反应
电池反应:
两电极反应式相加
电子流动方向:
负极 导线 正极
溶液中离子移动方向:
阳离子移向正极,阴离子移向负极
定义:把化学能转变为电能的装置
原电池形成条件
自发的氧化还原反应,电极材料,电解质溶液,闭合回路
原电池的应用
设计原电池
判断金属活泼性
加快反应速率
防止金属被腐蚀
1. M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。则这四种金属的还原性由强到弱的顺序是( )
A.P>M>N>E B.E>N>M>P
C.P>N>M>E D.E>P>M>N
A
2. 下列关于原电池的叙述中,不正确的是( )
A.原电池的负极发生的反应是氧化反应
B.原电池的正极上发生的反应为还原反应
C.原电池电解质溶液中阳离子移向负极,阴离子移向正极
D.原电池中电子流入的极一定是正极
稀硫酸
C
3. 一个原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该反应的原电池组成合理的是
选项 正极 负极 电解质溶液
A Zn Cu CuCl2溶液
B Zn Cu ZnCl2溶液
C Cu Zn H2SO4溶液
D Cu Zn CuSO4溶液
√
4. 如图所示,a的金属活动性在氢之前,b为碳棒。关于该装置的说法正确的是
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向a→b
D.反应后a极质量减小
√
a极作负极,失电子发生氧化反应,
b为正极,发生还原反应
H+在b极上得电子生成氢气,c(H+)减小
b→a
5. Mg——— 次氯酸盐燃料电池的工作原理为 Mg +ClO-+H2O === Mg(OH)2+Cl-。下列有关说法错误的是( )
A.镁做负极材料,发生氧化反应
B.放电时,所有阴离子都向负极迁移
C.负极反应式为Mg+2OH--2e-===Mg(OH)2
D.消耗12 g镁时转移1 mol电子
B
6. 一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭。电解液为KOH浓溶液。下列说法错误的是( )
A.电池总反应式为2Mg+O2+2H2O===2Mg(OH)2
B.正极反应式为O2+4e-+2H2O===4OH-
C.活性炭可以加快O2在负极上的反应速率
D.电子的移动方向由a经外电路到b
C
化学反应速率和限度(化学平衡)
1.下列各组化学反应,反应速率最快的是
选项 反应物 反应物浓度 反应温度
A H2和F2 均为0.02 mol·L-1 5 ℃
B H2和Br2 均为1 mol·L-1 200 ℃
C H2和Cl2 均为1 mol·L-1 100 ℃
D H2和N2 均为4 mol·L-1 300 ℃
√
2.下列关于化学平衡的说法中,不正确的是
A.当可逆反应达到平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡破坏
D.当可逆反应达到平衡时,尽管正、逆反应都还在进行,但各物质的浓度保
持不变
√
解析 可逆反应达到平衡时,v正=v逆≠0,化学平衡应为动态平衡。
3. 一定条件下,分别对反应C(s)+CO2(g)=2CO(g)进行如下操作:
①升高反应体系的温度;②减小CO2的浓度;③缩小反应体系的体积;④减小压强。
上述措施中一定能使反应速率显著变大的是( )
A.①②③④ B.①③④ C.①② D.①③
D
4. CaCO3与100 mL稀盐酸反应生成CO2的量与反应
时间的关系如图所示,下列结论不正确的是( )
A.反应在2~4 min内平均反应速率最大
B.反应在2~4 min内用盐酸表示的平均反应速率为v(HCl)=0.1 mol·L-1·min-1
C.反应开始阶段,反应速率逐渐增大是由于温度比浓度对反应速率的影响大
D.4 min后,反应速率减小的主要原因是c(H+)减小
B
5.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。
下列叙述中正确的是
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
√
6.在一定温度下的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2∶1∶1
⑤单位时间内生成n mol C,同时生成n mol D
⑥单位时间内生成n mol D,同时生成2n mol A
A.①②⑤ B.②③⑤
C.②③⑥ D.①③⑥
√
认识与调控化学反应
知识整理与素养检测
化
学
反
应
根据反应物和生成物的类别
以及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
根据
反应
中是
否有
电子
转移
氧化
还原
反应
非氧化还原反应
实质:
有电子转移(得失或偏移)
特征:
反应前后元素的化合价有变化
概念
及其
相互
关系
反
应
物
氧化剂
还原剂
有氧化性
得电子
化合价降低
有还原性
失电子
化合价升高
根据反应中是
否有离子参加
离子
反应
分子
反应
定义:
有离子参加的一类反应
离子
方程式
定义:
用实际参加反应的离子符号
来表示离子反应的式子
意义:
不仅表示一定物质间的某个反应,
而且表示所有同一类型的离子反应
发生还原反应
发生氧化反应
单质、氧化物、酸、碱、盐之间的转化关系
1.(2021·聊城高一检测)物质间的转化体现了化学核心素养之一——变化观念。下列物质之间的转化不能一步实现的是
A.Na2CO3―→NaOH B.CaCO3―→CaO
C.NaCl―→NaNO3 D.CuO―→Cu(OH)2
√
Na2CO3与Ba(OH)2、Ca(OH)2等反应可一步生成NaOH;CaCO3受热分解生成CaO;NaCl与AgNO3反应可生成NaNO3。
2.下列变化,能通过加盐酸一步反应实现的是
①AgNO3→HNO3 ②Fe2O3→FeCl2 ③Cu→CuCl2
④Cu(OH)2→CuCl2 ⑤Fe→FeCl3
A.①② B.②④
C.①④ D.③⑤
√
3.敞口放置的氢氧化钠溶液发生部分变质,要除去变质生成的Na2CO3可以选择适量的
A.Ca(OH)2溶液 B.稀盐酸
C.CaCl2溶液 D.Ca(NO3)2溶液
√
Na2CO3与Ca(OH)2溶液发生反应:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,过滤除去CaCO3后可得NaOH溶液。
4.试管内壁附着下列物质,不能用稀盐酸浸泡而除去的是
A.盛石灰水后留下的白色固体
B.氯化铁溶液和氢氧化钠溶液反应后留下的红褐色固体
C.用足量氢气还原氧化铜留下的红色物质
D.用足量CO还原氧化铁后留下的黑色物质
√
A项,露置的石灰水会和空气中的CO2反应生成难溶物CaCO3,CaCO3能与稀盐酸反应而被除去:CaCO3+2HCl===CaCl2+H2O+CO2↑;
B项,红褐色固体是难溶于水的Fe(OH)3,能与稀盐酸反应而被除去:Fe(OH)3+3HCl===FeCl3+3H2O;
C项,生成的红色物质是铜,Cu在金属活动性顺序中位于H后,不能与稀盐酸反应;
D项,生成的黑色物质是铁,Fe的金属活动性较强,能与稀盐酸反应而被除去:Fe+2HCl===FeCl2+H2↑。
1.判断下列反应的离子方程式的正误。
①稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑( )
②稀硫酸与氢氧化钡溶液混合: +Ba2+===BaSO4↓( )
③稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3( )
④氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O( )
⑤氢氧化铜和稀盐酸反应:OH-+H+===H2O( )
⑥镁和硝酸银溶液反应:Mg+Ag+===Mg2++Ag( )
⑦碳酸氢钠溶液与稀H2SO4反应: +2H+===H2O+CO2↑( )
⑧向澄清的石灰水中通过量CO2:Ca2++2OH-+CO2===CaCO3↓+H2O( )
×
√
×
×
×
×
×
×
Cu的活泼性小于H的活泼性,Cu不能和稀硫酸反应生成H2,故①错误;
反应生成的H2CO3不稳定,分解成CO2和水,故③错误;
Fe2O3为金属氧化物,在离子方程式中不能拆分为离子,故④正确;
Cu(OH)2在离子反应中不能拆分为离子,应为Cu(OH)2+2H+===Cu2++2H2O,故⑤错误;
电荷不守恒,应为Mg+2Ag+===2Ag+Mg2+,故⑥错误。
2.(2022·安徽高一开学考试)常温下,下列各组离子可以大量共存的是
√
Cu2+、Mg2+与OH-反应均生成沉淀,不能大量共存,A不选;
3.下列各组中的离子,能在溶液中大量共存的是
√
A项中的OH-与H+不能大量共存;
返回
1.海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂二氧化硫发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是
A.溴发生了还原反应
B.二氧化硫在反应中被还原
C.溴在反应中失去电子
D.该反应既是化合反应又是氧化还原反应
√
2.铬能慢慢地溶于稀盐酸得到蓝色溶液,若通入空气则溶液颜色变绿,发生的反应有①Cr+2HCl===CrCl2+H2↑、②4CrCl2+4HCl+O2===
4CrCl3+2H2O。下列叙述正确的是
A.反应①②均属于置换反应
B.HCl在反应①②中均发生还原反应
C.反应①中HCl被氧化
D.溶液颜色由蓝变绿是因为Cr2+发生了氧化反应
√
3.下列反应中,电子转移的方向和数目均正确的是
√
化学反应与热能
大
于
小
于
Q吸
Q放
E反
E生
Q放
Q吸
E生
E反
能量变化的计算公式有两个均可用:
(1)生成物能量之和 - 反应物能量之和=E生 - E反 > 0 吸热反应
(2)生成物能量之和 - 反应物能量之和=E生 - E反 < 0 放热反应
(3)反应物键能总和 - 生成物键能总和=Q吸-Q放< 0 放热反应
(4)反应物键能总和 - 生成物键能总和=Q吸-Q放> 0 吸热反应
1. 化学反应A2+B2===2AB的能量变化如图所示,
则下列说法正确的是( )
A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
C
2. 根据如图的能量图,下列说法正确的是( )
D
A.A2(g)+B2(g)===2AB(g)是一个放热反应
B.2 mol AB(l)总能量大于1 mol A2(g)和1 mol B2(g)能量之和
C.1 mol A2(g)和1 mol B2(g)的物质能量之和为a kJ
D.AB(g)物质能量更高,更不稳定
原电池
电极
正极
负极
电子流出(失电子)的一极
电极材料:
较活泼金属
电极材料:
电子流入(得电子)的一极
较不活泼金属或碳棒
电极
反应
负极:
正极:
电解质溶液中的阳离子得电子,发生还原反应
电极本身失电子,发生氧化反应
电池反应:
两电极反应式相加
电子流动方向:
负极 导线 正极
溶液中离子移动方向:
阳离子移向正极,阴离子移向负极
定义:把化学能转变为电能的装置
原电池形成条件
自发的氧化还原反应,电极材料,电解质溶液,闭合回路
原电池的应用
设计原电池
判断金属活泼性
加快反应速率
防止金属被腐蚀
1. M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。则这四种金属的还原性由强到弱的顺序是( )
A.P>M>N>E B.E>N>M>P
C.P>N>M>E D.E>P>M>N
A
2. 下列关于原电池的叙述中,不正确的是( )
A.原电池的负极发生的反应是氧化反应
B.原电池的正极上发生的反应为还原反应
C.原电池电解质溶液中阳离子移向负极,阴离子移向正极
D.原电池中电子流入的极一定是正极
稀硫酸
C
3. 一个原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该反应的原电池组成合理的是
选项 正极 负极 电解质溶液
A Zn Cu CuCl2溶液
B Zn Cu ZnCl2溶液
C Cu Zn H2SO4溶液
D Cu Zn CuSO4溶液
√
4. 如图所示,a的金属活动性在氢之前,b为碳棒。关于该装置的说法正确的是
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出,溶液中c(H+)增大
C.导线上有电流,电流方向a→b
D.反应后a极质量减小
√
a极作负极,失电子发生氧化反应,
b为正极,发生还原反应
H+在b极上得电子生成氢气,c(H+)减小
b→a
5. Mg——— 次氯酸盐燃料电池的工作原理为 Mg +ClO-+H2O === Mg(OH)2+Cl-。下列有关说法错误的是( )
A.镁做负极材料,发生氧化反应
B.放电时,所有阴离子都向负极迁移
C.负极反应式为Mg+2OH--2e-===Mg(OH)2
D.消耗12 g镁时转移1 mol电子
B
6. 一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭。电解液为KOH浓溶液。下列说法错误的是( )
A.电池总反应式为2Mg+O2+2H2O===2Mg(OH)2
B.正极反应式为O2+4e-+2H2O===4OH-
C.活性炭可以加快O2在负极上的反应速率
D.电子的移动方向由a经外电路到b
C
化学反应速率和限度(化学平衡)
1.下列各组化学反应,反应速率最快的是
选项 反应物 反应物浓度 反应温度
A H2和F2 均为0.02 mol·L-1 5 ℃
B H2和Br2 均为1 mol·L-1 200 ℃
C H2和Cl2 均为1 mol·L-1 100 ℃
D H2和N2 均为4 mol·L-1 300 ℃
√
2.下列关于化学平衡的说法中,不正确的是
A.当可逆反应达到平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡破坏
D.当可逆反应达到平衡时,尽管正、逆反应都还在进行,但各物质的浓度保
持不变
√
解析 可逆反应达到平衡时,v正=v逆≠0,化学平衡应为动态平衡。
3. 一定条件下,分别对反应C(s)+CO2(g)=2CO(g)进行如下操作:
①升高反应体系的温度;②减小CO2的浓度;③缩小反应体系的体积;④减小压强。
上述措施中一定能使反应速率显著变大的是( )
A.①②③④ B.①③④ C.①② D.①③
D
4. CaCO3与100 mL稀盐酸反应生成CO2的量与反应
时间的关系如图所示,下列结论不正确的是( )
A.反应在2~4 min内平均反应速率最大
B.反应在2~4 min内用盐酸表示的平均反应速率为v(HCl)=0.1 mol·L-1·min-1
C.反应开始阶段,反应速率逐渐增大是由于温度比浓度对反应速率的影响大
D.4 min后,反应速率减小的主要原因是c(H+)减小
B
5.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。
下列叙述中正确的是
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
√
6.在一定温度下的恒容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2∶1∶1
⑤单位时间内生成n mol C,同时生成n mol D
⑥单位时间内生成n mol D,同时生成2n mol A
A.①②⑤ B.②③⑤
C.②③⑥ D.①③⑥
√
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
