第五章 化工生产中的重要非金属元素(共19张PPT)-高一化学课件(人教版2019必修第二册)
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素(共19张PPT)-高一化学课件(人教版2019必修第二册) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 16:27:49 | ||
图片预览

文档简介
(共19张PPT)
组织建设
整理与提升
第五章 化工生产中的重要非金属元素
整理与提升
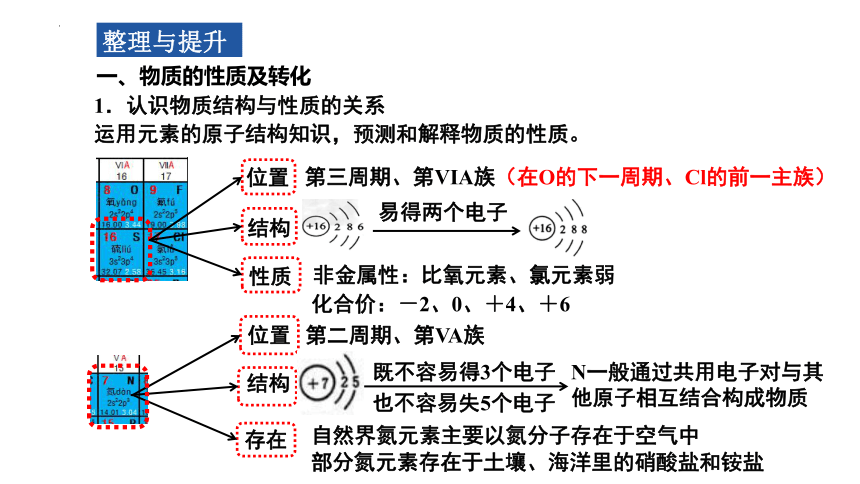
一、物质的性质及转化
1.认识物质结构与性质的关系
运用元素的原子结构知识,预测和解释物质的性质。
易得两个电子
化合价:-2、0、+4、+6
位置
第三周期、第ⅥA族(在O的下一周期、Cl的前一主族)
结构
性质
非金属性:比氧元素、氯元素弱
部分氮元素存在于土壤、海洋里的硝酸盐和铵盐
位置
第二周期、第VA族
结构
存在
自然界氮元素主要以氮分子存在于空气中
既不容易得3个电子
也不容易失5个电子
N一般通过共用电子对与其他原子相互结合构成物质
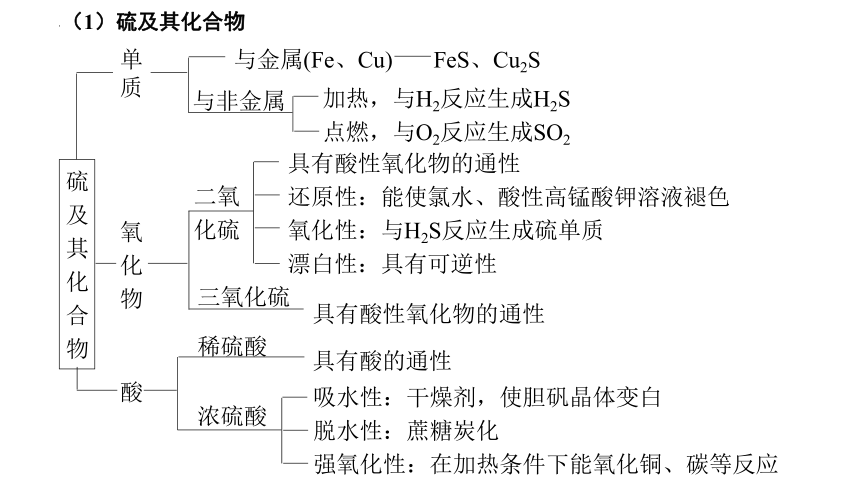
硫及其化合物
单质
氧化物
酸
与金属(Fe、Cu) FeS、Cu2S
与非金属
加热,与H2反应生成H2S
点燃,与O2反应生成SO2
二氧
化硫
具有酸性氧化物的通性
还原性:能使氯水、酸性高锰酸钾溶液褪色
氧化性:与H2S反应生成硫单质
漂白性:具有可逆性
三氧化硫
具有酸性氧化物的通性
稀硫酸
具有酸的通性
浓硫酸
吸水性:干燥剂,使胆矾晶体变白
脱水性:蔗糖炭化
强氧化性:在加热条件下能氧化铜、碳等反应
(1)硫及其化合物
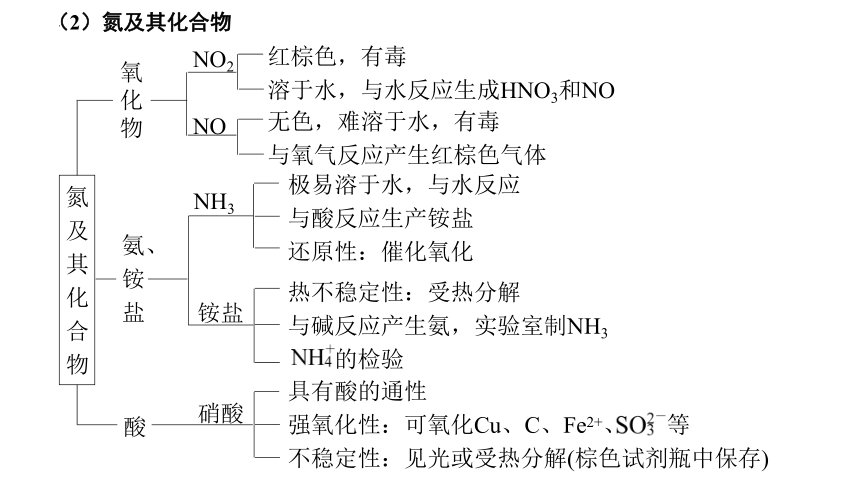
氮及其化合物
氧化物
氨、铵盐
酸
NO2
无色,难溶于水,有毒
与氧气反应产生红棕色气体
NH3
极易溶于水,与水反应
与酸反应生产铵盐
还原性:催化氧化
铵盐
热不稳定性:受热分解
与碱反应产生氨,实验室制NH3
的检验
硝酸
具有酸的通性
强氧化性:可氧化Cu、C、Fe2+、 等
不稳定性:见光或受热分解(棕色试剂瓶中保存)
NO
红棕色,有毒
溶于水,与水反应生成HNO3和NO
(2)氮及其化合物
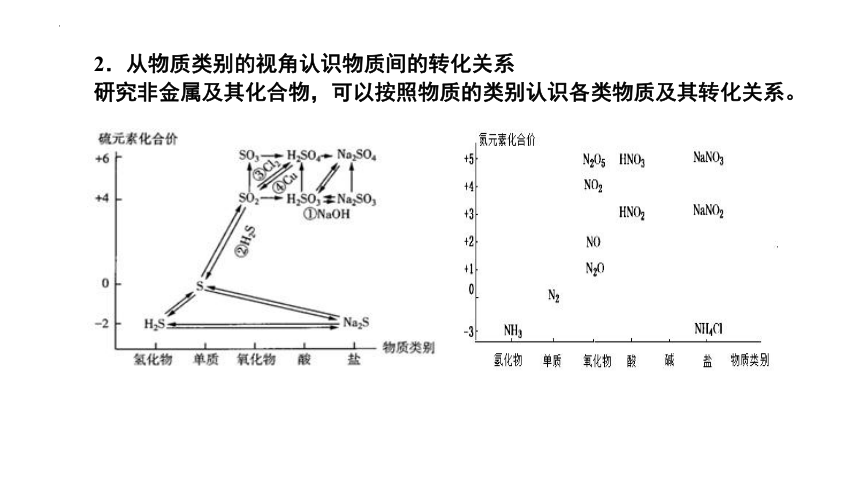
2.从物质类别的视角认识物质间的转化关系
研究非金属及其化合物,可以按照物质的类别认识各类物质及其转化关系。
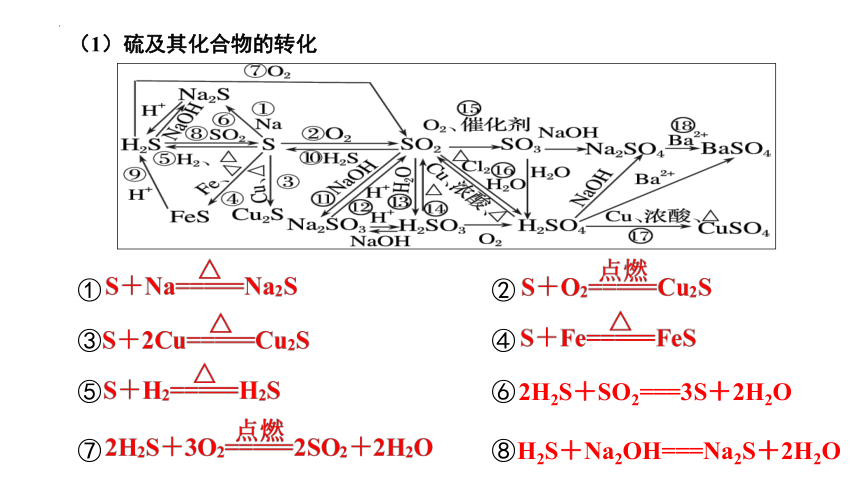
(1)硫及其化合物的转化
① ②
③ ④
⑤ ⑥
⑦ ⑧
2H2S+SO2===3S+2H2O
H2S+Na2OH===Na2S+2H2O
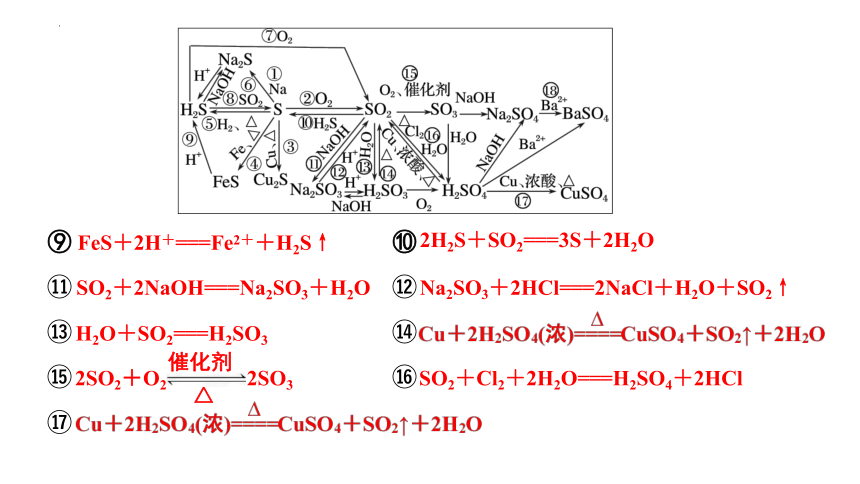
⑨ ⑩
FeS+2H+===Fe2++H2S↑
SO2+2NaOH===Na2SO3+H2O
SO2+Cl2+2H2O===H2SO4+2HCl
2H2S+SO2===3S+2H2O
Na2SO3+2HCl===2NaCl+H2O+SO2↑
H2O+SO2===H2SO3
催化剂
△
2SO2+O2 2SO3
(2)氮及其化合物的转化
①
②
③
④
⑤
⑥
NH3+HCl===NH4Cl
NH3+H2O NH3·H2O
⑦
⑧
⑨
⑩
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3NO2+H2O===2HNO3+NO
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
3.从元素价态的视角认识物质间的转化关系
把一种原料转化多种产品,路径之一是通过氧化还原反应改变主要元素的化合价,从而实现物质转化。
NH3 N2 NO NO2 HNO3
NH4+ N2O4 NO3-
4.辨识化学物质
通过对构成物质的阴、阳离子的检验,可以辨识化学物质。例如,在实验室可通过检验SO42-和NH4+来辨识硫酸盐和铵盐。
待测液
取清液
产生白色沉淀,
即可确定判断有SO42-
铵盐(NH4+)
无色气体(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
5.基于性质认识实验室制取物质的方法
以氨的实验室制取为例,谈谈在实验室里通过化学方法来制取某种物质,通常需要考虑哪些问题?
固+固→加热型
向下排空气法
湿润的红色石蕊试纸变蓝或蘸浓盐酸的玻璃棒
(与氧气的制取装置相同)
酸溶液或水(装置处理)
氯化铵晶体、消石灰固体
2NH4Cl+Ca(OH)2 == CaCl2+2H2O+2NH3↑
碱石灰、固体氧化钙、固体氢氧化钠
装置:
收集:
验满:
尾气吸收:
试剂:
原理:
干燥:
注意:无水CaCl2不能干燥NH3(形成CaCl2· 8NH3)
问:棉花的作用?
防止与空气对流,提高收集的氨气纯度;抑制氨气逸出,避免污染空气。
问:加热NH4Cl、NH4HCO3能制取NH3吗?
NH4Cl分解产生的NH3和HCl遇冷会再次化合为NH4Cl,不能用于制取NH3。
(1)为什么会倒吸?
问:尾气处理过程中的防倒吸怎么处理?
(2)倒吸一定会发生危险吗?
热的发生装置冷却使得内部压强减小,与大气压形成压强差。
压强差可被页面差消除;但气体被吸收(气体进一步被溶解或反应),冷水倒回热的发生装置,发生爆炸。
二、无机非金属材料
硅及其重要化合物之间的转化
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
SiO2+4HF=SiF4↑+2H2O
SiO2+2NaOH=Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3↓+2NaCl或Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
Si+2F2=SiF4
Si+2NaOH+H2O=Na2SiO3+2H2↑
1.部分含硫物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a可与O2反应直接生成c
B.b既可被氧化,也可被还原
C.可向H2O2中加入b制得d
D.可存在b→c→d→b的转化关系
A
2.结合氮及其化合物“价—类”二维图及氧化还原反应的基本规律,下列分析或预测正确的是( )
A.N2O3、NO2、N2O5均能与水反应生成
酸,三者均为酸性氧化物
B.HNO3、HNO2、NaNO3、NH3的水溶
液均可以导电,四者均属于电解质
C.联氨(N2H4)可能被亚硝酸(HNO2)氧化生成氢叠氮酸(HN3)
D.硝酸具有较强的氧化性,可用稀硝酸溶解Au、Ag、Cu
C
3.如图为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。下列关于甲、乙、丙、丁的判断不正确的是( )
A.甲只具有还原性
B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性
D.丁为黄色或淡黄色固体
A
组织建设
整理与提升
第五章 化工生产中的重要非金属元素
整理与提升
一、物质的性质及转化
1.认识物质结构与性质的关系
运用元素的原子结构知识,预测和解释物质的性质。
易得两个电子
化合价:-2、0、+4、+6
位置
第三周期、第ⅥA族(在O的下一周期、Cl的前一主族)
结构
性质
非金属性:比氧元素、氯元素弱
部分氮元素存在于土壤、海洋里的硝酸盐和铵盐
位置
第二周期、第VA族
结构
存在
自然界氮元素主要以氮分子存在于空气中
既不容易得3个电子
也不容易失5个电子
N一般通过共用电子对与其他原子相互结合构成物质
硫及其化合物
单质
氧化物
酸
与金属(Fe、Cu) FeS、Cu2S
与非金属
加热,与H2反应生成H2S
点燃,与O2反应生成SO2
二氧
化硫
具有酸性氧化物的通性
还原性:能使氯水、酸性高锰酸钾溶液褪色
氧化性:与H2S反应生成硫单质
漂白性:具有可逆性
三氧化硫
具有酸性氧化物的通性
稀硫酸
具有酸的通性
浓硫酸
吸水性:干燥剂,使胆矾晶体变白
脱水性:蔗糖炭化
强氧化性:在加热条件下能氧化铜、碳等反应
(1)硫及其化合物
氮及其化合物
氧化物
氨、铵盐
酸
NO2
无色,难溶于水,有毒
与氧气反应产生红棕色气体
NH3
极易溶于水,与水反应
与酸反应生产铵盐
还原性:催化氧化
铵盐
热不稳定性:受热分解
与碱反应产生氨,实验室制NH3
的检验
硝酸
具有酸的通性
强氧化性:可氧化Cu、C、Fe2+、 等
不稳定性:见光或受热分解(棕色试剂瓶中保存)
NO
红棕色,有毒
溶于水,与水反应生成HNO3和NO
(2)氮及其化合物
2.从物质类别的视角认识物质间的转化关系
研究非金属及其化合物,可以按照物质的类别认识各类物质及其转化关系。
(1)硫及其化合物的转化
① ②
③ ④
⑤ ⑥
⑦ ⑧
2H2S+SO2===3S+2H2O
H2S+Na2OH===Na2S+2H2O
⑨ ⑩
FeS+2H+===Fe2++H2S↑
SO2+2NaOH===Na2SO3+H2O
SO2+Cl2+2H2O===H2SO4+2HCl
2H2S+SO2===3S+2H2O
Na2SO3+2HCl===2NaCl+H2O+SO2↑
H2O+SO2===H2SO3
催化剂
△
2SO2+O2 2SO3
(2)氮及其化合物的转化
①
②
③
④
⑤
⑥
NH3+HCl===NH4Cl
NH3+H2O NH3·H2O
⑦
⑧
⑨
⑩
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3NO2+H2O===2HNO3+NO
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
3.从元素价态的视角认识物质间的转化关系
把一种原料转化多种产品,路径之一是通过氧化还原反应改变主要元素的化合价,从而实现物质转化。
NH3 N2 NO NO2 HNO3
NH4+ N2O4 NO3-
4.辨识化学物质
通过对构成物质的阴、阳离子的检验,可以辨识化学物质。例如,在实验室可通过检验SO42-和NH4+来辨识硫酸盐和铵盐。
待测液
取清液
产生白色沉淀,
即可确定判断有SO42-
铵盐(NH4+)
无色气体(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
5.基于性质认识实验室制取物质的方法
以氨的实验室制取为例,谈谈在实验室里通过化学方法来制取某种物质,通常需要考虑哪些问题?
固+固→加热型
向下排空气法
湿润的红色石蕊试纸变蓝或蘸浓盐酸的玻璃棒
(与氧气的制取装置相同)
酸溶液或水(装置处理)
氯化铵晶体、消石灰固体
2NH4Cl+Ca(OH)2 == CaCl2+2H2O+2NH3↑
碱石灰、固体氧化钙、固体氢氧化钠
装置:
收集:
验满:
尾气吸收:
试剂:
原理:
干燥:
注意:无水CaCl2不能干燥NH3(形成CaCl2· 8NH3)
问:棉花的作用?
防止与空气对流,提高收集的氨气纯度;抑制氨气逸出,避免污染空气。
问:加热NH4Cl、NH4HCO3能制取NH3吗?
NH4Cl分解产生的NH3和HCl遇冷会再次化合为NH4Cl,不能用于制取NH3。
(1)为什么会倒吸?
问:尾气处理过程中的防倒吸怎么处理?
(2)倒吸一定会发生危险吗?
热的发生装置冷却使得内部压强减小,与大气压形成压强差。
压强差可被页面差消除;但气体被吸收(气体进一步被溶解或反应),冷水倒回热的发生装置,发生爆炸。
二、无机非金属材料
硅及其重要化合物之间的转化
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
SiO2+4HF=SiF4↑+2H2O
SiO2+2NaOH=Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3↓+2NaCl或Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
Si+2F2=SiF4
Si+2NaOH+H2O=Na2SiO3+2H2↑
1.部分含硫物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a可与O2反应直接生成c
B.b既可被氧化,也可被还原
C.可向H2O2中加入b制得d
D.可存在b→c→d→b的转化关系
A
2.结合氮及其化合物“价—类”二维图及氧化还原反应的基本规律,下列分析或预测正确的是( )
A.N2O3、NO2、N2O5均能与水反应生成
酸,三者均为酸性氧化物
B.HNO3、HNO2、NaNO3、NH3的水溶
液均可以导电,四者均属于电解质
C.联氨(N2H4)可能被亚硝酸(HNO2)氧化生成氢叠氮酸(HN3)
D.硝酸具有较强的氧化性,可用稀硝酸溶解Au、Ag、Cu
C
3.如图为火山喷发时硫元素的转化示意图,其中甲、乙在常温下均为气体,丙为液体,丁为固体。下列关于甲、乙、丙、丁的判断不正确的是( )
A.甲只具有还原性
B.乙、丙均为酸性氧化物
C.乙既有氧化性,又有还原性
D.丁为黄色或淡黄色固体
A
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
