高考化学实验——综合定量探究2023届高三化学专项复习(共73张PPT)
文档属性
| 名称 | 高考化学实验——综合定量探究2023届高三化学专项复习(共73张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 16:30:59 | ||
图片预览








文档简介
(共73张PPT)
2023届高三化学综合实验专题复习
(定量实验、探究实验)
综合实验(制备、定量、探究实验)
化学综合
实验大题
物质的制备
定量实验(滴定实验)
探究实验
无机物的制备
有机物的制备
物质制备+性质探究
性质探究
原理探究
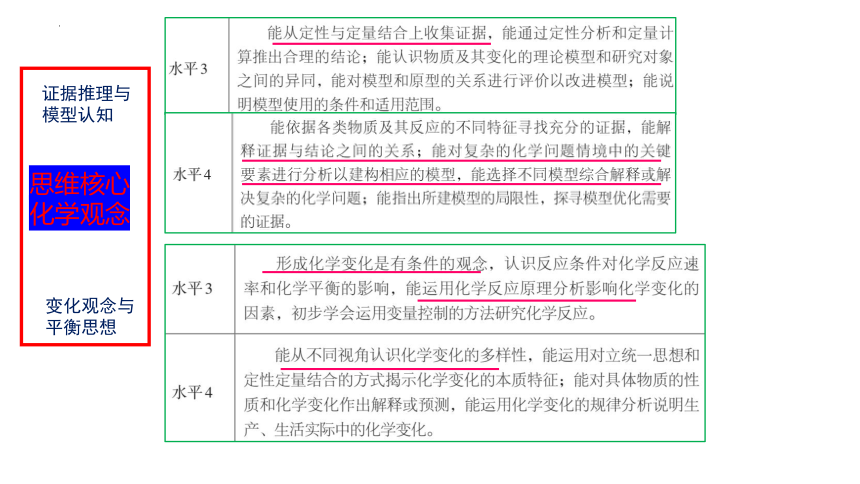
证据推理与
模型认知
变化观念与
平衡思想
思维核心化学观念
证据的唯一性
证据只有唯一性才具有充分性,当我们对一个推论探寻证据时,该推理应是形成该证据的唯一因素,若还有其他的因素也会导致相同证据结果的,则该证据就不具有充分性,依据该证据所得出的结论也就是不严谨的,此时就要排除其他因素的干扰或者进行对照试验,以证明该推论是形成所提供证据的唯一因素或决定性因素。
01化学实验中变量控制
1、因素(变量)的含义
因素:在科学实验中,影响实验指标的要素或原因。(百度百科)
变量:在某一过程中,数值可以变化的量。(现代汉语词典)
2019人教版必修第二册方法导引
2、反应速率的探究实验——教材重温
选择性必修一 p24
定性与定量研究影响化学反应速率的因素
例1. (2021年顺义高三二模)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该法降解有机污染物p—CP探究有关因素对该降解反应速率的影响。
【实验过程】取20mL工业废水,加入一定量FeSO4溶液和NaOH溶液,调节Fe2+浓度和pH,再加入一定浓度H2O2,用数据采集器测定p—CP的变化情况。
下列说法中不正确的是( )
A. 实验①②说明其它条件相同时,适当升温
可以提高降解速率
B. 实验①③的目的是探究H2O2浓度对降解速率
的影响
C. 实验①③④说明浓度改变对降解速率的影响
H2O2大于Fe2+
D. 实验⑤降解反应趋于停止的原因可能是Fe2+
与H2O2反应生成Fe(OH)3沉淀
本题的变量:H2O2浓度、Fe2+的浓度、pH 、温度
C
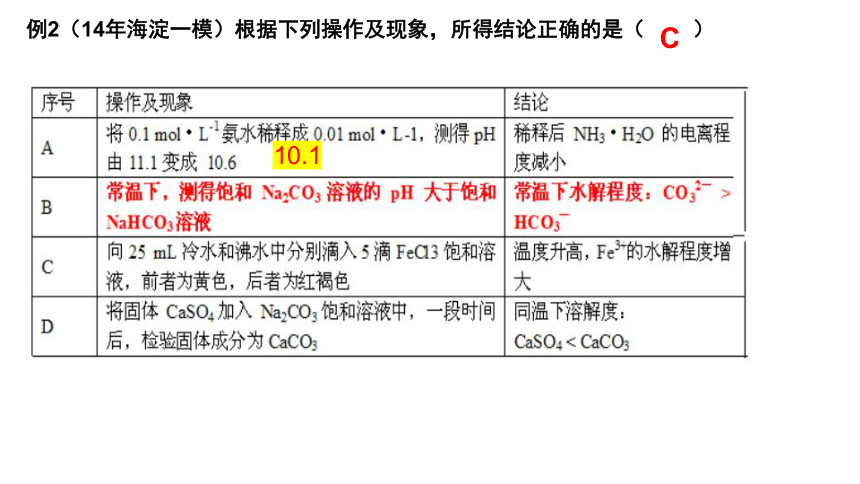
例2(14年海淀一模)根据下列操作及现象,所得结论正确的是( )
10.1
C
02有气体参与物质的制备
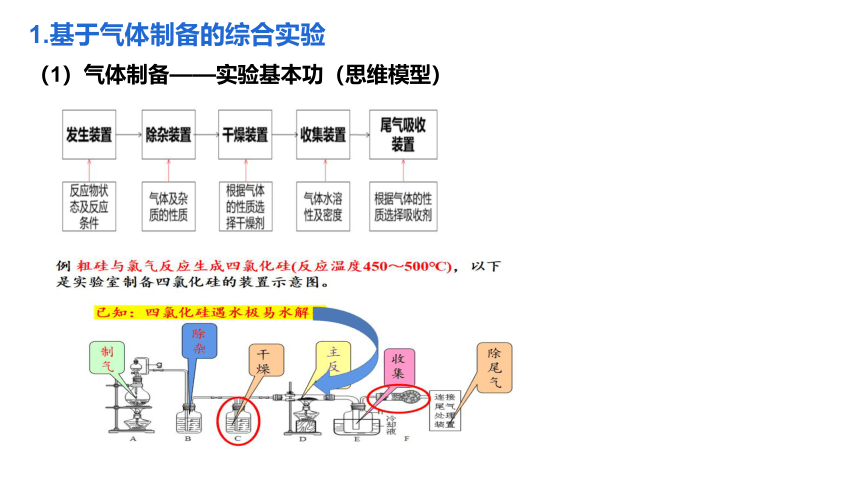
1.基于气体制备的综合实验
(1)气体制备——实验基本功(思维模型)
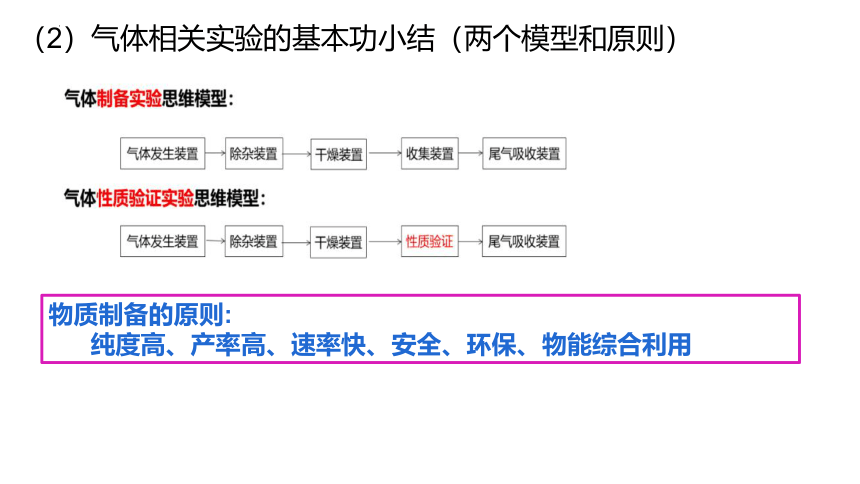
(2)气体相关实验的基本功小结(两个模型和原则)
物质制备的原则:
纯度高、产率高、速率快、安全、环保、物能综合利用
例3:无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机催化剂,实验室可用下列装置(夹持一起忽略)制备无水FeCl3固体。
思考:
1、A到G各个装置的作用是什么?
2.a和b的作用是什么?
题目关键信息
物质特性
易潮解
易升华
思考
物质制备实验要求产率高,纯度高,安全环保等,而这些特性的发生,会对物质制备造成什么影响?
易潮解——防潮解
分析水分来源
处理措施
水分来源分析
a.装置的气密性
b.装置内空气的水分
c.前方来水
d.后方返水
怎么防水呢
a.装置的气密性检查
b.实验前鼓气,排除装置的空气
c.前方加干燥装置
d.后方也要加干燥装置
FeCl3的制备,防潮解
FeCl3的制备,防潮解
怎么防水呢
a.装置的气密性检查
b.实验前鼓气,排除装置的空气
c.前方加干燥装置
d.后方也要加干燥装置
请思考有哪些防潮措施?
1、检查气密性
2、从a处通入N2,排出装置内的空气,或者是先点燃a处酒精灯,待装置中充满黄绿色气体后,再点燃D处酒精灯。
3.C中装浓硫酸
4.F处装浓硫酸。
实验室用Na与H2反应制备氢化钠(NaH)。
实验室用下图装置制取SnCl4,SnCl4遇水强烈水解,产生大量白烟。
思维
路径
抓信息
物质特性分析
特性发生的
环境途径分析
处理
措施
请大家讨论:
1.哪些位置容易堵塞
2.堵塞后有什么现象
3.如何处理?
FeCl3的制备,防堵塞
特性:易升华、易凝华、
易堵塞——防止堵塞
加热堵塞处或换用粗导管。
气体参与的物质制备实验思维模型
装置模型:
1、反应开始前:排尽装置内的空气,避免干扰实验(反应物或产物易被氧化、易水解、易潮解)
2.反应结束后:排出装置中有毒的气体,用溶液完全吸收,防止污染环境。(反应物或产物有毒),若在定量实验中,反应前后排出装置内的空气,和反应后将生成的气体全部吹入后续装置,充分吸收,可以减少误差
防止后续装置的水蒸汽或氧气进入前一段装置,引起水解、干扰实验等。
03定量实验(气体定量、沉淀定量、关系式定量、滴定问题)
I.气体体积有关定量实验
2.量气时应注意的问题
(1)量气时应保持装置处于室温状态。
(2)读数时要特别注意消除“压强差”,保持液面相平,同时要注意视线与液面最低处相平。如图(Ⅰ)、(Ⅳ)应使左侧和右侧的液面高度保持相平。
1.常用的量气装置
思考:
1.什么样的气体适合气体体积的定量呢?
2.测定气体的体积的目的是什么呢?
说明:气体体积定量实验,温度、压强、气体的溶解都会干扰体积的测定,必须让测定气体的温度和压强和环境一样,才能准确决定物质的量。
回答下列问题:
(2)以下是测量收集到气体体积必须包括的几个步骤;
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同? _ 。
(4)如果实验中得到的氧气体积是c L(0 ℃、1.01×l05 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为 (含a、b、c,不必化简):
例4:某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量
②①③
将量筒慢慢下压,使量筒内液面和水槽液面向平
气体的体积与温度、压强有关。
pv=nRT(气态方程)
Na2CO3+2HCl=2NaCl+CO2 +H2O
计算公式为:
碳酸钠的质量分数为=
思考:该同学想用(m2 -m1)来表示CO2的质量。如果不考虑称量误差,该生的实验是否有明显误差?如果有,请简要说明依据并提出改进措施。
II气体质量的测量
例5:为了测定工业纯碱中碳酸钠的质量分数(纯碱中经常含有少量的NaCl),某同学设计了实验装置如图所示的装置进行实验:
(1)准确测定盛有纯碱的干燥管的质量(设为m1).
(2)准确称取一定量纯碱样品(设为m0),放入烧瓶中。
(3)从分液漏斗中缓缓滴入稀盐酸待不再产生气体后,称得干燥管的中质量为
(设为m2)
挥发的
HCl和H2O
反应后装置内残留CO2
空气中CO2和H2O进入
改进后的装置
测定工业纯碱中碳酸钠的质量分数(纯碱中含有少量的氯化钠)的装置如下图所示。
避免反应物干扰
避免气体残留干扰
避免CO2中的蒸汽
避免环境干扰
例题:为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W g样品进行实验,下列实验方法所对应的实验方案和测量数据合理的是( )
选项 实验方法 实验方案 测量数据
A 滴定法 将样品配成100 mL溶液,取10 mL,加入酚酞,用标准盐酸滴定 消耗盐酸的体积
B 量气法 将样品与盐酸反应,生成的气体全部被碱石灰吸收 碱石灰增加的质量
C 重量法 将样品放入烧瓶中,置于电子天平上,加入足量盐酸 减少的质量
D 量气法 将样品与盐酸反应,气体通过排水量气装置量气 排出水的体积
A
III 滴定有关定量实验
滴定分析是重要的化学分析方法,是发展学生定量思维的重要素材。 2014—2022年,北京高考连续以滴定分析为载体、突出考查定量思想理解与应用水平。
2014、2015年考查简单的直接滴定;2017—2020年在各种实际情境中考查学生对滴定分析的理解与应用;2021年则是更进一步,利用滴定分析解决平衡原理中的实际问题;2022年与有机合成融合和库仑滴定。
以时间线为序梳理试题,可以明确感受到北京高考在滴定分析的考查上不断进阶,意图是通过考试引导教学重视真实状况下的化学计算。
例6(2020年北京高考)产品纯度测定:向a g产品中依次加入足量b g Na2C2O4和足量稀H2SO4,加热至充分反应,再用cmol/L KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为d L。产品纯度为 (用质量分数表示)。
(已知:MnO2及MnO4—均被还原为Mn2+。相对分子质量:MnO2 86.94,Na2C2O4 134.0)
MnO2 + C2O42— + 4H+ =Mn2++2CO2↑+2H2O
2MnO4—+5C2O42—+ 16H+ =2Mn2++10CO2↑+8H2O
2 5
cd x=2.5cd
86.94 1
y a/134 -2.5cd
y=86.94(b/134.0 - 2.5cd)
86.94(b/134.0 - 2.5cd)
a
2022北京高考
反应:SO2+ I3— +2H2O=3I—+SO42—+4H+
阳极:3I— —3e— = I3—
6I—+O2 + 4H+=2I3—+2H2O
SO2 ~2e—~I3—~3I—
对化学反应的认知——固有思维障碍
(2018年全国高考II)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。
(3)测定 三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至 终点。滴定终点的现象是___________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集
到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液
V mL。该晶体中铁的质量分数的表达式为_____________。
粉红色或浅红色
2Fe3++Zn=2Fe2++Zn2+
思考:上述操作是用 KMnO4溶液滴定溶液中的Fe2+,过量的Zn到底能否置换出铁呢?如果能置换出铁,必然会带来误差。
2MnO4—+5C2O42—+16H+=2Mn2++10CO2 +8H2O
MnO4—+5Fe2—+8H+=Mn2++5Fe3+ +4H2O
理论分析:Zn+Fe2+=Fe +Zn2+反应情况分析
热力学分析:
资料:2Fe3++Zn=2Fe2++Zn2+ K1=1051.8
Zn+Fe2+=Fe +Zn2+ K 2=1010.64
我们往往:只关注热力学因素,忽略了动力学因素,动力学因素具有可视化的特点,
思考:将过量的锌加入到酸性氯化铁溶液,预测一下应该怎样反应呢?
上述两个反应,从热力学的角度,反应程度都很大,理论上锌可以置换出铁。但是在我们这种滴定过程中,锌能不能快速置换出铁呢?通过研究发现Zn+Fe2+=Fe +Zn2+ 反应速率很慢,在我们滴定过程中几乎不发生。
现象:从氧化还原的角度,Fe3+氧化性大于H+,锌先跟Fe3+反应,这是热力学因素。实际现象是有气体产生,锌与氢离子先反应。原因在与Fe3+往往是以水和铁离子和氯离子形成配合物的形式,裸露的Fe3+很少。
04 综合探究实验
(根据课标中的描述)实验探究过程的核心要素
实验现象
近十二年北京高考的实验探究题
北京市所有的探究实验的题目,都涉及到氧化还原反应、物质检验、设计实验、对比、控制变量、实验设计、干扰因素的发现和排除,尤其是证据推理与模型认知,变化观念与平衡思想等核心素养的考查。
近十二年北京高考的实验探究题
高频考点
探究物质性质
硫及其化合物、铁及其化合物、锰的化合物、硝酸银......
探究反应规律
复分解反应、氧还反应、络合反应......
综合性强,思维容量大
陌生度高、推理路径长
探究物质性质
探究反应规律
主动预测
利用价态和类别通性对物质性质作出预测;利用电化学分析模型、氧还还原规律、平衡移动原理等对反应原理作出预测。
合理推测
在陌生、复杂的情境中,结合预测和题给信息,依据实验现象和找到新的证据,在特定实验条件下,作出科学合理的推测(推理路径长、强调思维的有序性和连续性)
解决实验探究题的思路方法
分析预测的角度1—物质的性质
元
素
物质
实验探究
具体性质:物理性质(宏观辨识,黄绿色、红棕色、臭鸡蛋气味)
化学性质:稳定性、酸碱性、氧还性、络合性
2022西城二模
例:(2022顺义高三备用)从废银催化剂(Ag、Al2O3和少量SiO2)中回收银的工艺流程如下图所示:
回答下列问题:
(4)“沉银”过程中,若沉淀剂过量太多,则沉淀率降低,其原因是 。
Ag++Cl— =AgCl↓
溶液中的反应:氧还、酸碱、沉淀、络合
PCMX(酚羟基)有还原性,NaClO有氧化性,二者能发生氧化还原反应。
ClO-+H2O2 == Cl-+O2↑+H2O
★常见的氧化剂和还原剂
常见的氧化剂:
KMnO4、K2Cr2O7
非金属单质:O3 O2 F2 Cl2 Br2
FeO42— 、Fe3+ 、MnO2、 HNO3、H2SO4(浓)、ClO— 、H2O2
常见的还原剂:
金属单质(Fe粉)、Al、
一些非金属单质(C、H2)
低价态物质:CO、H2S、S2—、HS—、SO2、SO32—、
HSO3—、H—、I— 、Br— 、Fe2+
NaBH4、LiBH4
最高价:只有氧化性
中间价:既有氧化性又有还原性(H2O2)
最低价:只有还原性
最高价只有氧化性,但是氧化性不一定强,比如稀硫酸溶液或硫酸盐溶液种的SO42—(正四面体结构)很稳定,几乎没有什么氧化性;
只有又是最高价又不稳定氧化性才强,比如KMnO4、HNO3、浓硫酸等。
★化学价原则要结构化
最低价只有还原性,还原性不一定强,比如F—是最低价,实际上F—还原性很弱的;同样都是最低价,比如NH3和NH4+还原性也不一样,因为NH4+是正四面体结构比较稳定;如果一种物质化合价最低,又不稳定,还原性一定强。
针对性训练:向某溶液体系种投入下列物质可能引起的变化
例:该小组同学预测FeCl3溶液与NaHSO3溶液混合时,溶液颜色由棕黄色变成浅绿色,他们预测的理论依据为: 。
FeCl3有氧化性,NaHSO3有还原性,混合发生氧化还原反应,生成Fe2+呈浅绿色
核心物质:FeCl3 、FeCl2、Na2SO3、 NaHSO3、Na2S 、NaHS 、NaClO、 AgNO3 、CuSO4 、NaNO2 、KI、 Na2FeO4、 Na2CO3 、NaHCO3 、H2O2 、盐酸、 浓硫酸、硝酸 、Cl2 、NH3 、SO2
Cl—、Fe3+都易 形成配合物
水解呈
酸性
强氧化性离子:MnO4—、Fe3+、FeO42—、ClO—、(H++NO3—)、Cr2O72—
强还原性离子:Fe2+、I—、S2—(HS—)、SO32—(HSO3—)、Br—、Cl—
在溶液中比较稳定的离子:K+、Na+、SO42—
★化学性质对立”的物质之间容易发生反应.
酸性离子:H+ ;弱碱的阳离子(Fe3+、Al3+、Fe2+、Cu2+、Ag+、NH4+ )
碱性离子:OH—;弱酸的阴离子(PO43—、CO32—、S2—、SO32—、C2O42— 、CH3COO—、AlO2—)
中性离子:强碱的阳离子(K+、Na+) 和强酸的阴离子(Cl—、SO42—)
两性离子:弱酸的酸式根离子(HCO3—、HS—、HSO3—、HC2O4— )
★熟悉一些核心物质的性质是高三学生重要的素养
依据“类别和价态”预测可能发生的反应
①氧化还原反应:强氧化剂+强还原剂=弱氧化剂+弱还原剂(可逆)
②复分解反应: 酸碱反应、沉淀反应、生成弱电解质的反应等
★③络合物反应:一般过渡金属(或Al3+)做中心原子,
Cl-、SCN-、CN-、H2O、NH3、CO、NO、C2O42-等作为配体
分析预测的角度2—反应类型
这些反应之间是什么关系:
竞争/协同、速率快慢、程度大小…
举例说明——化学反应中的多面手FeCl3和Na2SO3
例7 某化学小组对FeCl3溶液与NaHSO3溶液反应进行探究。
(一)配制溶液
(1)配制NaHSO3溶液前需检验是否变质,其操作为 。
取少量NaHSO3固体于试管中,加入蒸馏水溶解,先加过量的盐酸酸化,再加氯化钡溶液,如果没有白色沉淀生成,则NaHSO3未变质。
I — Cl— SO42— Fe3+ Fe2+ Ag+ NH4+ NH3 SO2 Ag
Fe3++3H2O Fe(OH)3+3H+
(2)用离子方程式解释配制FeCl3溶液时,先将FeCl3固体溶于稀盐酸,再稀释到所需的浓度的原因 。
(二)预测实验
(3)该小组同学预测FeCl3溶液与NaHSO3溶液混合时,溶液颜色由棕黄色变成浅绿色,他们预测的理论依据为: 。
FeCl3有氧化性,NaHSO3有还原性,混合发生氧化还原反应,生成Fe2+呈浅绿色
核心物质:FeCl3 、FeCl2、Na2SO3、 NaHSO3、Na2S 、NaHS 、NaClO、 AgNO3 、CuSO4 、NaNO2 、KI、 Na2FeO4、 Na2CO3 、NaHCO3 、H2O2 、盐酸、 浓硫酸、硝酸 、Cl2 、NH3 、SO2
Cl—、Fe3+都易 形成配合物
水解呈
酸性
(三)实施实验
(4)向2ml1mol/LNaHSO3溶液中逐滴加入0.5ml1mol/L的FeCl3溶液
装置 反应时间 实验现象
0~1 min 产生红色沉淀,有刺激性气味气体逸出
1~30 min 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30 min后 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
①小组同学同学认为刺激性气味气体的产生原因有两种可能,请写出相应的离子方程式_______。
②从反应速率和化学平衡两个角度解释1~30 min的实验现象_____________。
复分解反应(SO2)
生成红色配合物的反应速率快,红色配合物生成橙色配合物的速率较慢;
在O2的作用下,橙色的HOFeOSO2浓度下降,平衡 HOFeSO2 HOFeOSO2不断正向移动,最终溶液几乎无色
+4 +5
红色 橙色
(三)实施实验
(4)向2ml1mol/LNaHSO3溶液中逐滴加入0.5ml1mol/L的FeCl3溶液
装置 反应时间 实验现象
0~1 min 产生红色沉淀,有刺激性气味气体逸出
1~30 min 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30 min后 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
①小组同学同学认为刺激性气味气体的产生原因有两种可能,请写出相应的离子方程式_______。
30 min后溶液颜色变化的原因_____________。
生成的Fe2+被空气中的氧气氧化成Fe3+,又会与过量的HSO3—电离的SO32—和水解产生的OH—结合成红色的配合物,红色的配合物又会转化成橙色的配合物。
合理推测
多因素影响、多反应并行
速率的快慢、程度的大小
(5)小组同学认为没有观察到预期的实验现象,是因为混合产生气体的反应,干扰了氧化还原反应的发生,小组同学通过如下实验进行了探究。
装置 实验步骤 操作 实验现象
I 向烧杯中装好溶液、链接好装置、闭合开关 灵敏电流表指
针未发生偏转
II 向左侧烧杯中滴加 少量的FeCl3固体 灵敏电流表指针
向左侧偏转
III 继续向左侧烧杯中再滴加少量的铁氰化钾溶液 左侧烧杯中产生蓝色沉淀、灵敏电流表指针向左侧偏转幅度更大
①分析实验I电流计指针不偏转的原因是 。
在此条件下,FeCl3溶液和NaHSO3溶液因为浓度低不能发生氧化还原反应
氧化还原反应:2Fe3++HSO3— +H2O=2Fe2++SO42—+3H+
易于
发生
对于还原反应:Fe3++e—=Fe2+,增大Fe3+或降低Fe2+的浓度,Fe3+的氧化性会增强。
Fe3+ + e— = Fe2+
(5)小组同学认为没有观察到预期的实验现象,是因为混合产生气体的反应,干扰了氧化还原反应的发生,小组同学通过如下实验进行了探究。
装置 实验步骤 操作 实验现象
I 向烧杯中装好溶液、链接好装置、闭合开关 灵敏电流表指
针未发生偏转
II 向左侧烧杯中滴加 少量的FeCl3固体 灵敏电流表指针
向左侧偏转
III 继续向左侧烧杯中再滴加少量的铁氰化钾溶液 左侧烧杯中产生蓝色沉淀、灵敏电流表指针向左侧偏转幅度更大
②分析实验II电流计指针偏转以及实验III电流计指针偏转幅度更大的原因 。
步骤III中,加入铁氰化钾溶液,与Fe2+反应产生蓝色沉淀,降低了Fe2+的浓度,FeCl3氧化性增强,电流强度变大,电流表指针盘转幅度变大。
步骤II加入FeCl3固体,FeCl3氧化性增强,FeCl3溶液和NaHSO3溶液发生氧化还原反应,该装置构成了原电池,右侧为原电池的负极,左侧为原电池的正极,电流计指针偏转;
(5)小组同学认为没有观察到预期的实验现象,是因为混合产生气体的反应,干扰了氧化还原反应的发生,小组同学通过如下实验进行了探究。
装置 实验步骤 操作 实验现象
I 向烧杯中装好溶液、链接好装置、闭合开关 灵敏电流表指
针未发生偏转
II 向左侧烧杯中滴加 少量的FeCl3固体 灵敏电流表指针
向左侧偏转
III 继续向左侧烧杯中再滴加少量的铁氰化钾溶液 左侧烧杯中产生蓝色沉淀、灵敏电流表指针向左侧偏转幅度更大
③根据上述实验,可以得出的结论是: 。
得出的结论是,在实验条件下,2ml1mol/LNaHSO3溶液和0.5ml1mol/L的FeCl3溶液不能发生氧化还原反应。但如果增大FeCl3溶液的浓度或降低Fe2+可以发生氧化还原反应。
从“物质性质、反应类型”角度综合预测
与反应原理有关的三个角度
反应速率(温度、浓度、压强、催化剂、表面积、原电池、副反应)
反应限度(温度、浓度、压强、副反应…….)
反应方向(焓变、熵变、温度、光照、电解)
这些影响因素之间是什么关系:
一致/相反、主要/次要…
分析预测的角度3—反应原理
1.若某个反应本该发生,却在没有外界因素干扰的情况下未观察到预期的现象,则原因可能是什么呢?使该反应能够发生的实验方案是什么呢
例8(2020年海淀一模)某研究小组查阅资料发现Fe3+与I—的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+,并据此设计实验1(如下图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
实验2中,采取了增大反应物浓度、升高温度的措施提高化学反应速率,但溶液仍未变红。
(4)试管a的实验现象说明滤液1中含有________。
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是________。
Fe3+
I— +Ag+=AgI↓
耦合
协同
加入KSCN溶液,Fe3++3SCN— Fe(SCN)3,溶液变红;
Ag++SCN— =AgSCN↓,使上述平衡逆向移动,红色褪去,产生白色沉淀。
2021年北京高考题16题数据
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。
他提出如下假设:i. 可能是AgNO3氧化了Fe2+;ii. 可能是空气中的O2氧化了Fe2+。
他设计实施了实验4,实验记录如下表。
0.1 mol/L AgNO3溶液、
(7)根据实验1~4所得结论是________。
实验1溶液未变红是因为反应2Fe2++ I2 2Fe3+ + 2I-的限度很小,溶液中Fe3+浓度太低,未能检出。加入0.1 mol/L AgNO3促进反应正移。
编号 实验操作 实验现象
4 在试管中加入1滴0.2 mol/L (NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液 溶液不变红
① 试剂a是________。
② 依据实验4,甲同学做出判断:_______。
假设i、ii均不成立
2.不主动干预时,化学反应速率通常会随反应的进行而逐渐减小,但是有时候也会出现先增大后减小的情况,请分析原因。
例:金属镁和盐酸反应的速率随时间变化的情况如下图,分析原因。
例(2019年西城二模)
实验1:向1 mL 0.1 mol·L 1 FeSO4溶液中加入1 mL0.1 mol·L 1 AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。
实验2:实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
ⅰ.实验1中发生反应的离子方程式是______。
ⅱ.迅速出现灰黑色浑浊的可能的原因是______。
Ag++Fe2+ = Fe3+ +Ag
产生的Ag催化了Fe2+与Ag+的反应
典型例题——2019北京高考
1、生成Ag2SO3 沉淀,前提条件是它的Ksp足够小。
2、发生氧化还原反应,生成Ag、Ag2SO4
3、络合反应,Ag+有空轨道、SO32—、HSO
SO2 + O2+ H2O +2Ag+ === Ag2SO4 +2H+
3SO2 + 2NO3-+6Ag+ + 2H2O === 3Ag2SO4 + 2NO + 4H+
(2019年北京高考)将足量SO2通入AgNO3溶液中,迅速反应。得到无色溶液A和白色沉淀B
预测1:复分解反应——白色沉淀为Ag2SO3
SO2 +H2O+ 2Ag+ === Ag2SO3 +2H+
预测2:氧化还原反应——白色沉淀为Ag2SO4
SO2 +2H2O+ 2Ag+ === 2Ag +SO42-+4H+
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
2Ag++SO2+H2O= Ag2SO3↓+2H+
资料:25℃ Ksp(Ag2SO3)=1.5×10—14
Ksp(Ag2SO4)=1.4×10—5
预测3:上述反应同时发生——白色沉淀为Ag2SO3 和Ag2SO4
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。
将实验一所得混合物放置一段时间,有Ag和SO42—生成。
SO2与AgNO3溶液生成Ag2SO3的速率大于生成Ag和SO42—的速率
教学启示:复分解反应的速率大于氧化还原反应的速率。
化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量
SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
2Ag++SO2+H2O= Ag2SO3↓+2H+
实验二:验证B的成分
少BaSO4
Ag2SO4
Ag2SO3
BaSO4
BaSO3
NH3·H2O
Ag(NH3)2+
SO42— SO32—
途径2:实验二中,被氧化为进入D。
碱性环境中+4价的硫更加容易被空气中的氧气氧化。
二氧化硫氧化半反应:SO2—2e— +2H2O =SO42—+4H+
分析预测的角度4—影响因素
1.氧化还原反应规律
①影响氧化还原性强弱的“三度“:温度、浓度、酸碱度
②哪些离子还原性很强,需要考虑空气中O2对实验的干扰?
S2-、SO32-、I-、Fe2+
制备Fe(OH)2
3、通过理论分析,本该发生氧还原还原反应,却因为其它反应的干扰未能观察到预测的现象,则排除干扰的实验方案往往通过设计双液原电池。
例(2019北京西城一模)实验3】通过其他实验方案比较Fe2+和C2O42 的还原性强弱。用FeCl3溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和C2O42 的还原性强弱。画出装置图并描述预期现象:______。
思考:
1.是否电流表指针发生偏转就能证明吗?
2.我们因该检验什么产物呢合适呢?
1.不可以,灵敏电流计探测电势差,稍微有点变化就会偏转,比如浓度不一样、石墨电极插入溶液的深度不同都会有微弱的电势差。
2.因该检验还原产物,因为空气是一个氧化性的氛围,当然也可检验氧化产物,必须做对比实验排除干扰(也就是分别取实验前和实验后的溶液对比)
答案:电流计的指针偏转,电池工作一段时间后,取少量左侧烧杯中的溶液,滴加K3Fe(CN)6溶液,出现蓝色沉淀
分析预测的角度4—影响因素
2.探究外界条件对反应速率或实验产生的影响
(1)温度:速率、平衡、气体的溶解度、物质的稳定性、催化剂活性、副反应等等
(2)pH :微粒存在形式、水解或电离平衡、氧化还原性强弱、竞争放电问题等等
(3)浓度:速率、平衡、放电顺序、氧化还原性强弱
(4)滴加顺序:酸碱性、微粒浓度大小、反应先后顺序等
例5:某实验小组设计方案由正丁醇合成正丁醛。相关数据如下:
试剂A是啥?温度计1和温度计2
控制的温度分别是多少?
4、转化率、选择性、产率三者之间的关系
产率(收率)=选择性转化率
700 ℃
为工业合成气选择合适的温度
例:工业上生成合成气条件的选择:
目标产物产率=选择性×CO转化率%
发现问题 提出假设
设计实验 验证假设
收集证据 获取结论
试剂用量、操作设计
变量控制、排除干扰
合理预测、出现异常、
验证预测、及时改进、
目的
操作
现象
结论
化学实验探究题命题的一般思路及答题技巧
实验探究题的一般思路
2016年北京高考题28题
世上有一条很长很美的路,叫做梦想;
还有一堵很高很硬的墙,叫做现实;
翻越那堵墙,叫做坚持;
推倒那堵墙,叫做突破。
只有拼搏了才知道自己有多优秀!
我相信……
在追逐梦想的过程中,做最优的自己
2023届高三化学综合实验专题复习
(定量实验、探究实验)
综合实验(制备、定量、探究实验)
化学综合
实验大题
物质的制备
定量实验(滴定实验)
探究实验
无机物的制备
有机物的制备
物质制备+性质探究
性质探究
原理探究
证据推理与
模型认知
变化观念与
平衡思想
思维核心化学观念
证据的唯一性
证据只有唯一性才具有充分性,当我们对一个推论探寻证据时,该推理应是形成该证据的唯一因素,若还有其他的因素也会导致相同证据结果的,则该证据就不具有充分性,依据该证据所得出的结论也就是不严谨的,此时就要排除其他因素的干扰或者进行对照试验,以证明该推论是形成所提供证据的唯一因素或决定性因素。
01化学实验中变量控制
1、因素(变量)的含义
因素:在科学实验中,影响实验指标的要素或原因。(百度百科)
变量:在某一过程中,数值可以变化的量。(现代汉语词典)
2019人教版必修第二册方法导引
2、反应速率的探究实验——教材重温
选择性必修一 p24
定性与定量研究影响化学反应速率的因素
例1. (2021年顺义高三二模)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该法降解有机污染物p—CP探究有关因素对该降解反应速率的影响。
【实验过程】取20mL工业废水,加入一定量FeSO4溶液和NaOH溶液,调节Fe2+浓度和pH,再加入一定浓度H2O2,用数据采集器测定p—CP的变化情况。
下列说法中不正确的是( )
A. 实验①②说明其它条件相同时,适当升温
可以提高降解速率
B. 实验①③的目的是探究H2O2浓度对降解速率
的影响
C. 实验①③④说明浓度改变对降解速率的影响
H2O2大于Fe2+
D. 实验⑤降解反应趋于停止的原因可能是Fe2+
与H2O2反应生成Fe(OH)3沉淀
本题的变量:H2O2浓度、Fe2+的浓度、pH 、温度
C
例2(14年海淀一模)根据下列操作及现象,所得结论正确的是( )
10.1
C
02有气体参与物质的制备
1.基于气体制备的综合实验
(1)气体制备——实验基本功(思维模型)
(2)气体相关实验的基本功小结(两个模型和原则)
物质制备的原则:
纯度高、产率高、速率快、安全、环保、物能综合利用
例3:无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机催化剂,实验室可用下列装置(夹持一起忽略)制备无水FeCl3固体。
思考:
1、A到G各个装置的作用是什么?
2.a和b的作用是什么?
题目关键信息
物质特性
易潮解
易升华
思考
物质制备实验要求产率高,纯度高,安全环保等,而这些特性的发生,会对物质制备造成什么影响?
易潮解——防潮解
分析水分来源
处理措施
水分来源分析
a.装置的气密性
b.装置内空气的水分
c.前方来水
d.后方返水
怎么防水呢
a.装置的气密性检查
b.实验前鼓气,排除装置的空气
c.前方加干燥装置
d.后方也要加干燥装置
FeCl3的制备,防潮解
FeCl3的制备,防潮解
怎么防水呢
a.装置的气密性检查
b.实验前鼓气,排除装置的空气
c.前方加干燥装置
d.后方也要加干燥装置
请思考有哪些防潮措施?
1、检查气密性
2、从a处通入N2,排出装置内的空气,或者是先点燃a处酒精灯,待装置中充满黄绿色气体后,再点燃D处酒精灯。
3.C中装浓硫酸
4.F处装浓硫酸。
实验室用Na与H2反应制备氢化钠(NaH)。
实验室用下图装置制取SnCl4,SnCl4遇水强烈水解,产生大量白烟。
思维
路径
抓信息
物质特性分析
特性发生的
环境途径分析
处理
措施
请大家讨论:
1.哪些位置容易堵塞
2.堵塞后有什么现象
3.如何处理?
FeCl3的制备,防堵塞
特性:易升华、易凝华、
易堵塞——防止堵塞
加热堵塞处或换用粗导管。
气体参与的物质制备实验思维模型
装置模型:
1、反应开始前:排尽装置内的空气,避免干扰实验(反应物或产物易被氧化、易水解、易潮解)
2.反应结束后:排出装置中有毒的气体,用溶液完全吸收,防止污染环境。(反应物或产物有毒),若在定量实验中,反应前后排出装置内的空气,和反应后将生成的气体全部吹入后续装置,充分吸收,可以减少误差
防止后续装置的水蒸汽或氧气进入前一段装置,引起水解、干扰实验等。
03定量实验(气体定量、沉淀定量、关系式定量、滴定问题)
I.气体体积有关定量实验
2.量气时应注意的问题
(1)量气时应保持装置处于室温状态。
(2)读数时要特别注意消除“压强差”,保持液面相平,同时要注意视线与液面最低处相平。如图(Ⅰ)、(Ⅳ)应使左侧和右侧的液面高度保持相平。
1.常用的量气装置
思考:
1.什么样的气体适合气体体积的定量呢?
2.测定气体的体积的目的是什么呢?
说明:气体体积定量实验,温度、压强、气体的溶解都会干扰体积的测定,必须让测定气体的温度和压强和环境一样,才能准确决定物质的量。
回答下列问题:
(2)以下是测量收集到气体体积必须包括的几个步骤;
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同? _ 。
(4)如果实验中得到的氧气体积是c L(0 ℃、1.01×l05 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为 (含a、b、c,不必化简):
例4:某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量
②①③
将量筒慢慢下压,使量筒内液面和水槽液面向平
气体的体积与温度、压强有关。
pv=nRT(气态方程)
Na2CO3+2HCl=2NaCl+CO2 +H2O
计算公式为:
碳酸钠的质量分数为=
思考:该同学想用(m2 -m1)来表示CO2的质量。如果不考虑称量误差,该生的实验是否有明显误差?如果有,请简要说明依据并提出改进措施。
II气体质量的测量
例5:为了测定工业纯碱中碳酸钠的质量分数(纯碱中经常含有少量的NaCl),某同学设计了实验装置如图所示的装置进行实验:
(1)准确测定盛有纯碱的干燥管的质量(设为m1).
(2)准确称取一定量纯碱样品(设为m0),放入烧瓶中。
(3)从分液漏斗中缓缓滴入稀盐酸待不再产生气体后,称得干燥管的中质量为
(设为m2)
挥发的
HCl和H2O
反应后装置内残留CO2
空气中CO2和H2O进入
改进后的装置
测定工业纯碱中碳酸钠的质量分数(纯碱中含有少量的氯化钠)的装置如下图所示。
避免反应物干扰
避免气体残留干扰
避免CO2中的蒸汽
避免环境干扰
例题:为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W g样品进行实验,下列实验方法所对应的实验方案和测量数据合理的是( )
选项 实验方法 实验方案 测量数据
A 滴定法 将样品配成100 mL溶液,取10 mL,加入酚酞,用标准盐酸滴定 消耗盐酸的体积
B 量气法 将样品与盐酸反应,生成的气体全部被碱石灰吸收 碱石灰增加的质量
C 重量法 将样品放入烧瓶中,置于电子天平上,加入足量盐酸 减少的质量
D 量气法 将样品与盐酸反应,气体通过排水量气装置量气 排出水的体积
A
III 滴定有关定量实验
滴定分析是重要的化学分析方法,是发展学生定量思维的重要素材。 2014—2022年,北京高考连续以滴定分析为载体、突出考查定量思想理解与应用水平。
2014、2015年考查简单的直接滴定;2017—2020年在各种实际情境中考查学生对滴定分析的理解与应用;2021年则是更进一步,利用滴定分析解决平衡原理中的实际问题;2022年与有机合成融合和库仑滴定。
以时间线为序梳理试题,可以明确感受到北京高考在滴定分析的考查上不断进阶,意图是通过考试引导教学重视真实状况下的化学计算。
例6(2020年北京高考)产品纯度测定:向a g产品中依次加入足量b g Na2C2O4和足量稀H2SO4,加热至充分反应,再用cmol/L KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为d L。产品纯度为 (用质量分数表示)。
(已知:MnO2及MnO4—均被还原为Mn2+。相对分子质量:MnO2 86.94,Na2C2O4 134.0)
MnO2 + C2O42— + 4H+ =Mn2++2CO2↑+2H2O
2MnO4—+5C2O42—+ 16H+ =2Mn2++10CO2↑+8H2O
2 5
cd x=2.5cd
86.94 1
y a/134 -2.5cd
y=86.94(b/134.0 - 2.5cd)
86.94(b/134.0 - 2.5cd)
a
2022北京高考
反应:SO2+ I3— +2H2O=3I—+SO42—+4H+
阳极:3I— —3e— = I3—
6I—+O2 + 4H+=2I3—+2H2O
SO2 ~2e—~I3—~3I—
对化学反应的认知——固有思维障碍
(2018年全国高考II)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。
(3)测定 三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至 终点。滴定终点的现象是___________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集
到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液
V mL。该晶体中铁的质量分数的表达式为_____________。
粉红色或浅红色
2Fe3++Zn=2Fe2++Zn2+
思考:上述操作是用 KMnO4溶液滴定溶液中的Fe2+,过量的Zn到底能否置换出铁呢?如果能置换出铁,必然会带来误差。
2MnO4—+5C2O42—+16H+=2Mn2++10CO2 +8H2O
MnO4—+5Fe2—+8H+=Mn2++5Fe3+ +4H2O
理论分析:Zn+Fe2+=Fe +Zn2+反应情况分析
热力学分析:
资料:2Fe3++Zn=2Fe2++Zn2+ K1=1051.8
Zn+Fe2+=Fe +Zn2+ K 2=1010.64
我们往往:只关注热力学因素,忽略了动力学因素,动力学因素具有可视化的特点,
思考:将过量的锌加入到酸性氯化铁溶液,预测一下应该怎样反应呢?
上述两个反应,从热力学的角度,反应程度都很大,理论上锌可以置换出铁。但是在我们这种滴定过程中,锌能不能快速置换出铁呢?通过研究发现Zn+Fe2+=Fe +Zn2+ 反应速率很慢,在我们滴定过程中几乎不发生。
现象:从氧化还原的角度,Fe3+氧化性大于H+,锌先跟Fe3+反应,这是热力学因素。实际现象是有气体产生,锌与氢离子先反应。原因在与Fe3+往往是以水和铁离子和氯离子形成配合物的形式,裸露的Fe3+很少。
04 综合探究实验
(根据课标中的描述)实验探究过程的核心要素
实验现象
近十二年北京高考的实验探究题
北京市所有的探究实验的题目,都涉及到氧化还原反应、物质检验、设计实验、对比、控制变量、实验设计、干扰因素的发现和排除,尤其是证据推理与模型认知,变化观念与平衡思想等核心素养的考查。
近十二年北京高考的实验探究题
高频考点
探究物质性质
硫及其化合物、铁及其化合物、锰的化合物、硝酸银......
探究反应规律
复分解反应、氧还反应、络合反应......
综合性强,思维容量大
陌生度高、推理路径长
探究物质性质
探究反应规律
主动预测
利用价态和类别通性对物质性质作出预测;利用电化学分析模型、氧还还原规律、平衡移动原理等对反应原理作出预测。
合理推测
在陌生、复杂的情境中,结合预测和题给信息,依据实验现象和找到新的证据,在特定实验条件下,作出科学合理的推测(推理路径长、强调思维的有序性和连续性)
解决实验探究题的思路方法
分析预测的角度1—物质的性质
元
素
物质
实验探究
具体性质:物理性质(宏观辨识,黄绿色、红棕色、臭鸡蛋气味)
化学性质:稳定性、酸碱性、氧还性、络合性
2022西城二模
例:(2022顺义高三备用)从废银催化剂(Ag、Al2O3和少量SiO2)中回收银的工艺流程如下图所示:
回答下列问题:
(4)“沉银”过程中,若沉淀剂过量太多,则沉淀率降低,其原因是 。
Ag++Cl— =AgCl↓
溶液中的反应:氧还、酸碱、沉淀、络合
PCMX(酚羟基)有还原性,NaClO有氧化性,二者能发生氧化还原反应。
ClO-+H2O2 == Cl-+O2↑+H2O
★常见的氧化剂和还原剂
常见的氧化剂:
KMnO4、K2Cr2O7
非金属单质:O3 O2 F2 Cl2 Br2
FeO42— 、Fe3+ 、MnO2、 HNO3、H2SO4(浓)、ClO— 、H2O2
常见的还原剂:
金属单质(Fe粉)、Al、
一些非金属单质(C、H2)
低价态物质:CO、H2S、S2—、HS—、SO2、SO32—、
HSO3—、H—、I— 、Br— 、Fe2+
NaBH4、LiBH4
最高价:只有氧化性
中间价:既有氧化性又有还原性(H2O2)
最低价:只有还原性
最高价只有氧化性,但是氧化性不一定强,比如稀硫酸溶液或硫酸盐溶液种的SO42—(正四面体结构)很稳定,几乎没有什么氧化性;
只有又是最高价又不稳定氧化性才强,比如KMnO4、HNO3、浓硫酸等。
★化学价原则要结构化
最低价只有还原性,还原性不一定强,比如F—是最低价,实际上F—还原性很弱的;同样都是最低价,比如NH3和NH4+还原性也不一样,因为NH4+是正四面体结构比较稳定;如果一种物质化合价最低,又不稳定,还原性一定强。
针对性训练:向某溶液体系种投入下列物质可能引起的变化
例:该小组同学预测FeCl3溶液与NaHSO3溶液混合时,溶液颜色由棕黄色变成浅绿色,他们预测的理论依据为: 。
FeCl3有氧化性,NaHSO3有还原性,混合发生氧化还原反应,生成Fe2+呈浅绿色
核心物质:FeCl3 、FeCl2、Na2SO3、 NaHSO3、Na2S 、NaHS 、NaClO、 AgNO3 、CuSO4 、NaNO2 、KI、 Na2FeO4、 Na2CO3 、NaHCO3 、H2O2 、盐酸、 浓硫酸、硝酸 、Cl2 、NH3 、SO2
Cl—、Fe3+都易 形成配合物
水解呈
酸性
强氧化性离子:MnO4—、Fe3+、FeO42—、ClO—、(H++NO3—)、Cr2O72—
强还原性离子:Fe2+、I—、S2—(HS—)、SO32—(HSO3—)、Br—、Cl—
在溶液中比较稳定的离子:K+、Na+、SO42—
★化学性质对立”的物质之间容易发生反应.
酸性离子:H+ ;弱碱的阳离子(Fe3+、Al3+、Fe2+、Cu2+、Ag+、NH4+ )
碱性离子:OH—;弱酸的阴离子(PO43—、CO32—、S2—、SO32—、C2O42— 、CH3COO—、AlO2—)
中性离子:强碱的阳离子(K+、Na+) 和强酸的阴离子(Cl—、SO42—)
两性离子:弱酸的酸式根离子(HCO3—、HS—、HSO3—、HC2O4— )
★熟悉一些核心物质的性质是高三学生重要的素养
依据“类别和价态”预测可能发生的反应
①氧化还原反应:强氧化剂+强还原剂=弱氧化剂+弱还原剂(可逆)
②复分解反应: 酸碱反应、沉淀反应、生成弱电解质的反应等
★③络合物反应:一般过渡金属(或Al3+)做中心原子,
Cl-、SCN-、CN-、H2O、NH3、CO、NO、C2O42-等作为配体
分析预测的角度2—反应类型
这些反应之间是什么关系:
竞争/协同、速率快慢、程度大小…
举例说明——化学反应中的多面手FeCl3和Na2SO3
例7 某化学小组对FeCl3溶液与NaHSO3溶液反应进行探究。
(一)配制溶液
(1)配制NaHSO3溶液前需检验是否变质,其操作为 。
取少量NaHSO3固体于试管中,加入蒸馏水溶解,先加过量的盐酸酸化,再加氯化钡溶液,如果没有白色沉淀生成,则NaHSO3未变质。
I — Cl— SO42— Fe3+ Fe2+ Ag+ NH4+ NH3 SO2 Ag
Fe3++3H2O Fe(OH)3+3H+
(2)用离子方程式解释配制FeCl3溶液时,先将FeCl3固体溶于稀盐酸,再稀释到所需的浓度的原因 。
(二)预测实验
(3)该小组同学预测FeCl3溶液与NaHSO3溶液混合时,溶液颜色由棕黄色变成浅绿色,他们预测的理论依据为: 。
FeCl3有氧化性,NaHSO3有还原性,混合发生氧化还原反应,生成Fe2+呈浅绿色
核心物质:FeCl3 、FeCl2、Na2SO3、 NaHSO3、Na2S 、NaHS 、NaClO、 AgNO3 、CuSO4 、NaNO2 、KI、 Na2FeO4、 Na2CO3 、NaHCO3 、H2O2 、盐酸、 浓硫酸、硝酸 、Cl2 、NH3 、SO2
Cl—、Fe3+都易 形成配合物
水解呈
酸性
(三)实施实验
(4)向2ml1mol/LNaHSO3溶液中逐滴加入0.5ml1mol/L的FeCl3溶液
装置 反应时间 实验现象
0~1 min 产生红色沉淀,有刺激性气味气体逸出
1~30 min 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30 min后 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
①小组同学同学认为刺激性气味气体的产生原因有两种可能,请写出相应的离子方程式_______。
②从反应速率和化学平衡两个角度解释1~30 min的实验现象_____________。
复分解反应(SO2)
生成红色配合物的反应速率快,红色配合物生成橙色配合物的速率较慢;
在O2的作用下,橙色的HOFeOSO2浓度下降,平衡 HOFeSO2 HOFeOSO2不断正向移动,最终溶液几乎无色
+4 +5
红色 橙色
(三)实施实验
(4)向2ml1mol/LNaHSO3溶液中逐滴加入0.5ml1mol/L的FeCl3溶液
装置 反应时间 实验现象
0~1 min 产生红色沉淀,有刺激性气味气体逸出
1~30 min 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30 min后 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
①小组同学同学认为刺激性气味气体的产生原因有两种可能,请写出相应的离子方程式_______。
30 min后溶液颜色变化的原因_____________。
生成的Fe2+被空气中的氧气氧化成Fe3+,又会与过量的HSO3—电离的SO32—和水解产生的OH—结合成红色的配合物,红色的配合物又会转化成橙色的配合物。
合理推测
多因素影响、多反应并行
速率的快慢、程度的大小
(5)小组同学认为没有观察到预期的实验现象,是因为混合产生气体的反应,干扰了氧化还原反应的发生,小组同学通过如下实验进行了探究。
装置 实验步骤 操作 实验现象
I 向烧杯中装好溶液、链接好装置、闭合开关 灵敏电流表指
针未发生偏转
II 向左侧烧杯中滴加 少量的FeCl3固体 灵敏电流表指针
向左侧偏转
III 继续向左侧烧杯中再滴加少量的铁氰化钾溶液 左侧烧杯中产生蓝色沉淀、灵敏电流表指针向左侧偏转幅度更大
①分析实验I电流计指针不偏转的原因是 。
在此条件下,FeCl3溶液和NaHSO3溶液因为浓度低不能发生氧化还原反应
氧化还原反应:2Fe3++HSO3— +H2O=2Fe2++SO42—+3H+
易于
发生
对于还原反应:Fe3++e—=Fe2+,增大Fe3+或降低Fe2+的浓度,Fe3+的氧化性会增强。
Fe3+ + e— = Fe2+
(5)小组同学认为没有观察到预期的实验现象,是因为混合产生气体的反应,干扰了氧化还原反应的发生,小组同学通过如下实验进行了探究。
装置 实验步骤 操作 实验现象
I 向烧杯中装好溶液、链接好装置、闭合开关 灵敏电流表指
针未发生偏转
II 向左侧烧杯中滴加 少量的FeCl3固体 灵敏电流表指针
向左侧偏转
III 继续向左侧烧杯中再滴加少量的铁氰化钾溶液 左侧烧杯中产生蓝色沉淀、灵敏电流表指针向左侧偏转幅度更大
②分析实验II电流计指针偏转以及实验III电流计指针偏转幅度更大的原因 。
步骤III中,加入铁氰化钾溶液,与Fe2+反应产生蓝色沉淀,降低了Fe2+的浓度,FeCl3氧化性增强,电流强度变大,电流表指针盘转幅度变大。
步骤II加入FeCl3固体,FeCl3氧化性增强,FeCl3溶液和NaHSO3溶液发生氧化还原反应,该装置构成了原电池,右侧为原电池的负极,左侧为原电池的正极,电流计指针偏转;
(5)小组同学认为没有观察到预期的实验现象,是因为混合产生气体的反应,干扰了氧化还原反应的发生,小组同学通过如下实验进行了探究。
装置 实验步骤 操作 实验现象
I 向烧杯中装好溶液、链接好装置、闭合开关 灵敏电流表指
针未发生偏转
II 向左侧烧杯中滴加 少量的FeCl3固体 灵敏电流表指针
向左侧偏转
III 继续向左侧烧杯中再滴加少量的铁氰化钾溶液 左侧烧杯中产生蓝色沉淀、灵敏电流表指针向左侧偏转幅度更大
③根据上述实验,可以得出的结论是: 。
得出的结论是,在实验条件下,2ml1mol/LNaHSO3溶液和0.5ml1mol/L的FeCl3溶液不能发生氧化还原反应。但如果增大FeCl3溶液的浓度或降低Fe2+可以发生氧化还原反应。
从“物质性质、反应类型”角度综合预测
与反应原理有关的三个角度
反应速率(温度、浓度、压强、催化剂、表面积、原电池、副反应)
反应限度(温度、浓度、压强、副反应…….)
反应方向(焓变、熵变、温度、光照、电解)
这些影响因素之间是什么关系:
一致/相反、主要/次要…
分析预测的角度3—反应原理
1.若某个反应本该发生,却在没有外界因素干扰的情况下未观察到预期的现象,则原因可能是什么呢?使该反应能够发生的实验方案是什么呢
例8(2020年海淀一模)某研究小组查阅资料发现Fe3+与I—的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+,并据此设计实验1(如下图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
实验2中,采取了增大反应物浓度、升高温度的措施提高化学反应速率,但溶液仍未变红。
(4)试管a的实验现象说明滤液1中含有________。
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是________。
Fe3+
I— +Ag+=AgI↓
耦合
协同
加入KSCN溶液,Fe3++3SCN— Fe(SCN)3,溶液变红;
Ag++SCN— =AgSCN↓,使上述平衡逆向移动,红色褪去,产生白色沉淀。
2021年北京高考题16题数据
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。
他提出如下假设:i. 可能是AgNO3氧化了Fe2+;ii. 可能是空气中的O2氧化了Fe2+。
他设计实施了实验4,实验记录如下表。
0.1 mol/L AgNO3溶液、
(7)根据实验1~4所得结论是________。
实验1溶液未变红是因为反应2Fe2++ I2 2Fe3+ + 2I-的限度很小,溶液中Fe3+浓度太低,未能检出。加入0.1 mol/L AgNO3促进反应正移。
编号 实验操作 实验现象
4 在试管中加入1滴0.2 mol/L (NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液 溶液不变红
① 试剂a是________。
② 依据实验4,甲同学做出判断:_______。
假设i、ii均不成立
2.不主动干预时,化学反应速率通常会随反应的进行而逐渐减小,但是有时候也会出现先增大后减小的情况,请分析原因。
例:金属镁和盐酸反应的速率随时间变化的情况如下图,分析原因。
例(2019年西城二模)
实验1:向1 mL 0.1 mol·L 1 FeSO4溶液中加入1 mL0.1 mol·L 1 AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。
实验2:实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
ⅰ.实验1中发生反应的离子方程式是______。
ⅱ.迅速出现灰黑色浑浊的可能的原因是______。
Ag++Fe2+ = Fe3+ +Ag
产生的Ag催化了Fe2+与Ag+的反应
典型例题——2019北京高考
1、生成Ag2SO3 沉淀,前提条件是它的Ksp足够小。
2、发生氧化还原反应,生成Ag、Ag2SO4
3、络合反应,Ag+有空轨道、SO32—、HSO
SO2 + O2+ H2O +2Ag+ === Ag2SO4 +2H+
3SO2 + 2NO3-+6Ag+ + 2H2O === 3Ag2SO4 + 2NO + 4H+
(2019年北京高考)将足量SO2通入AgNO3溶液中,迅速反应。得到无色溶液A和白色沉淀B
预测1:复分解反应——白色沉淀为Ag2SO3
SO2 +H2O+ 2Ag+ === Ag2SO3 +2H+
预测2:氧化还原反应——白色沉淀为Ag2SO4
SO2 +2H2O+ 2Ag+ === 2Ag +SO42-+4H+
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
2Ag++SO2+H2O= Ag2SO3↓+2H+
资料:25℃ Ksp(Ag2SO3)=1.5×10—14
Ksp(Ag2SO4)=1.4×10—5
预测3:上述反应同时发生——白色沉淀为Ag2SO3 和Ag2SO4
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。
将实验一所得混合物放置一段时间,有Ag和SO42—生成。
SO2与AgNO3溶液生成Ag2SO3的速率大于生成Ag和SO42—的速率
教学启示:复分解反应的速率大于氧化还原反应的速率。
化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量
SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
2Ag++SO2+H2O= Ag2SO3↓+2H+
实验二:验证B的成分
少BaSO4
Ag2SO4
Ag2SO3
BaSO4
BaSO3
NH3·H2O
Ag(NH3)2+
SO42— SO32—
途径2:实验二中,被氧化为进入D。
碱性环境中+4价的硫更加容易被空气中的氧气氧化。
二氧化硫氧化半反应:SO2—2e— +2H2O =SO42—+4H+
分析预测的角度4—影响因素
1.氧化还原反应规律
①影响氧化还原性强弱的“三度“:温度、浓度、酸碱度
②哪些离子还原性很强,需要考虑空气中O2对实验的干扰?
S2-、SO32-、I-、Fe2+
制备Fe(OH)2
3、通过理论分析,本该发生氧还原还原反应,却因为其它反应的干扰未能观察到预测的现象,则排除干扰的实验方案往往通过设计双液原电池。
例(2019北京西城一模)实验3】通过其他实验方案比较Fe2+和C2O42 的还原性强弱。用FeCl3溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和C2O42 的还原性强弱。画出装置图并描述预期现象:______。
思考:
1.是否电流表指针发生偏转就能证明吗?
2.我们因该检验什么产物呢合适呢?
1.不可以,灵敏电流计探测电势差,稍微有点变化就会偏转,比如浓度不一样、石墨电极插入溶液的深度不同都会有微弱的电势差。
2.因该检验还原产物,因为空气是一个氧化性的氛围,当然也可检验氧化产物,必须做对比实验排除干扰(也就是分别取实验前和实验后的溶液对比)
答案:电流计的指针偏转,电池工作一段时间后,取少量左侧烧杯中的溶液,滴加K3Fe(CN)6溶液,出现蓝色沉淀
分析预测的角度4—影响因素
2.探究外界条件对反应速率或实验产生的影响
(1)温度:速率、平衡、气体的溶解度、物质的稳定性、催化剂活性、副反应等等
(2)pH :微粒存在形式、水解或电离平衡、氧化还原性强弱、竞争放电问题等等
(3)浓度:速率、平衡、放电顺序、氧化还原性强弱
(4)滴加顺序:酸碱性、微粒浓度大小、反应先后顺序等
例5:某实验小组设计方案由正丁醇合成正丁醛。相关数据如下:
试剂A是啥?温度计1和温度计2
控制的温度分别是多少?
4、转化率、选择性、产率三者之间的关系
产率(收率)=选择性转化率
700 ℃
为工业合成气选择合适的温度
例:工业上生成合成气条件的选择:
目标产物产率=选择性×CO转化率%
发现问题 提出假设
设计实验 验证假设
收集证据 获取结论
试剂用量、操作设计
变量控制、排除干扰
合理预测、出现异常、
验证预测、及时改进、
目的
操作
现象
结论
化学实验探究题命题的一般思路及答题技巧
实验探究题的一般思路
2016年北京高考题28题
世上有一条很长很美的路,叫做梦想;
还有一堵很高很硬的墙,叫做现实;
翻越那堵墙,叫做坚持;
推倒那堵墙,叫做突破。
只有拼搏了才知道自己有多优秀!
我相信……
在追逐梦想的过程中,做最优的自己
同课章节目录
