高考化学水溶液中的离子反应与平衡系统讲解-2023届高三化学专项复习(共45张PPT)
文档属性
| 名称 | 高考化学水溶液中的离子反应与平衡系统讲解-2023届高三化学专项复习(共45张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-10 16:32:10 | ||
图片预览







文档简介
(共45张PPT)
2023届高三化学复习——水溶液中的离子反应与平衡
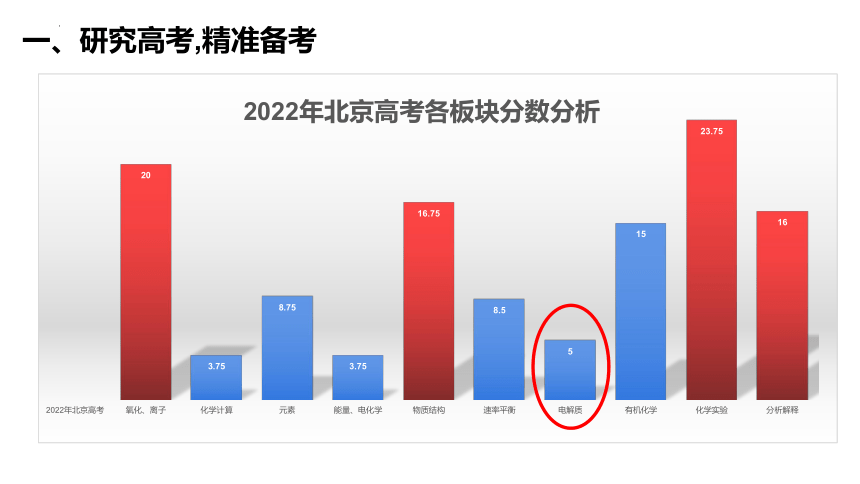
一、研究高考,精准备考
二、课标的要求
1 电解质在水溶液中的行为
从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应。
统领全章的核心任务
核心物质在水溶液中的行为:
CH3COOH、NH3 H2O、H2O、NH4Cl、CH3COONa、FeCl3、Na2CO3、NaHCO3、NaHSO3、沉淀(溶解平衡)
2、平衡观、微粒观、变化观、守恒观;发挥平衡常数的的功能;注意量变引起质变。
关于pH的教学要基于应用、滴定注意进阶;
工业流程中关于pH的调节模型
例:除去CuCl2酸性溶液中的Fe3+和Fe2+,正确的操作为 。
将混合液,先加入氯水,充分反应,再加入氧化铜,将溶液pH调节到3.7到5.0之间,过滤。
Cu2+(Fe3+ Fe2+)、Cl—
溶液的pH比2.2小。
Cu2+、Cl—溶液必须低于5.0
三、近几年的高考题特点及备考策略
例:从FeCl3 6H2O晶体得到无水氯化铁固体的方法。
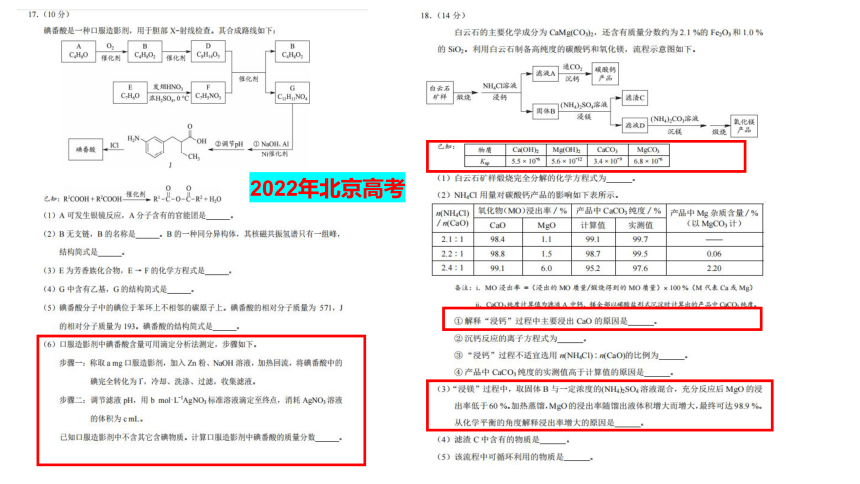
2022年北京高考
2022年北京高考
2021年北京高考
2021年北京高考
2020年北京高考
反滴定
2020年北京高考
2022全国乙卷
水溶液
2022海南
考查水溶液中的离子平衡,角度创新,难度比前两年有所下降
特点:主要在选择题中出现,化学用语分散考的问题。大题重点是:沉淀溶解平衡、滴定、调节pH。
策略:不系统复习,重点突破(课时2课时左右),注意回归教材。
缓冲体系(平衡)
越热越水解、越稀越水解
四、本章的复习——注意化学思想方法
1.动态变化的思想
思考:向醋酸溶液中滴加氢氧化钠溶液,思考在加入氢氧化钠溶液的过程中,水电离程度如何变化(水电离出的氢离子浓度如何变化,能画出相应的图像吗?)
例:常温下,向20 mL 0.1 mol·L-1氨水中滴加0.1 mol·L-1盐酸,溶液中由水电离出的c(H+)随加入盐酸体积的变化如图所示。则下列说法正确的是( )
A. c点溶液中,c(NH4+)=c(Cl-)
B. a、b之间的任意一点:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. b、d两点溶液pH均为7
D. b、c、d任意一点都有: c(NH4+)+c(H+)=c(OH-)+ c(Cl-)
2015年西城一模
顺义2020年高二期末
2.抓主要矛盾可以将问题简化
例:以用0.1000 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/LHA溶液为例,其滴定曲线如图。
关键点 粒子浓度关系
起点(点①)
反应—半点(点②)
中性点(点③)
恰好完全反应点(点④)
过量点(点⑤)
情境 宏观物质 主要微粒 相互作用
点② NaA:HA=1:1 Na+、A— NaA水解
H2O HA—、H+ HA电离
溶液呈酸性,电离大于水解,忽略水解,问题简化
3.极端假设平均值思想、守恒的思想
例(2012年北京)用亚硫酸钠溶液吸收液吸收SO2的过程中,pH随n(SO32—):n(HSO3—)变化关系如下表:
溶质:NaHSO3 Na2SO3
且NaHSO3 比Na2SO3多
思考:
(1)0.1mol/L的醋酸溶液,加入蒸馏水,溶液中所有的微粒浓度都减小吗?
(2)0.1mol/L氯化铁溶液,加水稀释,溶液中所有的微粒浓度都减小吗?
4、定性到定量的思想要强化
2022全国乙卷
PbSO4(s)+CO32-(ag) PbCO3(S)+SO42-(aq)
PbSO4(s)+CO32-(ag) PbCO3(S)+SO42-(aq)
的平衡常数为:
从平衡常数的角度分析,凸显学生的理性思维。
2009年北京高考
强调AgNO3必须少量
如果硝酸银过量,存在很多的Ag+,再加KI溶液时,Ag++I— =AgI↓会干扰AgCl+I— =AgI↓+Cl—。
能证明Ag2S比AgCl难溶解吗?
5.注意避免思维定式
例6(21海淀1模)为研究沉淀的生成及转化,同学们进行如下图所示实验。
下列关于该实验的分析不正确的是( )
Ag+ 、NO3—、
K+、AgSCN、
滴加Fe(NO3)3
溶液不变红
说明溶液几乎没SCN—
滴加KI
产生黄色沉淀,且溶液变红,说明产生了SCN—
AgSCN+I—=AgI↓+SCN—
Ag++SCN— =AgSCN↓
教学启示:避免思维定势,要本质上理解化学原理和反应过程。
D
6、注意多因素影响的问题
例题:实验测得0.5 mol·L 1CH3COONa溶液、
0.5 mol·L 1 CuSO4溶液以及H2O的pH随温度
变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH )
B.随温度升高,CH3COONa溶液的c(OH )减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO 、Cu2+水解平衡移动方向不同
CH3COO—+H2O CH3COOH+OH—
pH=—lgC(H+)
C(H+)=
Kw
C(OH—)
7.让学生自主构建思维模型,可以使问题简化
(1)电离显酸性:如硫酸、盐酸、醋酸、硫酸氢钠等
水电离H+
水电离OH—
酸电离出H+
电离显酸性:溶液中的氢氧根离子代表水的电离。
2:水解显碱性
例:常温下,0.1mol/L的碳酸钠溶液pH=12,计算水电离出的氢离子浓度。
水电离出的OH—
水电离出的H+
HCO3-
H2CO3
自由H+
C(OH—)=C(H+)+C(HCO3— )+2 C(H2CO3 )
水解显碱性:溶液中的氢氧根离子代表水的电离
例题(2021海淀一模)MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有、FeO、CoO等)为原料制备MnSO4的工艺流程如下图。
分析解释类问题解答模型
题目已
知条件
结论
?
分析题目确
定思考角度
利用图表、已知
信息等建立已知
和结论的关联
结合相关要素形成严谨逻辑推理路径,规范表达
(2022·江西模拟)实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3·3H2O,其实验流程如图:
(1)“酸浸”时所加硫酸溶液不宜过量的原因是____。
避免后续“反应”步骤消耗更多的碳酸钠
8.综合考虑问题提高经济效益
必修第一册,教材的编写,融合了核心素养,润物细无声的把立德树人根本任务进行了落实,我们要培养什么样的人,就是综合考虑各种问题,最大的提高综合经济、社会效益。
目标产物产率=选择性×CO转化率%
9.量变引起质变
例(2020年北京顺义高二期末)常温下,某溶液由amol/LCH3COONa和bmol/LCH3COOH组成的混合液,下列说法中正确的是( )
A.该溶液一定呈酸性
B.该溶液一定呈碱性
C.该溶液一定呈中性
D. CH3COONa会抑制CH3COOH的电离
比如:电离是绝对的,不电离是相对的
溶解是绝对的,不溶解是相对的
可逆是绝对的,不可逆是相对的
五、图形图像的分析
1.分布系数曲线
(1)透析分布曲线 遵定思维方向:
分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
CH3COOH CH3COO—+H+
K a=
C(CH3COO—)C(H+)
C(CH3COOH )
2.明确解题要领 快速准确作答
(1)读“曲线”——每条曲线所代表的粒子及变化趋势;
(2)读“浓度”——通过横坐标的垂线,可读出某pH时的粒子浓度;
(3)用“交点”——交点是某两种粒子浓度相等的点,可计算电离常数K;
(4)可“替换”——根据溶液中的元素质量守恒进行替换,分析得出结论。
例:(2020全国甲)以酚酞为指示剂,用0.1000 mol·L 1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积的变化关系如下图所示。
分析:恰好中和点氢氧化钠溶液体积为40ml,通过计算H2A浓度为0.1mo/L,B不正确。
起点pH=1.0,c(H+)=0.100 0 mol·L-1,可知H2A第一步完全电离,溶液中没有H2A,所以曲线①代表δ(HA-),曲线②代表δ(A2-),A项错误。
由图可知,当δ(A2-)=δ(HA-)时,pH=2.0,c(H+)=1.0×10-2 mol·L-1,
HA- A2-+H+,Ka(HA-)=C(H+)=1.0×10-2,C项正确
滴定终点时,根据电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),以酚酞为指示剂,说明滴定终点时溶液呈碱性,c(OH-)>c(H+),
所以c(Na+)>2c(A2-)+c(HA-),D项错误。
=1.0×10—3
HA H+ + A—
平衡时:C(HA) C(H+) C(A—)
B
I中:C(HA)总=(104+1)C(HA)
II中:C(HA)总=(1.01)C(HA)
2022全国乙卷
2.新图像
M(OH)2(s) M2+ (ag)+2 OH— (ag)
M(OH)2的K(sp)=C(M2+)C2(OH—) =1.0×10—17
BD
pH=14.5,溶液中的氢氧根离子浓度大于1,也就是盐酸中和氢氧根都不能中和完,溶液中M任然主要以M(OH)42—存在。
2022海南
五、教学建议(3课时)
第一课时 基础梳理
核心物质在水溶液中的行为:
CH3COOH、NH3 H2O、H2O、NH4Cl、CH3COONa、FeCl3、Na2CO3、NaHCO3、沉淀(溶解平衡)
第二课时 滴定问题(关系式、计算)
(酸碱中和滴定、氧化还原滴定、沉淀滴定)
第三课时 融合训练(图像、工业流程)
第二课时 滴定问题(关系式、计算)
环节一:介绍原理和用到的主要仪器
1.只要有确定定量反应关系(写出方程式)
2.能够通过颜色变化或者是通过指示剂判断恰好反应点。
3.氧化还原滴定、沉淀滴定、络合滴定
环节二、典型例题及变式训练
例1:(2020年北京高考)某a g二氧化锰粗产品中依次加入足量b g Na2C2O4和足量稀H2SO4,加热至充分反应,再用cmol/L KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为d L。
(已知:MnO2及MnO4—均被还原为Mn2+。相对分子质量:MnO2 86.94,Na2C2O4 134.0)
(1)写出上述过程中发生反应的离子方程式 。
(2)产品纯度为 (用质量分数表示)。
针对性练习:(21年北京高考题18题)铁黄(FeOOH)纯度可以通过产品的耗酸量确定。
(1)写书上述过程发生反应的方程式。
(2)计算该铁黄的纯度。
(3)Na2C2O4过量,会使测定结果____(填“偏大”“偏小”或“不受影响”)。
FeOOH+6H+=2Fe3++4H2O
Fe3++3C2O42— = [Fe(C2O4)3]3—
H++C2O42— =HC2O4—
HC2O4—+OH—=C2O42— +H2O
例2:某化学兴趣小组利用0.200 0 mol·L-1的AgNO3溶液测定某NaCl、KCl混合溶液中Cl-的物质的量浓度。
已知25 ℃时,以下五种物质的Ksp如下表所示:
(1)现以所配制的AgNO3溶液测定某溶液中c(Cl-),适宜作滴定指示剂的物质是__________(填字母)。
A.K2CrO4溶液 B.KBr溶液 C.KI溶液 D.K2S溶液
(2)实验数据记录如下表所示:
则该待测液中,c(Cl-)的物质的量浓度为________ mol·L-1。(结果保留四位有效数字)
环节三、总结归纳解题模型
课后训练:
1、NOx含量的测定
将V L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO,加水稀释至100.00 mL。量取20.00 mL该溶液,加入V1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
(1)写出滴定过程中发生反应的离子方程式: 。
(2)则气样中NOx折合成NO2的含量为________ mg·m-3。
(3)判断下列情况对NOx含量测定结果的影响(填“偏高”“偏低”或“无影响”)。
若FeSO4标准溶液部分变质,会使测定结果__________。
2.某小组实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应并测定其平衡常数。
(1)实验验证
实验I:将0.0100 mol/L Ag2SO4溶液与0.0400 mo/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验II:向少量Ag粉中加入0.0100 mol/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
(2)测定平衡常数
实验Ⅲ:一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用c1 mol/L KSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1 mL。
资料:Ag++SCN- AgSCN↓(白色) K=1012
Fe3++SCN- (FeSCN)2+(红色) K=102.3
①滴定过程中Fe3+的作用是_______。
②测得平衡常数K=_______。
(3)思考问题
①取实验I的浊液测定c(Ag+),会使所测K值_______(填“偏高”“偏低”或“不受影响”)。
②不用实验II中清液测定K的原因是_______。
利用滴定解决问题
面对诸多挑战的化学教学
莫听穿林打叶声,何妨吟啸且徐行?
2023届高三化学复习——水溶液中的离子反应与平衡
一、研究高考,精准备考
二、课标的要求
1 电解质在水溶液中的行为
从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应。
统领全章的核心任务
核心物质在水溶液中的行为:
CH3COOH、NH3 H2O、H2O、NH4Cl、CH3COONa、FeCl3、Na2CO3、NaHCO3、NaHSO3、沉淀(溶解平衡)
2、平衡观、微粒观、变化观、守恒观;发挥平衡常数的的功能;注意量变引起质变。
关于pH的教学要基于应用、滴定注意进阶;
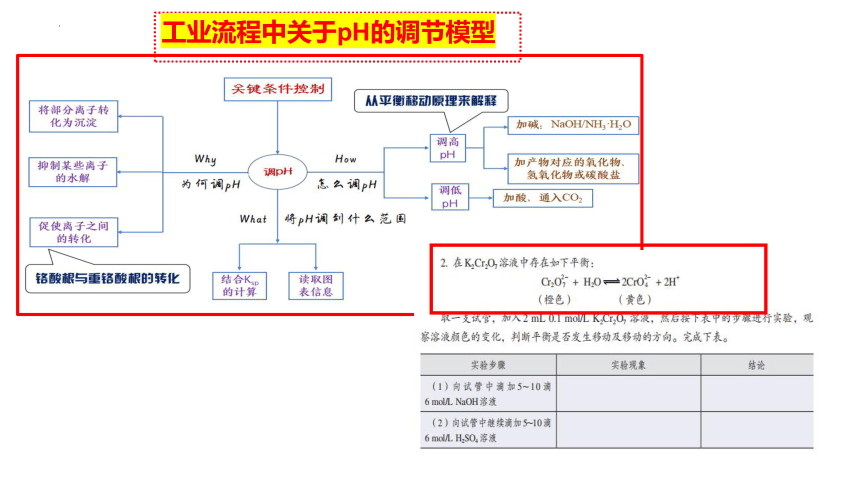
工业流程中关于pH的调节模型
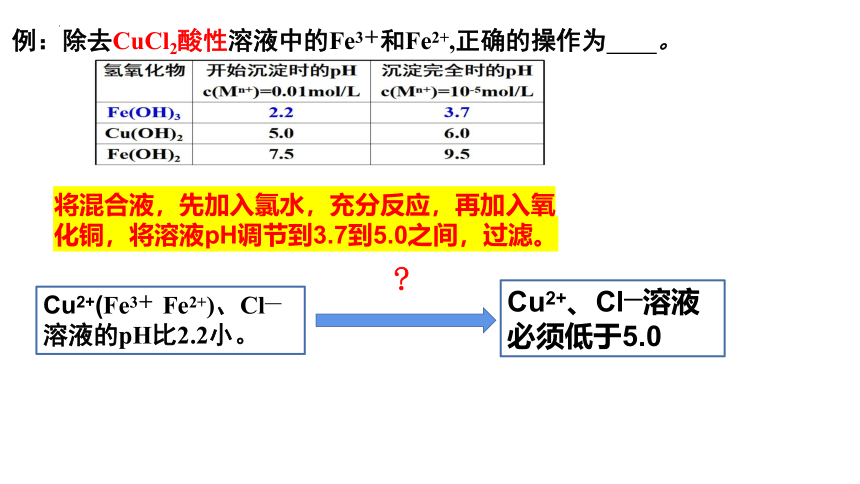
例:除去CuCl2酸性溶液中的Fe3+和Fe2+,正确的操作为 。
将混合液,先加入氯水,充分反应,再加入氧化铜,将溶液pH调节到3.7到5.0之间,过滤。
Cu2+(Fe3+ Fe2+)、Cl—
溶液的pH比2.2小。
Cu2+、Cl—溶液必须低于5.0
三、近几年的高考题特点及备考策略
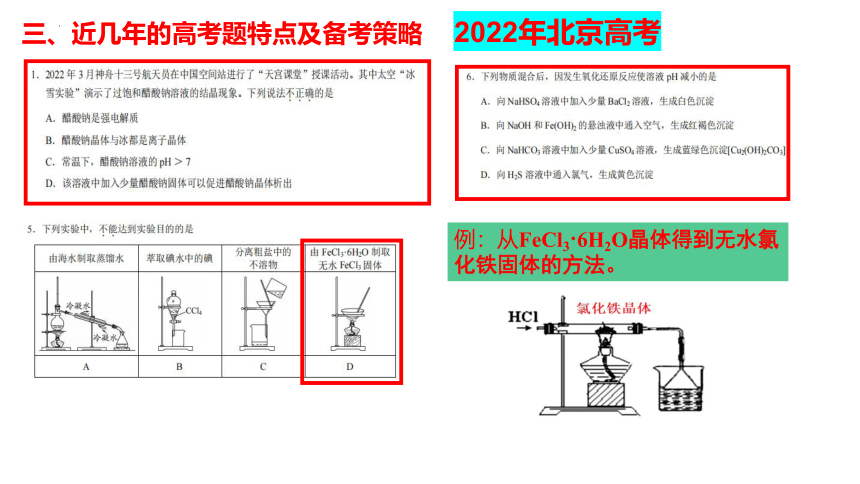
例:从FeCl3 6H2O晶体得到无水氯化铁固体的方法。
2022年北京高考
2022年北京高考
2021年北京高考
2021年北京高考
2020年北京高考
反滴定
2020年北京高考
2022全国乙卷
水溶液
2022海南
考查水溶液中的离子平衡,角度创新,难度比前两年有所下降
特点:主要在选择题中出现,化学用语分散考的问题。大题重点是:沉淀溶解平衡、滴定、调节pH。
策略:不系统复习,重点突破(课时2课时左右),注意回归教材。
缓冲体系(平衡)
越热越水解、越稀越水解
四、本章的复习——注意化学思想方法
1.动态变化的思想
思考:向醋酸溶液中滴加氢氧化钠溶液,思考在加入氢氧化钠溶液的过程中,水电离程度如何变化(水电离出的氢离子浓度如何变化,能画出相应的图像吗?)
例:常温下,向20 mL 0.1 mol·L-1氨水中滴加0.1 mol·L-1盐酸,溶液中由水电离出的c(H+)随加入盐酸体积的变化如图所示。则下列说法正确的是( )
A. c点溶液中,c(NH4+)=c(Cl-)
B. a、b之间的任意一点:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. b、d两点溶液pH均为7
D. b、c、d任意一点都有: c(NH4+)+c(H+)=c(OH-)+ c(Cl-)
2015年西城一模
顺义2020年高二期末
2.抓主要矛盾可以将问题简化
例:以用0.1000 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/LHA溶液为例,其滴定曲线如图。
关键点 粒子浓度关系
起点(点①)
反应—半点(点②)
中性点(点③)
恰好完全反应点(点④)
过量点(点⑤)
情境 宏观物质 主要微粒 相互作用
点② NaA:HA=1:1 Na+、A— NaA水解
H2O HA—、H+ HA电离
溶液呈酸性,电离大于水解,忽略水解,问题简化
3.极端假设平均值思想、守恒的思想
例(2012年北京)用亚硫酸钠溶液吸收液吸收SO2的过程中,pH随n(SO32—):n(HSO3—)变化关系如下表:
溶质:NaHSO3 Na2SO3
且NaHSO3 比Na2SO3多
思考:
(1)0.1mol/L的醋酸溶液,加入蒸馏水,溶液中所有的微粒浓度都减小吗?
(2)0.1mol/L氯化铁溶液,加水稀释,溶液中所有的微粒浓度都减小吗?
4、定性到定量的思想要强化
2022全国乙卷
PbSO4(s)+CO32-(ag) PbCO3(S)+SO42-(aq)
PbSO4(s)+CO32-(ag) PbCO3(S)+SO42-(aq)
的平衡常数为:
从平衡常数的角度分析,凸显学生的理性思维。
2009年北京高考
强调AgNO3必须少量
如果硝酸银过量,存在很多的Ag+,再加KI溶液时,Ag++I— =AgI↓会干扰AgCl+I— =AgI↓+Cl—。
能证明Ag2S比AgCl难溶解吗?
5.注意避免思维定式
例6(21海淀1模)为研究沉淀的生成及转化,同学们进行如下图所示实验。
下列关于该实验的分析不正确的是( )
Ag+ 、NO3—、
K+、AgSCN、
滴加Fe(NO3)3
溶液不变红
说明溶液几乎没SCN—
滴加KI
产生黄色沉淀,且溶液变红,说明产生了SCN—
AgSCN+I—=AgI↓+SCN—
Ag++SCN— =AgSCN↓
教学启示:避免思维定势,要本质上理解化学原理和反应过程。
D
6、注意多因素影响的问题
例题:实验测得0.5 mol·L 1CH3COONa溶液、
0.5 mol·L 1 CuSO4溶液以及H2O的pH随温度
变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH )
B.随温度升高,CH3COONa溶液的c(OH )减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO 、Cu2+水解平衡移动方向不同
CH3COO—+H2O CH3COOH+OH—
pH=—lgC(H+)
C(H+)=
Kw
C(OH—)
7.让学生自主构建思维模型,可以使问题简化
(1)电离显酸性:如硫酸、盐酸、醋酸、硫酸氢钠等
水电离H+
水电离OH—
酸电离出H+
电离显酸性:溶液中的氢氧根离子代表水的电离。
2:水解显碱性
例:常温下,0.1mol/L的碳酸钠溶液pH=12,计算水电离出的氢离子浓度。
水电离出的OH—
水电离出的H+
HCO3-
H2CO3
自由H+
C(OH—)=C(H+)+C(HCO3— )+2 C(H2CO3 )
水解显碱性:溶液中的氢氧根离子代表水的电离
例题(2021海淀一模)MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有、FeO、CoO等)为原料制备MnSO4的工艺流程如下图。
分析解释类问题解答模型
题目已
知条件
结论
?
分析题目确
定思考角度
利用图表、已知
信息等建立已知
和结论的关联
结合相关要素形成严谨逻辑推理路径,规范表达
(2022·江西模拟)实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3·3H2O,其实验流程如图:
(1)“酸浸”时所加硫酸溶液不宜过量的原因是____。
避免后续“反应”步骤消耗更多的碳酸钠
8.综合考虑问题提高经济效益
必修第一册,教材的编写,融合了核心素养,润物细无声的把立德树人根本任务进行了落实,我们要培养什么样的人,就是综合考虑各种问题,最大的提高综合经济、社会效益。
目标产物产率=选择性×CO转化率%
9.量变引起质变
例(2020年北京顺义高二期末)常温下,某溶液由amol/LCH3COONa和bmol/LCH3COOH组成的混合液,下列说法中正确的是( )
A.该溶液一定呈酸性
B.该溶液一定呈碱性
C.该溶液一定呈中性
D. CH3COONa会抑制CH3COOH的电离
比如:电离是绝对的,不电离是相对的
溶解是绝对的,不溶解是相对的
可逆是绝对的,不可逆是相对的
五、图形图像的分析
1.分布系数曲线
(1)透析分布曲线 遵定思维方向:
分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
CH3COOH CH3COO—+H+
K a=
C(CH3COO—)C(H+)
C(CH3COOH )
2.明确解题要领 快速准确作答
(1)读“曲线”——每条曲线所代表的粒子及变化趋势;
(2)读“浓度”——通过横坐标的垂线,可读出某pH时的粒子浓度;
(3)用“交点”——交点是某两种粒子浓度相等的点,可计算电离常数K;
(4)可“替换”——根据溶液中的元素质量守恒进行替换,分析得出结论。
例:(2020全国甲)以酚酞为指示剂,用0.1000 mol·L 1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积的变化关系如下图所示。
分析:恰好中和点氢氧化钠溶液体积为40ml,通过计算H2A浓度为0.1mo/L,B不正确。
起点pH=1.0,c(H+)=0.100 0 mol·L-1,可知H2A第一步完全电离,溶液中没有H2A,所以曲线①代表δ(HA-),曲线②代表δ(A2-),A项错误。
由图可知,当δ(A2-)=δ(HA-)时,pH=2.0,c(H+)=1.0×10-2 mol·L-1,
HA- A2-+H+,Ka(HA-)=C(H+)=1.0×10-2,C项正确
滴定终点时,根据电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),以酚酞为指示剂,说明滴定终点时溶液呈碱性,c(OH-)>c(H+),
所以c(Na+)>2c(A2-)+c(HA-),D项错误。
=1.0×10—3
HA H+ + A—
平衡时:C(HA) C(H+) C(A—)
B
I中:C(HA)总=(104+1)C(HA)
II中:C(HA)总=(1.01)C(HA)
2022全国乙卷
2.新图像
M(OH)2(s) M2+ (ag)+2 OH— (ag)
M(OH)2的K(sp)=C(M2+)C2(OH—) =1.0×10—17
BD
pH=14.5,溶液中的氢氧根离子浓度大于1,也就是盐酸中和氢氧根都不能中和完,溶液中M任然主要以M(OH)42—存在。
2022海南
五、教学建议(3课时)
第一课时 基础梳理
核心物质在水溶液中的行为:
CH3COOH、NH3 H2O、H2O、NH4Cl、CH3COONa、FeCl3、Na2CO3、NaHCO3、沉淀(溶解平衡)
第二课时 滴定问题(关系式、计算)
(酸碱中和滴定、氧化还原滴定、沉淀滴定)
第三课时 融合训练(图像、工业流程)
第二课时 滴定问题(关系式、计算)
环节一:介绍原理和用到的主要仪器
1.只要有确定定量反应关系(写出方程式)
2.能够通过颜色变化或者是通过指示剂判断恰好反应点。
3.氧化还原滴定、沉淀滴定、络合滴定
环节二、典型例题及变式训练
例1:(2020年北京高考)某a g二氧化锰粗产品中依次加入足量b g Na2C2O4和足量稀H2SO4,加热至充分反应,再用cmol/L KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为d L。
(已知:MnO2及MnO4—均被还原为Mn2+。相对分子质量:MnO2 86.94,Na2C2O4 134.0)
(1)写出上述过程中发生反应的离子方程式 。
(2)产品纯度为 (用质量分数表示)。
针对性练习:(21年北京高考题18题)铁黄(FeOOH)纯度可以通过产品的耗酸量确定。
(1)写书上述过程发生反应的方程式。
(2)计算该铁黄的纯度。
(3)Na2C2O4过量,会使测定结果____(填“偏大”“偏小”或“不受影响”)。
FeOOH+6H+=2Fe3++4H2O
Fe3++3C2O42— = [Fe(C2O4)3]3—
H++C2O42— =HC2O4—
HC2O4—+OH—=C2O42— +H2O
例2:某化学兴趣小组利用0.200 0 mol·L-1的AgNO3溶液测定某NaCl、KCl混合溶液中Cl-的物质的量浓度。
已知25 ℃时,以下五种物质的Ksp如下表所示:
(1)现以所配制的AgNO3溶液测定某溶液中c(Cl-),适宜作滴定指示剂的物质是__________(填字母)。
A.K2CrO4溶液 B.KBr溶液 C.KI溶液 D.K2S溶液
(2)实验数据记录如下表所示:
则该待测液中,c(Cl-)的物质的量浓度为________ mol·L-1。(结果保留四位有效数字)
环节三、总结归纳解题模型
课后训练:
1、NOx含量的测定
将V L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO,加水稀释至100.00 mL。量取20.00 mL该溶液,加入V1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
(1)写出滴定过程中发生反应的离子方程式: 。
(2)则气样中NOx折合成NO2的含量为________ mg·m-3。
(3)判断下列情况对NOx含量测定结果的影响(填“偏高”“偏低”或“无影响”)。
若FeSO4标准溶液部分变质,会使测定结果__________。
2.某小组实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应并测定其平衡常数。
(1)实验验证
实验I:将0.0100 mol/L Ag2SO4溶液与0.0400 mo/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验II:向少量Ag粉中加入0.0100 mol/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
(2)测定平衡常数
实验Ⅲ:一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用c1 mol/L KSCN标准溶液滴定Ag+,至出现稳定的浅红色时消耗KSCN标准溶液v1 mL。
资料:Ag++SCN- AgSCN↓(白色) K=1012
Fe3++SCN- (FeSCN)2+(红色) K=102.3
①滴定过程中Fe3+的作用是_______。
②测得平衡常数K=_______。
(3)思考问题
①取实验I的浊液测定c(Ag+),会使所测K值_______(填“偏高”“偏低”或“不受影响”)。
②不用实验II中清液测定K的原因是_______。
利用滴定解决问题
面对诸多挑战的化学教学
莫听穿林打叶声,何妨吟啸且徐行?
同课章节目录
