2022-2023学年高一化学 苏教版2019 必修第二册 教学课件 (共33张PPT)9-2-2 反应条件的控制
文档属性
| 名称 | 2022-2023学年高一化学 苏教版2019 必修第二册 教学课件 (共33张PPT)9-2-2 反应条件的控制 |

|
|
| 格式 | pptx | ||
| 文件大小 | 34.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-12 08:29:15 | ||
图片预览









文档简介
(共33张PPT)
9.2.2 反应条件的控制
学习目标
1.了解常见的铁的化合物
2.认识铁的氢氧化物
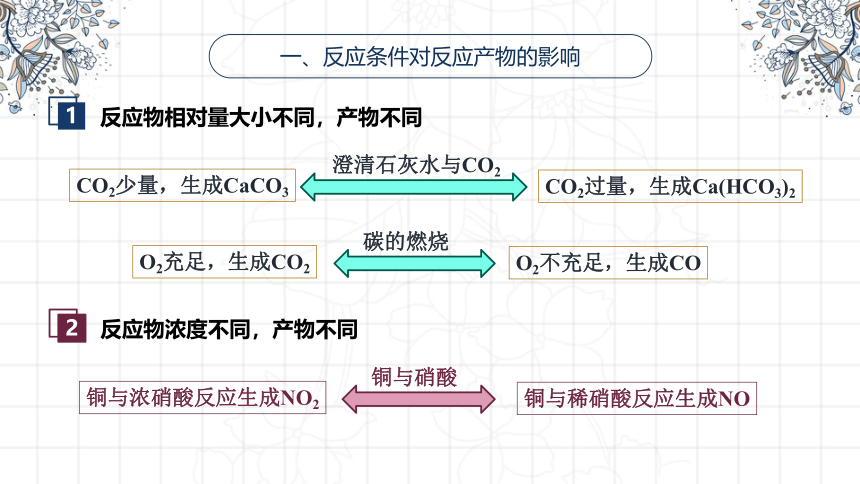
一、反应条件对反应产物的影响
反应物相对量大小不同,产物不同
澄清石灰水与CO2
CO2少量,生成CaCO3
CO2过量,生成Ca(HCO3)2
1
碳的燃烧
O2充足,生成CO2
O2不充足,生成CO
反应物浓度不同,产物不同
铜与硝酸
铜与浓硝酸反应生成NO2
铜与稀硝酸反应生成NO
2
一、反应条件对反应产物的影响
反应温度不同,产物不同
Na与O2
常温下,生成Na2O
点燃,生成Na2O2
3
反应物滴加方式不同,产物不同
Na2CO3溶液与稀盐酸
Na2CO3溶液逐滴滴入稀盐酸,先产生CO2
稀盐酸逐滴滴入Na2CO3溶液,先产生NaHCO3
4
一、氯化铁的制备
1.物质转化的思路:
反应的类型
反应条件
反应的装置
产物分离的要求
反应原料
目标产物
可能的反应路径
请设计以铁屑为原料制取氯化铁的转化思路
一、氯化铁的制备
1.物质转化的思路:
Fe
FeCl3
在氯气中点燃
路径一
从反应炉中排出并经冷凝得到固体FeCl3
2Fe+3Cl2=== 2FeCl3
点燃
Fe
FeCl3
盐酸溶解铁
路径二
FeCl2
Fe+2HCl== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
氯气氧化后分离提纯
Fe
FeCl3
缓慢氧化
路径三
Fe2O3
盐酸溶解后分离提纯
4Fe+3O2==2Fe2O3
Fe2O3 +6HCl ==2FeCl3+3H2O
思考探究
思考
若滴加方式不同,FeSO4溶液与NaOH溶液反应产物分别为什么?
FeSO4溶液与NaOH溶液
方案a
方案b
一、氢氧化铁与氢氧化亚铁
实验
现象
有灰绿色和红褐色沉淀生成,最终沉淀全部变成红褐色。
先有白色沉淀生成,在空气中迅速变成灰绿色,最后变成红褐色。
一、氢氧化铁与氢氧化亚铁
思考
实验B中的相关离子方程式为哪些?
先有白色沉淀生成,在空气中迅速变成灰绿色,最后变成红褐色。
Fe2++2OH===Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色)
1、生成白色沉淀
2、白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
灰绿色沉淀具体成分是什么目前争议颇多。
比较广泛的两种说法是:
一、灰绿色物质是氢氧化亚铁胶核吸附溶液中大量亚铁离子得到的;
二、灰绿色沉淀是因为既含亚铁又含铁的氢氧化物,两种价态的原子间发生电子转移引起吸光 。这是中间态,不稳定的 。
拓展:
一、氢氧化铁与氢氧化亚铁
氢氧化亚铁 氢氧化铁
化学式 Fe(OH)2 Fe(OH)3
物质类别 难溶 弱碱 难溶 弱碱
色 白色 红褐色
稳定性 不稳定,在空气中易被氧化 稳定,受热可分解
与H+反应
制备现象及反应方程式
Fe(OH)3+ 3H+ = Fe3++ 3H2O
Fe(OH)2+2H+=Fe2++2H2O
4Fe(OH)2+2H2O+O2=4Fe(OH)3
2Fe(OH)3 =Fe2O3+ 3H2O
4Fe(OH)2+2H2O+O2=4Fe(OH)3
2NaOH+FeCl2 =Fe(OH)2↓+2NaCl
产生白色沉淀迅速变成灰绿色最后变为红褐色.
产生红褐色沉淀
3NaOH+FeCl3 =Fe(OH)3↓+3NaCl
防止O2的干扰
二、氢氧化铁和氢氧化亚铁的制备
二、氢氧化铁和氢氧化亚铁的制备
思考
制备Fe(OH)2需注意什么?
隔绝氧气
氧气会在哪些途径对制备Fe(OH)2实验造成影响?
生成的Fe(OH)2接触空气
滴加过程中
配置溶液时的水中
溶液配置后露置于空气中
01
03
04
02
二、氢氧化铁和氢氧化亚铁的制备
思考
制备Fe(OH)2可以采取哪些措施?
为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
Fe2+极易被氧化,所以FeSO4溶液要现用现配。
1
2
为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
3
4
为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
二、氢氧化铁和氢氧化亚铁的制备
氢氧化亚铁制备实验的改进
方案一:有机覆盖层法
(1)配制NaOH和FeSO4溶液的蒸馏水要经过____________,目的是_________________。
加热煮沸
赶走溶解的氧气
(2)在FeSO4溶液表面覆盖一层苯,作用是___________________。
隔绝空气中的氧气
二、氢氧化铁和氢氧化亚铁的制备
方案二:还原性气体保护法
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
思考解答下列问题:
(3)在试管Ⅰ里加入的试剂是_______________。
稀H2SO4、铁屑
(4)在试管Ⅱ里加入的试剂是____________。
(5)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_______________________________________________。
NaOH溶液
打开止水夹a,待Ⅰ中反应生成的氢气排净装置中的空气后,再关闭止水夹a
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________________________________________________________________。
试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
生活向导
铁元素与生活健康
人体膳食结构中的铁元素
血红素铁
非血红素铁
血红素铁是与血红蛋白、肌红蛋白中的卟啉结合的二价铁。
血红素铁容易被人体吸收利用。
非血红素铁则主要以三价铁形式存在于植物中。
非血红素铁则需要将三价铁还原为二价铁才能被吸收。
生活向导
铁元素与生活健康
维生素C具有还原性,能将三价铁转化为二价铁。因此,营养学家建议进食含铁的植物食品时,补充一定量的维生素C,以促进铁的吸收。
为了预防缺铁性贫血,人们应合理进食含铁食物,如动物血、肝脏、骨髓、蛋黄、红枣、大豆、芝麻等。
铁的性质
Fe+ 2H+ = Fe2+ + H2 ↑
Fe+2Fe3+ =3Fe2+
Fe+ Cu2+ = Fe2+ + Cu
Fe+I2=Fe2++2I-
Fe+ 4H++NO3-过 = Fe3+ + NO↑+2H2O
2Fe+3Cl2 == 2FeCl3
点燃
3Fe过+ 8H++2NO3- = 3Fe2+ + 2NO↑+4H2O
3Fe+4H2O(g) Fe3O4+4H2
↑
高温
1.铁与稀硫酸反应
2.铁与水反应
3.铁与某些盐溶液反应
4.铁与非金属单质反应
5.铁与稀硝酸反应
6.铁与浓硝酸常温下发生钝化反应
2Fe+2O2 == Fe3O4
点燃
Fe+S = FeS
△
铁的氧化物
名 称 氧化亚铁FeO 氧化铁 Fe2O3 四氧化三铁Fe3O4
俗 称
颜色状态
铁的价态
溶解性
磁性氧化铁
黑色粉末
黑色晶体
不溶于水
+2
+2、+3
铁红
红棕色粉末
+3
FeO Fe2O3
铁的氢氧化物
红褐色固体,不溶于水
白色固体,不溶于水
亚铁离子的检验
Fe2+的检验:
1.加入氢氧化钠溶液,产生白色沉淀迅速变为灰绿色,最后变为红褐色,说明溶液中有Fe2+
2.加入铁氰化钾(K3[Fe(CN)6])溶液,溶液变为绛蓝色,说明溶液中有Fe2+
3.加入硫氰化钾(KSCN)溶液,溶液无明显变化,在通入氯气,溶液变血红色,说明溶液中有Fe2+
Fe2+的性质:
1.与OH-、S2-、CO32-等阴离子结合生成沉淀
2.Fe2+具有较强的还原性,能被氯气、双氧水、氧气、高锰酸钾、硝酸等氧化为Fe3+
3.Fe2+具有一定的氧化性,能被锌等金属还原为Fe
铁离子的检验
Fe3+的检验:
1.加入氢氧化钠溶液,产生红褐色沉淀,说明溶液中有Fe3+
2.加入硫氰化钾溶液,溶液变血红色,说明溶液中有Fe3+
3SCN-+Fe3+ =Fe(SCN)3
Fe3+的性质:
1.与OH-生成沉淀,与HCO3-、CO32-等阴离子发生水解反应
2.Fe3+具较强的氧化性,能与Al、 Zn 、Fe 、Cu、I-、 S2- 及维生素C等还原剂发生反应
三、铁及化合物的转换
在生产和科学实验中,要实现单质铁、+2价的亚铁盐、+3价的铁盐之间的相互转化,可以选择适当的氧化剂或还原剂。
具有还原性
具有氧化性
既有氧化性
又有还原性
1.化合价升高加氧化剂
2化合价降低加还原剂
Fe、Fe2+、Fe3+的相互转化:
非强氧化性酸(盐酸、硫酸、醋酸等)、Cu2+、I2、S只能将Fe氧化为Fe2+
硝酸、HClO、HClO3、MnO4-、H2O2、Cl2、Br2、O2等能将Fe及Fe2+氧化为Fe3+
氧化性 F2> O2 > Cl2 > Br2 > Fe3+ >Cu2+ > H+ > I2 > S> Fe2+ > Zn2+
1.化合价升高加氧化剂
2化合价降低加还原剂
还原性Al> Zn > Fe > Cu> I- > S2- > Fe2+ >Br- > Cl-
往Fe3+、Fe2+盐中加还原性大于Fe的还原剂,可生成铁单质
往Fe3+盐中加还原性大于Fe2+的还原剂,可生成Fe2+
课堂练习
1.要证明某溶液中不含有Fe3+而含有Fe2+,进行如下实验时的最佳操作及顺序为( )
①加入少量KSCN溶液 ②加入适量氯水 ③加入足量的高锰酸钾溶液
A.③① B.①②
C.②③ D.①②③
B
课堂练习
2.下列氯化物既可由金属和氯气直接反应制得,也可由金属和盐酸反应制得的是( )
A.ZnCl2 B.FeCl3
C.FeCl2 D.AlCl3
AD
课堂练习
3.下列物质能将Fe2+氧化为Fe3+,且能使单质Fe由0价变为+3价的是( )
A.氢气 B.氯气
C.浓盐酸 D.稀硫酸
B
课堂练习
4.(2021·广东等级考,10)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是 ( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
C
作业布置
1.预习第二课时《导与练》P88~90
观
看
谢
谢
9.2.2 反应条件的控制
学习目标
1.了解常见的铁的化合物
2.认识铁的氢氧化物
一、反应条件对反应产物的影响
反应物相对量大小不同,产物不同
澄清石灰水与CO2
CO2少量,生成CaCO3
CO2过量,生成Ca(HCO3)2
1
碳的燃烧
O2充足,生成CO2
O2不充足,生成CO
反应物浓度不同,产物不同
铜与硝酸
铜与浓硝酸反应生成NO2
铜与稀硝酸反应生成NO
2
一、反应条件对反应产物的影响
反应温度不同,产物不同
Na与O2
常温下,生成Na2O
点燃,生成Na2O2
3
反应物滴加方式不同,产物不同
Na2CO3溶液与稀盐酸
Na2CO3溶液逐滴滴入稀盐酸,先产生CO2
稀盐酸逐滴滴入Na2CO3溶液,先产生NaHCO3
4
一、氯化铁的制备
1.物质转化的思路:
反应的类型
反应条件
反应的装置
产物分离的要求
反应原料
目标产物
可能的反应路径
请设计以铁屑为原料制取氯化铁的转化思路
一、氯化铁的制备
1.物质转化的思路:
Fe
FeCl3
在氯气中点燃
路径一
从反应炉中排出并经冷凝得到固体FeCl3
2Fe+3Cl2=== 2FeCl3
点燃
Fe
FeCl3
盐酸溶解铁
路径二
FeCl2
Fe+2HCl== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
氯气氧化后分离提纯
Fe
FeCl3
缓慢氧化
路径三
Fe2O3
盐酸溶解后分离提纯
4Fe+3O2==2Fe2O3
Fe2O3 +6HCl ==2FeCl3+3H2O
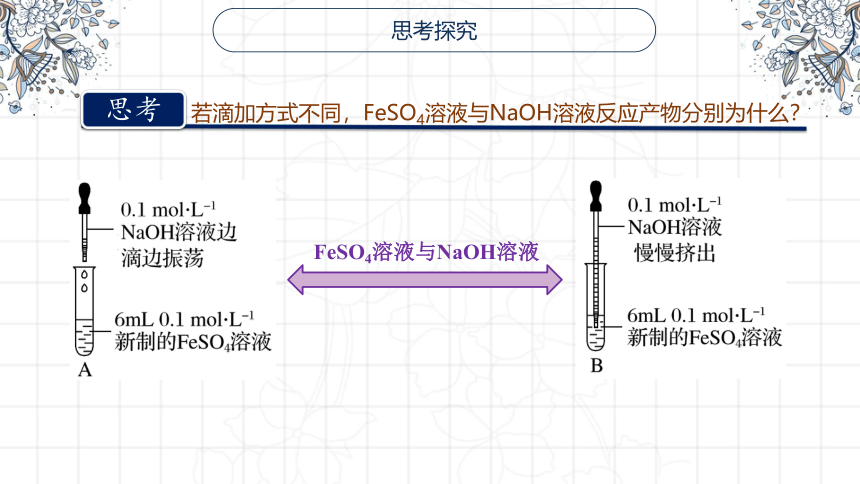
思考探究
思考
若滴加方式不同,FeSO4溶液与NaOH溶液反应产物分别为什么?
FeSO4溶液与NaOH溶液
方案a
方案b
一、氢氧化铁与氢氧化亚铁
实验
现象
有灰绿色和红褐色沉淀生成,最终沉淀全部变成红褐色。
先有白色沉淀生成,在空气中迅速变成灰绿色,最后变成红褐色。
一、氢氧化铁与氢氧化亚铁
思考
实验B中的相关离子方程式为哪些?
先有白色沉淀生成,在空气中迅速变成灰绿色,最后变成红褐色。
Fe2++2OH===Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色)
1、生成白色沉淀
2、白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
灰绿色沉淀具体成分是什么目前争议颇多。
比较广泛的两种说法是:
一、灰绿色物质是氢氧化亚铁胶核吸附溶液中大量亚铁离子得到的;
二、灰绿色沉淀是因为既含亚铁又含铁的氢氧化物,两种价态的原子间发生电子转移引起吸光 。这是中间态,不稳定的 。
拓展:
一、氢氧化铁与氢氧化亚铁
氢氧化亚铁 氢氧化铁
化学式 Fe(OH)2 Fe(OH)3
物质类别 难溶 弱碱 难溶 弱碱
色 白色 红褐色
稳定性 不稳定,在空气中易被氧化 稳定,受热可分解
与H+反应
制备现象及反应方程式
Fe(OH)3+ 3H+ = Fe3++ 3H2O
Fe(OH)2+2H+=Fe2++2H2O
4Fe(OH)2+2H2O+O2=4Fe(OH)3
2Fe(OH)3 =Fe2O3+ 3H2O
4Fe(OH)2+2H2O+O2=4Fe(OH)3
2NaOH+FeCl2 =Fe(OH)2↓+2NaCl
产生白色沉淀迅速变成灰绿色最后变为红褐色.
产生红褐色沉淀
3NaOH+FeCl3 =Fe(OH)3↓+3NaCl
防止O2的干扰
二、氢氧化铁和氢氧化亚铁的制备
二、氢氧化铁和氢氧化亚铁的制备
思考
制备Fe(OH)2需注意什么?
隔绝氧气
氧气会在哪些途径对制备Fe(OH)2实验造成影响?
生成的Fe(OH)2接触空气
滴加过程中
配置溶液时的水中
溶液配置后露置于空气中
01
03
04
02
二、氢氧化铁和氢氧化亚铁的制备
思考
制备Fe(OH)2可以采取哪些措施?
为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
Fe2+极易被氧化,所以FeSO4溶液要现用现配。
1
2
为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
3
4
为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
二、氢氧化铁和氢氧化亚铁的制备
氢氧化亚铁制备实验的改进
方案一:有机覆盖层法
(1)配制NaOH和FeSO4溶液的蒸馏水要经过____________,目的是_________________。
加热煮沸
赶走溶解的氧气
(2)在FeSO4溶液表面覆盖一层苯,作用是___________________。
隔绝空气中的氧气
二、氢氧化铁和氢氧化亚铁的制备
方案二:还原性气体保护法
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
思考解答下列问题:
(3)在试管Ⅰ里加入的试剂是_______________。
稀H2SO4、铁屑
(4)在试管Ⅱ里加入的试剂是____________。
(5)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_______________________________________________。
NaOH溶液
打开止水夹a,待Ⅰ中反应生成的氢气排净装置中的空气后,再关闭止水夹a
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________________________________________________________________。
试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
生活向导
铁元素与生活健康
人体膳食结构中的铁元素
血红素铁
非血红素铁
血红素铁是与血红蛋白、肌红蛋白中的卟啉结合的二价铁。
血红素铁容易被人体吸收利用。
非血红素铁则主要以三价铁形式存在于植物中。
非血红素铁则需要将三价铁还原为二价铁才能被吸收。
生活向导
铁元素与生活健康
维生素C具有还原性,能将三价铁转化为二价铁。因此,营养学家建议进食含铁的植物食品时,补充一定量的维生素C,以促进铁的吸收。
为了预防缺铁性贫血,人们应合理进食含铁食物,如动物血、肝脏、骨髓、蛋黄、红枣、大豆、芝麻等。
铁的性质
Fe+ 2H+ = Fe2+ + H2 ↑
Fe+2Fe3+ =3Fe2+
Fe+ Cu2+ = Fe2+ + Cu
Fe+I2=Fe2++2I-
Fe+ 4H++NO3-过 = Fe3+ + NO↑+2H2O
2Fe+3Cl2 == 2FeCl3
点燃
3Fe过+ 8H++2NO3- = 3Fe2+ + 2NO↑+4H2O
3Fe+4H2O(g) Fe3O4+4H2
↑
高温
1.铁与稀硫酸反应
2.铁与水反应
3.铁与某些盐溶液反应
4.铁与非金属单质反应
5.铁与稀硝酸反应
6.铁与浓硝酸常温下发生钝化反应
2Fe+2O2 == Fe3O4
点燃
Fe+S = FeS
△
铁的氧化物
名 称 氧化亚铁FeO 氧化铁 Fe2O3 四氧化三铁Fe3O4
俗 称
颜色状态
铁的价态
溶解性
磁性氧化铁
黑色粉末
黑色晶体
不溶于水
+2
+2、+3
铁红
红棕色粉末
+3
FeO Fe2O3
铁的氢氧化物
红褐色固体,不溶于水
白色固体,不溶于水
亚铁离子的检验
Fe2+的检验:
1.加入氢氧化钠溶液,产生白色沉淀迅速变为灰绿色,最后变为红褐色,说明溶液中有Fe2+
2.加入铁氰化钾(K3[Fe(CN)6])溶液,溶液变为绛蓝色,说明溶液中有Fe2+
3.加入硫氰化钾(KSCN)溶液,溶液无明显变化,在通入氯气,溶液变血红色,说明溶液中有Fe2+
Fe2+的性质:
1.与OH-、S2-、CO32-等阴离子结合生成沉淀
2.Fe2+具有较强的还原性,能被氯气、双氧水、氧气、高锰酸钾、硝酸等氧化为Fe3+
3.Fe2+具有一定的氧化性,能被锌等金属还原为Fe
铁离子的检验
Fe3+的检验:
1.加入氢氧化钠溶液,产生红褐色沉淀,说明溶液中有Fe3+
2.加入硫氰化钾溶液,溶液变血红色,说明溶液中有Fe3+
3SCN-+Fe3+ =Fe(SCN)3
Fe3+的性质:
1.与OH-生成沉淀,与HCO3-、CO32-等阴离子发生水解反应
2.Fe3+具较强的氧化性,能与Al、 Zn 、Fe 、Cu、I-、 S2- 及维生素C等还原剂发生反应
三、铁及化合物的转换
在生产和科学实验中,要实现单质铁、+2价的亚铁盐、+3价的铁盐之间的相互转化,可以选择适当的氧化剂或还原剂。
具有还原性
具有氧化性
既有氧化性
又有还原性
1.化合价升高加氧化剂
2化合价降低加还原剂
Fe、Fe2+、Fe3+的相互转化:
非强氧化性酸(盐酸、硫酸、醋酸等)、Cu2+、I2、S只能将Fe氧化为Fe2+
硝酸、HClO、HClO3、MnO4-、H2O2、Cl2、Br2、O2等能将Fe及Fe2+氧化为Fe3+
氧化性 F2> O2 > Cl2 > Br2 > Fe3+ >Cu2+ > H+ > I2 > S> Fe2+ > Zn2+
1.化合价升高加氧化剂
2化合价降低加还原剂
还原性Al> Zn > Fe > Cu> I- > S2- > Fe2+ >Br- > Cl-
往Fe3+、Fe2+盐中加还原性大于Fe的还原剂,可生成铁单质
往Fe3+盐中加还原性大于Fe2+的还原剂,可生成Fe2+
课堂练习
1.要证明某溶液中不含有Fe3+而含有Fe2+,进行如下实验时的最佳操作及顺序为( )
①加入少量KSCN溶液 ②加入适量氯水 ③加入足量的高锰酸钾溶液
A.③① B.①②
C.②③ D.①②③
B
课堂练习
2.下列氯化物既可由金属和氯气直接反应制得,也可由金属和盐酸反应制得的是( )
A.ZnCl2 B.FeCl3
C.FeCl2 D.AlCl3
AD
课堂练习
3.下列物质能将Fe2+氧化为Fe3+,且能使单质Fe由0价变为+3价的是( )
A.氢气 B.氯气
C.浓盐酸 D.稀硫酸
B
课堂练习
4.(2021·广东等级考,10)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是 ( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
C
作业布置
1.预习第二课时《导与练》P88~90
观
看
谢
谢
