人教版(2019)高中化学必修第二册 《6.2.3 化学反应的限度》名师学案(无答案)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《6.2.3 化学反应的限度》名师学案(无答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 201.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-12 08:52:43 | ||
图片预览


文档简介
《化学反应的限度》学案
【学习目标】
1.能通过实验现象得到可逆反应的特征;
2.能从物料变化、反应速率变化演绎化学平衡状态的建立过程;
【学习过程】
I、课堂引入
阅读以下新闻,完成相应思考。
(金台资讯)2020年9月23日,扬州市区一女子在家打扫卫生时,因误将84消毒液和洁厕灵混合起来使用,导致出现中毒症状。
据悉,事发时,该女子吸入大量气体后,身体出现严重不适,后来被送到附近医院救治。急诊科医生介绍,该名女子因氯气中毒引发哮喘、胸闷、心悸等症状,如果得不到及时医治,该患者可能会有生命危险。
【生活中的化学】查阅资料可知,84消毒液的有效成分为NaClO,洁厕灵的主要成分是盐酸,将其混合,会发生化学反应:________________________________________________。
【知识回顾】我们在必修第一册中学习过氯气与水的反应:__________________________。
【思考】对比以上两个反应方程式,你想起了什么?
______________________________________________________________________。
II、可逆反应与可逆反应的特点
一、可逆反应的定义
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
注:向生成物方向进行的反应叫做________,向反应物方向进行的反应叫做________。
【思考】请列举一些学过的可逆反应。
【思考】与是否互为可逆反应,为什么?
__________________________________________________________________。
二、可逆反应的特点
实验 探究可逆反应的特点 实验一 取溶液与溶液混合,然后向混合液中加入,振荡后静置,观察实验现象。 实验现象:____________________________________________________________; 实验结论:_____________________________________________________________ ____________________________________________________________。 另取溶液与碘水混合,然后向混合液中加入KSCN溶液,观察实验现象。 实验现象:____________________________________________________________; 实验结论:_____________________________________________________________ ____________________________________________________________。 实验二 取溶液与溶液混合,然后分装在两支试管内。 向其中一支试管中加入,振荡后静置,观察实验现象①。 向另一试管中加入KSCN 溶液,观察实验现象②。 实验现象①:__________________________________________________________; 实验结论①:__________________________________________________________。 实验现象②:__________________________________________________________; 实验结论②:__________________________________________________________。
1、双向性
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行。
【思考】对于可逆反应,某条件下向反应容器中充入和,可生成;若在相同条件下向反应容器中充入,______得到。
2、不完全性
可逆反应不能完全进行,反应物不能完全被消耗,反应物转化率小于100%。
注:
【思考】对于可逆反应,向反应容器中充入和,充分反应后,
①反应容器中____剩余;
②最终可得到________。
小结:可逆反应充分进行后,达到一个反应物、生成物共存的状态,即达到该反应进行的限度。我们把这种状态成为_________________。
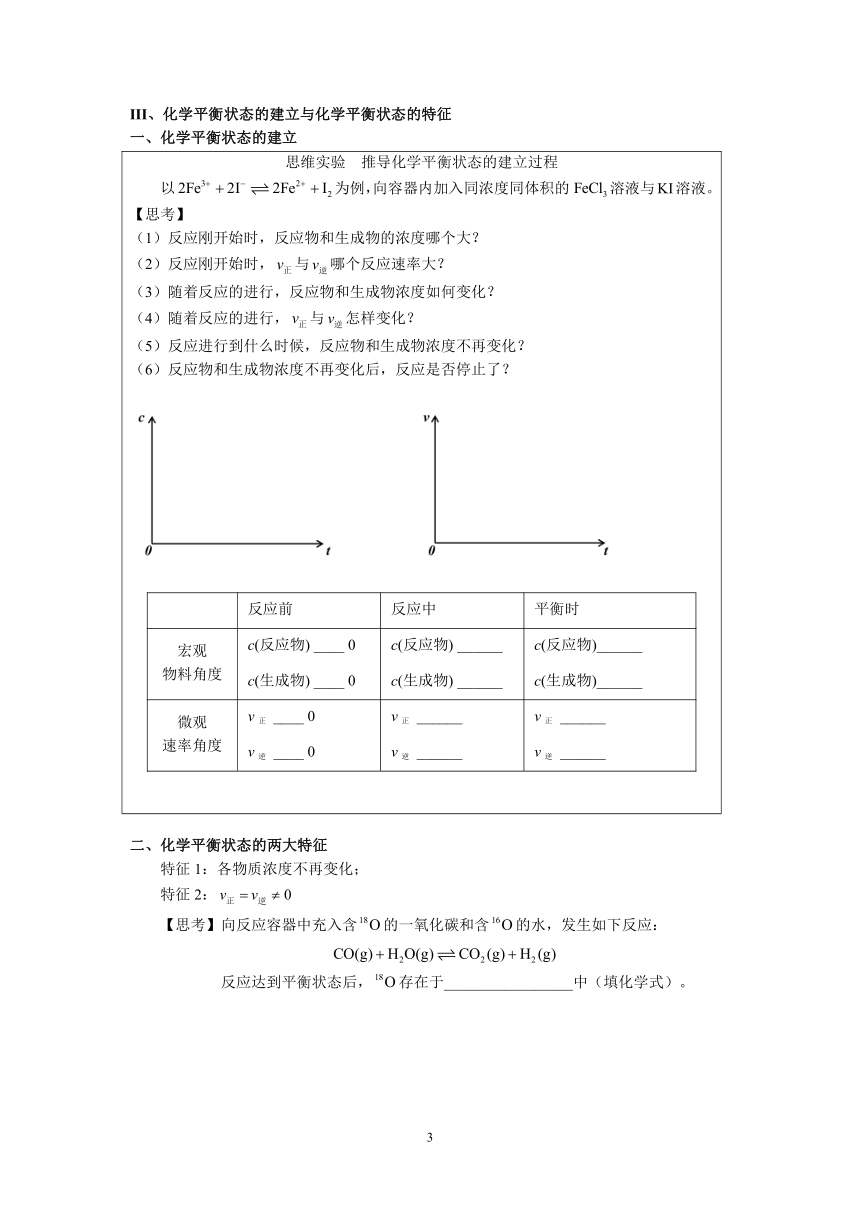
III、化学平衡状态的建立与化学平衡状态的特征
一、化学平衡状态的建立
思维实验 推导化学平衡状态的建立过程 以为例,向容器内加入同浓度同体积的溶液与KI溶液。 【思考】 (1)反应刚开始时,反应物和生成物的浓度哪个大? (2)反应刚开始时,与哪个反应速率大? (3)随着反应的进行,反应物和生成物浓度如何变化? (4)随着反应的进行,与怎样变化? (5)反应进行到什么时候,反应物和生成物浓度不再变化? (6)反应物和生成物浓度不再变化后,反应是否停止了? 反应前反应中平衡时宏观 物料角度c(反应物) ____ 0c(反应物) ______c(反应物)______c(生成物) ____ 0c(生成物) ______c(生成物)______微观 速率角度v正 ____ 0v正 ______v正 ______v逆 ____ 0v逆 ______v逆 ______
二、化学平衡状态的两大特征
特征1:各物质浓度不再变化;
特征2:
【思考】向反应容器中充入含的一氧化碳和含的水,发生如下反应:
反应达到平衡状态后,存在于_________________中(填化学式)。
【学习效果】
1.下列反应不是可逆反应的是
A.和
B.和
C.和
D.和
2.在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如下图所示。下列有关说法正确的是
A.t1 时刻,反应逆向进行
B.t2 时刻,正反应速率大于逆反应速率
C.t3 时刻,达到反应进行的限度
D.t4 时刻,反应处于平衡状态
3.下列关于化学平衡状态的叙述错误的是
A.化学平衡是所有可逆反应都存在的一种状态
B.在给定条件下,达到平衡时可逆反应完成程度达到最大
C.达到平衡时,正、逆反应速率均为零
D.达到平衡时,反应物和生成物的浓度不再发生变化
4.汽车尾气污染已成为突出的环境问题。反应可用于净化汽车尾气。一定条件下,该反应进行一段时间后,各物质的浓度均不再变化,此时
A.反成完全停止
B.反应达到了平衡状态
C.反应物消耗完全
D.正反速率大于逆反应速率
5.已知为可逆反应。一定条件下,把一定量的和充入密闭容器中,反应达到平衡状态时存在于
A.、中
B.、中
C.、、中
D.、中
6.一定温度下,在10 L的恒容密闭容器中加气体X和Y,如图,下列说法错误的是
A.10 s末时,X的反应速率为
B.此反应的化学方程式为
C.Y的平衡转化率为75%
D.平衡时,Z的体积分数约为72.73%
7.在一定条件下,1 L容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是
A.反应的化学方程式为
B.时段,N平均反应速率
C.时,正反应速率大于逆反应速率
D.时段,M的平均速率等于N的平均速率的2倍
8.一定温度下,在恒容密闭容器中发生反应:。当、、、的浓度不再变化时,下列说法正确的是
A.该反应已达到化学平衡状态
B.正、逆反应速率相等且等于零
C.和全部转化为和
D.、、、的浓度一定相等
9.汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为2种无毒气体。时,将0.8 mol NO和0.8 mol CO充入容积为1 L的密闭容器中,模拟尾气转化,容器中NO物质的量随时间变化如图。
(1)将NO、CO转化为2种无毒气体的化学方程式是_________________________。
(2)反应开始至10min,_____。
(3)下列说法正确的是_______。
A.新型催化剂可以加快NO、CO的转化速率
B.该反应进行到10 min时达到化学平衡状态
C.平衡时的浓度为
D.平衡时CO的转化率为50%
10.设计实验证明为可逆反应。可选用药品:溶液,溶液,溶液,溶液,固体,溶液。
反应原理
所用药品
操作
预期现象
结论 为可逆反应。
(编写:阮荣毅 修订:陈汉 审定: )
1
【学习目标】
1.能通过实验现象得到可逆反应的特征;
2.能从物料变化、反应速率变化演绎化学平衡状态的建立过程;
【学习过程】
I、课堂引入
阅读以下新闻,完成相应思考。
(金台资讯)2020年9月23日,扬州市区一女子在家打扫卫生时,因误将84消毒液和洁厕灵混合起来使用,导致出现中毒症状。
据悉,事发时,该女子吸入大量气体后,身体出现严重不适,后来被送到附近医院救治。急诊科医生介绍,该名女子因氯气中毒引发哮喘、胸闷、心悸等症状,如果得不到及时医治,该患者可能会有生命危险。
【生活中的化学】查阅资料可知,84消毒液的有效成分为NaClO,洁厕灵的主要成分是盐酸,将其混合,会发生化学反应:________________________________________________。
【知识回顾】我们在必修第一册中学习过氯气与水的反应:__________________________。
【思考】对比以上两个反应方程式,你想起了什么?
______________________________________________________________________。
II、可逆反应与可逆反应的特点
一、可逆反应的定义
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
注:向生成物方向进行的反应叫做________,向反应物方向进行的反应叫做________。
【思考】请列举一些学过的可逆反应。
【思考】与是否互为可逆反应,为什么?
__________________________________________________________________。
二、可逆反应的特点
实验 探究可逆反应的特点 实验一 取溶液与溶液混合,然后向混合液中加入,振荡后静置,观察实验现象。 实验现象:____________________________________________________________; 实验结论:_____________________________________________________________ ____________________________________________________________。 另取溶液与碘水混合,然后向混合液中加入KSCN溶液,观察实验现象。 实验现象:____________________________________________________________; 实验结论:_____________________________________________________________ ____________________________________________________________。 实验二 取溶液与溶液混合,然后分装在两支试管内。 向其中一支试管中加入,振荡后静置,观察实验现象①。 向另一试管中加入KSCN 溶液,观察实验现象②。 实验现象①:__________________________________________________________; 实验结论①:__________________________________________________________。 实验现象②:__________________________________________________________; 实验结论②:__________________________________________________________。
1、双向性
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行。
【思考】对于可逆反应,某条件下向反应容器中充入和,可生成;若在相同条件下向反应容器中充入,______得到。
2、不完全性
可逆反应不能完全进行,反应物不能完全被消耗,反应物转化率小于100%。
注:
【思考】对于可逆反应,向反应容器中充入和,充分反应后,
①反应容器中____剩余;
②最终可得到________。
小结:可逆反应充分进行后,达到一个反应物、生成物共存的状态,即达到该反应进行的限度。我们把这种状态成为_________________。
III、化学平衡状态的建立与化学平衡状态的特征
一、化学平衡状态的建立
思维实验 推导化学平衡状态的建立过程 以为例,向容器内加入同浓度同体积的溶液与KI溶液。 【思考】 (1)反应刚开始时,反应物和生成物的浓度哪个大? (2)反应刚开始时,与哪个反应速率大? (3)随着反应的进行,反应物和生成物浓度如何变化? (4)随着反应的进行,与怎样变化? (5)反应进行到什么时候,反应物和生成物浓度不再变化? (6)反应物和生成物浓度不再变化后,反应是否停止了? 反应前反应中平衡时宏观 物料角度c(反应物) ____ 0c(反应物) ______c(反应物)______c(生成物) ____ 0c(生成物) ______c(生成物)______微观 速率角度v正 ____ 0v正 ______v正 ______v逆 ____ 0v逆 ______v逆 ______
二、化学平衡状态的两大特征
特征1:各物质浓度不再变化;
特征2:
【思考】向反应容器中充入含的一氧化碳和含的水,发生如下反应:
反应达到平衡状态后,存在于_________________中(填化学式)。
【学习效果】
1.下列反应不是可逆反应的是
A.和
B.和
C.和
D.和
2.在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如下图所示。下列有关说法正确的是
A.t1 时刻,反应逆向进行
B.t2 时刻,正反应速率大于逆反应速率
C.t3 时刻,达到反应进行的限度
D.t4 时刻,反应处于平衡状态
3.下列关于化学平衡状态的叙述错误的是
A.化学平衡是所有可逆反应都存在的一种状态
B.在给定条件下,达到平衡时可逆反应完成程度达到最大
C.达到平衡时,正、逆反应速率均为零
D.达到平衡时,反应物和生成物的浓度不再发生变化
4.汽车尾气污染已成为突出的环境问题。反应可用于净化汽车尾气。一定条件下,该反应进行一段时间后,各物质的浓度均不再变化,此时
A.反成完全停止
B.反应达到了平衡状态
C.反应物消耗完全
D.正反速率大于逆反应速率
5.已知为可逆反应。一定条件下,把一定量的和充入密闭容器中,反应达到平衡状态时存在于
A.、中
B.、中
C.、、中
D.、中
6.一定温度下,在10 L的恒容密闭容器中加气体X和Y,如图,下列说法错误的是
A.10 s末时,X的反应速率为
B.此反应的化学方程式为
C.Y的平衡转化率为75%
D.平衡时,Z的体积分数约为72.73%
7.在一定条件下,1 L容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是
A.反应的化学方程式为
B.时段,N平均反应速率
C.时,正反应速率大于逆反应速率
D.时段,M的平均速率等于N的平均速率的2倍
8.一定温度下,在恒容密闭容器中发生反应:。当、、、的浓度不再变化时,下列说法正确的是
A.该反应已达到化学平衡状态
B.正、逆反应速率相等且等于零
C.和全部转化为和
D.、、、的浓度一定相等
9.汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为2种无毒气体。时,将0.8 mol NO和0.8 mol CO充入容积为1 L的密闭容器中,模拟尾气转化,容器中NO物质的量随时间变化如图。
(1)将NO、CO转化为2种无毒气体的化学方程式是_________________________。
(2)反应开始至10min,_____。
(3)下列说法正确的是_______。
A.新型催化剂可以加快NO、CO的转化速率
B.该反应进行到10 min时达到化学平衡状态
C.平衡时的浓度为
D.平衡时CO的转化率为50%
10.设计实验证明为可逆反应。可选用药品:溶液,溶液,溶液,溶液,固体,溶液。
反应原理
所用药品
操作
预期现象
结论 为可逆反应。
(编写:阮荣毅 修订:陈汉 审定: )
1
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
