人教版(2019)高中化学必修第二册 《化学反应的限度和化学反应条件的控制》优质课件(共28张PPT)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《化学反应的限度和化学反应条件的控制》优质课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-12 09:02:56 | ||
图片预览







文档简介
(共28张PPT)
人教版必修第二册
第六章 化学反应与能量
第二节 化学反应速率与限度
第2课时 化学反应的限度和化学反应条件的控制
【学习目标与核心素养】
【学习目标与核心素养】
学习目标
1、了解可逆反应。
2、理解化学平衡状态和学会平衡状态的判断。
3、了解控制反应条件在生产生活和科学研究中的作用。
核心素养
1、变化观念与平衡思想:化学反应有一定限度,是可以调控的。
2、证据推理与模型认知:通过分析推理认识化学平衡的特征。
【引入】
思考:我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
① 2H2 + O2 = 2H2O
已知:2mol 1mol
② 2SO2 + O2 = 2SO3
已知:2mol 1mol
2mol
<2mol
由上可知可逆反应进行得不完全,正、逆向反应同时同条件进行。化学反应物不可能全部转化为生成物,存在一定的化学反应限度。其实任何化学反应的进程都有一定的限度(可逆性),反应物不可能完全参加了反应,有些能进行地较彻底(非可逆反应),有些反应是不彻底的,甚至是可逆的(可逆反应)。
一、化学反应限度
1、可逆反应:
在相同条件下能向正反应方向进行同时又能向逆反应方向进行的反应称为可逆反应。
同一条件下
表示方法:书写可逆反应的化学方程式时不用“===”而用“ ”。
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2
放电
充电
2H2O
H2↑+O2 ↑
电解
点燃
√
×
√
×
14CO2、14C、14CO
2、14CO2 + C CO,达到化学平衡后,平衡混合物中含14C 的粒子有 。
1、以下几个反应是否是可逆反应?为什么?
【思考与交流】
【思考】
1、反应刚开始时, v正 、v逆 为何值?
2、随着反应的进行,反应物和生成物的浓度如何改变?速率如何变化?
3、v正 递减、v逆 递增将导致二者之间出现什么的结果?
4、在v正 = v逆 后,v正会继续减小吗?v逆 会继续增大吗?反应物和生成物的浓度呢?
在一固定容积的密闭容器里,加 1 mol N2和 3 mol H2 (合适催化剂),能发生什么反应?2 mol NH3?
N2+3H2 2NH3
催化剂
高温高压
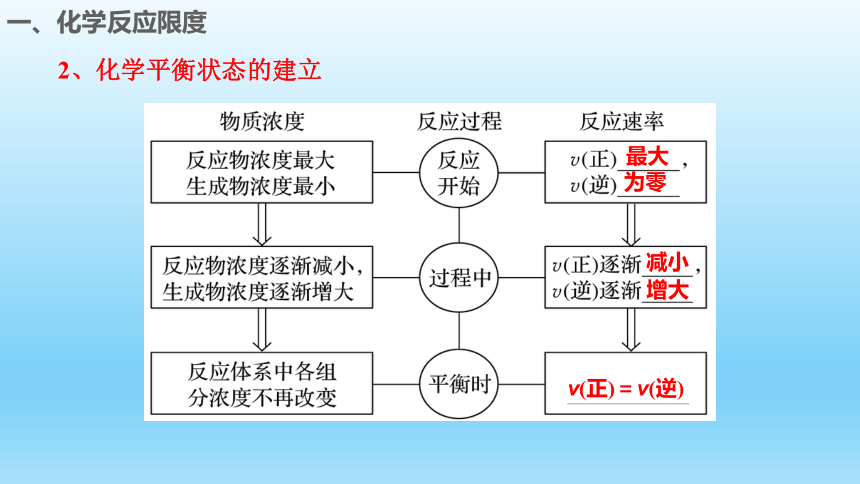
2、化学平衡状态的建立
一、化学反应限度
最大
为零
减小
增大
v(正)=v(逆)
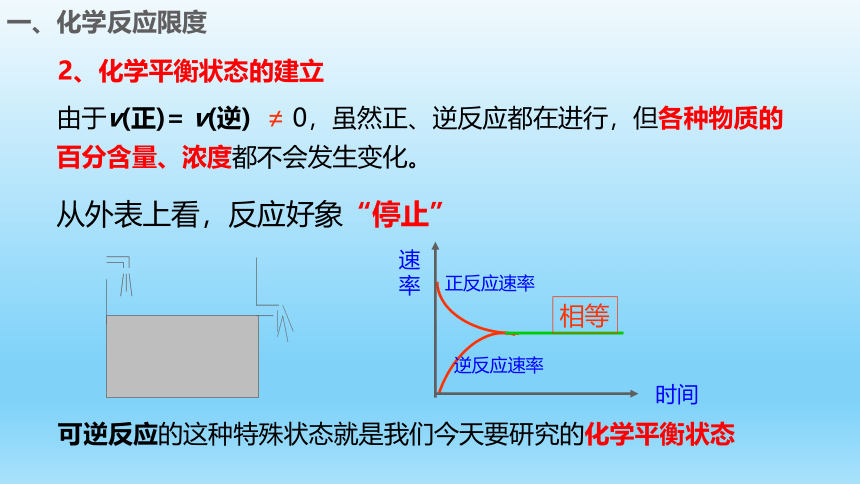
2、化学平衡状态的建立
一、化学反应限度
由于v(正)= v(逆) ≠ 0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化。
从外表上看,反应好象“停止”
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态
正反应速率
逆反应速率
相等
时间
速率
2、化学平衡状态的建立
一、化学反应限度
3、化学平衡状态的定义:
在一定条件下,可逆反应中,当正、逆两个方向的反应速率相等时,反应物的浓度和生成物的浓度都不在改变。达到了一种表面静止的状态,我们称之为“化学平衡状态”。化学平衡状态是可逆反应在一定条件下能达到的或完成的最大“限度”。
【思考】
(1) 达化学平衡的反应中,如何理解正逆反应速率相等?
(2) 当一个可逆反应达到平衡时,各物质的浓度保持不变,这时反应停止了吗?
反应速率
v(正)
v(逆)
t1
时间
0
可逆反应中 v正 = v逆 是针对同一物质而言的
化学反应限度决定了反应物在该条件下的最大转化率
一、化学反应限度
4、化学平衡状态的特征:
逆、等、动、定、变
(1) 逆:讨论的对象是可逆反应 (前提)
(2) 等:同一物质 v正 = v逆≠0 (实质)
(3) 动:化学平衡是一种动态平衡。化学反应达到平衡时,反应并没有停止。
(4) 定:在平衡混合物中,各组成成分的含量保持不变 (标志)
(5) 变:化学平衡状态是有条件的,当影响化学平衡的外界条件发生改变,化学平衡就会被破坏,在新的条件下建立新的化学平衡。
一、化学反应限度
高炉炼铁的主要反应是:2C(焦炭)+O2(空气) =2CO(放出热量),
Fe2O3+3CO 2Fe+3CO2。
炼制1吨生铁所需焦炭的实际用量远高于
按照化学方程式计算所需的量,且从高炉
中出来的气体中含有没利用的CO气体,
开始,炼铁工程师们认为是CO与铁矿石
接触不充分之故,于是设法增加高炉的
高度,然而高炉增高后,高炉尾气中的
CO比例竟没有改变,这是什么原因呢?
【科学史话】
1、对于可逆反应M+N Q 达到平衡时,下列说法正确的是( )
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. 反应物和生成物的浓度都保持不变
D. 反应已经停止
C
2、在一定温度下,可逆反应A(g)+3B (g) 2C(g) 达到平衡状态的标志是( )
A. C的生成速率和C的分解速率相等.
B. 单位时间内生成1molA同时生成了3molB.
C. A、B、C浓度不再变化.
D. A、B、C的分子个数之比为1:3:2
A C
【课堂练习】
直 接
速率
v(正)=v(逆)
浓度不再改变
vA(耗)=vA(生)
等号一边一生一死,量与系数成正比
等号两边同生共死,量与系数成正比
各组分的浓度不再变化
各组分的n/m/W(n)不再变化
5、化学平衡状态的判断
一、化学反应限度
1、以3H2+N2 2NH3为列分析,判断下列情形是否达到平衡状态
(1) 若有1molN2消耗,则有1molN2生成。
(2) 若有1molN2消耗,则有3molH2生成。
(3) 若有1molN2消耗,则有2molNH3生成。
(4) 若有1molN≡N键断裂,则有6molN﹣H键断裂。
(5) 若有1molN≡N键断裂,则有6molN﹣H键生成。
(6) 若反应体系中N2、H2、NH3的百分含量不变。
(7) 反应体系中平均相对分子质量一定。
(8) 若体系的体积一定,气体的密度一定。
(9) 若体系的体积一定,气体的压强一定。
是
否
是
是
是
是
否
是
否
【课堂练习】
间 接
压强不变
若m+n≠p+q
一 定
若m+n=p+q
不一定
平均相对分子质量不变
若m+n≠p+q
若m+n=p+q
一 定
不一定
密度不变
若m+n≠p+q
若m+n=p+q
不一定
不一定
颜色不变
一 定
5、化学平衡状态的判断
一、化学反应限度
以mA(g)+nB(g) pC(g)+qD(g) 为例
1、可逆反应2NO2(红棕色) 2NO(无色)+O2(无色)在密闭容器中反应,达到化学平衡状态的是( )
A.单位时间内生成n mol O2同时生成2n mol NO2
B.单位时间内生成n mol O2同时生成2n mol NO
C.c(NO2):c(NO):c(CO2)= 2: 2: 1
D.混合气体的颜色不再改变
F.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
H.混合气体个组分的 体积分数不再改变
ADEH
【课堂练习】
H2(g)+I2(g) 2HI(g)
2、 3molA和2.5molB混合于2L的密闭容器中发生反应:
3A(g)+B(g) aC(g)+2D(g),
5min后达到平衡,已知v(c)=0.05 mol /(min·L),生成D为1 mol。下列选项正确的是( )
A. v (A)=0.15 mol/(min·L) B. a=2
C.平衡时B的转化率为20% D.平衡时压强为起始时的0.8倍
C
【课堂练习】
化学平衡状态的判断依据
(1)直接判断依据
(2)间接判断依据
以mA(g)+nB(g) pC(g)+qD(g)为例
类型 判断依据 平衡状态
混合物体系中各成分的含量 ①各物质的物质的量或各物质的物质的量分数一定 平衡
②各物质的质量或各物质的质量分数一定 平衡
【总结】
正、逆反应速率的关系 ①在单位时间内消耗了m mol A同时生成m mol A,即v正=v逆 平衡
②在单位时间内消耗了n mol B同时生成p mol C,则v正不一定等于v逆 不一定
③在单位时间内生成n mol B,同时消耗q mol D,因二者变化均表示v逆,所以v正不一定等于v逆 不一定
温度 体系温度一定(其他不变) 平衡
颜色 反应体系内有色物质的颜色一定 平衡
【总结】
二、化学反应条件的控制
在生产和生活中,人们希望促进有利的化学反应(提高反应速率,提高反应物的转化率即原料的利用率),抑制有害的化学反应(降低反应速率,控制副反应的发生,减少甚至消除有害物质的产生),这就需要进行化学反应条件的控制。
二、化学反应条件的控制
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
催化剂
高温、高压
N2 + 3H2 2NH3
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
【思考与讨论】
为提高燃料的燃烧效率,应如何调控燃烧反应的条件?(提示:可以从以下几方面考虑,如燃料的状态、空气用量、炉膛材料、烟道废气中热能的利用,等等。)
①燃料与空气接触;
②温度达到燃料的着火点。
(2)燃料充分燃烧的条件
①要有足够的空气或氧气(助燃剂);
②燃料与空气或氧气要有足够大的接触面积。
(3)燃料充分燃烧的意义
①使有限的能量发挥最大的作用,节约能源;
②降低污染程度。
促进
抑制
【总结】
1.下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的最大限度
B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
A
【课堂练习】
C
【课堂练习】
2.在体积不变的密闭容器中发生反应N2(g)+3H2(g) 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1 mol N≡N键断裂时,有6 mol N—H键断裂
D.单位时间内生成2a mol NH3,同时消耗a mol N2
3.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面说法中错误的是( )
A.能够节约原料和能源 B.能够提高产品的产量
C.能够提高经济效益 D.能够提高化学反应速率
D
4.下列措施可以提高燃料燃烧效率的是_________(填序号)。
①提高燃料的着火点 ②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化处理
⑤将煤进行气化处理 ⑥通入适当过量的空气
③④⑤⑥
【课堂练习】
5.下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是___________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒
(2)步骤②中“加压”可以加快反应速率
(3)步骤②采用的压强是2×107 Pa,因为在该压强下铁触媒的活性最大
(4)步骤③,选择高效催化剂是合成氨反应的重要条件
(5)目前,步骤③一般选择控制反应温度为700 ℃左右
(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
【课堂练习】
人教版必修第二册
第六章 化学反应与能量
第二节 化学反应速率与限度
第2课时 化学反应的限度和化学反应条件的控制
【学习目标与核心素养】
【学习目标与核心素养】
学习目标
1、了解可逆反应。
2、理解化学平衡状态和学会平衡状态的判断。
3、了解控制反应条件在生产生活和科学研究中的作用。
核心素养
1、变化观念与平衡思想:化学反应有一定限度,是可以调控的。
2、证据推理与模型认知:通过分析推理认识化学平衡的特征。
【引入】
思考:我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
① 2H2 + O2 = 2H2O
已知:2mol 1mol
② 2SO2 + O2 = 2SO3
已知:2mol 1mol
2mol
<2mol
由上可知可逆反应进行得不完全,正、逆向反应同时同条件进行。化学反应物不可能全部转化为生成物,存在一定的化学反应限度。其实任何化学反应的进程都有一定的限度(可逆性),反应物不可能完全参加了反应,有些能进行地较彻底(非可逆反应),有些反应是不彻底的,甚至是可逆的(可逆反应)。
一、化学反应限度
1、可逆反应:
在相同条件下能向正反应方向进行同时又能向逆反应方向进行的反应称为可逆反应。
同一条件下
表示方法:书写可逆反应的化学方程式时不用“===”而用“ ”。
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2
放电
充电
2H2O
H2↑+O2 ↑
电解
点燃
√
×
√
×
14CO2、14C、14CO
2、14CO2 + C CO,达到化学平衡后,平衡混合物中含14C 的粒子有 。
1、以下几个反应是否是可逆反应?为什么?
【思考与交流】
【思考】
1、反应刚开始时, v正 、v逆 为何值?
2、随着反应的进行,反应物和生成物的浓度如何改变?速率如何变化?
3、v正 递减、v逆 递增将导致二者之间出现什么的结果?
4、在v正 = v逆 后,v正会继续减小吗?v逆 会继续增大吗?反应物和生成物的浓度呢?
在一固定容积的密闭容器里,加 1 mol N2和 3 mol H2 (合适催化剂),能发生什么反应?2 mol NH3?
N2+3H2 2NH3
催化剂
高温高压
2、化学平衡状态的建立
一、化学反应限度
最大
为零
减小
增大
v(正)=v(逆)
2、化学平衡状态的建立
一、化学反应限度
由于v(正)= v(逆) ≠ 0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化。
从外表上看,反应好象“停止”
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态
正反应速率
逆反应速率
相等
时间
速率
2、化学平衡状态的建立
一、化学反应限度
3、化学平衡状态的定义:
在一定条件下,可逆反应中,当正、逆两个方向的反应速率相等时,反应物的浓度和生成物的浓度都不在改变。达到了一种表面静止的状态,我们称之为“化学平衡状态”。化学平衡状态是可逆反应在一定条件下能达到的或完成的最大“限度”。
【思考】
(1) 达化学平衡的反应中,如何理解正逆反应速率相等?
(2) 当一个可逆反应达到平衡时,各物质的浓度保持不变,这时反应停止了吗?
反应速率
v(正)
v(逆)
t1
时间
0
可逆反应中 v正 = v逆 是针对同一物质而言的
化学反应限度决定了反应物在该条件下的最大转化率
一、化学反应限度
4、化学平衡状态的特征:
逆、等、动、定、变
(1) 逆:讨论的对象是可逆反应 (前提)
(2) 等:同一物质 v正 = v逆≠0 (实质)
(3) 动:化学平衡是一种动态平衡。化学反应达到平衡时,反应并没有停止。
(4) 定:在平衡混合物中,各组成成分的含量保持不变 (标志)
(5) 变:化学平衡状态是有条件的,当影响化学平衡的外界条件发生改变,化学平衡就会被破坏,在新的条件下建立新的化学平衡。
一、化学反应限度
高炉炼铁的主要反应是:2C(焦炭)+O2(空气) =2CO(放出热量),
Fe2O3+3CO 2Fe+3CO2。
炼制1吨生铁所需焦炭的实际用量远高于
按照化学方程式计算所需的量,且从高炉
中出来的气体中含有没利用的CO气体,
开始,炼铁工程师们认为是CO与铁矿石
接触不充分之故,于是设法增加高炉的
高度,然而高炉增高后,高炉尾气中的
CO比例竟没有改变,这是什么原因呢?
【科学史话】
1、对于可逆反应M+N Q 达到平衡时,下列说法正确的是( )
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. 反应物和生成物的浓度都保持不变
D. 反应已经停止
C
2、在一定温度下,可逆反应A(g)+3B (g) 2C(g) 达到平衡状态的标志是( )
A. C的生成速率和C的分解速率相等.
B. 单位时间内生成1molA同时生成了3molB.
C. A、B、C浓度不再变化.
D. A、B、C的分子个数之比为1:3:2
A C
【课堂练习】
直 接
速率
v(正)=v(逆)
浓度不再改变
vA(耗)=vA(生)
等号一边一生一死,量与系数成正比
等号两边同生共死,量与系数成正比
各组分的浓度不再变化
各组分的n/m/W(n)不再变化
5、化学平衡状态的判断
一、化学反应限度
1、以3H2+N2 2NH3为列分析,判断下列情形是否达到平衡状态
(1) 若有1molN2消耗,则有1molN2生成。
(2) 若有1molN2消耗,则有3molH2生成。
(3) 若有1molN2消耗,则有2molNH3生成。
(4) 若有1molN≡N键断裂,则有6molN﹣H键断裂。
(5) 若有1molN≡N键断裂,则有6molN﹣H键生成。
(6) 若反应体系中N2、H2、NH3的百分含量不变。
(7) 反应体系中平均相对分子质量一定。
(8) 若体系的体积一定,气体的密度一定。
(9) 若体系的体积一定,气体的压强一定。
是
否
是
是
是
是
否
是
否
【课堂练习】
间 接
压强不变
若m+n≠p+q
一 定
若m+n=p+q
不一定
平均相对分子质量不变
若m+n≠p+q
若m+n=p+q
一 定
不一定
密度不变
若m+n≠p+q
若m+n=p+q
不一定
不一定
颜色不变
一 定
5、化学平衡状态的判断
一、化学反应限度
以mA(g)+nB(g) pC(g)+qD(g) 为例
1、可逆反应2NO2(红棕色) 2NO(无色)+O2(无色)在密闭容器中反应,达到化学平衡状态的是( )
A.单位时间内生成n mol O2同时生成2n mol NO2
B.单位时间内生成n mol O2同时生成2n mol NO
C.c(NO2):c(NO):c(CO2)= 2: 2: 1
D.混合气体的颜色不再改变
F.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
H.混合气体个组分的 体积分数不再改变
ADEH
【课堂练习】
H2(g)+I2(g) 2HI(g)
2、 3molA和2.5molB混合于2L的密闭容器中发生反应:
3A(g)+B(g) aC(g)+2D(g),
5min后达到平衡,已知v(c)=0.05 mol /(min·L),生成D为1 mol。下列选项正确的是( )
A. v (A)=0.15 mol/(min·L) B. a=2
C.平衡时B的转化率为20% D.平衡时压强为起始时的0.8倍
C
【课堂练习】
化学平衡状态的判断依据
(1)直接判断依据
(2)间接判断依据
以mA(g)+nB(g) pC(g)+qD(g)为例
类型 判断依据 平衡状态
混合物体系中各成分的含量 ①各物质的物质的量或各物质的物质的量分数一定 平衡
②各物质的质量或各物质的质量分数一定 平衡
【总结】
正、逆反应速率的关系 ①在单位时间内消耗了m mol A同时生成m mol A,即v正=v逆 平衡
②在单位时间内消耗了n mol B同时生成p mol C,则v正不一定等于v逆 不一定
③在单位时间内生成n mol B,同时消耗q mol D,因二者变化均表示v逆,所以v正不一定等于v逆 不一定
温度 体系温度一定(其他不变) 平衡
颜色 反应体系内有色物质的颜色一定 平衡
【总结】
二、化学反应条件的控制
在生产和生活中,人们希望促进有利的化学反应(提高反应速率,提高反应物的转化率即原料的利用率),抑制有害的化学反应(降低反应速率,控制副反应的发生,减少甚至消除有害物质的产生),这就需要进行化学反应条件的控制。
二、化学反应条件的控制
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
催化剂
高温、高压
N2 + 3H2 2NH3
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
【思考与讨论】
为提高燃料的燃烧效率,应如何调控燃烧反应的条件?(提示:可以从以下几方面考虑,如燃料的状态、空气用量、炉膛材料、烟道废气中热能的利用,等等。)
①燃料与空气接触;
②温度达到燃料的着火点。
(2)燃料充分燃烧的条件
①要有足够的空气或氧气(助燃剂);
②燃料与空气或氧气要有足够大的接触面积。
(3)燃料充分燃烧的意义
①使有限的能量发挥最大的作用,节约能源;
②降低污染程度。
促进
抑制
【总结】
1.下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的最大限度
B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
A
【课堂练习】
C
【课堂练习】
2.在体积不变的密闭容器中发生反应N2(g)+3H2(g) 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1 mol N≡N键断裂时,有6 mol N—H键断裂
D.单位时间内生成2a mol NH3,同时消耗a mol N2
3.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面说法中错误的是( )
A.能够节约原料和能源 B.能够提高产品的产量
C.能够提高经济效益 D.能够提高化学反应速率
D
4.下列措施可以提高燃料燃烧效率的是_________(填序号)。
①提高燃料的着火点 ②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化处理
⑤将煤进行气化处理 ⑥通入适当过量的空气
③④⑤⑥
【课堂练习】
5.下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是___________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒
(2)步骤②中“加压”可以加快反应速率
(3)步骤②采用的压强是2×107 Pa,因为在该压强下铁触媒的活性最大
(4)步骤③,选择高效催化剂是合成氨反应的重要条件
(5)目前,步骤③一般选择控制反应温度为700 ℃左右
(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
【课堂练习】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
