富集在海水中的元素氯课件
图片预览








文档简介
课件55张PPT。第四章 第二节
富集在海水中的元素——氯新课程高中化学《必修1》浩瀚的海洋 资源的宝库海水中含盐3%,主要为氯化钠;
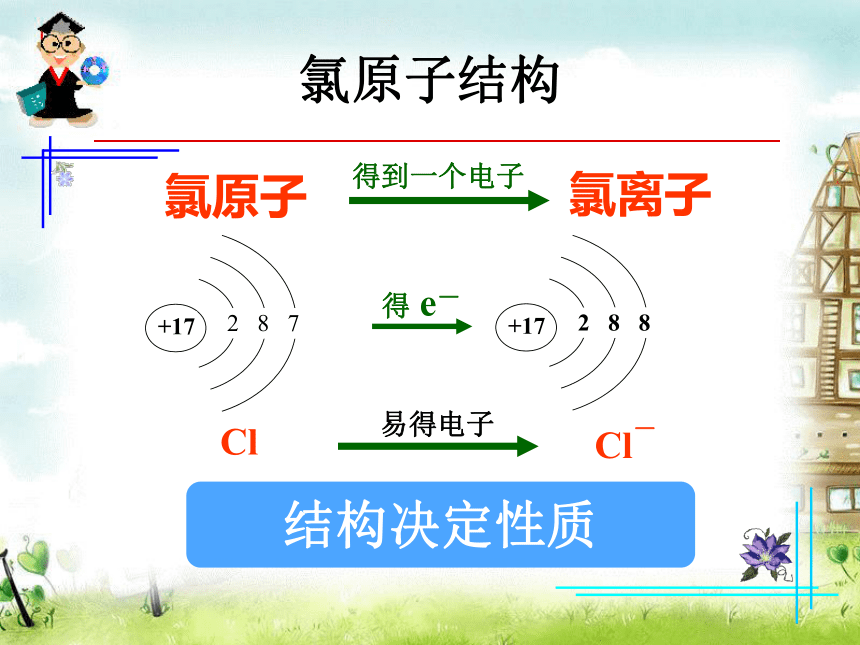
还含有氯化镁、硫酸镁等。氯在自然界中以化合态存在(主要是NaCl)。结构决定性质氯原子结构ClCl-得 e-氯原子氯离子得到一个电子易得电子一、活泼的黄绿色气体—氯气 思考与交流:
游离态的氯是以氯原子还是氯分子的形式存在?试从原子的结构分析。氯气的发现和确认:舍勒 【瑞典】 公元1742一1786 舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。双原子分子Cl2思考与交流 从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误 的理论,建立正确的理论或推动科学理论的发展。启示3:科学研究需要有热爱科学的思想和奉献科学的精神。京沪高速公路淮安路段液氯的泄漏新华网报道:2005年3月29日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : “一股黄绿色的气体就像探照灯光一样,‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
事发后消防队员不断地用水枪喷射,但还是造成350 人中毒进医院救治, 28人中毒死亡,附近居民采取应急措施,疏散到高坡上。颜色
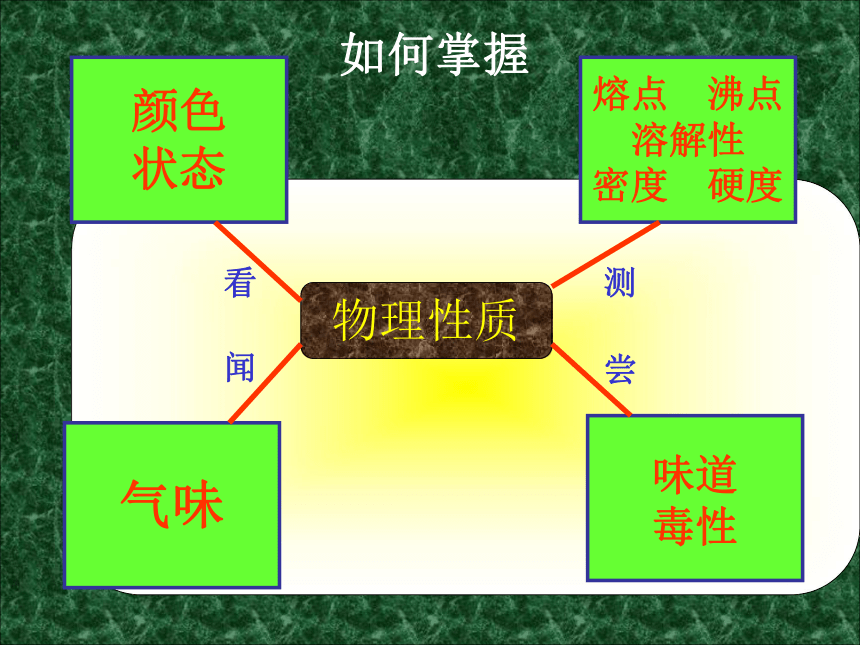
状态气味溶解性密度毒性物理性质颜色
状态
味道
毒性
气味熔点 沸点
溶解性
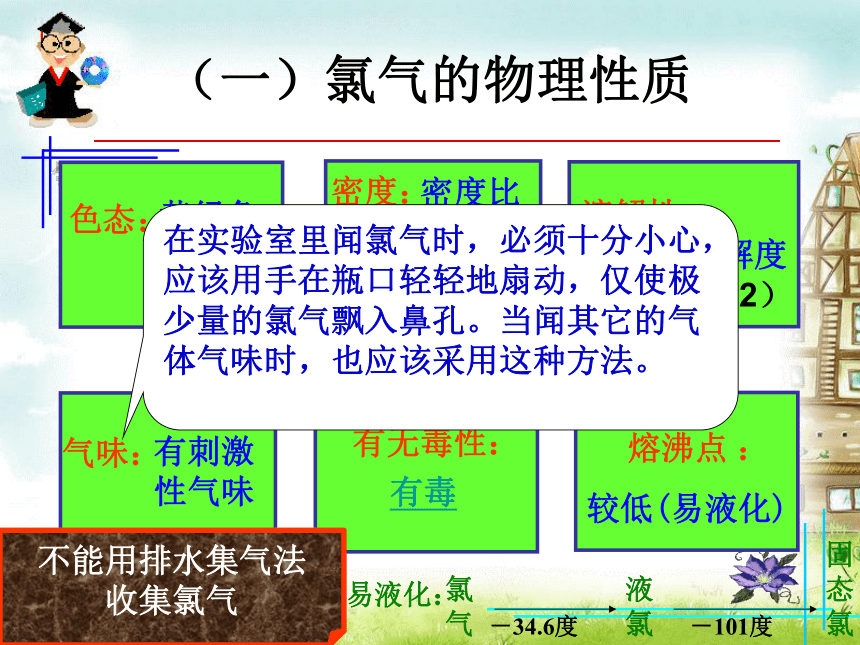
密度 硬度看尝闻测如何掌握(一)氯气的物理性质物理性质黄绿色
气体密度比
空气大在水中溶解度不大(1:2)有刺激
性气味有毒 较低(易液化)在实验室里闻氯气时,必须十分小心,应该用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。当闻其它的气体气味时,也应该采用这种方法。不能用排水集气法
收集氯气思考与交流
1.氯气有毒,氯离子是否有毒?氯气是黄绿色,氯离子是否也是黄绿色?
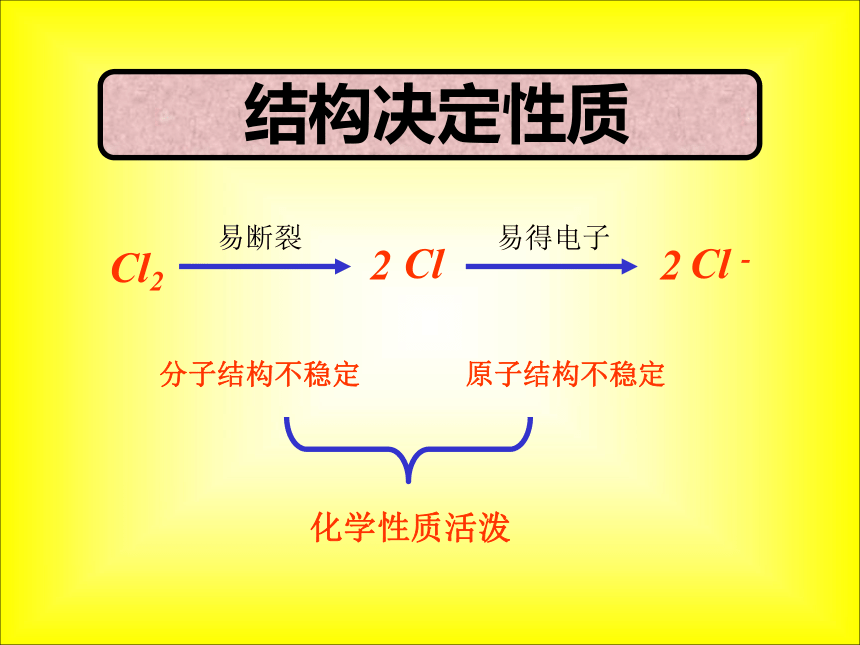
2.试比较氯原子、氯分子、氯离子的活泼性。Cl222易断裂易得电子分子结构不稳定原子结构不稳定化学性质活泼 结构决定性质ClCl -(二) 化学性质试从原子结构的特点推测氯气应该具有什么样的化学性质?
当氯气参加反应时:非常活泼,体现强氧化性1.与金属反应 (1)钠与氯气反应现象:金属钠在氯气中剧烈燃烧,黄色火焰,产生大量的白烟,生成白色固体(二) 化学性质在通常情况下,干燥氯气不与铁反应,所以可用钢瓶盛装和运输液氯。
注意:不生成 FeCl2。与变价金属反应,均生成金属的高价态化合物 实验 铁丝在氯气中燃烧
现象:红热的铁丝在氯气中剧烈燃烧,产生棕黄色的烟; 溶于水后溶液呈黄色。 (2)铁与氯气反应实验(二) 化学性质 (3)铜与氯气反应现象:金属铜在氯气中燃烧,产生大量的棕黄色的烟,加水溶解得蓝绿色溶液。(二) 化学性质
小结
①氯气具有很强的氧化性,属于氧化剂,而金属属于还原剂。
②金属+氯气→金属氯化物(盐)
成盐元素——卤素
2.与非金属反应演示实验4-3
现象:氢气在氯气中安静燃烧,发出苍白色火焰,瓶口呈白雾状。
生成的HCl极易溶于水,
与空气中的水蒸气结合形成
的盐酸(氢氯酸)小液滴。
2.与非金属反应 在点燃(或光照)下氯气均能与氢气反应
演示实验实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合。2.与非金属反应(与H2反应)思考与交流
通过氢气在氯气中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?①燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。②燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。定义:任何发光发热的剧烈的化学反应叫燃烧。点燃和燃烧有何区别? 点燃是一种反应条件 燃烧是一种剧烈的化学反应,特点是有发光发热的现象。 在化学方程式等号的上方或下方
书写的是反应条件,因此只能写点燃
而不能写燃烧。描述反应现象要注意的事项:烟-固体小颗粒分散在空气中雾-小液滴分散在空气中2. 不要把现象和结果混淆不要说成是:有氯化铜生成。(这是反应的结果)1. 区分烟和雾:氯气与铜反应的现象是:有棕黄色的烟产生课堂练习1.下列叙述正确的是( )
A.氯原子和氯离子的化学性质相同。
B.氯离子比氯原子多一个电子。
C.氯气有毒,氯离子也有毒。
D.氯气和氯离子都呈黄绿色。B课堂练习2.下列氯化物中,不能直接利用金属与氯气反应得到的是( )
A.氯化铁 B.氯化铜
C.氯化镁 D.氯化亚铁D课堂练习3.关于氯气的叙述中,下列正确的是( )
A.氯气是能够与金属反应,不能与非金属
反应
B.氯气在自然界中既可以以化合态存在,
也可以以游离态存在
C.氯气不能溶解于水,所以可用排水法收
集氯气
D.氯气、液氯是同一种物质,只是状态不
同,都属于纯净物D课堂练习D4.下列关于对燃烧现象的认识中,不正确的是( )
A.燃烧一定是氧化还原反应
B.燃烧一定发光放热
C.燃烧一定是化学反应
D.燃烧一定有氧气参与3.氯气与水的反应(溶于水中的
部分Cl2与水发生反应次氯酸(HClO)的性质 一元弱酸(酸性比碳酸还弱),强氧化性(杀菌、消毒),漂白性,不稳定易分解次氯酸可以消毒、杀菌、具有漂白性、见光易分解都源于其+1价的氯的强氧化性氯气的化学性质3. 与水反应 实验
向一支充满
氯气的试管中加
入少量水,迅速
塞紧塞子,充分
振荡。溶液有点发黄上部空间气体颜色变浅 氯气能溶于水,但溶解度不大氯水中有游离态的氯现象:结论:氯气的化学性质3. 与水反应 实验
用玻棒蘸取
氯水滴在蓝色石
蕊试纸上。滴有氯水的试纸中间变白
外围变红 含有能使有色物质褪色的物质有酸生成Cl2 + H2O =次氯酸思考: 氯水中哪种物质具有漂白作用?怎样用实验证明?+ HClOHCl氯气的化学性质3. 与水反应 实验
取两条蓝色
石蕊试纸分别放
入装有氯气和装
有氯水的集气瓶
中。放入氯气中,蓝色石蕊试纸不褪色放入氯水中,蓝色石蕊试纸褪色。Cl2 + H2O = HCl + HClO次氯酸 结论:
氯气无漂白作用现象:次氯酸有漂白作用氯气的化学性质3. 与水反应 思考
液氯和氯水
有何区别 ?液氯是纯净物 ,只含有氯分子氯水是混合物Cl2 + H2O = HCl + HClO次氯酸 氯水中主要含有:Cl2, H2O 、HClO, H+, Cl- 等微粒还含有ClO- 和 OH-怎样证明氯水分解放出的气体是氧气? 氯水长时间放置后,颜色
有何变化?组成上有何变化?氯水颜色变浅盐酸成份增多液氯与氯水的区别?新制氯水与久置氯水的区别?纯净物混合物分子:离子:Cl2 ,HClO,H2OH+,Cl-,ClO-分子:H2O离子:H+,Cl-新制有氧化性,无酸性和漂白性有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置只有Cl2分子实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中只有酸性想一想根据氯气与水的反应原理,推测氯气与NaOH能否发生反应?若反应,其产物是什么?4、氯气与碱反应2NaOH+Cl2=NaClO+NaCl+H2O有效成分:NaClO2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O漂白粉、漂粉精漂白液有效成分:Ca(ClO)2氯气化学性质氯气的化学性质4. 与碱反应 实验
将滴有酚酞
的氢氧化钠溶液
滴入充满氯气的
集气瓶中,振荡气体颜色消失溶液红色褪去Cl2 + H2O = HCl + HClO现象:反应:HCl + NaOH = NaCl + H2OHClO+ NaOH = NaClO + H2OCl2 + 2 NaOH = NaCl + NaClO + H2O次氯酸钠想一想4、氯气与碱反应 氯气跟碱反应的化学方程式有规律吗?日常 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO工业 Ca(ClO)2+2HCl===CaCl2+2HClO漂白原理:(反应原理:强酸制取弱酸)氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO漂白粉失效原理思
考 为什么不直接用次氯酸作漂白剂?次氯酸不稳定,次氯酸盐较稳定。 怎样保存漂白粉?密封,保存于干燥处。 漂白性的比较名称原理实质程度范围过氧化钠氯 水将有色的色素
氧化为稳定的
无色物质 氯水中的次氯酸将有色物质氧化成无色物质 氧化作用 氧化作用永久性 永久性 漂白大多数有色物质 漂白大多数有色物质,能使紫色石蕊试液褪色活性炭吸附有色
色素物理吸附1. 把氯气通入紫色石蕊试液中,出现的现象是
(A)溶液变红色 (B)溶液变蓝色
(C)溶液不变色 (D)溶液先变红后褪色(E)溶液先褪色后变红 解析:Cl2通入石蕊试液中,先与水反应生成盐酸和次氯酸,盐酸使石蕊试液变红(速度较快),而次氯酸有强氧化性,能把有色物质氧化成无色(速度较慢),故选(D)(D)2. 用自来水养鱼之前,应先将盛有自来水的鱼缸放在阳光下晒一段时间,主要目的是( )
(A)除去水中的HClO (B)紫外线杀菌消毒
(C)增加水中含氧量 (D)提高水温 解析:自来水用氯气消毒,因此水中含有次氯酸,次氯酸对生物不利,光照可使次氯酸分解,选(A)。(D)A课堂练习 次氯酸钙能与碳酸反应生成次氯酸,证明次氯酸的酸性
比碳酸弱,次氯酸是弱酸。 3. 次氯酸是一种强氧化剂,能杀死水里的细菌,能使
染料和有机色质褪色。它是强酸还是弱酸?怎样证明?课堂练习思路:强酸和弱酸的盐反应能生成弱酸和强酸的盐氯气性质
小结自然界有氯气存在吗?为什么? 氯气是一种活泼非金属,
能与大多数金属反应,
能与非金属反应,
能与水反应,
能与碱反应,
所以,自然界中没有氯气
存在。(三)氯气的用途 阅读课本相关文字,联系氯气的性质归纳氯气的用途及使用氯气的注意事项。
阅读与思考氯气的制取 H GFE-1-10+4+2分液漏斗连接顺序:要用浓盐酸用向上排气法收集用氢氧化钠溶液吸收固液反应,需加热氯气的制取 已知氯气在饱和食盐水中的溶解度不大,欲收集 纯净干燥
的氯气而且不造成空气污染,下列装置的连接顺序是:C D A H GFBE除去氯化氢干燥氯气收集氯气吸收氯气制取氯气气体净化洗气瓶考考你的智慧 20克 36.5%的浓盐酸与足量的二氧化锰加热反应,能生成多少克氯气?解: 设能生成氯气的质量为 x
MnO2 + 4 HCl = MnCl2 + 2H2O + Cl2↑14671 20×36.5%gx20×36.5%×71
146x == 3.6g 答:能生成氯气3.6 克此答案对吗?为什么? 不对!随着反应的进行,浓盐酸变成稀盐酸,反应就
停止了,故生成的氯气必少于3.6克。二、氯离子(Cl-)的检验有关反应的离子方程式是:
Ag+ + Cl– == AgCl ?
2Ag+ + CO32- == Ag2CO3 ?
Ag2CO3 + 2H+ == 2Ag+ + CO2 ?+ H2O 某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对? 在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。(2)方法和结论:(1)试剂:AgNO3溶液、稀硝酸 或 在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。小 结 ?氟 F 9氯 Cl 17 溴 Br 35碘 I 53砹 At 85卤素的原子结构三、成盐元素—卤素 卤素原子结构有何相似点和不同点?由此推测它们化学性质有何相似性和递变性?想一想最外层7个电子易得一个电子,核电荷数递增电子层数递增原子半径依次增大得电子能力逐渐减弱原子结构性质决定具氧化性氧化性逐渐减弱卤素单质的化学性质①对比Cl2,写出Br2与 Na 、Fe 反应的化学方程式。 与金属反应:F2 Cl2 Br2 的氧化性强,能把可变化合价
的金属氧化成高价的金属卤化物,I2 的氧化能力最弱,
跟铁反应只夺取铁的2个电子,生成FeI2。②对比Cl2,写出F2 、Br2、I2与 H2 反应的化学方程式。 它们发生反应的条件相同吗? ③对比Cl2,写出Br2与 H2O 反应的化学方程式。 I2 +Fe=FeI2Br2+2Na=2NaBr
3Br2+2Fe=2FeBr3F2 冷暗处爆炸 H2+F2====2HF HF很稳定 Cl2 光照或点燃 H2+Cl2=====2HCl HCl稳定Br2 高温 H2+Br2======2HBr HBr较不稳定I2 高温、持续加热 H2+I2======2HI HI很不稳定
缓慢进行 2. 卤素与氢气的反应结论: F Cl Br I 随着核电荷数的增多,原子半径的增大,
(1)卤素单质与H2化合的难易关系:F2 >Cl2> Br2> I 2(2)卤化氢的稳定性关系:HF > HCl > HBr > HI Br2+ H2O=====HBr+HBrO反应越来越难以发生2F2+2H2O=====4HF+O2 (特例)Cl2 +H2O=====HCl+HClO3.卤素与水反应通式:X2 + H2O=====HX+HXO(X:Cl、Br、I)I2 +H2O=====HI+HIO4.卤素间的相互置换1. Cl2+ 2Br- ===== 2Cl-+Br2
2. Cl2+ 2I- ===== 2Cl-+I2
3. Br2+ 2I- ===== 2Br-+I2 思考:根据上述实验,排出Cl2、Br2、I2的氧化性强弱顺序及Cl-、Br-、I-的还原性强弱顺序结论: 氧化性:Cl2>Br2>I2
还原性:I->Br->Cl-Cl-、Br-、 I-的检验试剂:硝酸银和稀硝酸
反应:Ag++ Cl-=AgCl↓ 白色沉淀
Ag++ Br-=AgBr↓ 浅(淡)黄色沉淀
Ag++l-=AgI↓黄色沉淀
小 结卤素原子结构的相似性,决定了单质化学性质的
相似性。与金属反应,生成卤化物。与氢气反应,生成卤化氢。与水反应,生成卤化氢和次卤酸。卤素原子结构的差异性,决定了单质化学性质的
差异性和递变性与氢反应的能力渐弱氢化物的稳定性渐弱与水反应的能力渐弱特性碘遇淀粉显蓝色。氟气和水的反应: 2F2 +2H2O=4HF+ O2 小
结1 . 通过对氯气的学习,学会研究物质物理性质的方法。2. 结构决定性质,这是学习化学的一个重要思维方法。氯气活泼的化学性质,是氯分子和氯原子结构不稳定的结果。3. 通过对燃烧定义的讨论,明确到认识事物有一个发展的过程,对知识要不断深化。课堂小结4. 通过演示实验,培养观察能力和分析推理能力如:氯气能否能溶于水,氯水中有无氯分子存在?氯与水反应会生成哪类物质?氯水中哪种物质具有漂白能力?5. 学会比较,这是学习化学的重要方法。液氯和氯水有何不同?新制氯水和久置氯水成份有何不同?小
结6. 氯气是一种比氧气还活泼的气体7. 氯水在反应过程中有三种 “有效成分”,分别是Cl2、HClO、HCl, 体现出强氧化性, 漂白性和酸的通性。8. 制氧、制氢和制氯的装置是中学化学制取气体的三种典型装置。9. 解题时,必需充分注意反应的条件,
如浓度,温度,酸碱度,反应物相对
用量等。
还含有氯化镁、硫酸镁等。氯在自然界中以化合态存在(主要是NaCl)。结构决定性质氯原子结构ClCl-得 e-氯原子氯离子得到一个电子易得电子一、活泼的黄绿色气体—氯气 思考与交流:
游离态的氯是以氯原子还是氯分子的形式存在?试从原子的结构分析。氯气的发现和确认:舍勒 【瑞典】 公元1742一1786 舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。双原子分子Cl2思考与交流 从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误 的理论,建立正确的理论或推动科学理论的发展。启示3:科学研究需要有热爱科学的思想和奉献科学的精神。京沪高速公路淮安路段液氯的泄漏新华网报道:2005年3月29日,京沪高速公路淮安路段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : “一股黄绿色的气体就像探照灯光一样,‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
事发后消防队员不断地用水枪喷射,但还是造成350 人中毒进医院救治, 28人中毒死亡,附近居民采取应急措施,疏散到高坡上。颜色
状态气味溶解性密度毒性物理性质颜色
状态
味道
毒性
气味熔点 沸点
溶解性
密度 硬度看尝闻测如何掌握(一)氯气的物理性质物理性质黄绿色
气体密度比
空气大在水中溶解度不大(1:2)有刺激
性气味有毒 较低(易液化)在实验室里闻氯气时,必须十分小心,应该用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。当闻其它的气体气味时,也应该采用这种方法。不能用排水集气法
收集氯气思考与交流
1.氯气有毒,氯离子是否有毒?氯气是黄绿色,氯离子是否也是黄绿色?
2.试比较氯原子、氯分子、氯离子的活泼性。Cl222易断裂易得电子分子结构不稳定原子结构不稳定化学性质活泼 结构决定性质ClCl -(二) 化学性质试从原子结构的特点推测氯气应该具有什么样的化学性质?
当氯气参加反应时:非常活泼,体现强氧化性1.与金属反应 (1)钠与氯气反应现象:金属钠在氯气中剧烈燃烧,黄色火焰,产生大量的白烟,生成白色固体(二) 化学性质在通常情况下,干燥氯气不与铁反应,所以可用钢瓶盛装和运输液氯。
注意:不生成 FeCl2。与变价金属反应,均生成金属的高价态化合物 实验 铁丝在氯气中燃烧
现象:红热的铁丝在氯气中剧烈燃烧,产生棕黄色的烟; 溶于水后溶液呈黄色。 (2)铁与氯气反应实验(二) 化学性质 (3)铜与氯气反应现象:金属铜在氯气中燃烧,产生大量的棕黄色的烟,加水溶解得蓝绿色溶液。(二) 化学性质
小结
①氯气具有很强的氧化性,属于氧化剂,而金属属于还原剂。
②金属+氯气→金属氯化物(盐)
成盐元素——卤素
2.与非金属反应演示实验4-3
现象:氢气在氯气中安静燃烧,发出苍白色火焰,瓶口呈白雾状。
生成的HCl极易溶于水,
与空气中的水蒸气结合形成
的盐酸(氢氯酸)小液滴。
2.与非金属反应 在点燃(或光照)下氯气均能与氢气反应
演示实验实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合。2.与非金属反应(与H2反应)思考与交流
通过氢气在氯气中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?①燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。②燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。定义:任何发光发热的剧烈的化学反应叫燃烧。点燃和燃烧有何区别? 点燃是一种反应条件 燃烧是一种剧烈的化学反应,特点是有发光发热的现象。 在化学方程式等号的上方或下方
书写的是反应条件,因此只能写点燃
而不能写燃烧。描述反应现象要注意的事项:烟-固体小颗粒分散在空气中雾-小液滴分散在空气中2. 不要把现象和结果混淆不要说成是:有氯化铜生成。(这是反应的结果)1. 区分烟和雾:氯气与铜反应的现象是:有棕黄色的烟产生课堂练习1.下列叙述正确的是( )
A.氯原子和氯离子的化学性质相同。
B.氯离子比氯原子多一个电子。
C.氯气有毒,氯离子也有毒。
D.氯气和氯离子都呈黄绿色。B课堂练习2.下列氯化物中,不能直接利用金属与氯气反应得到的是( )
A.氯化铁 B.氯化铜
C.氯化镁 D.氯化亚铁D课堂练习3.关于氯气的叙述中,下列正确的是( )
A.氯气是能够与金属反应,不能与非金属
反应
B.氯气在自然界中既可以以化合态存在,
也可以以游离态存在
C.氯气不能溶解于水,所以可用排水法收
集氯气
D.氯气、液氯是同一种物质,只是状态不
同,都属于纯净物D课堂练习D4.下列关于对燃烧现象的认识中,不正确的是( )
A.燃烧一定是氧化还原反应
B.燃烧一定发光放热
C.燃烧一定是化学反应
D.燃烧一定有氧气参与3.氯气与水的反应(溶于水中的
部分Cl2与水发生反应次氯酸(HClO)的性质 一元弱酸(酸性比碳酸还弱),强氧化性(杀菌、消毒),漂白性,不稳定易分解次氯酸可以消毒、杀菌、具有漂白性、见光易分解都源于其+1价的氯的强氧化性氯气的化学性质3. 与水反应 实验
向一支充满
氯气的试管中加
入少量水,迅速
塞紧塞子,充分
振荡。溶液有点发黄上部空间气体颜色变浅 氯气能溶于水,但溶解度不大氯水中有游离态的氯现象:结论:氯气的化学性质3. 与水反应 实验
用玻棒蘸取
氯水滴在蓝色石
蕊试纸上。滴有氯水的试纸中间变白
外围变红 含有能使有色物质褪色的物质有酸生成Cl2 + H2O =次氯酸思考: 氯水中哪种物质具有漂白作用?怎样用实验证明?+ HClOHCl氯气的化学性质3. 与水反应 实验
取两条蓝色
石蕊试纸分别放
入装有氯气和装
有氯水的集气瓶
中。放入氯气中,蓝色石蕊试纸不褪色放入氯水中,蓝色石蕊试纸褪色。Cl2 + H2O = HCl + HClO次氯酸 结论:
氯气无漂白作用现象:次氯酸有漂白作用氯气的化学性质3. 与水反应 思考
液氯和氯水
有何区别 ?液氯是纯净物 ,只含有氯分子氯水是混合物Cl2 + H2O = HCl + HClO次氯酸 氯水中主要含有:Cl2, H2O 、HClO, H+, Cl- 等微粒还含有ClO- 和 OH-怎样证明氯水分解放出的气体是氧气? 氯水长时间放置后,颜色
有何变化?组成上有何变化?氯水颜色变浅盐酸成份增多液氯与氯水的区别?新制氯水与久置氯水的区别?纯净物混合物分子:离子:Cl2 ,HClO,H2OH+,Cl-,ClO-分子:H2O离子:H+,Cl-新制有氧化性,无酸性和漂白性有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置只有Cl2分子实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中只有酸性想一想根据氯气与水的反应原理,推测氯气与NaOH能否发生反应?若反应,其产物是什么?4、氯气与碱反应2NaOH+Cl2=NaClO+NaCl+H2O有效成分:NaClO2 Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O漂白粉、漂粉精漂白液有效成分:Ca(ClO)2氯气化学性质氯气的化学性质4. 与碱反应 实验
将滴有酚酞
的氢氧化钠溶液
滴入充满氯气的
集气瓶中,振荡气体颜色消失溶液红色褪去Cl2 + H2O = HCl + HClO现象:反应:HCl + NaOH = NaCl + H2OHClO+ NaOH = NaClO + H2OCl2 + 2 NaOH = NaCl + NaClO + H2O次氯酸钠想一想4、氯气与碱反应 氯气跟碱反应的化学方程式有规律吗?日常 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO工业 Ca(ClO)2+2HCl===CaCl2+2HClO漂白原理:(反应原理:强酸制取弱酸)氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO漂白粉失效原理思
考 为什么不直接用次氯酸作漂白剂?次氯酸不稳定,次氯酸盐较稳定。 怎样保存漂白粉?密封,保存于干燥处。 漂白性的比较名称原理实质程度范围过氧化钠氯 水将有色的色素
氧化为稳定的
无色物质 氯水中的次氯酸将有色物质氧化成无色物质 氧化作用 氧化作用永久性 永久性 漂白大多数有色物质 漂白大多数有色物质,能使紫色石蕊试液褪色活性炭吸附有色
色素物理吸附1. 把氯气通入紫色石蕊试液中,出现的现象是
(A)溶液变红色 (B)溶液变蓝色
(C)溶液不变色 (D)溶液先变红后褪色(E)溶液先褪色后变红 解析:Cl2通入石蕊试液中,先与水反应生成盐酸和次氯酸,盐酸使石蕊试液变红(速度较快),而次氯酸有强氧化性,能把有色物质氧化成无色(速度较慢),故选(D)(D)2. 用自来水养鱼之前,应先将盛有自来水的鱼缸放在阳光下晒一段时间,主要目的是( )
(A)除去水中的HClO (B)紫外线杀菌消毒
(C)增加水中含氧量 (D)提高水温 解析:自来水用氯气消毒,因此水中含有次氯酸,次氯酸对生物不利,光照可使次氯酸分解,选(A)。(D)A课堂练习 次氯酸钙能与碳酸反应生成次氯酸,证明次氯酸的酸性
比碳酸弱,次氯酸是弱酸。 3. 次氯酸是一种强氧化剂,能杀死水里的细菌,能使
染料和有机色质褪色。它是强酸还是弱酸?怎样证明?课堂练习思路:强酸和弱酸的盐反应能生成弱酸和强酸的盐氯气性质
小结自然界有氯气存在吗?为什么? 氯气是一种活泼非金属,
能与大多数金属反应,
能与非金属反应,
能与水反应,
能与碱反应,
所以,自然界中没有氯气
存在。(三)氯气的用途 阅读课本相关文字,联系氯气的性质归纳氯气的用途及使用氯气的注意事项。
阅读与思考氯气的制取 H GFE-1-10+4+2分液漏斗连接顺序:要用浓盐酸用向上排气法收集用氢氧化钠溶液吸收固液反应,需加热氯气的制取 已知氯气在饱和食盐水中的溶解度不大,欲收集 纯净干燥
的氯气而且不造成空气污染,下列装置的连接顺序是:C D A H GFBE除去氯化氢干燥氯气收集氯气吸收氯气制取氯气气体净化洗气瓶考考你的智慧 20克 36.5%的浓盐酸与足量的二氧化锰加热反应,能生成多少克氯气?解: 设能生成氯气的质量为 x
MnO2 + 4 HCl = MnCl2 + 2H2O + Cl2↑14671 20×36.5%gx20×36.5%×71
146x == 3.6g 答:能生成氯气3.6 克此答案对吗?为什么? 不对!随着反应的进行,浓盐酸变成稀盐酸,反应就
停止了,故生成的氯气必少于3.6克。二、氯离子(Cl-)的检验有关反应的离子方程式是:
Ag+ + Cl– == AgCl ?
2Ag+ + CO32- == Ag2CO3 ?
Ag2CO3 + 2H+ == 2Ag+ + CO2 ?+ H2O 某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对? 在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。(2)方法和结论:(1)试剂:AgNO3溶液、稀硝酸 或 在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。小 结 ?氟 F 9氯 Cl 17 溴 Br 35碘 I 53砹 At 85卤素的原子结构三、成盐元素—卤素 卤素原子结构有何相似点和不同点?由此推测它们化学性质有何相似性和递变性?想一想最外层7个电子易得一个电子,核电荷数递增电子层数递增原子半径依次增大得电子能力逐渐减弱原子结构性质决定具氧化性氧化性逐渐减弱卤素单质的化学性质①对比Cl2,写出Br2与 Na 、Fe 反应的化学方程式。 与金属反应:F2 Cl2 Br2 的氧化性强,能把可变化合价
的金属氧化成高价的金属卤化物,I2 的氧化能力最弱,
跟铁反应只夺取铁的2个电子,生成FeI2。②对比Cl2,写出F2 、Br2、I2与 H2 反应的化学方程式。 它们发生反应的条件相同吗? ③对比Cl2,写出Br2与 H2O 反应的化学方程式。 I2 +Fe=FeI2Br2+2Na=2NaBr
3Br2+2Fe=2FeBr3F2 冷暗处爆炸 H2+F2====2HF HF很稳定 Cl2 光照或点燃 H2+Cl2=====2HCl HCl稳定Br2 高温 H2+Br2======2HBr HBr较不稳定I2 高温、持续加热 H2+I2======2HI HI很不稳定
缓慢进行 2. 卤素与氢气的反应结论: F Cl Br I 随着核电荷数的增多,原子半径的增大,
(1)卤素单质与H2化合的难易关系:F2 >Cl2> Br2> I 2(2)卤化氢的稳定性关系:HF > HCl > HBr > HI Br2+ H2O=====HBr+HBrO反应越来越难以发生2F2+2H2O=====4HF+O2 (特例)Cl2 +H2O=====HCl+HClO3.卤素与水反应通式:X2 + H2O=====HX+HXO(X:Cl、Br、I)I2 +H2O=====HI+HIO4.卤素间的相互置换1. Cl2+ 2Br- ===== 2Cl-+Br2
2. Cl2+ 2I- ===== 2Cl-+I2
3. Br2+ 2I- ===== 2Br-+I2 思考:根据上述实验,排出Cl2、Br2、I2的氧化性强弱顺序及Cl-、Br-、I-的还原性强弱顺序结论: 氧化性:Cl2>Br2>I2
还原性:I->Br->Cl-Cl-、Br-、 I-的检验试剂:硝酸银和稀硝酸
反应:Ag++ Cl-=AgCl↓ 白色沉淀
Ag++ Br-=AgBr↓ 浅(淡)黄色沉淀
Ag++l-=AgI↓黄色沉淀
小 结卤素原子结构的相似性,决定了单质化学性质的
相似性。与金属反应,生成卤化物。与氢气反应,生成卤化氢。与水反应,生成卤化氢和次卤酸。卤素原子结构的差异性,决定了单质化学性质的
差异性和递变性与氢反应的能力渐弱氢化物的稳定性渐弱与水反应的能力渐弱特性碘遇淀粉显蓝色。氟气和水的反应: 2F2 +2H2O=4HF+ O2 小
结1 . 通过对氯气的学习,学会研究物质物理性质的方法。2. 结构决定性质,这是学习化学的一个重要思维方法。氯气活泼的化学性质,是氯分子和氯原子结构不稳定的结果。3. 通过对燃烧定义的讨论,明确到认识事物有一个发展的过程,对知识要不断深化。课堂小结4. 通过演示实验,培养观察能力和分析推理能力如:氯气能否能溶于水,氯水中有无氯分子存在?氯与水反应会生成哪类物质?氯水中哪种物质具有漂白能力?5. 学会比较,这是学习化学的重要方法。液氯和氯水有何不同?新制氯水和久置氯水成份有何不同?小
结6. 氯气是一种比氧气还活泼的气体7. 氯水在反应过程中有三种 “有效成分”,分别是Cl2、HClO、HCl, 体现出强氧化性, 漂白性和酸的通性。8. 制氧、制氢和制氯的装置是中学化学制取气体的三种典型装置。9. 解题时,必需充分注意反应的条件,
如浓度,温度,酸碱度,反应物相对
用量等。
