浙教版科学八年级下期中解答题专练二(含解析)
文档属性
| 名称 | 浙教版科学八年级下期中解答题专练二(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 263.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-04-12 08:05:44 | ||
图片预览




文档简介
期中解答题专练二
、解答题
国家规定燃气灶须安装熄火自动保护装置,在意外熄火(如汤水溢出)时,装置能自动关闭气路。图甲为小晨设计的模拟装置示意图,电源电压U=9伏,当电磁铁线圈中的电流 安时,衔铁K被释放从而关闭气路(未画出)启动保护。不计线圈电阻,热敏电阻 的阻值与温度的关系如图乙中图线①所示。闭合开关 ,问:
(1)电磁铁下端的磁极为 极。
(2)若温度降至80℃时就启动保护,电路中定值电阻R0为多大?
(3)现仅将 更换为图线②所示的热敏电阻,若燃气灶熄火后,该电阻温度下降的快慢与图线①所示的电阻相同,装置启动保护的灵敏度会 ▲ (填“增强”或“降低”)要恢复与原来相同的灵敏度,电阻R0的取值要作如何的变化?并说明理由_。
作图:
(1)平静水面上的小鸟和水中的小鱼,某时刻的实际位置如图所示,水面一侧C点的人眼恰好看到它们在水中的像重合,以小鸟眼睛A点代表小鸟,以小鱼眼睛B点代表小鱼,请画出图中小鸟在水中像的位置以及人眼看到小鸟和小鱼的光路图。(保留作图痕迹)
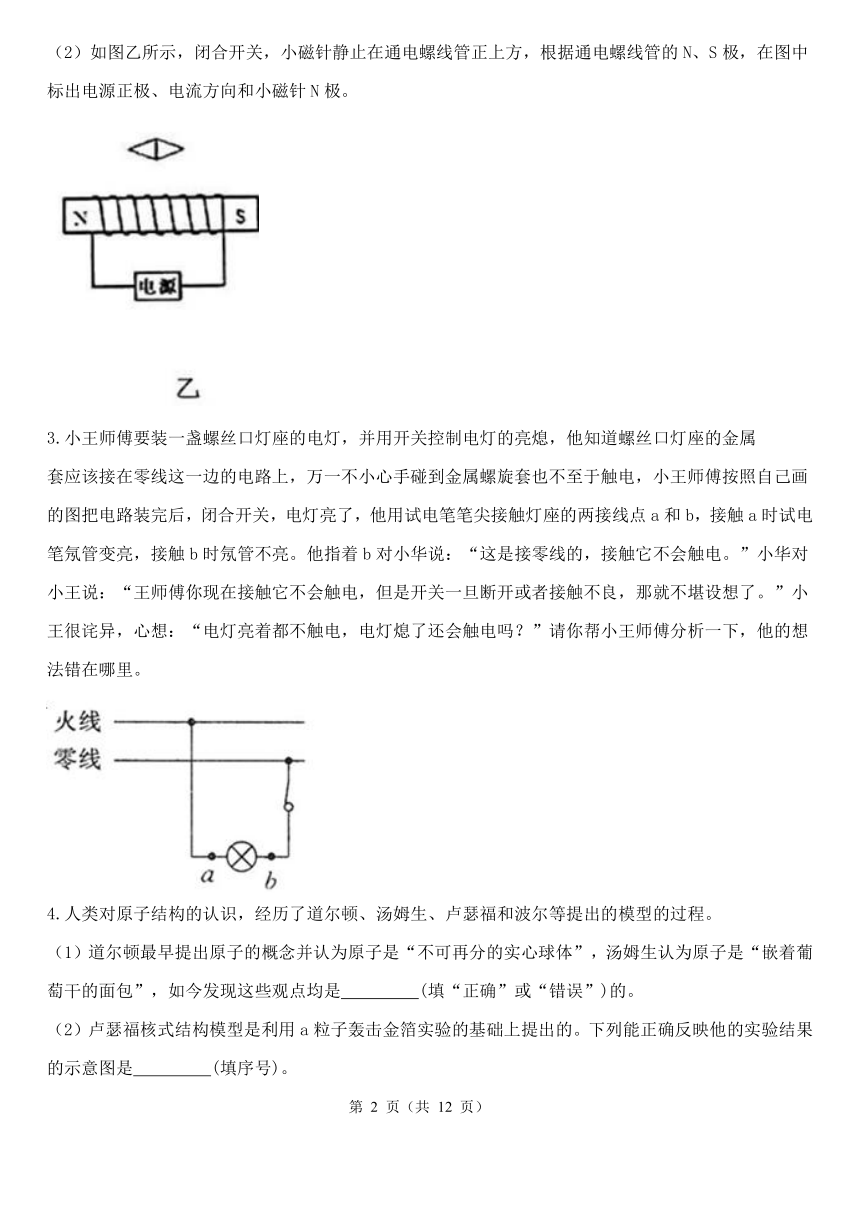
(2)如图乙所示,闭合开关,小磁针静止在通电螺线管正上方,根据通电螺线管的N、S极,在图中标出电源正极、电流方向和小磁针N极。
小王师傅要装一盏螺丝口灯座的电灯,并用开关控制电灯的亮熄,他知道螺丝口灯座的金属
套应该接在零线这一边的电路上,万一不小心手碰到金属螺旋套也不至于触电,小王师傅按照自己画的图把电路装完后,闭合开关,电灯亮了,他用试电笔笔尖接触灯座的两接线点a和b,接触a时试电笔氖管变亮,接触b时氖管不亮。他指着b对小华说:“这是接零线的,接触它不会触电。”小华对小王说:“王师傅你现在接触它不会触电,但是开关一旦断开或者接触不良,那就不堪设想了。”小王很诧异,心想:“电灯亮着都不触电,电灯熄了还会触电吗?”请你帮小王师傅分析一下,他的想法错在哪里。
人类对原子结构的认识,经历了道尔顿、汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是 (填“正确”或“错误”)的。
(2)卢瑟福核式结构模型是利用a粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
(3)从原子结构模型建立的过程中,我们发现 (填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
抗流感药物—“达菲”被认为是迄今为止对禽流感最有疗效的药物后,全球对达菲的市场需求膨胀,达菲的主要原料莽草酸一下子成了抢手货,价格上涨几倍。全球蔓延的H1N1甲型流感,感染早期用达菲(Oseltamivir)有显著效果。“达菲”的原料莽草酸是我国传统的香料——八角茴香的重要成分。请你根据莽草酸的化学式(C7H10O5)计算:
(1)莽草酸中碳、氢、氧元素的质量比为 ;
(2)莽草酸中碳元素的质量分数是多少;(保留一位小数);
(3)174 克莽草酸中含有多少克碳元素;
(4)目前“达菲”两颗装售价涨至30元,其中一颗“达菲”药物质量为75毫克,其中莽草酸占该药质量的80%,而目前莽草酸的市场价格为3元/克,则一颗“达菲”中莽草酸的成本价为多少元
由于受新冠疫情影响,学校每天都会对教室和公共区域道行消毒,使用的是84 消毒液,下面是84 消毒液的产品说明书。
产品品名 84 消毒液
主要原科 次氯酸钠(NaClO),有效含氯量大于等于5%
主要作用 瓜、餐具、厨房用品;白色衣物及物体表面;肝炎。病毒性感冒及肺炎患者的污染物
产品规格 500g
(1)NaClO分子中钠、氯、氧三种元素的原子个数比是 。
(2)NaClO中氯元素的化合价为 。
(3)计算 NaClO中氯元素质量分数?(写出计算过程)。
(4)该消毒液中至少含有次氯酸钠的质量?(写出计算过程)。
赤铁矿(Fe2O3)的主要成分是氧化铁.某赤铁矿含氧化铁为80%,现有该赤铁矿石200t,试计算:
(1)这些赤铁矿石中含氧化铁的质量.
(2)这些赤铁矿石中含铁元素的质量.
(3)这些赤铁矿石中含铁元素的质量,相当于多少吨含四氧化三铁为90%的磁铁矿石中含铁元素的质量.(计算结果精确到0.1t)
仅用5年时间,中国闪亮地跨入引领世界的高铁交通新时代。铺设无缝钢轨,需要用大量的钢铁,钢铁在生活中应用非常广泛。铁有多重氧化物,根据下列信息推断他们的化学式:
(1)某铁的氧化物中铁元素的化合价为+3价,则该铁的氧化物的化学式 。
(2)某铁的氧化物化学式为FexOy,相对分子质量为72,则该铁的氧化物的化学方程式为 。
向100g稀H2SO4溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示。请回答
(1)生成的沉淀是 (填化学式);
(2)加入的镁粉质量是多少
土豆是常见的农产品,我们平常的食用部分是植株的块茎。央视播出的《源味中国》,介绍我国“最好吃”的土豆产自山西省岚县。岚县的平均海拔超过1500米、昼夜温差大,且日照充足、土壤含钾高。这里种出来的土豆,不仅淀粉含量高、富含优质膳食纤维,每百克蛋白质含量是普通土豆的两倍。请回答:
(1)岚县的土壤含钾高,这里的“钾”是指 (选填“物质”、“元素”或“原子”)。
(2)已知每百克该土豆含氮元素的质量为0.56克。赖氨酸(C6H14N2O2)是土豆含有的一种蛋白质,若岚县土豆含有的蛋白质均以赖氨酸计,则每百克该土豆中含有多少克赖氨酸?
(3)请你分析岚县土豆产量高,富含淀粉的原因 。
我国科学家屠呦呦发现的青蒿素(化学式:C15H22O5),是一种用于治疗疟疾的药物,挽救了全球数百万人的生命,因而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素发现之前最热门的抗疟药物之一。回答下列问题。
(1)一个青蒿素分子中含有 个原子。
(2)青蒿素中的氢元素与氧元素的质量比是 。
(3)14.1克青蒿素中含有碳元素的质量
低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种.请回答:
(1)苹果酸钠盐的相对分子质量是 .
(2)苹果酸钠盐中各元素的质量比为C:H:O:Na= .
NH4NO3 是常用的化肥,但在化肥生产和使用中,伴随着能源耗费和环境污染等问题。利用生物固氮、雷电固氮等作用可以减少化肥的使用。请回答:
(1)能用水鉴别 NH4NO3、NaOH 和 NaCl 三种固体的原理是 。
(2)NH4NO3 中各元素的质量比是 。
(3)资料显示一公顷林地平均每年固定氮元素的质量约为 100 千克。这些氮元素如果从NH4NO3 中获得,则需要施加多少千克 NH4NO3 (精确到 0.1 千克)
期中解答题专练二答案解析
、解答题
【答案】(1)N
(2)解:若温度降至80℃时就启动保护,由题意可知,此时电路中的电流I=0.05A,由图乙可知,Rt=100Ω,电路的总电阻R总= =180Ω
因串联电路中总电阻等于各分电阻之和,所以,电路中定值电阻R0=R总-Rt=180Ω-100Ω=80Ω
(3)装置启动保护时,电路中的电流为I=0.05A不变,电路的总电阻不变,热敏电阻的阻值不变,由图乙可知,热敏电阻的阻值相同时,②热敏电阻比①热敏电阻对应的温度较低,即②热敏电阻降的温度更低,装置才能启动保护,所以,仅将Rt更换为图线②所示的热敏电阻后,装置启动保护的灵敏度会降低。
要恢复与原来相同的灵敏度,应提高②热敏电阻对应的温度,此时其对应的阻值减小,在装置启动保护时总阻值不变的情况下,应增大定值电阻R0的阻值。
【解析】(1)根据安培定则判断电磁铁的磁极方向。
(2)首先根据乙图确定80℃时热敏电阻的阻值,再根据计算出此时的总电阻,最后根据 R0=R总-Rt 计算出定值电阻的阻值。
(3)当装置启动时,通过电路的电流大小不变,即电路的总电阻不变,也就是热敏电阻的阻值不变。通过图乙比较两个热敏电阻在阻值相同时的温度高低,从而确定启动温度的变化,最终确定装置灵敏度的变化。
要恢复原来的灵敏度,即升高温度,根据图乙确定它的阻值变化,最后根据R总=R1+R0分析R0的阻值变化。
【解答】(1)由图甲可知,电流从电磁铁的上端流入、下端流出,由安培定则可知,电磁铁下端的磁极为N极,上端是S极。
【答案】(1)解:如图所示:
(2)解:如图所示:
【解析】(1)从C点看到小鸟的像与小鱼的像重合,说明从小鸟发出光线对应的反射光线和小鱼发出光线对应的折射光线是重合的,即入射点相同,只要找到这个入射点即可。利用平面镜成像的特点找到小鸟的像点,将像点与C点连接起来,与水面的交点就是入射点,最后根据将各点与此点连接即可;
(2)首先根据安培定则判断线圈上电流的方向,据此再确定电源的正负极;然后根据磁极之间的相互作用判断小磁针的N极指向。
【解答】(1)通过A点作水面的垂线,然后根据“物像等距”在这条垂线上找到它的像A'的位置。将A'点与C点连接,与水面的交点就是入射点O,最后连接AO、OC和BO即可,如下图:
(2)用右手握住螺线管,大拇指指向左端(N极),弯曲的四指指向上面,因此线圈上电流向上,那么电流从右端流入,即电源的右端是正极;根据“异名磁极相互吸引”可知,小磁针的右端是N极,如下图:
【答案】当电灯亮着时,若接触b点,此时由于导线的电阻很小或接近于零,而人体的电阻比较大,所以电流经b点后,再经导线回到负极,相当于人体发生短路,所以电灯亮着都不触电;
但电灯不亮时,开关断开,虽然火线和零线间无法构成回路,但通过接触点,电流会从灯丝、人体构成通路,造成人的触电事故。
【解析】①在电路上的两点之间,如果由若干条通路,其中一条通路上没有用电器,那么所有的电流都从这个支路通过,其它的支路将被短路;
②触电的两个条件:①接触带电体;②与大地形成通路,据此分析解答。
(1)错误
(2)乙
(3)A;B;D
【解析】(1)原子内部绝大部分都是空的,原子核体积很小质量很大,在原子的中间。电子在周围绕原子核高速旋转,据此分析解答;
(2)根据电荷之间的相互作用规律分析解答;
(3)根据自己对科学研究的认识分析判断。
【解答】(1)根据卢瑟福的核实结构可知,道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是错误的。
(2)a粒子带正电荷,原子核也带正电荷,根据"同种电荷相互排斥”可知,a粒子会受到原子核的排斥力而改变运动方向,即从上方经过的运动轨迹向上弯曲,从下方经过的运动轨迹向下弯曲。极少数a粒子正面撞向原子核,此时它们受到的排斥力最大,几乎沿原路返回,故选乙。
(3)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,故B正确;
C.波尔的原子模型建立,使人们对原子结构的认识达到了新的高度,但是距离完美还有一段距离,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
(1)42:5:40
(2)根据某元素的质量分数的计算公式,可以莽草酸中碳元素的质量分数约为:
(3)莽草酸中碳元素的质量分数约为48.3%,莽草酸为174g,所以m(C)=174gx48.3%≈84g
(4)一颗达菲药物质量为75毫克,其中莽草酸占该药物质量的80% ,则一颗达菲中莽草酸的质量为 75x80%=60毫克 =0.06克 而目前莽草酸的市场价格为3元/克,则一颗达菲中莽草酸的成本价为 0.06x3=0.18元
元素质量比等于物质中元素的相对原子质量乘以原子个数之比,根据相对分子质量等于各元素原子量之和进行计算,某元素的质量分数=计算。
【解答】(1)根据元素质量比等于元素的相对原子质量乘以原子个数之比,可推出莽草酸(分子式C7H1005)中碳、氢、氧三种元素的质量比为:(12×7):(1×10):(16×5)=42:5:40;
(2)根据某元素的质量分数的计算公式,可以莽草酸中碳元素的质量分数约为:
(3)莽草酸中碳元素的质量分数约为48.3%,莽草酸为174g,所以m(C)=174gx48.3%≈84g
(4)一颗达菲药物质量为75毫克,其中莽草酸占该药物质量的80% ,则一颗达菲中莽草酸的质量为 75x80%=60毫克 =0.06克 而目前莽草酸的市场价格为3元/克,则一颗达菲中莽草酸的成本价为 0.06x3=0.18元
(1)1:1:1
(2)+1价
(3)解:NaClO 中氯元素质量分数为: ×100%=47.7%
答:NaClO 中氯元素质量分数为47.7%
(4)解:该消毒液中氯酸钠的质量最少有:500g×5%=25g;
则该消毒液中次氯酸钠的质量最少有25g÷47.7%=52.4g
答;该消毒液中至少含有次氯酸钠的质量为52.4g。
(1)在化学式中,元素符号右下角的数字就是该种原子的个数;
(2)在化学式中,正负化合价的代数和为零,据此推算氯元素的化合价;
(3)元素的质量分数等于相对原子质量和个数的乘积与化学式的式量之比。
(4)首先用消毒液的质量×氯元素的含量计算出氯元素的质量,再用氯元素的质量÷氯元素的质量分数计算出次氯酸钠的质量。
【解答】(1)根据化学式 NaClO 可知,次氯酸钠分子中钠、氯、氧三种元素的原子个数比是:1:1:1.
(2)在化学式NaClO中,Na的化合价为+1价,O的化合价为-2价,根据正负化合价代数和为零得到:(+1)+x+(-2)=0,解得:x=+1价。
(1)有机物
(2)29:36:15
(3)m碳=312g× ×100%=174g
(1)根据含碳元素化合物为有机物分析;
(2)根据化学式右下角数字为分子中原子个数比分析;
(3)根据元素质量为物质质量×元素质量分数分析。
【解答】 (1)连翘脂素是含碳元素的化合物,属于有机物;
(2)由化学式可知, 连翘脂素中碳、氢、氧三种元素的原子个数比为29:36:15 ;
故答案为:(1)有机物;(2) 29:36:15 ;(3)174g.
(1)Fe2O3
(2)FeO
(1)在化学式中,正负化合价的代数和为零,据此推算氧化物的化学式;
(2)相对分子质量等于相对原子质量和个数的乘积之和,据此推算铁的氧化物的化学式。
【解答】(1)设铁的氧化物的化学式为FexOy,其中Fe的化合价为+3价,O的化合价为-2价,根据正负化合价的代数和为零得到:(+3)x+(-2)y=0,解得:x:y=2:3,那么铁的氧化物的化学式为Fe2O3。
(2)某铁的氧化物化学式为FexOy,那么它的相对分子质量:56x+16y=72,解得:x:y=1:1,则它的化学式为: FeO 。
(1)Mg(OH)2
(2) 氢氧化镁中镁元素的质量分数微:;
加入的镁粉的质量为:。
(1)镁与稀硫酸反应生成硫酸镁,硫酸镁再与氢氧化钠反应,生成硫酸钠和氢氧化镁沉淀;
(2)根据质量守恒定律可知,氢氧化镁中镁元素的质量就是加入镁粉的质量,用氢氧化镁的质量×镁的质量分数即可。
【解答】(1) 生成的沉淀 是Mg(OH)2;
(2)氢氧化镁中镁元素的质量分数微:;
加入的镁粉的质量为:。
(1)元素
(2)2.92g
(3)日照充足,光合作用强产生的有机物多,昼夜温差大,呼吸作用弱,消耗的有机物少,则土豆积累的有机物多
该题主要考查元素的概念及根据化学式中的元素质量分数计算物质的质量;
【解答】(1)土壤中的钾指的是钾元素;
(2) 赖氨酸(C6H14N2O2) 的相对分子质量为:
所以每100g土豆中含有的赖氨酸质量为:
(3)由信息可知,岚县的海拔高,日照充足,则土豆的光合作用强度大,能够产生更多的有机物,而且当地的昼夜温差大,则呼吸作用弱,消耗的有机物少,这样土豆中积累的有机物量大,所以岚县的土豆产量高,富含淀粉;
故答案为:(1)元素;(2)2.92g;(3) 日照充足,光合作用强产生的有机物多,昼夜温差大,呼吸作用弱,消耗的有机物少,则土豆积累的有机物多
(1)42
(2)11:40
(3)14.1克× =14.1克× =9克
(1)根据化学式可知一个分子的原子构成;(2)通过化学式中各元素的相对原子质量之比可得到该物质中的各元素质量比;(3)可根据化学式先算出碳元素的质量分数,再算出14.1克青蒿素中碳元素的质量。
(1)156
(2)48:5:80:23
【解析】【解答】(1)苹果酸钠盐的相对分子质量为:12×4+5+16×5+23=156;故答案为:156;(2)苹果酸钠盐中各元素的质量比为:(12×4):5:(16×5):23=48:5:80:23;故答案为:48:5:80:23;
根据相对分子的质量为组成分子的各原子的相对原子质量之和,化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答.
(1)NH4NO3 溶于水吸热,温度下降;NaOH 溶于水放热,温度升高;NaCl 溶于水温度无明显变化
(2)N:H:O=7:1:12
(3)解: =100kg
x≈285.7kg
(1)根据溶解时热量的变化可判断三种固体;(2)根据化学式中各元素的相对原子质量可得到各元素的质量之比;(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
第 1 页(共 1 页)
、解答题
国家规定燃气灶须安装熄火自动保护装置,在意外熄火(如汤水溢出)时,装置能自动关闭气路。图甲为小晨设计的模拟装置示意图,电源电压U=9伏,当电磁铁线圈中的电流 安时,衔铁K被释放从而关闭气路(未画出)启动保护。不计线圈电阻,热敏电阻 的阻值与温度的关系如图乙中图线①所示。闭合开关 ,问:
(1)电磁铁下端的磁极为 极。
(2)若温度降至80℃时就启动保护,电路中定值电阻R0为多大?
(3)现仅将 更换为图线②所示的热敏电阻,若燃气灶熄火后,该电阻温度下降的快慢与图线①所示的电阻相同,装置启动保护的灵敏度会 ▲ (填“增强”或“降低”)要恢复与原来相同的灵敏度,电阻R0的取值要作如何的变化?并说明理由_。
作图:
(1)平静水面上的小鸟和水中的小鱼,某时刻的实际位置如图所示,水面一侧C点的人眼恰好看到它们在水中的像重合,以小鸟眼睛A点代表小鸟,以小鱼眼睛B点代表小鱼,请画出图中小鸟在水中像的位置以及人眼看到小鸟和小鱼的光路图。(保留作图痕迹)
(2)如图乙所示,闭合开关,小磁针静止在通电螺线管正上方,根据通电螺线管的N、S极,在图中标出电源正极、电流方向和小磁针N极。
小王师傅要装一盏螺丝口灯座的电灯,并用开关控制电灯的亮熄,他知道螺丝口灯座的金属
套应该接在零线这一边的电路上,万一不小心手碰到金属螺旋套也不至于触电,小王师傅按照自己画的图把电路装完后,闭合开关,电灯亮了,他用试电笔笔尖接触灯座的两接线点a和b,接触a时试电笔氖管变亮,接触b时氖管不亮。他指着b对小华说:“这是接零线的,接触它不会触电。”小华对小王说:“王师傅你现在接触它不会触电,但是开关一旦断开或者接触不良,那就不堪设想了。”小王很诧异,心想:“电灯亮着都不触电,电灯熄了还会触电吗?”请你帮小王师傅分析一下,他的想法错在哪里。
人类对原子结构的认识,经历了道尔顿、汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是 (填“正确”或“错误”)的。
(2)卢瑟福核式结构模型是利用a粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是 (填序号)。
(3)从原子结构模型建立的过程中,我们发现 (填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
抗流感药物—“达菲”被认为是迄今为止对禽流感最有疗效的药物后,全球对达菲的市场需求膨胀,达菲的主要原料莽草酸一下子成了抢手货,价格上涨几倍。全球蔓延的H1N1甲型流感,感染早期用达菲(Oseltamivir)有显著效果。“达菲”的原料莽草酸是我国传统的香料——八角茴香的重要成分。请你根据莽草酸的化学式(C7H10O5)计算:
(1)莽草酸中碳、氢、氧元素的质量比为 ;
(2)莽草酸中碳元素的质量分数是多少;(保留一位小数);
(3)174 克莽草酸中含有多少克碳元素;
(4)目前“达菲”两颗装售价涨至30元,其中一颗“达菲”药物质量为75毫克,其中莽草酸占该药质量的80%,而目前莽草酸的市场价格为3元/克,则一颗“达菲”中莽草酸的成本价为多少元
由于受新冠疫情影响,学校每天都会对教室和公共区域道行消毒,使用的是84 消毒液,下面是84 消毒液的产品说明书。
产品品名 84 消毒液
主要原科 次氯酸钠(NaClO),有效含氯量大于等于5%
主要作用 瓜、餐具、厨房用品;白色衣物及物体表面;肝炎。病毒性感冒及肺炎患者的污染物
产品规格 500g
(1)NaClO分子中钠、氯、氧三种元素的原子个数比是 。
(2)NaClO中氯元素的化合价为 。
(3)计算 NaClO中氯元素质量分数?(写出计算过程)。
(4)该消毒液中至少含有次氯酸钠的质量?(写出计算过程)。
赤铁矿(Fe2O3)的主要成分是氧化铁.某赤铁矿含氧化铁为80%,现有该赤铁矿石200t,试计算:
(1)这些赤铁矿石中含氧化铁的质量.
(2)这些赤铁矿石中含铁元素的质量.
(3)这些赤铁矿石中含铁元素的质量,相当于多少吨含四氧化三铁为90%的磁铁矿石中含铁元素的质量.(计算结果精确到0.1t)
仅用5年时间,中国闪亮地跨入引领世界的高铁交通新时代。铺设无缝钢轨,需要用大量的钢铁,钢铁在生活中应用非常广泛。铁有多重氧化物,根据下列信息推断他们的化学式:
(1)某铁的氧化物中铁元素的化合价为+3价,则该铁的氧化物的化学式 。
(2)某铁的氧化物化学式为FexOy,相对分子质量为72,则该铁的氧化物的化学方程式为 。
向100g稀H2SO4溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示。请回答
(1)生成的沉淀是 (填化学式);
(2)加入的镁粉质量是多少
土豆是常见的农产品,我们平常的食用部分是植株的块茎。央视播出的《源味中国》,介绍我国“最好吃”的土豆产自山西省岚县。岚县的平均海拔超过1500米、昼夜温差大,且日照充足、土壤含钾高。这里种出来的土豆,不仅淀粉含量高、富含优质膳食纤维,每百克蛋白质含量是普通土豆的两倍。请回答:
(1)岚县的土壤含钾高,这里的“钾”是指 (选填“物质”、“元素”或“原子”)。
(2)已知每百克该土豆含氮元素的质量为0.56克。赖氨酸(C6H14N2O2)是土豆含有的一种蛋白质,若岚县土豆含有的蛋白质均以赖氨酸计,则每百克该土豆中含有多少克赖氨酸?
(3)请你分析岚县土豆产量高,富含淀粉的原因 。
我国科学家屠呦呦发现的青蒿素(化学式:C15H22O5),是一种用于治疗疟疾的药物,挽救了全球数百万人的生命,因而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素发现之前最热门的抗疟药物之一。回答下列问题。
(1)一个青蒿素分子中含有 个原子。
(2)青蒿素中的氢元素与氧元素的质量比是 。
(3)14.1克青蒿素中含有碳元素的质量
低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种.请回答:
(1)苹果酸钠盐的相对分子质量是 .
(2)苹果酸钠盐中各元素的质量比为C:H:O:Na= .
NH4NO3 是常用的化肥,但在化肥生产和使用中,伴随着能源耗费和环境污染等问题。利用生物固氮、雷电固氮等作用可以减少化肥的使用。请回答:
(1)能用水鉴别 NH4NO3、NaOH 和 NaCl 三种固体的原理是 。
(2)NH4NO3 中各元素的质量比是 。
(3)资料显示一公顷林地平均每年固定氮元素的质量约为 100 千克。这些氮元素如果从NH4NO3 中获得,则需要施加多少千克 NH4NO3 (精确到 0.1 千克)
期中解答题专练二答案解析
、解答题
【答案】(1)N
(2)解:若温度降至80℃时就启动保护,由题意可知,此时电路中的电流I=0.05A,由图乙可知,Rt=100Ω,电路的总电阻R总= =180Ω
因串联电路中总电阻等于各分电阻之和,所以,电路中定值电阻R0=R总-Rt=180Ω-100Ω=80Ω
(3)装置启动保护时,电路中的电流为I=0.05A不变,电路的总电阻不变,热敏电阻的阻值不变,由图乙可知,热敏电阻的阻值相同时,②热敏电阻比①热敏电阻对应的温度较低,即②热敏电阻降的温度更低,装置才能启动保护,所以,仅将Rt更换为图线②所示的热敏电阻后,装置启动保护的灵敏度会降低。
要恢复与原来相同的灵敏度,应提高②热敏电阻对应的温度,此时其对应的阻值减小,在装置启动保护时总阻值不变的情况下,应增大定值电阻R0的阻值。
【解析】(1)根据安培定则判断电磁铁的磁极方向。
(2)首先根据乙图确定80℃时热敏电阻的阻值,再根据计算出此时的总电阻,最后根据 R0=R总-Rt 计算出定值电阻的阻值。
(3)当装置启动时,通过电路的电流大小不变,即电路的总电阻不变,也就是热敏电阻的阻值不变。通过图乙比较两个热敏电阻在阻值相同时的温度高低,从而确定启动温度的变化,最终确定装置灵敏度的变化。
要恢复原来的灵敏度,即升高温度,根据图乙确定它的阻值变化,最后根据R总=R1+R0分析R0的阻值变化。
【解答】(1)由图甲可知,电流从电磁铁的上端流入、下端流出,由安培定则可知,电磁铁下端的磁极为N极,上端是S极。
【答案】(1)解:如图所示:
(2)解:如图所示:
【解析】(1)从C点看到小鸟的像与小鱼的像重合,说明从小鸟发出光线对应的反射光线和小鱼发出光线对应的折射光线是重合的,即入射点相同,只要找到这个入射点即可。利用平面镜成像的特点找到小鸟的像点,将像点与C点连接起来,与水面的交点就是入射点,最后根据将各点与此点连接即可;
(2)首先根据安培定则判断线圈上电流的方向,据此再确定电源的正负极;然后根据磁极之间的相互作用判断小磁针的N极指向。
【解答】(1)通过A点作水面的垂线,然后根据“物像等距”在这条垂线上找到它的像A'的位置。将A'点与C点连接,与水面的交点就是入射点O,最后连接AO、OC和BO即可,如下图:
(2)用右手握住螺线管,大拇指指向左端(N极),弯曲的四指指向上面,因此线圈上电流向上,那么电流从右端流入,即电源的右端是正极;根据“异名磁极相互吸引”可知,小磁针的右端是N极,如下图:
【答案】当电灯亮着时,若接触b点,此时由于导线的电阻很小或接近于零,而人体的电阻比较大,所以电流经b点后,再经导线回到负极,相当于人体发生短路,所以电灯亮着都不触电;
但电灯不亮时,开关断开,虽然火线和零线间无法构成回路,但通过接触点,电流会从灯丝、人体构成通路,造成人的触电事故。
【解析】①在电路上的两点之间,如果由若干条通路,其中一条通路上没有用电器,那么所有的电流都从这个支路通过,其它的支路将被短路;
②触电的两个条件:①接触带电体;②与大地形成通路,据此分析解答。
(1)错误
(2)乙
(3)A;B;D
【解析】(1)原子内部绝大部分都是空的,原子核体积很小质量很大,在原子的中间。电子在周围绕原子核高速旋转,据此分析解答;
(2)根据电荷之间的相互作用规律分析解答;
(3)根据自己对科学研究的认识分析判断。
【解答】(1)根据卢瑟福的核实结构可知,道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是错误的。
(2)a粒子带正电荷,原子核也带正电荷,根据"同种电荷相互排斥”可知,a粒子会受到原子核的排斥力而改变运动方向,即从上方经过的运动轨迹向上弯曲,从下方经过的运动轨迹向下弯曲。极少数a粒子正面撞向原子核,此时它们受到的排斥力最大,几乎沿原路返回,故选乙。
(3)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,故B正确;
C.波尔的原子模型建立,使人们对原子结构的认识达到了新的高度,但是距离完美还有一段距离,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
(1)42:5:40
(2)根据某元素的质量分数的计算公式,可以莽草酸中碳元素的质量分数约为:
(3)莽草酸中碳元素的质量分数约为48.3%,莽草酸为174g,所以m(C)=174gx48.3%≈84g
(4)一颗达菲药物质量为75毫克,其中莽草酸占该药物质量的80% ,则一颗达菲中莽草酸的质量为 75x80%=60毫克 =0.06克 而目前莽草酸的市场价格为3元/克,则一颗达菲中莽草酸的成本价为 0.06x3=0.18元
元素质量比等于物质中元素的相对原子质量乘以原子个数之比,根据相对分子质量等于各元素原子量之和进行计算,某元素的质量分数=计算。
【解答】(1)根据元素质量比等于元素的相对原子质量乘以原子个数之比,可推出莽草酸(分子式C7H1005)中碳、氢、氧三种元素的质量比为:(12×7):(1×10):(16×5)=42:5:40;
(2)根据某元素的质量分数的计算公式,可以莽草酸中碳元素的质量分数约为:
(3)莽草酸中碳元素的质量分数约为48.3%,莽草酸为174g,所以m(C)=174gx48.3%≈84g
(4)一颗达菲药物质量为75毫克,其中莽草酸占该药物质量的80% ,则一颗达菲中莽草酸的质量为 75x80%=60毫克 =0.06克 而目前莽草酸的市场价格为3元/克,则一颗达菲中莽草酸的成本价为 0.06x3=0.18元
(1)1:1:1
(2)+1价
(3)解:NaClO 中氯元素质量分数为: ×100%=47.7%
答:NaClO 中氯元素质量分数为47.7%
(4)解:该消毒液中氯酸钠的质量最少有:500g×5%=25g;
则该消毒液中次氯酸钠的质量最少有25g÷47.7%=52.4g
答;该消毒液中至少含有次氯酸钠的质量为52.4g。
(1)在化学式中,元素符号右下角的数字就是该种原子的个数;
(2)在化学式中,正负化合价的代数和为零,据此推算氯元素的化合价;
(3)元素的质量分数等于相对原子质量和个数的乘积与化学式的式量之比。
(4)首先用消毒液的质量×氯元素的含量计算出氯元素的质量,再用氯元素的质量÷氯元素的质量分数计算出次氯酸钠的质量。
【解答】(1)根据化学式 NaClO 可知,次氯酸钠分子中钠、氯、氧三种元素的原子个数比是:1:1:1.
(2)在化学式NaClO中,Na的化合价为+1价,O的化合价为-2价,根据正负化合价代数和为零得到:(+1)+x+(-2)=0,解得:x=+1价。
(1)有机物
(2)29:36:15
(3)m碳=312g× ×100%=174g
(1)根据含碳元素化合物为有机物分析;
(2)根据化学式右下角数字为分子中原子个数比分析;
(3)根据元素质量为物质质量×元素质量分数分析。
【解答】 (1)连翘脂素是含碳元素的化合物,属于有机物;
(2)由化学式可知, 连翘脂素中碳、氢、氧三种元素的原子个数比为29:36:15 ;
故答案为:(1)有机物;(2) 29:36:15 ;(3)174g.
(1)Fe2O3
(2)FeO
(1)在化学式中,正负化合价的代数和为零,据此推算氧化物的化学式;
(2)相对分子质量等于相对原子质量和个数的乘积之和,据此推算铁的氧化物的化学式。
【解答】(1)设铁的氧化物的化学式为FexOy,其中Fe的化合价为+3价,O的化合价为-2价,根据正负化合价的代数和为零得到:(+3)x+(-2)y=0,解得:x:y=2:3,那么铁的氧化物的化学式为Fe2O3。
(2)某铁的氧化物化学式为FexOy,那么它的相对分子质量:56x+16y=72,解得:x:y=1:1,则它的化学式为: FeO 。
(1)Mg(OH)2
(2) 氢氧化镁中镁元素的质量分数微:;
加入的镁粉的质量为:。
(1)镁与稀硫酸反应生成硫酸镁,硫酸镁再与氢氧化钠反应,生成硫酸钠和氢氧化镁沉淀;
(2)根据质量守恒定律可知,氢氧化镁中镁元素的质量就是加入镁粉的质量,用氢氧化镁的质量×镁的质量分数即可。
【解答】(1) 生成的沉淀 是Mg(OH)2;
(2)氢氧化镁中镁元素的质量分数微:;
加入的镁粉的质量为:。
(1)元素
(2)2.92g
(3)日照充足,光合作用强产生的有机物多,昼夜温差大,呼吸作用弱,消耗的有机物少,则土豆积累的有机物多
该题主要考查元素的概念及根据化学式中的元素质量分数计算物质的质量;
【解答】(1)土壤中的钾指的是钾元素;
(2) 赖氨酸(C6H14N2O2) 的相对分子质量为:
所以每100g土豆中含有的赖氨酸质量为:
(3)由信息可知,岚县的海拔高,日照充足,则土豆的光合作用强度大,能够产生更多的有机物,而且当地的昼夜温差大,则呼吸作用弱,消耗的有机物少,这样土豆中积累的有机物量大,所以岚县的土豆产量高,富含淀粉;
故答案为:(1)元素;(2)2.92g;(3) 日照充足,光合作用强产生的有机物多,昼夜温差大,呼吸作用弱,消耗的有机物少,则土豆积累的有机物多
(1)42
(2)11:40
(3)14.1克× =14.1克× =9克
(1)根据化学式可知一个分子的原子构成;(2)通过化学式中各元素的相对原子质量之比可得到该物质中的各元素质量比;(3)可根据化学式先算出碳元素的质量分数,再算出14.1克青蒿素中碳元素的质量。
(1)156
(2)48:5:80:23
【解析】【解答】(1)苹果酸钠盐的相对分子质量为:12×4+5+16×5+23=156;故答案为:156;(2)苹果酸钠盐中各元素的质量比为:(12×4):5:(16×5):23=48:5:80:23;故答案为:48:5:80:23;
根据相对分子的质量为组成分子的各原子的相对原子质量之和,化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答.
(1)NH4NO3 溶于水吸热,温度下降;NaOH 溶于水放热,温度升高;NaCl 溶于水温度无明显变化
(2)N:H:O=7:1:12
(3)解: =100kg
x≈285.7kg
(1)根据溶解时热量的变化可判断三种固体;(2)根据化学式中各元素的相对原子质量可得到各元素的质量之比;(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
第 1 页(共 1 页)
同课章节目录
