人教版(2019)高中化学必修第二册 《化学反应与能量》章末测试(含答案)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 《化学反应与能量》章末测试(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 953.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-13 08:49:42 | ||
图片预览




文档简介
第二章 化学反应与能量
一、单选题:共30题每题2分共60分
1.下列反应属于吸热反应的是( )
A.盐酸和氢氧化钠溶液混合 B.灼热的木炭与二氧化碳反应
C.锌放入稀硫酸中 D.碳不完全燃烧生成一氧化碳
2.100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
A.①③ B.②③ C.①④ D.②④
3.在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4s时测得各物质的浓度如表,则下列判断正确的是( )
A.在t3s时反应已经停止
B.t3~t4s内正、逆反应速率不相等
C.在容器中发生的反应为A+BC
D.在t2~t3s内A的平均反应速率为 mol/(L·s)
4.如图所示的装置中,金属a能从酸中置换出H2,b为碳棒,关于此装置的各种叙述中不正确的是( )
A.碳棒上有气体放出,溶液pH值变大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极到b极
D.a极上发生了氧化反应
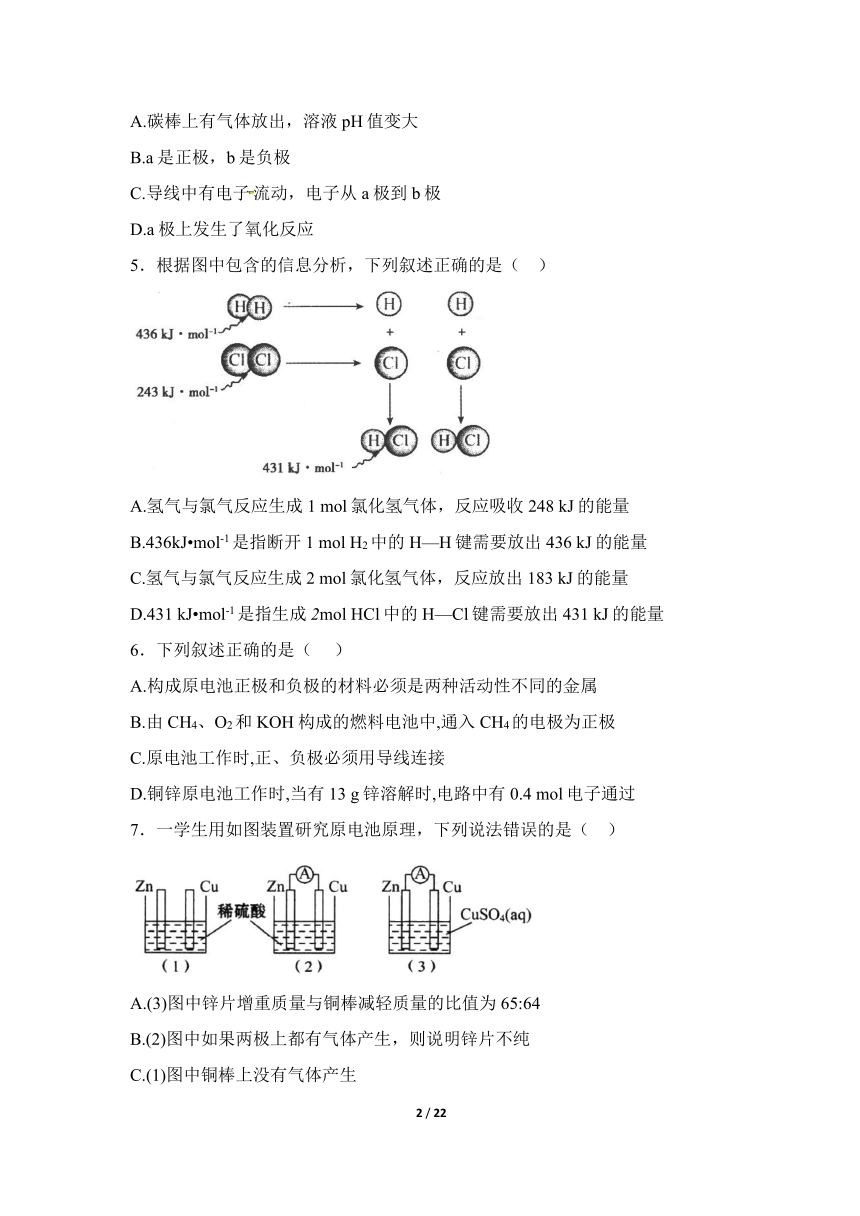
5.根据图中包含的信息分析,下列叙述正确的是( )
A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B.436kJ mol-1是指断开1 mol H2中的H—H键需要放出436 kJ的能量
C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D.431 kJ mol-1是指生成2mol HCl中的H—Cl键需要放出431 kJ的能量
6.下列叙述正确的是( )
A.构成原电池正极和负极的材料必须是两种活动性不同的金属
B.由CH4、O2和KOH构成的燃料电池中,通入CH4的电极为正极
C.原电池工作时,正、负极必须用导线连接
D.铜锌原电池工作时,当有13 g锌溶解时,电路中有0.4 mol电子通过
7.一学生用如图装置研究原电池原理,下列说法错误的是( )
A.(3)图中锌片增重质量与铜棒减轻质量的比值为65:64
B.(2)图中如果两极上都有气体产生,则说明锌片不纯
C.(1)图中铜棒上没有气体产生
D.(2)图与(3)图中正极生成物质质量比为1:32时,锌片减轻的质量相等
8.一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
锌片:2Zn-4e-+4OH-2ZnO+ 2H2O
石墨:2H2O+O2+4e-4OH-
下列说法中不正确的是( )
A.电子从石墨经外电路流向锌片,电解质溶液为酸性溶液
B.锌片是负极,石墨是正极
C.电池反应为2Zn+O22ZnO
D.该原电池工作一段时间后石墨附近溶液中的c(OH-)增大
9.在一定条件下,将3 mol A和1 mol B两种气体在容积固定的2 L密闭容器中混合,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。2 min末时生成0.8 mol D,并测得C的浓度为0.2mol L-1。下列判断不正确的是( )
A.x=l
B.2 min内A的反应速率为0.3mol L-1 min-1
C.B的转化率为40%
D.x无法求解
10.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
A.反应的化学方程式为:2MN
B.t2时,正逆反应速率相等,达到限度
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
11.对于可逆反应2SO2+ O22SO3,在混合气体中充入一定量的18O2,达到平衡以后,18O原子( )
A.只存在于O2中 B.只存在于O2和SO2中
C.只存在于O2和SO3中 D.存在于O2、SO2和SO3中
12.关于化学电源的叙述,错误的是( )
A.化学电源均是根据原电池的工作原理设计的
B.在干电池中,碳棒只起导电作用,并不参加化学反应
C.镍镉电池不能随意丢弃的主要原因是镍、镉的资源有限,价格昂贵
D.燃料电池是一种高效、环保的新型化学电源
13.NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g)2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后反应达到平衡,测得生成的H2O占混合气体总体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( )
A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.250 mol·L-1·min-1
14.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列说法正确的是( )
A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合能直接反应生成NO
C.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的能量
D.1 mol N2(g)和1 mol O2(g)反应放出的能量为179.3 kJ
15.下列关于燃料充分燃烧的说法,不正确的是( )
A.空气量越多越好 B.应通入适量的空气
C.固体燃料燃烧前最好粉碎 D.液体燃料燃烧时可以以雾状喷出
16.下列反应在恒容密闭容器中进行,aA(g)+bB(g)mC(g)+nD(g),表示其已达到平衡状态的叙述中正确的是( )
A.平衡时的压强与反应起始的压强之比为m++b
B.用物质A表示的反应速度与物质C表示的反应速度之比为
C.体系内的气体密度不再发生变化
D.单位时间内bmol B参加反应同时有a mol A生成
17.某金属能和盐酸反应生成氢气,该金属与锌构成原电池时,锌作负极,则该金属可能为 ( )
A.铝 B.铜 C.锡 D.硅
18.向某一固定体积的密闭容器中充入NO2,在一定条件下进行反应:2NO22NO+O2。达到平衡状态的标志是( )
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1
A.①② B.③④ C.①④ D.②③
19.下表是稀硫酸与某金属反应的实验数据:
实验序号 金属质量/g 金属状态 c(H2SO4)/mol L-1 V(H2SO4)/mL 溶液温度/℃ 金属消失的时间/s
反应前 反应后
1 0.10 丝 0.5 50 20 34 500
2 0.10 粉末 0.5 50 20 35 50
3 0.10 丝 0.7 50 20 36 250
4 0.10 丝 0.8 50 20 35 200
5 0.10 粉末 0.8 50 20 36 25
6 0.10 丝 1.0 50 20 35 125
7 0.10 丝 1.0 50 35 50 50
8 0.10 丝 1.1 50 20 34 100
9 0.10 丝 1.1 50 20 44 40
分析上述数据,回答下列问题:
(1)实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规律另一组实验是___________(填实验序号)。
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有_______________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有____________,其实验序号是____________。
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:_________________________________________________________。
20.在一定条件下,某密闭容器中进行反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g)。反应开始时NH3的浓度是1.0 mol/L,经过20 s后,它的浓度变成了0.2 mol/L,容器体积不变,在这20 s内H2O的化学反应速率为( )
A.0.06mol/(L·s) B.0.04 mol/(L·s) C.0.6 mol/(L·s) D.0.8 mol/(L·s)
21.根据如图所示的信息,判断下列叙述不正确的是( )
A.1 mol H2的共价键形成放出436 kJ能量
B.氢气跟氧气反应生成水的同时吸收能量
C.1 mol H2(g)跟 mol O2(g)反应生成1 mol H2O(g)释放能量245 kJ
D.1 mol H2(g)与mol O2(g)的总能量大于1 mol H2O(g)的能量
22.如图是市场上常见的两种燃料电池示意图。
下列有关电池电极a、b、c、d的叙述正确的是( )
A.电极a为正极,电极反应产物为H2O
B.电极b为正极,电极反应产物为H2O
C.电极c为正极,电极反应产物为H2O
D.电极d为正极,电极反应产物为H2O
23.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量,已知12 g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是( )
A.Q1B.石墨不如金刚石稳定
C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低
D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多
24.(2013·四川绵阳中学高一检测)将N2、H2的混合气体分别充入甲、乙、丙三个容器后,测得化学反应速率分别为甲:v(H2)=3 mol/(L·min);乙:v(N2)=2 mol/(L·min);丙:v(NH3)=1 mol/(L·min)。则三个容器中合成氨的反应速率( )
A.v(甲)>v(乙)>v(丙) B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙) D.v(乙)>v(甲)>v(丙)
25.已知断开1mol H2中的化学键需要吸收436kJ的能量,断开1mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学键要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为( )
A.吸收183kJ B.吸收366kJ C.放出183kJ D.放出366kJ
26.已知密闭容器中进行的合成氨反应:N2+ 3H22NH3,该反应为放热反应。下列判断正确的是( )
A.1 mol N2和3 mol H2的能量之和与2 mol NH3的能量相等
B.增加N2的浓度有利于提高H2的转化率
C.降低NH3的浓度,正反应速率增大、逆反应速率减小
D.当反应速率满足v(N2)∶v(H2)=1∶3时,反应达最大限度
27.如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下。在卡片上,描述合理的是( )
实验后的记录:
①Zn为正极,Cu为负极②H+向负极移动③电子流动方向,由Zn经外电路流向Cu ④Cu极上有H2产生⑤若有1 mol电子流过导线,则产生H2为0. 5 mol ⑥正极的电极反应式为Zn — 2e一Zn2+
A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
28.已知:
(1)胆矾失水的热化学方程式为CuSO4·5H2O(s)===CuSO4(s)+5H2O(l) ΔH=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为CuSO4(s)===Cu2+(aq)+S (aq) ΔH=-Q2kJ/mol
(3)胆矾(CuSO4·5H2O)溶于水时溶液温度降低。则Q1与Q2的关系是(Q1、Q2为正数) ( )
A.Q1>Q2 B.Q1=Q2 C.Q129.下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100 mL 2 mol L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
30.参照反应Br+H2 HBr+H的能量对反应历程的示意图。
下列叙述正确的是( )
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
二、综合题:共4题每题10分共40分
31.通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
(1)在酸式介质中,负极材料为 ,正极材料为 ,酸式电池的电极反应:负极: ,正极: 。电解质溶液的pH (填“变大”、“变小”或“不变”)。
(2)在碱式介质中,碱式电池的电极反应:
负极: ,正极: 。
电解质溶液的pH (填“变大”、“变小”或“不变”)。
(3)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是________。
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同
(4)纯电动车采用了高效耐用的一种新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。
①该电池放电时负极反应式为_________________。
②放电时每转移3 mol电子,正极有________ mol K2FeO4被还原。
(5)锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位,电池反应式为:Li1-xMnO4+LixLiMnO4,下列有关说法不正确的是________。
A.放电时电池的正极反应式为:Li1-xMnO4+xLi++xe-LiMnO4
B.放电过程中,石墨没有得失电子
C.该电池也能在KOH溶液的环境中正常工作
D.充电时电池上标有“-”的电极应与外接电源的负极相连
32.CH4既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0 gCH4完全燃烧生成液体水放出444.8 kJ热量。则CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH= kJ·mol-1。
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,则通入a气体的电极名称为 ,通入b气体的电极反应式为 。(质子交换膜只允许H+通过)
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在 左右。
②该反应催化剂的有效成分为偏铝酸亚铜 (CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 。
(4)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96 LCH4可处理22.4 LNOx,则x值为 。
33.在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌,如图所示。
试回答下列问题:
(1)实验中要立即用玻璃棒迅速搅拌的原因是______________________________。
(2)如果实验中没有看到“结冰”现象,可能的原因是_______________________(答出3个或3个以上原因)。
(3)如果没有看到“结冰”现象,为说明该反应吸热,我们还可以采取的方式是________________(答出两种方案)。
(4)实验中即使不“结冰”,提起烧杯的时候,发现烧杯与玻璃片也“黏在一起了”,原因是__________________。
(5)试用简单的方法说明烧杯与玻璃片之间是因为“结冰”而黏在一起的:________________。
34.(1)一定温度下,容积固定的密闭容器内发生反应A2(g)+B2(g)2AB(g),可说明该反应已达到化学平衡状态的是 。
A.容器内的总压强不随时间改变
B.容器内混合气体的密度不随时间改变
C.消耗nmol A2的同时生成2nmol AB
D.A2的消耗速率与AB的消耗速率之比为1∶2
(2)100 mL 2 mol·L-1的盐酸与过量锌片反应,为减小反应速率,又不影响生成氢气的总量,可采用的方法是 。
A.加入适量6 mol·L-1的盐酸 B.加入适量Na2CO3溶液
C.加入适量Na2SO4溶液 D.加入适量蒸馏水
(3)某化学兴趣小组为了研究反应A+BC+D(在溶液中进行的)的反应速率,他们将A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的曲线。
①在O~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是 ,生成C的量最多的是 。
②从反应速率的变化情况,可以看出该反应可能是 (填“放热”或“吸热”)反应。
参考答案
1.【答案】B
【解析】酸碱中和反应、活泼金属与酸的反应、燃烧反应等为放热反应,木炭与二氧化碳反应属于吸热反应。
2.【答案】B
【解析】本题考查影响化学反应速率的因素,意在考查考生的理解能力。题中反应为Zn+2H+Zn2++H2 ,①加入Na2CO3溶液,会消耗H+,使生成氢气的总量减少,错误;②加入水,减小氢离子的浓度,减缓反应速率,但未减少H+的数量,不影响生成氢气的量,正确;③K2SO4溶液为中性溶液,不和氢离子反应,但加入之后扩大了溶液体积,相当于稀释,减小氢离子的浓度,减缓反应,正确;④N和H+相当于硝酸,会和锌发生氧化还原反应,生成NO,减少氢气的总量,错误。故选项B正确。
3.【答案】D
【解析】由题给数据可知,t3s时可逆反应达到化学平衡状态,此时,v正=v逆≠0,A错误;t3~t4s内,A、B、C的浓度没有发生变化,反应处于化学平衡状态,正、逆反应速率相等,B错误;达到化学平衡状态时,A、B、C的浓度变化量之比为 4∶2∶2=2∶1∶1,故该反应的化学方程式为2A+BC,C错误;t2~t3s内,Δc(A)=1 mol·L-1,故用A表示的该时间段的化学反应速率为 mol/(L·s),D正确。
4.【答案】B
【解析】金属a能从酸中置换出H2说明a为负极发生了氧化反应,导线中有电子流动,电子从a极到b极,b为正极H+在正极反应产生H2,有气体放出。ACD正确B错误。
5.【答案】C
【解析】断开化学键需要吸收能量,B错误;431 kJ mol-1是指生成1 mol HCl中H—Cl键需要放出431 kJ的能量,D错误;据图中信息知生成2 mol HCl时能量变化为(436 kJ mol-1+243 kJ mol-1)—2×431 kJ mol-1= -183 kJ mol-1,故A错误。
6.【答案】D
【解析】A项,两种活动性不同的金属与电解质溶液能够构成原电池,但一种金属与可导电的非金属及电解质溶液也可构成原电池,如锌与石墨电极与电解质溶液构成原电池,错误;B项,在该燃料电池中,CH4被O2氧化而失去电子,发生氧化反应,故通入CH4的电极为负极,错误;C项,正、负极直接接触也可形成闭合回路,错误;D项,铜锌原电池工作时,锌失电子作负极,电极反应为Zn-2e-Zn2+,1 mol Zn失去2 mol 电子,则0.2 mol Zn(质量为13 g)溶解时,电路中有0.4 mol电子通过,正确。
7.【答案】A
【解析】A项,装置(3)属于原电池,Zn是负极,发生的电极反应为Zn-2e-Zn2+(质量减轻),Cu是正极,发生的电极反应为Cu2++2e-Cu(质量增加);B项,装置(2)属于原电池,如果两极上都有气体产生,则说明锌片不纯;C项,装置(1)不属于原电池,在金属Cu上没有化学反应发生;D项,装置(2)正极发生的电极反应为2H++2e-H2↑,装置(3)正极发生的电极反应为Cu2++2e-Cu,所以正极生成物质质量比为1:32时,锌片减轻的质量相等。
8.【答案】A
【解析】由电极反应可知Zn发生氧化反应,是原电池的负极,O2发生还原反应,石墨是正极;电解质溶液应为碱性溶液;随着反应的进行,石墨周围产生OH-,使OH-浓度增大;两电极反应相加得总反应式:2Zn+O22ZnO。
9.【答案】D
【解析】无
10.【答案】D
【解析】随反应的进行N每减少2mol,M增加lmol。t3时达到平衡。
11.【答案】D
【解析】可逆反应的特点是正、逆反应同时进行,18O原子在达到平衡以后会存在于O2、SO2、SO3中。
12.【答案】C
【解析】镍镉电池不能随意丢弃的主要原因是镍、镉属于重金属,会对环境造成严重的污染。
13.【答案】C
【解析】设转化的NH3的物质的量为x,则
4NH3(g)+3O2(g)2N2(g)+6H2O(g)
n(始)/mol 4 3 0 0
n(变)/mol x 0.75x 0.5x 1.5x
n(平)/mol 4-x 3-0.75x 0.5x 1.5x
根据题意,则有×100%=40%,解得x=2,v(NH3)==0.25 mol·L-1·min-1,则v(O2)=0.187 5 mol·L-1·min-1,v(N2)=0.125 mol·L-1·min-1,v(H2O)=0.375 mol·L-1·min-1。
14.【答案】C
【解析】A项,通常情况下,N2比NO稳定,错误。B项,N2(g)和O2(g)在高温或放电条件下才能反应生成NO,错误。C项,根据图示,1 mol N2(g)和1 mol O2(g)转化为2 mol NO(g)时吸收的能量为946 kJ+497.3 kJ-632 kJ×2=179.3 kJ,该反应为吸热反应,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,正确。D项,1 mol N2(g)和1 mol O2(g)反应吸收的能量为179.3 kJ,错误。
15.【答案】A
【解析】燃料燃烧时空气应适当过量,并非越多越好。
16.【答案】D
【解析】本题考查化学平衡状态的判断。A、压强之比等于反应前后的总物质的量之比,错误;B、在任意时刻A表示的反应速度与物质C表示的反应速度之比都为,不能说明到达平衡状态;C、在恒容条件下,体系内的气体密度一直不变,不能说明是否平衡;D、单位时间内bmol B参加反应同时有a mol A生成 ,说明正反应速率等于逆反应速率,达到平衡,正确,所以选D。
17.【答案】C
【解析】该金属与锌构成原电池时,锌作负极,说明其金属活动性比锌的弱,该金属能与盐酸反应生成氢气,说明在金属活动性顺序表中位于氢的前面,符合条件的为锡。
18.【答案】A
【解析】本题考查了化学平衡状态的判断。①中颜色不再变化即浓度不变,成立;②中压强不变,对于左右两边气体系数和不相等的反应是正确的,也成立;③中说的速率都是指逆反应的,不成立;④容器中c(NO2):c(NO):c(O2)=2:2:1,不能判断化学反应达到平衡状态,不成立。故答案为A。
19.【答案】(1)固体表面积;固体表面积越大;实验1和2;(2)实验1、3、4;(3)温度;实验6和7;(4)反应物的量相同,放出热量相同
【解析】本题主要考查了化学科学探究等考点的理解。影响化学反应速率的因素很多:1、固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越小,固体反应物的表面积越小,化学反应速率降低;2、反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;3、反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低。(1)观察实验4和5,金属和稀硫酸的量相同,金属的状态不同,可知固体的表面积越大反应速率越快。(2)仅表明反应物浓度对反应速率产生影响的实验,金属的状态就应该相同,或者为丝状,或者为粉末,因此答案为:1、3、4、6、8或2、5。(3)本实验中,反应温度也影响化学反应速率,如实验6和7。(4)由于反应物的量相同,放出热量相同,所以实验中,反应前后溶液的温度变化值(约15℃)相近。故答案为(1)固体表面积;固体表面积越大;实验1和2;(2)实验1、3、4;(3)温度;实验6和7;(4)反应物的量相同,放出热量相同。
20.【答案】A
【解析】本题考查化学反应速率。v(NH3)=0.8 mol/L/20s=0.04 mol/(L·s),所以H2O的化学反应速率为v(NH3)=0.06mol/(L·s),所以选A。
21.【答案】B
【解析】本题主要考查化学反应过程中能量的变化。断裂和形成1mol相同的共价键吸收和放出能量相同,A对;ΔH=436kJ/mol+249kJ/mol-930kJ/mol=-245kJ/mol<0,所以反应放热,B错;C对;反应放热,反应物能量大于生成物能量,D对;故选B。
22.【答案】C
【解析】本题考查电化学知识。两种电池的总反应均为
2H2+O22H2O,根据该反应中元素化合价的变化可知空气中的氧气发生还原反应,在原电池的正极放电,故B、D均错。考虑到两种燃料电池的电解质,电极a的电极反应式为O2+4e-2O2-,电极c的电极反应式应为O2+4H++4e-2H2O,故A错误,C正确。
23.【答案】B
【解析】石墨在一定条件下可以转化为金刚石并需要吸收能量,说明石墨的能量低,石墨比金刚石稳定,由于等质量的金刚石含有的能量比石墨高,当它们完全燃烧时所放出的热量金刚石就比石墨要多。即Q1一样多,故选B。
24.【答案】D
【解析】N2、H2合成NH3的反应:N2(g)+3H2(g)2NH3(g),将三个容器中的化学反应速率均转化为用N2表示的化学反应速率为甲:v(N2)=v(H2)=1 mol/(L·min);乙:v(N2)=2 mol/(L·min);丙:v(N2)=v(NH3)=0.5 mol/(L·min),则v(乙)>v(甲)>v(丙)。
25.【答案】C
【解析】本题主要考查了反应热的计算。H2(g)+Cl2(g)2HCl(g)的反应热=生成物的键能减去反应物的键能=436kJ mol-1+243kJ mol-1-2×431 kJ mol-1=-183kJ mol-1,故1mol氢气与1mol氯气反应时放出热量为183kJ,故选C。
26.【答案】B
【解析】合成氨的反应为放热反应,反应物的总能量大于生成物的总能量,A错误;增加N2的浓度有利于H2的转化,从而提高H2的转化率,B正确;降低NH3的浓度,正、逆反应速率都减小,C错误;无论反应是否达到最大限度,都满足:v(N2)∶v(H2)=1∶3,D错误。
27.【答案】B
【解析】在该原电池中,Zn比Cu活泼,故Zn作负极,Cu作正极,电子由Zn流出经导线流向Cu片,负极反应为Zn -2e-Zn2+,正极反应为2H++2eH2↑,故每转移1 mol电子时,产生H20.5 mol,在溶液中H+向正极移动,向负极移动,故①②⑥错误,③④⑤正确,选B。
28.【答案】A
【解析】胆矾(CuSO4·5H2O)溶于水时的过程包含1、2两个过程,即Q1-Q2,此时溶液温度降低,吸热,Q1-Q2>0,故Q1>Q2,故答案选A。
29.【答案】D
【解析】铁片在浓硫酸中钝化,不产生H2,A项错误;B项中氯化钠溶液对盐酸起稀释作用,反应速率减慢,B项错误;不管什么样的化学反应,升高温度,化学反应速率加快,C项错误;减小压强,体系的体积增大,浓度减小,反应速率减慢,D项正确。
30.【答案】C
【解析】本题考查化学反应中的能量变化和反应速率的影响因素;A、生成物的总能量高于反应物的总能量,该反应为吸热反应,故错误;B、反应热与是否加入催化剂无关,故B错误;C、从图可知反应物的总能量低于生成物的总能量,故正确;D、升高温度正反应和逆反应的速率均增大,故错误;故选C。
31.【答案】(1)石墨,石墨,H2-2e-2H+;O2+4H++4e-2H2O;变大
(2)H2-2e-+2OH-2H2O;O2+2H2O+4e-4OH-;变小
(3)C
(4)①Zn-2e-+2OH-Zn(OH)2;②1
(5)C
【解析】本题考查原电池原理。(1)氢氧燃料电池的正负极材料都是石墨;正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合生成H2O。负极上,H2失电子变为H+,H+进入电解质溶液。电池总反应为H2在O2中燃烧的反应,由于有水生成,溶液将逐渐变稀,故pH增大。(2)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O分子结合生成OH-;负极上,H2失去电子变为H+,碱性条件下H+不能大量存在,与OH-结合生成水。电池总反应也是H2在O2中的燃烧反应。同样,由于有水生成,c(OH-)变小,pH变小。(3)A、太阳能催化分解水制氢气将太阳能直接转化为化学能,节省能源,故A正确;B、氢氧燃料电池产物无污染,能有效保护环境,故B正确;C、以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式分别为:H2-2e-4H+,H2-2e-+2OH-2H2O,不相同,故C错误;D、以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同,都是氢气和氧气生成水,正确。所以选C。(4)①放电时,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-+2OH-Zn(OH)2,故答案为:Zn-2e-+2OH-Zn(OH)2;②放电时,正极上1molK2FeO4得3mol电子发生还原反应生成1molFe(OH)3,所以每转移3 mol电子,正极有1molK2FeO4被还原,(5) 原电池中正极得到电子,所以根据总反应式可知,A正确;充电相当于电解池,阳离子向阴极移动,即电池内部向负极移动;放电相当于原电池,石墨没有参与反应,只是作为电极,B正确;因为锂能和水反应,所以不能用KOH水溶液,C错误;充电时,标注有“-”的电极应与外接电源的负极相连,D正确,所以选C。
32.【答案】(1)-889.6 (2)负极,O2+ 4e-+ 4 H+2H2O
(3)①250℃ ②3CuAlO2+ 16H++ NO↑+ 3Al3++ 3Cu2++ 8H2O
(4)1.6
【解析】本题属于拼合型题目,涉及反应热计算、原电池、反应条件控制、离子方程式书写、氧化还原反应计算等,是对学生综合能力的考查。(1)1mol甲烷完全放热放出的热量为444.8kJ×889.6kJ,故△H=﹣889.6kJ/mol;
(2)由图可知,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极,通入b为氧气,获得电子,酸性条件下生成水,正极电极反应式为:O2+ 4e-+ 4H+2H2O;
(3)①250℃时乙酸反应速率最大、催化活性,故选择250℃;
②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,反应离子方程式为:3CuAlO2+16H++NO↑+3 Al3++3Cu2++8H2O;
(4)根据电子转移守恒,则8.96L×[4﹣(﹣4)]=22.4L×2x,解得x=1.6,故答案为:1.6。
33.【答案】(1)使反应物迅速混合而充分反应,使温度迅速下降
(2)①药品用量太少;②Ba(OH)2·8H2O晶体未研成粉末,反应太慢;③没有迅速搅拌;④环境温度太高;⑤玻璃片上加水太多;⑥氢氧化钡晶体失水
(3)①用皮肤感受,感觉很凉;②用温度计来检验,发现温度降低
(4)水排开了烧杯底部与玻璃片之间的空气,在大气压的作用下,烧杯与玻璃片黏在一起了
(5)看能否从侧面相对滑动,若不能,则是由于“结冰”而黏在一起的
【解析】本题是教材中实验的拓展探究,对实验成败的关键以及实验过程中可能出现的现象进行了综合分析,对跨学科知识也进行了综合考查。要想证明该反应吸热,不一定要通过“结冰”现象,还可以是“人的感觉”、“温度计”等,但是无论通过什么方式,实验成功的关键是让反应快速进行,从而在较短的时间内使体系温度得到明显的下降。
34.【答案】(1)D (2)CD (3)①t1~t2 t1~t2 ②放热
【解析】(1)由于容器的容积固定,反应前后气体体积不发生变化,所以任何时刻体系内的气体密度、压强都相同;任何时刻,消耗nmol A2的同时一定生成2nmol AB;A2的消耗速率与AB的消耗速率之比为1∶2,即说明A2的消耗速率等于其生成速率,反应达到化学平衡状态。
(2)为了减小反应速率,又不影响生成氢气的总量,采取的措施要注意:一不能增加H+的量或减少H+的量,二加入的物质不能与H+反应。可采用降低H+的浓度或者降低温度等方法,注意Na2CO3要消耗H+导致产生H2的量减少。
(3)①分析图像可知:t1~t2min时间段,C的物质的量浓度的变化值最大,因此生成C的物质的量最多,反应速率最大。
②分析图像可知:O~t1min时间段,C的浓度增加较慢,t1~t2min时间段,C的浓度增加很快;由此推知该反应为放热反应,温度升高,反应速率增大,t2min后由于A、B浓度均减小,反应速率逐渐减小。
1 / 21
一、单选题:共30题每题2分共60分
1.下列反应属于吸热反应的是( )
A.盐酸和氢氧化钠溶液混合 B.灼热的木炭与二氧化碳反应
C.锌放入稀硫酸中 D.碳不完全燃烧生成一氧化碳
2.100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
A.①③ B.②③ C.①④ D.②④
3.在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1~t4s时测得各物质的浓度如表,则下列判断正确的是( )
A.在t3s时反应已经停止
B.t3~t4s内正、逆反应速率不相等
C.在容器中发生的反应为A+BC
D.在t2~t3s内A的平均反应速率为 mol/(L·s)
4.如图所示的装置中,金属a能从酸中置换出H2,b为碳棒,关于此装置的各种叙述中不正确的是( )
A.碳棒上有气体放出,溶液pH值变大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极到b极
D.a极上发生了氧化反应
5.根据图中包含的信息分析,下列叙述正确的是( )
A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B.436kJ mol-1是指断开1 mol H2中的H—H键需要放出436 kJ的能量
C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D.431 kJ mol-1是指生成2mol HCl中的H—Cl键需要放出431 kJ的能量
6.下列叙述正确的是( )
A.构成原电池正极和负极的材料必须是两种活动性不同的金属
B.由CH4、O2和KOH构成的燃料电池中,通入CH4的电极为正极
C.原电池工作时,正、负极必须用导线连接
D.铜锌原电池工作时,当有13 g锌溶解时,电路中有0.4 mol电子通过
7.一学生用如图装置研究原电池原理,下列说法错误的是( )
A.(3)图中锌片增重质量与铜棒减轻质量的比值为65:64
B.(2)图中如果两极上都有气体产生,则说明锌片不纯
C.(1)图中铜棒上没有气体产生
D.(2)图与(3)图中正极生成物质质量比为1:32时,锌片减轻的质量相等
8.一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
锌片:2Zn-4e-+4OH-2ZnO+ 2H2O
石墨:2H2O+O2+4e-4OH-
下列说法中不正确的是( )
A.电子从石墨经外电路流向锌片,电解质溶液为酸性溶液
B.锌片是负极,石墨是正极
C.电池反应为2Zn+O22ZnO
D.该原电池工作一段时间后石墨附近溶液中的c(OH-)增大
9.在一定条件下,将3 mol A和1 mol B两种气体在容积固定的2 L密闭容器中混合,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。2 min末时生成0.8 mol D,并测得C的浓度为0.2mol L-1。下列判断不正确的是( )
A.x=l
B.2 min内A的反应速率为0.3mol L-1 min-1
C.B的转化率为40%
D.x无法求解
10.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
A.反应的化学方程式为:2MN
B.t2时,正逆反应速率相等,达到限度
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
11.对于可逆反应2SO2+ O22SO3,在混合气体中充入一定量的18O2,达到平衡以后,18O原子( )
A.只存在于O2中 B.只存在于O2和SO2中
C.只存在于O2和SO3中 D.存在于O2、SO2和SO3中
12.关于化学电源的叙述,错误的是( )
A.化学电源均是根据原电池的工作原理设计的
B.在干电池中,碳棒只起导电作用,并不参加化学反应
C.镍镉电池不能随意丢弃的主要原因是镍、镉的资源有限,价格昂贵
D.燃料电池是一种高效、环保的新型化学电源
13.NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g)2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后反应达到平衡,测得生成的H2O占混合气体总体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( )
A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.250 mol·L-1·min-1
14.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列说法正确的是( )
A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合能直接反应生成NO
C.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的能量
D.1 mol N2(g)和1 mol O2(g)反应放出的能量为179.3 kJ
15.下列关于燃料充分燃烧的说法,不正确的是( )
A.空气量越多越好 B.应通入适量的空气
C.固体燃料燃烧前最好粉碎 D.液体燃料燃烧时可以以雾状喷出
16.下列反应在恒容密闭容器中进行,aA(g)+bB(g)mC(g)+nD(g),表示其已达到平衡状态的叙述中正确的是( )
A.平衡时的压强与反应起始的压强之比为m++b
B.用物质A表示的反应速度与物质C表示的反应速度之比为
C.体系内的气体密度不再发生变化
D.单位时间内bmol B参加反应同时有a mol A生成
17.某金属能和盐酸反应生成氢气,该金属与锌构成原电池时,锌作负极,则该金属可能为 ( )
A.铝 B.铜 C.锡 D.硅
18.向某一固定体积的密闭容器中充入NO2,在一定条件下进行反应:2NO22NO+O2。达到平衡状态的标志是( )
①体系的颜色不再发生变化
②容器内压强不随时间变化而变化
③NO和O2的消耗速率之比为2:1
④容器中c(NO2):c(NO):c(O2)=2:2:1
A.①② B.③④ C.①④ D.②③
19.下表是稀硫酸与某金属反应的实验数据:
实验序号 金属质量/g 金属状态 c(H2SO4)/mol L-1 V(H2SO4)/mL 溶液温度/℃ 金属消失的时间/s
反应前 反应后
1 0.10 丝 0.5 50 20 34 500
2 0.10 粉末 0.5 50 20 35 50
3 0.10 丝 0.7 50 20 36 250
4 0.10 丝 0.8 50 20 35 200
5 0.10 粉末 0.8 50 20 36 25
6 0.10 丝 1.0 50 20 35 125
7 0.10 丝 1.0 50 35 50 50
8 0.10 丝 1.1 50 20 34 100
9 0.10 丝 1.1 50 20 44 40
分析上述数据,回答下列问题:
(1)实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规律另一组实验是___________(填实验序号)。
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有_______________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有____________,其实验序号是____________。
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:_________________________________________________________。
20.在一定条件下,某密闭容器中进行反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g)。反应开始时NH3的浓度是1.0 mol/L,经过20 s后,它的浓度变成了0.2 mol/L,容器体积不变,在这20 s内H2O的化学反应速率为( )
A.0.06mol/(L·s) B.0.04 mol/(L·s) C.0.6 mol/(L·s) D.0.8 mol/(L·s)
21.根据如图所示的信息,判断下列叙述不正确的是( )
A.1 mol H2的共价键形成放出436 kJ能量
B.氢气跟氧气反应生成水的同时吸收能量
C.1 mol H2(g)跟 mol O2(g)反应生成1 mol H2O(g)释放能量245 kJ
D.1 mol H2(g)与mol O2(g)的总能量大于1 mol H2O(g)的能量
22.如图是市场上常见的两种燃料电池示意图。
下列有关电池电极a、b、c、d的叙述正确的是( )
A.电极a为正极,电极反应产物为H2O
B.电极b为正极,电极反应产物为H2O
C.电极c为正极,电极反应产物为H2O
D.电极d为正极,电极反应产物为H2O
23.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量,已知12 g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是( )
A.Q1
C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低
D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多
24.(2013·四川绵阳中学高一检测)将N2、H2的混合气体分别充入甲、乙、丙三个容器后,测得化学反应速率分别为甲:v(H2)=3 mol/(L·min);乙:v(N2)=2 mol/(L·min);丙:v(NH3)=1 mol/(L·min)。则三个容器中合成氨的反应速率( )
A.v(甲)>v(乙)>v(丙) B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙) D.v(乙)>v(甲)>v(丙)
25.已知断开1mol H2中的化学键需要吸收436kJ的能量,断开1mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学键要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为( )
A.吸收183kJ B.吸收366kJ C.放出183kJ D.放出366kJ
26.已知密闭容器中进行的合成氨反应:N2+ 3H22NH3,该反应为放热反应。下列判断正确的是( )
A.1 mol N2和3 mol H2的能量之和与2 mol NH3的能量相等
B.增加N2的浓度有利于提高H2的转化率
C.降低NH3的浓度,正反应速率增大、逆反应速率减小
D.当反应速率满足v(N2)∶v(H2)=1∶3时,反应达最大限度
27.如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下。在卡片上,描述合理的是( )
实验后的记录:
①Zn为正极,Cu为负极②H+向负极移动③电子流动方向,由Zn经外电路流向Cu ④Cu极上有H2产生⑤若有1 mol电子流过导线,则产生H2为0. 5 mol ⑥正极的电极反应式为Zn — 2e一Zn2+
A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
28.已知:
(1)胆矾失水的热化学方程式为CuSO4·5H2O(s)===CuSO4(s)+5H2O(l) ΔH=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为CuSO4(s)===Cu2+(aq)+S (aq) ΔH=-Q2kJ/mol
(3)胆矾(CuSO4·5H2O)溶于水时溶液温度降低。则Q1与Q2的关系是(Q1、Q2为正数) ( )
A.Q1>Q2 B.Q1=Q2 C.Q1
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100 mL 2 mol L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
30.参照反应Br+H2 HBr+H的能量对反应历程的示意图。
下列叙述正确的是( )
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
二、综合题:共4题每题10分共40分
31.通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
(1)在酸式介质中,负极材料为 ,正极材料为 ,酸式电池的电极反应:负极: ,正极: 。电解质溶液的pH (填“变大”、“变小”或“不变”)。
(2)在碱式介质中,碱式电池的电极反应:
负极: ,正极: 。
电解质溶液的pH (填“变大”、“变小”或“不变”)。
(3)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是________。
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同
(4)纯电动车采用了高效耐用的一种新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。
①该电池放电时负极反应式为_________________。
②放电时每转移3 mol电子,正极有________ mol K2FeO4被还原。
(5)锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位,电池反应式为:Li1-xMnO4+LixLiMnO4,下列有关说法不正确的是________。
A.放电时电池的正极反应式为:Li1-xMnO4+xLi++xe-LiMnO4
B.放电过程中,石墨没有得失电子
C.该电池也能在KOH溶液的环境中正常工作
D.充电时电池上标有“-”的电极应与外接电源的负极相连
32.CH4既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0 gCH4完全燃烧生成液体水放出444.8 kJ热量。则CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH= kJ·mol-1。
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,则通入a气体的电极名称为 ,通入b气体的电极反应式为 。(质子交换膜只允许H+通过)
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在 左右。
②该反应催化剂的有效成分为偏铝酸亚铜 (CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 。
(4)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96 LCH4可处理22.4 LNOx,则x值为 。
33.在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌,如图所示。
试回答下列问题:
(1)实验中要立即用玻璃棒迅速搅拌的原因是______________________________。
(2)如果实验中没有看到“结冰”现象,可能的原因是_______________________(答出3个或3个以上原因)。
(3)如果没有看到“结冰”现象,为说明该反应吸热,我们还可以采取的方式是________________(答出两种方案)。
(4)实验中即使不“结冰”,提起烧杯的时候,发现烧杯与玻璃片也“黏在一起了”,原因是__________________。
(5)试用简单的方法说明烧杯与玻璃片之间是因为“结冰”而黏在一起的:________________。
34.(1)一定温度下,容积固定的密闭容器内发生反应A2(g)+B2(g)2AB(g),可说明该反应已达到化学平衡状态的是 。
A.容器内的总压强不随时间改变
B.容器内混合气体的密度不随时间改变
C.消耗nmol A2的同时生成2nmol AB
D.A2的消耗速率与AB的消耗速率之比为1∶2
(2)100 mL 2 mol·L-1的盐酸与过量锌片反应,为减小反应速率,又不影响生成氢气的总量,可采用的方法是 。
A.加入适量6 mol·L-1的盐酸 B.加入适量Na2CO3溶液
C.加入适量Na2SO4溶液 D.加入适量蒸馏水
(3)某化学兴趣小组为了研究反应A+BC+D(在溶液中进行的)的反应速率,他们将A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的曲线。
①在O~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是 ,生成C的量最多的是 。
②从反应速率的变化情况,可以看出该反应可能是 (填“放热”或“吸热”)反应。
参考答案
1.【答案】B
【解析】酸碱中和反应、活泼金属与酸的反应、燃烧反应等为放热反应,木炭与二氧化碳反应属于吸热反应。
2.【答案】B
【解析】本题考查影响化学反应速率的因素,意在考查考生的理解能力。题中反应为Zn+2H+Zn2++H2 ,①加入Na2CO3溶液,会消耗H+,使生成氢气的总量减少,错误;②加入水,减小氢离子的浓度,减缓反应速率,但未减少H+的数量,不影响生成氢气的量,正确;③K2SO4溶液为中性溶液,不和氢离子反应,但加入之后扩大了溶液体积,相当于稀释,减小氢离子的浓度,减缓反应,正确;④N和H+相当于硝酸,会和锌发生氧化还原反应,生成NO,减少氢气的总量,错误。故选项B正确。
3.【答案】D
【解析】由题给数据可知,t3s时可逆反应达到化学平衡状态,此时,v正=v逆≠0,A错误;t3~t4s内,A、B、C的浓度没有发生变化,反应处于化学平衡状态,正、逆反应速率相等,B错误;达到化学平衡状态时,A、B、C的浓度变化量之比为 4∶2∶2=2∶1∶1,故该反应的化学方程式为2A+BC,C错误;t2~t3s内,Δc(A)=1 mol·L-1,故用A表示的该时间段的化学反应速率为 mol/(L·s),D正确。
4.【答案】B
【解析】金属a能从酸中置换出H2说明a为负极发生了氧化反应,导线中有电子流动,电子从a极到b极,b为正极H+在正极反应产生H2,有气体放出。ACD正确B错误。
5.【答案】C
【解析】断开化学键需要吸收能量,B错误;431 kJ mol-1是指生成1 mol HCl中H—Cl键需要放出431 kJ的能量,D错误;据图中信息知生成2 mol HCl时能量变化为(436 kJ mol-1+243 kJ mol-1)—2×431 kJ mol-1= -183 kJ mol-1,故A错误。
6.【答案】D
【解析】A项,两种活动性不同的金属与电解质溶液能够构成原电池,但一种金属与可导电的非金属及电解质溶液也可构成原电池,如锌与石墨电极与电解质溶液构成原电池,错误;B项,在该燃料电池中,CH4被O2氧化而失去电子,发生氧化反应,故通入CH4的电极为负极,错误;C项,正、负极直接接触也可形成闭合回路,错误;D项,铜锌原电池工作时,锌失电子作负极,电极反应为Zn-2e-Zn2+,1 mol Zn失去2 mol 电子,则0.2 mol Zn(质量为13 g)溶解时,电路中有0.4 mol电子通过,正确。
7.【答案】A
【解析】A项,装置(3)属于原电池,Zn是负极,发生的电极反应为Zn-2e-Zn2+(质量减轻),Cu是正极,发生的电极反应为Cu2++2e-Cu(质量增加);B项,装置(2)属于原电池,如果两极上都有气体产生,则说明锌片不纯;C项,装置(1)不属于原电池,在金属Cu上没有化学反应发生;D项,装置(2)正极发生的电极反应为2H++2e-H2↑,装置(3)正极发生的电极反应为Cu2++2e-Cu,所以正极生成物质质量比为1:32时,锌片减轻的质量相等。
8.【答案】A
【解析】由电极反应可知Zn发生氧化反应,是原电池的负极,O2发生还原反应,石墨是正极;电解质溶液应为碱性溶液;随着反应的进行,石墨周围产生OH-,使OH-浓度增大;两电极反应相加得总反应式:2Zn+O22ZnO。
9.【答案】D
【解析】无
10.【答案】D
【解析】随反应的进行N每减少2mol,M增加lmol。t3时达到平衡。
11.【答案】D
【解析】可逆反应的特点是正、逆反应同时进行,18O原子在达到平衡以后会存在于O2、SO2、SO3中。
12.【答案】C
【解析】镍镉电池不能随意丢弃的主要原因是镍、镉属于重金属,会对环境造成严重的污染。
13.【答案】C
【解析】设转化的NH3的物质的量为x,则
4NH3(g)+3O2(g)2N2(g)+6H2O(g)
n(始)/mol 4 3 0 0
n(变)/mol x 0.75x 0.5x 1.5x
n(平)/mol 4-x 3-0.75x 0.5x 1.5x
根据题意,则有×100%=40%,解得x=2,v(NH3)==0.25 mol·L-1·min-1,则v(O2)=0.187 5 mol·L-1·min-1,v(N2)=0.125 mol·L-1·min-1,v(H2O)=0.375 mol·L-1·min-1。
14.【答案】C
【解析】A项,通常情况下,N2比NO稳定,错误。B项,N2(g)和O2(g)在高温或放电条件下才能反应生成NO,错误。C项,根据图示,1 mol N2(g)和1 mol O2(g)转化为2 mol NO(g)时吸收的能量为946 kJ+497.3 kJ-632 kJ×2=179.3 kJ,该反应为吸热反应,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,正确。D项,1 mol N2(g)和1 mol O2(g)反应吸收的能量为179.3 kJ,错误。
15.【答案】A
【解析】燃料燃烧时空气应适当过量,并非越多越好。
16.【答案】D
【解析】本题考查化学平衡状态的判断。A、压强之比等于反应前后的总物质的量之比,错误;B、在任意时刻A表示的反应速度与物质C表示的反应速度之比都为,不能说明到达平衡状态;C、在恒容条件下,体系内的气体密度一直不变,不能说明是否平衡;D、单位时间内bmol B参加反应同时有a mol A生成 ,说明正反应速率等于逆反应速率,达到平衡,正确,所以选D。
17.【答案】C
【解析】该金属与锌构成原电池时,锌作负极,说明其金属活动性比锌的弱,该金属能与盐酸反应生成氢气,说明在金属活动性顺序表中位于氢的前面,符合条件的为锡。
18.【答案】A
【解析】本题考查了化学平衡状态的判断。①中颜色不再变化即浓度不变,成立;②中压强不变,对于左右两边气体系数和不相等的反应是正确的,也成立;③中说的速率都是指逆反应的,不成立;④容器中c(NO2):c(NO):c(O2)=2:2:1,不能判断化学反应达到平衡状态,不成立。故答案为A。
19.【答案】(1)固体表面积;固体表面积越大;实验1和2;(2)实验1、3、4;(3)温度;实验6和7;(4)反应物的量相同,放出热量相同
【解析】本题主要考查了化学科学探究等考点的理解。影响化学反应速率的因素很多:1、固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越小,固体反应物的表面积越小,化学反应速率降低;2、反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;3、反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低。(1)观察实验4和5,金属和稀硫酸的量相同,金属的状态不同,可知固体的表面积越大反应速率越快。(2)仅表明反应物浓度对反应速率产生影响的实验,金属的状态就应该相同,或者为丝状,或者为粉末,因此答案为:1、3、4、6、8或2、5。(3)本实验中,反应温度也影响化学反应速率,如实验6和7。(4)由于反应物的量相同,放出热量相同,所以实验中,反应前后溶液的温度变化值(约15℃)相近。故答案为(1)固体表面积;固体表面积越大;实验1和2;(2)实验1、3、4;(3)温度;实验6和7;(4)反应物的量相同,放出热量相同。
20.【答案】A
【解析】本题考查化学反应速率。v(NH3)=0.8 mol/L/20s=0.04 mol/(L·s),所以H2O的化学反应速率为v(NH3)=0.06mol/(L·s),所以选A。
21.【答案】B
【解析】本题主要考查化学反应过程中能量的变化。断裂和形成1mol相同的共价键吸收和放出能量相同,A对;ΔH=436kJ/mol+249kJ/mol-930kJ/mol=-245kJ/mol<0,所以反应放热,B错;C对;反应放热,反应物能量大于生成物能量,D对;故选B。
22.【答案】C
【解析】本题考查电化学知识。两种电池的总反应均为
2H2+O22H2O,根据该反应中元素化合价的变化可知空气中的氧气发生还原反应,在原电池的正极放电,故B、D均错。考虑到两种燃料电池的电解质,电极a的电极反应式为O2+4e-2O2-,电极c的电极反应式应为O2+4H++4e-2H2O,故A错误,C正确。
23.【答案】B
【解析】石墨在一定条件下可以转化为金刚石并需要吸收能量,说明石墨的能量低,石墨比金刚石稳定,由于等质量的金刚石含有的能量比石墨高,当它们完全燃烧时所放出的热量金刚石就比石墨要多。即Q1
24.【答案】D
【解析】N2、H2合成NH3的反应:N2(g)+3H2(g)2NH3(g),将三个容器中的化学反应速率均转化为用N2表示的化学反应速率为甲:v(N2)=v(H2)=1 mol/(L·min);乙:v(N2)=2 mol/(L·min);丙:v(N2)=v(NH3)=0.5 mol/(L·min),则v(乙)>v(甲)>v(丙)。
25.【答案】C
【解析】本题主要考查了反应热的计算。H2(g)+Cl2(g)2HCl(g)的反应热=生成物的键能减去反应物的键能=436kJ mol-1+243kJ mol-1-2×431 kJ mol-1=-183kJ mol-1,故1mol氢气与1mol氯气反应时放出热量为183kJ,故选C。
26.【答案】B
【解析】合成氨的反应为放热反应,反应物的总能量大于生成物的总能量,A错误;增加N2的浓度有利于H2的转化,从而提高H2的转化率,B正确;降低NH3的浓度,正、逆反应速率都减小,C错误;无论反应是否达到最大限度,都满足:v(N2)∶v(H2)=1∶3,D错误。
27.【答案】B
【解析】在该原电池中,Zn比Cu活泼,故Zn作负极,Cu作正极,电子由Zn流出经导线流向Cu片,负极反应为Zn -2e-Zn2+,正极反应为2H++2eH2↑,故每转移1 mol电子时,产生H20.5 mol,在溶液中H+向正极移动,向负极移动,故①②⑥错误,③④⑤正确,选B。
28.【答案】A
【解析】胆矾(CuSO4·5H2O)溶于水时的过程包含1、2两个过程,即Q1-Q2,此时溶液温度降低,吸热,Q1-Q2>0,故Q1>Q2,故答案选A。
29.【答案】D
【解析】铁片在浓硫酸中钝化,不产生H2,A项错误;B项中氯化钠溶液对盐酸起稀释作用,反应速率减慢,B项错误;不管什么样的化学反应,升高温度,化学反应速率加快,C项错误;减小压强,体系的体积增大,浓度减小,反应速率减慢,D项正确。
30.【答案】C
【解析】本题考查化学反应中的能量变化和反应速率的影响因素;A、生成物的总能量高于反应物的总能量,该反应为吸热反应,故错误;B、反应热与是否加入催化剂无关,故B错误;C、从图可知反应物的总能量低于生成物的总能量,故正确;D、升高温度正反应和逆反应的速率均增大,故错误;故选C。
31.【答案】(1)石墨,石墨,H2-2e-2H+;O2+4H++4e-2H2O;变大
(2)H2-2e-+2OH-2H2O;O2+2H2O+4e-4OH-;变小
(3)C
(4)①Zn-2e-+2OH-Zn(OH)2;②1
(5)C
【解析】本题考查原电池原理。(1)氢氧燃料电池的正负极材料都是石墨;正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合生成H2O。负极上,H2失电子变为H+,H+进入电解质溶液。电池总反应为H2在O2中燃烧的反应,由于有水生成,溶液将逐渐变稀,故pH增大。(2)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O分子结合生成OH-;负极上,H2失去电子变为H+,碱性条件下H+不能大量存在,与OH-结合生成水。电池总反应也是H2在O2中的燃烧反应。同样,由于有水生成,c(OH-)变小,pH变小。(3)A、太阳能催化分解水制氢气将太阳能直接转化为化学能,节省能源,故A正确;B、氢氧燃料电池产物无污染,能有效保护环境,故B正确;C、以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式分别为:H2-2e-4H+,H2-2e-+2OH-2H2O,不相同,故C错误;D、以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同,都是氢气和氧气生成水,正确。所以选C。(4)①放电时,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-+2OH-Zn(OH)2,故答案为:Zn-2e-+2OH-Zn(OH)2;②放电时,正极上1molK2FeO4得3mol电子发生还原反应生成1molFe(OH)3,所以每转移3 mol电子,正极有1molK2FeO4被还原,(5) 原电池中正极得到电子,所以根据总反应式可知,A正确;充电相当于电解池,阳离子向阴极移动,即电池内部向负极移动;放电相当于原电池,石墨没有参与反应,只是作为电极,B正确;因为锂能和水反应,所以不能用KOH水溶液,C错误;充电时,标注有“-”的电极应与外接电源的负极相连,D正确,所以选C。
32.【答案】(1)-889.6 (2)负极,O2+ 4e-+ 4 H+2H2O
(3)①250℃ ②3CuAlO2+ 16H++ NO↑+ 3Al3++ 3Cu2++ 8H2O
(4)1.6
【解析】本题属于拼合型题目,涉及反应热计算、原电池、反应条件控制、离子方程式书写、氧化还原反应计算等,是对学生综合能力的考查。(1)1mol甲烷完全放热放出的热量为444.8kJ×889.6kJ,故△H=﹣889.6kJ/mol;
(2)由图可知,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极,通入b为氧气,获得电子,酸性条件下生成水,正极电极反应式为:O2+ 4e-+ 4H+2H2O;
(3)①250℃时乙酸反应速率最大、催化活性,故选择250℃;
②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,反应离子方程式为:3CuAlO2+16H++NO↑+3 Al3++3Cu2++8H2O;
(4)根据电子转移守恒,则8.96L×[4﹣(﹣4)]=22.4L×2x,解得x=1.6,故答案为:1.6。
33.【答案】(1)使反应物迅速混合而充分反应,使温度迅速下降
(2)①药品用量太少;②Ba(OH)2·8H2O晶体未研成粉末,反应太慢;③没有迅速搅拌;④环境温度太高;⑤玻璃片上加水太多;⑥氢氧化钡晶体失水
(3)①用皮肤感受,感觉很凉;②用温度计来检验,发现温度降低
(4)水排开了烧杯底部与玻璃片之间的空气,在大气压的作用下,烧杯与玻璃片黏在一起了
(5)看能否从侧面相对滑动,若不能,则是由于“结冰”而黏在一起的
【解析】本题是教材中实验的拓展探究,对实验成败的关键以及实验过程中可能出现的现象进行了综合分析,对跨学科知识也进行了综合考查。要想证明该反应吸热,不一定要通过“结冰”现象,还可以是“人的感觉”、“温度计”等,但是无论通过什么方式,实验成功的关键是让反应快速进行,从而在较短的时间内使体系温度得到明显的下降。
34.【答案】(1)D (2)CD (3)①t1~t2 t1~t2 ②放热
【解析】(1)由于容器的容积固定,反应前后气体体积不发生变化,所以任何时刻体系内的气体密度、压强都相同;任何时刻,消耗nmol A2的同时一定生成2nmol AB;A2的消耗速率与AB的消耗速率之比为1∶2,即说明A2的消耗速率等于其生成速率,反应达到化学平衡状态。
(2)为了减小反应速率,又不影响生成氢气的总量,采取的措施要注意:一不能增加H+的量或减少H+的量,二加入的物质不能与H+反应。可采用降低H+的浓度或者降低温度等方法,注意Na2CO3要消耗H+导致产生H2的量减少。
(3)①分析图像可知:t1~t2min时间段,C的物质的量浓度的变化值最大,因此生成C的物质的量最多,反应速率最大。
②分析图像可知:O~t1min时间段,C的浓度增加较慢,t1~t2min时间段,C的浓度增加很快;由此推知该反应为放热反应,温度升高,反应速率增大,t2min后由于A、B浓度均减小,反应速率逐渐减小。
1 / 21
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
