人教版(2019)高中化学必修第二册 课件《化学反应与能量》专题突破(二)(共46张PPT)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册 课件《化学反应与能量》专题突破(二)(共46张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 907.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-13 08:52:44 | ||
图片预览











文档简介
(共46张PPT)
微型专题重点突破(四)
第二章 化学反应与能量
[学习目标]
1.会进行化学反应速率的计算与比较。
2.理解外界条件对化学反应速率的影响。
3.会判断化学平衡的状态。
4.会分析化学反应速率和化学平衡图像。
[核心素养]
1.变化观念:认识反应条件对化学反应速率及限度的影响,形成化学变化是有条件的观念。
2.模型认知:根据化学反应速率及化学平衡知识规律,建立相关思维模型,并运用模型解释实际问题。
微型专题
考题精选
内容索引
微型专题
一、化学反应速率的计算与比较
例1 NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g)??2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2, 4 min后反应达到平衡,测得生成的H2O(g)占混合气体总体积的40%,则下列表示的此段时间内该反应的平均速率不正确的是
A.v(N2)=0.125 mol·L-1·min-1
B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1
D.v(NH3)=0.25 mol·L-1·min-1
答案
解析
√
解析 设转化的NH3的物质的量为x mol,则
4NH3(g)+3O2(g) ?? 2N2(g)+6H2O(g)
n(始)/mol 4 3 0 0
n(变)/mol x 0.75x 0.5x 1.5x
n(平)/mol 4-x 3-0.75x 0.5x 1.5x
则v(O2)=0.187 5 mol·L-1·min-1,v(N2)=0.125 mol·L-1·min-1,
v(H2O)=0.375 mol·L-1·min-1。
化学反应速率的计算及比较
(1)根据已知数据,找出某一时间段内指定物质的浓度的改变值,然后根据Δc和Δt的比值计算得出反应速率。
(2)已知具体反应方程式和某一物质的反应速率,根据“化学计量数之比等于对应物质的化学反应速率之比,也等于变化量之比”求解其他物质的反应速率。
(3)用不同物质表示的反应速率来判断反应进行的快慢时,不能认为其反应速率数值大,反应速率就快,一定要先转化为同一物质的反应速率再进行比较。
(4)在进行化学反应速率的计算与比较时要注意时间单位的转化。
归纳总结
变式1 在2A+3B===2C+D的反应中,表示反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1
B.v(B)=0.6 mol·L-1·min-1
C.v(C)=0.35 mol·L-1·min-1
D.v(D)=0.4 mol·L-1·min-1
答案
解析
√
解析 将用B、C、D物质表示的化学反应速率换算成用A物质表示,然后进行比较。
C项,v(A)=v(C)=0.35 mol·L-1·min-1;
D项,v(A)=2v(D)=2×0.4 mol·L-1·min-1=0.8 mol·L-1·min-1,通过数值大小比较知,D项反应速率最快。
二、控制变量法探究影响化学反应速率的因素
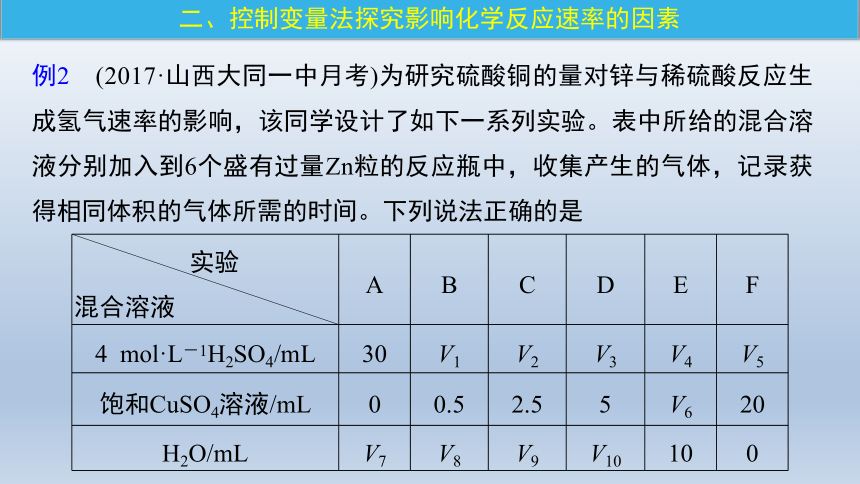
例2 (2017·山西大同一中月考)为研究硫酸铜的量对锌与稀硫酸反应生成氢气速率的影响,该同学设计了如下一系列实验。表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。下列说法正确的是
实验 混合溶液 A B C D E F
4 mol·L-1H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
A.V1=30,V6=10
B.反应一段时间后,实验A、E中的金属呈暗红色
C.加入MgSO4与Ag2SO4可以起与硫酸铜相同的加速作用
D.硫酸铜的量越多,产生氢气的速率肯定越快
答案
解析
√
解析 A项,反应的总体积应该相同。A组中硫酸为30 mL,那么其他组硫酸量也都为30 mL,因此V1=30,而硫酸铜溶液和水的总量应相同,F组中硫酸铜为20 mL,水为0 mL,那么总量为20 mL,因此V6=10,故正确;
B项,A中Zn反应较慢,反应一段时间后金属呈灰黑色,而E中置换出大量的Cu,反应一段时间后金属呈红色,故错误;
C项,硫酸镁与锌不反应,不能形成原电池,故错误;
D项,如果硫酸铜过多,生成的铜附着在锌表面,会阻碍锌与硫酸的反应,反而会降低反应速率,故错误。
(1)确定变量:解答这类题目时首先要认真审题,找出影响实验探究结果的因素。
(2)定多变一:在探究时,应先控制其他的因素不变,只改变一种因素,探究这种因素与题给问题的关系,然后按此方法依次分析其他因素与所探究问题的关系。
(3)数据有效:解答时注意选择的数据(或设置实验)要有效,且变量统一,否则无法做出正确判断。
思维模型
变式2 (2017·湖南五市十校教改共同体联考)草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
组别 10%硫酸体积/mL 温度/℃ 其他物质
Ⅰ 2 20
Ⅱ 2 20 10滴饱和MnSO4溶液
Ⅲ 2 30
Ⅳ 1 20 1 mL蒸馏水
(1)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是 ;如果研究温度对化学反应速率的影响,使用实验Ⅰ和 (用Ⅰ~Ⅳ表示)。
解析 实验Ⅰ、Ⅱ中温度、浓度相同,研究了催化剂对化学反应速率的影响;研究温度对化学反应速率的影响,应保证浓度相同,且不使用催化剂,则选实验Ⅰ和Ⅲ。
答案
解析
催化剂
Ⅲ
(2)实验Ⅳ中加入1 mL蒸馏水的目的是_____________________________
。
解析 实验Ⅰ和Ⅳ中,硫酸的浓度不同,可研究浓度对化学反应速率的影响,加1 mL蒸馏水可确保两实验中各物质浓度和总体积相等。
答案
解析
确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同
三、化学平衡状态的判断
例3 (2017·福建宁德霞浦一中月考)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)??Y(g) (乙)A(s)+2B(g)??C(g)+D(g),当下列物理量不再发生变化时,其中能表明(甲)、(乙)均达到化学平衡状态的有
①混合气体的密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比 ④混合气体的压强
⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量
A.①②③⑤ B.①③⑤⑥
C.②③⑤ D.②③④
答案
解析
√
解析 ①(甲)混合气体的密度始终不变,所以不能作为平衡状态的标志,故错误;
②反应容器中生成物的百分含量不变,说明各组分物质的量不变,达平衡状态,故正确;
③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比,说明正、逆反应速率相等,故正确;
④(乙)混合气体的压强始终不变,故错误;
⑤混合气体的平均相对分子质量不变,说明正、逆反应速率相等,故正确;
⑥(乙)混合气体的总物质的量始终不变,故错误。综上所述,C正确。
判断可逆反应达到平衡状态的标志
1.直接标志
(1)v正=v逆≠0(化学平衡的本质)
①同一种物质的生成速率等于消耗速率。
②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于相应物质的化学计量数之比。
③化学方程式两边的不同物质的生成(或消耗)速率之比等于相应物质的化学计量数之比。
归纳总结
(2)各组分的浓度保持一定(化学平衡的特征)
①各组分的浓度不随时间的改变而改变。
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
2.间接标志——“变量不变”
(1)反应体系中的总压强不随时间的改变而变化(适用于有气体参与且反应前后气体的体积不等的可逆反应)。
(2)混合气体的密度不随时间的改变而变化(适用于①恒压且反应前后气体的体积不等的可逆反应;②恒容且有固体、液体参与或生成的可逆反应)。
(3)对于反应混合物中存在有颜色物质的可逆反应,若体系的颜色不再改变,则反应达到平衡状态。
(4)体系中某反应物的转化率或某生成物的产率达到最大值且不再随时间而变化。
3.不能作为标志的条件——定量不能作为判据
(1)恒容容器中,对于全部是气体的反应体系,密度不变不能作为反应达到化学平衡状态的标志。
(2)恒容容器中,对于化学方程式两边气态物质的化学计量数之和相等的反应,压强不变不能作为反应达到化学平衡状态的标志。
(3)对于全部是气体的反应体系,若反应物和生成物的化学计量数之和相等,则气体的平均相对分子质量不变不能作为反应达到化学平衡状态的标志。
变式3 (2017·湖北恩施月考)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生NO2(g)+SO2(g)??SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
答案
解析
√
解析 A项,反应前后气体总物质的量不变,恒温恒容下,压强始终不变,故错误;
B项,混合气体颜色保持不变,说明二氧化氮的浓度不变,反应达到平衡,故正确;
C项,自反应开始,SO3和NO的体积比始终为1∶1,保持不变不能说明达到平衡,故错误;
D项,每消耗1 mol SO3的同时生成1 mol NO2,均表示逆反应速率,不能说明达到平衡,故错误。
四、化学反应速率和限度图像分析
例4 在某容积为2 L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化曲线如图所示:
下列说法正确的是
A.前2 min内,v(A)=0.2 mol·L-1·min-1
B.在2 min时,图像发生改变的原因只可能是增加压强
C.其他条件不变,4 min时体系的压强不再发生变化
D.增加气体D的浓度,A的反应速率随之降低
答案
解析
√
解析 从前2 min看,A、B、C、D改变的物质的量分别为0.4 mol、0.5 mol、0.6 mol、0.4 mol,且A、B的物质的量减少,应为反应物;C、D的物质的量增加,应为生成物。故反应方程式为4A+5B??6C+4D。
选项B,从图像看,2~3 min时的图像斜率变大,说明化学反应速率变快,增大压强、升高温度、加入催化剂等均可;
选项C,4 min时反应达到平衡状态,体系压强不再改变;
选项D,增加生成物D的浓度,A的浓度随之增大,故A的反应速率加快。
化学反应速率和反应限度图像题分析
(1)看图像
①看面,弄清楚横、纵坐标所表示的含义;
②看线,弄清楚线的走向和变化趋势;
③看点,弄清楚曲线上点的含义,特别是曲线上的折点、交点、最高点、最低点等;
④看辅助线,作横轴或纵轴的垂直线(如等温线、等压线、平衡线等);
⑤看量的变化,弄清楚是物质的量的变化、浓度的变化,还是转化率的变化。
思维模型
(2)想规律
如各物质的转化量之比与化学计量数之比的关系,各物质的化学反应速率之比与化学计量数之比的关系,外界条件的改变对化学反应速率的影响规律以及反应达到平衡时,外界条件的改变对正、逆反应速率的影响规律等。
(3)做判断
利用有关规律,结合图像,通过对比分析,做出正确判断。
变式4 在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是
A.该反应的化学方程式为A(g)+3B(g)??2C(g)
B.到达t1 s时刻该反应停止
C.(t1+10) s时,升高温度,正、逆反应速率加快
D.若该反应在绝热容器中进行,也在t1时刻达到平衡
答案
解析
√
解析 A项,从开始到t1 s,A的浓度减小了(0.8-0.2) mol·L-1=0.6 mol·L-1,B的浓度减小了(0.5-0.3) mol·L-1=0.2 mol·L-1,C的浓度增大了(0.4-0) mol·
L-1=0.4 mol·L-1,所以该反应的化学方程式为3A(g)+B(g)??2C(g),错误;
B项,在t1 s 时,反应达到平衡状态,但是反应仍在进行,错误;
C项,升高温度,正、逆反应速率均加快,正确;
D项,若该反应在绝热容器中进行,随反应的进行温度会发生变化,反应速率也会发生变化,不会在t1时刻达到平衡,错误。
考题精选
1.(2018·鞍山市期中)下列关于化学反应速率的说法中,正确的是
①用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
②增加反应物的用量,一定会增大化学反应速率
③决定化学反应速率的主要因素是反应物的浓度
④光是影响某些化学反应速率的外界条件之一
⑤使用催化剂,使反应的活化能降低,反应速率加快
⑥用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液能加快反应速率
A.①⑤⑥ B.④⑤⑥
C.②④⑥ D.③⑥
1
2
3
4
5
6
答案
解析
√
7
1
2
3
4
5
6
解析 ①常温下铁在浓硫酸中钝化,得不到氢气,错误;
②增加反应物的用量,不一定会增大化学反应速率,例如改变固体的质量,错误;
③决定化学反应速率的主要因素是反应物自身的性质,错误。
7
2.(2018·桂林市期中)在容积固定的容器中,发生反应2HI(g)??H2(g)+I2(g),下列方法中能证明已达到平衡状态的是
①混合气体的颜色不再变化 ②各组分浓度相等 ③v正(H2)=2v逆(HI) ④一个H—H键断裂的同时有两个H—I键断裂 ⑤混合气体的平均摩尔质量不再变化
A.①④ B.①②④
C.①③⑤ D.①④⑤
答案
解析
√
1
2
3
4
5
6
7
1
2
3
4
5
6
解析 ②各组分浓度相等,但相等并不是不变,不能说明反应达到平衡状态,错误;
③反应速率v正(H2)=2v逆(HI),速率之比与计量数不成比例,反应没有达到平衡状态,错误;
⑤混合气体的平均相对分子质量是混合气体的质量和混合气体的总的物质的量的比值,质量和物质的量均不变,所以混合气体的平均摩尔质量不再变化不能说明反应达到平衡状态,错误。
7
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5 min时,v正(X)=v逆(Z)
C.6 min时,容器中剩余1.4 mol Y
D.其他条件不变,将X的物质的量改为10 mol,则可得4 mol Z
3.已知反应2X(g)+Y(g)??2Z(g),某研究小组将4 mol X和2 mol Y置于一容积不变的密闭容器中,测定不同时间段内X的转化率,得到的数据如下表,下列判断正确的是
答案
解析
1
2
3
4
5
6
t/min 2 4.5 5 6
X的转化率 30% 40% 70% 70%
√
7
1
2
3
4
5
6
解析 X、Y、Z都是气体,随着反应的进行,气体总质量不变,容器体积不变,则混合气体的密度不变,A项错误;
根据表中数据可知,反应在5 min时已经达到平衡状态,平衡时正、逆反应速率相等,B项正确;
6 min时,X的转化率为70%,即反应消耗了2.8 mol X,由化学计量数的关系可知,反应消耗了1.4 mol Y,则容器中剩余0.6 mol Y,C项错误;
其他条件不变,将X的物质的量改为10 mol,当2 mol Y完全反应时可得4 mol Z,但Y不可能完全反应,所以得到的Z小于4 mol,D项错误。
7
4.(2018·贵阳期中)在一定条件下,将3 mol A和1 mol B投入容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)??xC(g)+2D(g)。2 min末测得此时容器中C和D的浓度分别为0.2 mol·L-1和0.4 mol·L-1。下列叙述正确的是
A.x=2
B.2 min时,B的浓度为0.4 mol·L-1
C.0~2 min内B的反应速率为0.2 mol·L-1·min-1
D.此时A的转化率为40%
答案
解析
√
1
2
3
4
5
6
7
1
2
3
4
5
6
解析 2 min末测得此时容器中C和D的浓度为0.2 mol·L-1和0.4 mol·L-1,根据浓度的变化量之比是相应的化学计量数之比可知x=1,A项错误;
消耗B应该是0.2 mol·L-1,则0~2 min内B的反应速率为0.2 mol·L-1
÷2 min=0.1 mol·L-1·min-1,C项错误;
7
5.(2017·沈阳校级模拟考试)工业生产硫酸的过程中,涉及SO2转化为SO3的反应,某研究小组在450 ℃时,在一容积固定的10 L密闭容器中研究该可逆反应2SO2(g)+O2(g)??2SO3(g),得出相关数据如下表:
1
2
3
4
5
6
时间/min n(SO2)/mol n(O2)/mol n(SO3)/mol
0 0.20 0.10 0
10 0.19 0.095 0.010
15 0.16 0.080 0.040
20 0.16 0.080 0.040
25 0.15 0.15 0.050
7
根据表中数据,下列判断正确的是
A.0~10 min内的平均反应速率可表示为v(SO2)=0.01 mol·L-1·min-1
B.15~20 min内正、逆反应速率不相等
C.工业上常用提高SO2的量来提高O2的转化率
D.20~25 min内各物质数值变化的原因可能是增加了O2的物质的量
1
2
3
4
5
6
答案
解析
√
7
1
2
3
4
5
6
解析 0~10 min内的平均反应速率可表示为v(SO2)=0.000 1 mol·L-1·min-1,A项错误;
15~20 min内,各物质的浓度不再发生变化,说明反应达到平衡状态,正、逆反应速率相等,B项错误;
工业上常用提高廉价的空气(O2)的量来提高SO2的转化率,C项错误;
20~25 min内,反应物O2和生成物SO3的浓度都在增加,但SO2的浓度在减小,其原因可能是增大了O2的浓度,即增加了O2的物质的量,D项正确。
7
1
2
3
4
5
6
6.(2018·湖北重点中学联考)在溶液中可进行反应A+B??C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是
A.该反应是吸热反应
B.反应速率最大的时间段是在t1~t2
C.四个时间段内生成C的量最多的是t1~t2
D.反应速率后来减慢主要是受反应物浓度变化的影响
答案
解析
√
7
1
2
3
4
5
6
解析 根据图像无法判断反应是放热反应还是吸热反应,A项错误;
斜率越大,反应速率越快,因此反应速率最大的时间段是在t1~t2,B项正确;
根据纵坐标数据可知四个时间段内生成C的量最多的是t1~t2,C项正确;
反应后阶段,反应物浓度减小,因此反应速率后来减慢主要是受反应物浓度变化的影响,D项正确。
7
7.某固定容积的2 L密闭容器中进行反应N2+3H2 2NH3。起始时加入的N2、H2、NH3均为2 mol,5 min后反应达到平衡,NH3的物质的量为3 mol,计算:
(1)这5 min内用N2来表示该反应的反应速率(请写出计算过程,下同)。
答案
答案 5 min内由NH3表示的该反应的反应速率
1
2
3
4
5
6
7
(2)求平衡时H2的物质的量浓度。
答案
1
2
3
4
5
6
7
起始/mol 2 2 2
平衡/mol 3
变化/mol Δn(H2) 3-2
平衡时n(H2)=(2-1.5) mol=0.5 mol
(3)平衡时容器的压强为初始时的多少倍?
答案
1
2
3
4
5
6
7
由(2)得Δn(N2)=0.5 mol,平衡时n(N2)=(2-0.5) mol=1.5 mol
平衡时n总2=(1.5+0.5+3) mol=5 mol
微型专题重点突破(四)
第二章 化学反应与能量
[学习目标]
1.会进行化学反应速率的计算与比较。
2.理解外界条件对化学反应速率的影响。
3.会判断化学平衡的状态。
4.会分析化学反应速率和化学平衡图像。
[核心素养]
1.变化观念:认识反应条件对化学反应速率及限度的影响,形成化学变化是有条件的观念。
2.模型认知:根据化学反应速率及化学平衡知识规律,建立相关思维模型,并运用模型解释实际问题。
微型专题
考题精选
内容索引
微型专题
一、化学反应速率的计算与比较
例1 NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g)??2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2, 4 min后反应达到平衡,测得生成的H2O(g)占混合气体总体积的40%,则下列表示的此段时间内该反应的平均速率不正确的是
A.v(N2)=0.125 mol·L-1·min-1
B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1
D.v(NH3)=0.25 mol·L-1·min-1
答案
解析
√
解析 设转化的NH3的物质的量为x mol,则
4NH3(g)+3O2(g) ?? 2N2(g)+6H2O(g)
n(始)/mol 4 3 0 0
n(变)/mol x 0.75x 0.5x 1.5x
n(平)/mol 4-x 3-0.75x 0.5x 1.5x
则v(O2)=0.187 5 mol·L-1·min-1,v(N2)=0.125 mol·L-1·min-1,
v(H2O)=0.375 mol·L-1·min-1。
化学反应速率的计算及比较
(1)根据已知数据,找出某一时间段内指定物质的浓度的改变值,然后根据Δc和Δt的比值计算得出反应速率。
(2)已知具体反应方程式和某一物质的反应速率,根据“化学计量数之比等于对应物质的化学反应速率之比,也等于变化量之比”求解其他物质的反应速率。
(3)用不同物质表示的反应速率来判断反应进行的快慢时,不能认为其反应速率数值大,反应速率就快,一定要先转化为同一物质的反应速率再进行比较。
(4)在进行化学反应速率的计算与比较时要注意时间单位的转化。
归纳总结
变式1 在2A+3B===2C+D的反应中,表示反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1
B.v(B)=0.6 mol·L-1·min-1
C.v(C)=0.35 mol·L-1·min-1
D.v(D)=0.4 mol·L-1·min-1
答案
解析
√
解析 将用B、C、D物质表示的化学反应速率换算成用A物质表示,然后进行比较。
C项,v(A)=v(C)=0.35 mol·L-1·min-1;
D项,v(A)=2v(D)=2×0.4 mol·L-1·min-1=0.8 mol·L-1·min-1,通过数值大小比较知,D项反应速率最快。
二、控制变量法探究影响化学反应速率的因素
例2 (2017·山西大同一中月考)为研究硫酸铜的量对锌与稀硫酸反应生成氢气速率的影响,该同学设计了如下一系列实验。表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。下列说法正确的是
实验 混合溶液 A B C D E F
4 mol·L-1H2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
A.V1=30,V6=10
B.反应一段时间后,实验A、E中的金属呈暗红色
C.加入MgSO4与Ag2SO4可以起与硫酸铜相同的加速作用
D.硫酸铜的量越多,产生氢气的速率肯定越快
答案
解析
√
解析 A项,反应的总体积应该相同。A组中硫酸为30 mL,那么其他组硫酸量也都为30 mL,因此V1=30,而硫酸铜溶液和水的总量应相同,F组中硫酸铜为20 mL,水为0 mL,那么总量为20 mL,因此V6=10,故正确;
B项,A中Zn反应较慢,反应一段时间后金属呈灰黑色,而E中置换出大量的Cu,反应一段时间后金属呈红色,故错误;
C项,硫酸镁与锌不反应,不能形成原电池,故错误;
D项,如果硫酸铜过多,生成的铜附着在锌表面,会阻碍锌与硫酸的反应,反而会降低反应速率,故错误。
(1)确定变量:解答这类题目时首先要认真审题,找出影响实验探究结果的因素。
(2)定多变一:在探究时,应先控制其他的因素不变,只改变一种因素,探究这种因素与题给问题的关系,然后按此方法依次分析其他因素与所探究问题的关系。
(3)数据有效:解答时注意选择的数据(或设置实验)要有效,且变量统一,否则无法做出正确判断。
思维模型
变式2 (2017·湖南五市十校教改共同体联考)草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
组别 10%硫酸体积/mL 温度/℃ 其他物质
Ⅰ 2 20
Ⅱ 2 20 10滴饱和MnSO4溶液
Ⅲ 2 30
Ⅳ 1 20 1 mL蒸馏水
(1)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是 ;如果研究温度对化学反应速率的影响,使用实验Ⅰ和 (用Ⅰ~Ⅳ表示)。
解析 实验Ⅰ、Ⅱ中温度、浓度相同,研究了催化剂对化学反应速率的影响;研究温度对化学反应速率的影响,应保证浓度相同,且不使用催化剂,则选实验Ⅰ和Ⅲ。
答案
解析
催化剂
Ⅲ
(2)实验Ⅳ中加入1 mL蒸馏水的目的是_____________________________
。
解析 实验Ⅰ和Ⅳ中,硫酸的浓度不同,可研究浓度对化学反应速率的影响,加1 mL蒸馏水可确保两实验中各物质浓度和总体积相等。
答案
解析
确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同
三、化学平衡状态的判断
例3 (2017·福建宁德霞浦一中月考)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)??Y(g) (乙)A(s)+2B(g)??C(g)+D(g),当下列物理量不再发生变化时,其中能表明(甲)、(乙)均达到化学平衡状态的有
①混合气体的密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比 ④混合气体的压强
⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量
A.①②③⑤ B.①③⑤⑥
C.②③⑤ D.②③④
答案
解析
√
解析 ①(甲)混合气体的密度始终不变,所以不能作为平衡状态的标志,故错误;
②反应容器中生成物的百分含量不变,说明各组分物质的量不变,达平衡状态,故正确;
③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比,说明正、逆反应速率相等,故正确;
④(乙)混合气体的压强始终不变,故错误;
⑤混合气体的平均相对分子质量不变,说明正、逆反应速率相等,故正确;
⑥(乙)混合气体的总物质的量始终不变,故错误。综上所述,C正确。
判断可逆反应达到平衡状态的标志
1.直接标志
(1)v正=v逆≠0(化学平衡的本质)
①同一种物质的生成速率等于消耗速率。
②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于相应物质的化学计量数之比。
③化学方程式两边的不同物质的生成(或消耗)速率之比等于相应物质的化学计量数之比。
归纳总结
(2)各组分的浓度保持一定(化学平衡的特征)
①各组分的浓度不随时间的改变而改变。
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
2.间接标志——“变量不变”
(1)反应体系中的总压强不随时间的改变而变化(适用于有气体参与且反应前后气体的体积不等的可逆反应)。
(2)混合气体的密度不随时间的改变而变化(适用于①恒压且反应前后气体的体积不等的可逆反应;②恒容且有固体、液体参与或生成的可逆反应)。
(3)对于反应混合物中存在有颜色物质的可逆反应,若体系的颜色不再改变,则反应达到平衡状态。
(4)体系中某反应物的转化率或某生成物的产率达到最大值且不再随时间而变化。
3.不能作为标志的条件——定量不能作为判据
(1)恒容容器中,对于全部是气体的反应体系,密度不变不能作为反应达到化学平衡状态的标志。
(2)恒容容器中,对于化学方程式两边气态物质的化学计量数之和相等的反应,压强不变不能作为反应达到化学平衡状态的标志。
(3)对于全部是气体的反应体系,若反应物和生成物的化学计量数之和相等,则气体的平均相对分子质量不变不能作为反应达到化学平衡状态的标志。
变式3 (2017·湖北恩施月考)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生NO2(g)+SO2(g)??SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
答案
解析
√
解析 A项,反应前后气体总物质的量不变,恒温恒容下,压强始终不变,故错误;
B项,混合气体颜色保持不变,说明二氧化氮的浓度不变,反应达到平衡,故正确;
C项,自反应开始,SO3和NO的体积比始终为1∶1,保持不变不能说明达到平衡,故错误;
D项,每消耗1 mol SO3的同时生成1 mol NO2,均表示逆反应速率,不能说明达到平衡,故错误。
四、化学反应速率和限度图像分析
例4 在某容积为2 L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化曲线如图所示:
下列说法正确的是
A.前2 min内,v(A)=0.2 mol·L-1·min-1
B.在2 min时,图像发生改变的原因只可能是增加压强
C.其他条件不变,4 min时体系的压强不再发生变化
D.增加气体D的浓度,A的反应速率随之降低
答案
解析
√
解析 从前2 min看,A、B、C、D改变的物质的量分别为0.4 mol、0.5 mol、0.6 mol、0.4 mol,且A、B的物质的量减少,应为反应物;C、D的物质的量增加,应为生成物。故反应方程式为4A+5B??6C+4D。
选项B,从图像看,2~3 min时的图像斜率变大,说明化学反应速率变快,增大压强、升高温度、加入催化剂等均可;
选项C,4 min时反应达到平衡状态,体系压强不再改变;
选项D,增加生成物D的浓度,A的浓度随之增大,故A的反应速率加快。
化学反应速率和反应限度图像题分析
(1)看图像
①看面,弄清楚横、纵坐标所表示的含义;
②看线,弄清楚线的走向和变化趋势;
③看点,弄清楚曲线上点的含义,特别是曲线上的折点、交点、最高点、最低点等;
④看辅助线,作横轴或纵轴的垂直线(如等温线、等压线、平衡线等);
⑤看量的变化,弄清楚是物质的量的变化、浓度的变化,还是转化率的变化。
思维模型
(2)想规律
如各物质的转化量之比与化学计量数之比的关系,各物质的化学反应速率之比与化学计量数之比的关系,外界条件的改变对化学反应速率的影响规律以及反应达到平衡时,外界条件的改变对正、逆反应速率的影响规律等。
(3)做判断
利用有关规律,结合图像,通过对比分析,做出正确判断。
变式4 在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是
A.该反应的化学方程式为A(g)+3B(g)??2C(g)
B.到达t1 s时刻该反应停止
C.(t1+10) s时,升高温度,正、逆反应速率加快
D.若该反应在绝热容器中进行,也在t1时刻达到平衡
答案
解析
√
解析 A项,从开始到t1 s,A的浓度减小了(0.8-0.2) mol·L-1=0.6 mol·L-1,B的浓度减小了(0.5-0.3) mol·L-1=0.2 mol·L-1,C的浓度增大了(0.4-0) mol·
L-1=0.4 mol·L-1,所以该反应的化学方程式为3A(g)+B(g)??2C(g),错误;
B项,在t1 s 时,反应达到平衡状态,但是反应仍在进行,错误;
C项,升高温度,正、逆反应速率均加快,正确;
D项,若该反应在绝热容器中进行,随反应的进行温度会发生变化,反应速率也会发生变化,不会在t1时刻达到平衡,错误。
考题精选
1.(2018·鞍山市期中)下列关于化学反应速率的说法中,正确的是
①用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
②增加反应物的用量,一定会增大化学反应速率
③决定化学反应速率的主要因素是反应物的浓度
④光是影响某些化学反应速率的外界条件之一
⑤使用催化剂,使反应的活化能降低,反应速率加快
⑥用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液能加快反应速率
A.①⑤⑥ B.④⑤⑥
C.②④⑥ D.③⑥
1
2
3
4
5
6
答案
解析
√
7
1
2
3
4
5
6
解析 ①常温下铁在浓硫酸中钝化,得不到氢气,错误;
②增加反应物的用量,不一定会增大化学反应速率,例如改变固体的质量,错误;
③决定化学反应速率的主要因素是反应物自身的性质,错误。
7
2.(2018·桂林市期中)在容积固定的容器中,发生反应2HI(g)??H2(g)+I2(g),下列方法中能证明已达到平衡状态的是
①混合气体的颜色不再变化 ②各组分浓度相等 ③v正(H2)=2v逆(HI) ④一个H—H键断裂的同时有两个H—I键断裂 ⑤混合气体的平均摩尔质量不再变化
A.①④ B.①②④
C.①③⑤ D.①④⑤
答案
解析
√
1
2
3
4
5
6
7
1
2
3
4
5
6
解析 ②各组分浓度相等,但相等并不是不变,不能说明反应达到平衡状态,错误;
③反应速率v正(H2)=2v逆(HI),速率之比与计量数不成比例,反应没有达到平衡状态,错误;
⑤混合气体的平均相对分子质量是混合气体的质量和混合气体的总的物质的量的比值,质量和物质的量均不变,所以混合气体的平均摩尔质量不再变化不能说明反应达到平衡状态,错误。
7
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5 min时,v正(X)=v逆(Z)
C.6 min时,容器中剩余1.4 mol Y
D.其他条件不变,将X的物质的量改为10 mol,则可得4 mol Z
3.已知反应2X(g)+Y(g)??2Z(g),某研究小组将4 mol X和2 mol Y置于一容积不变的密闭容器中,测定不同时间段内X的转化率,得到的数据如下表,下列判断正确的是
答案
解析
1
2
3
4
5
6
t/min 2 4.5 5 6
X的转化率 30% 40% 70% 70%
√
7
1
2
3
4
5
6
解析 X、Y、Z都是气体,随着反应的进行,气体总质量不变,容器体积不变,则混合气体的密度不变,A项错误;
根据表中数据可知,反应在5 min时已经达到平衡状态,平衡时正、逆反应速率相等,B项正确;
6 min时,X的转化率为70%,即反应消耗了2.8 mol X,由化学计量数的关系可知,反应消耗了1.4 mol Y,则容器中剩余0.6 mol Y,C项错误;
其他条件不变,将X的物质的量改为10 mol,当2 mol Y完全反应时可得4 mol Z,但Y不可能完全反应,所以得到的Z小于4 mol,D项错误。
7
4.(2018·贵阳期中)在一定条件下,将3 mol A和1 mol B投入容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)??xC(g)+2D(g)。2 min末测得此时容器中C和D的浓度分别为0.2 mol·L-1和0.4 mol·L-1。下列叙述正确的是
A.x=2
B.2 min时,B的浓度为0.4 mol·L-1
C.0~2 min内B的反应速率为0.2 mol·L-1·min-1
D.此时A的转化率为40%
答案
解析
√
1
2
3
4
5
6
7
1
2
3
4
5
6
解析 2 min末测得此时容器中C和D的浓度为0.2 mol·L-1和0.4 mol·L-1,根据浓度的变化量之比是相应的化学计量数之比可知x=1,A项错误;
消耗B应该是0.2 mol·L-1,则0~2 min内B的反应速率为0.2 mol·L-1
÷2 min=0.1 mol·L-1·min-1,C项错误;
7
5.(2017·沈阳校级模拟考试)工业生产硫酸的过程中,涉及SO2转化为SO3的反应,某研究小组在450 ℃时,在一容积固定的10 L密闭容器中研究该可逆反应2SO2(g)+O2(g)??2SO3(g),得出相关数据如下表:
1
2
3
4
5
6
时间/min n(SO2)/mol n(O2)/mol n(SO3)/mol
0 0.20 0.10 0
10 0.19 0.095 0.010
15 0.16 0.080 0.040
20 0.16 0.080 0.040
25 0.15 0.15 0.050
7
根据表中数据,下列判断正确的是
A.0~10 min内的平均反应速率可表示为v(SO2)=0.01 mol·L-1·min-1
B.15~20 min内正、逆反应速率不相等
C.工业上常用提高SO2的量来提高O2的转化率
D.20~25 min内各物质数值变化的原因可能是增加了O2的物质的量
1
2
3
4
5
6
答案
解析
√
7
1
2
3
4
5
6
解析 0~10 min内的平均反应速率可表示为v(SO2)=0.000 1 mol·L-1·min-1,A项错误;
15~20 min内,各物质的浓度不再发生变化,说明反应达到平衡状态,正、逆反应速率相等,B项错误;
工业上常用提高廉价的空气(O2)的量来提高SO2的转化率,C项错误;
20~25 min内,反应物O2和生成物SO3的浓度都在增加,但SO2的浓度在减小,其原因可能是增大了O2的浓度,即增加了O2的物质的量,D项正确。
7
1
2
3
4
5
6
6.(2018·湖北重点中学联考)在溶液中可进行反应A+B??C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是
A.该反应是吸热反应
B.反应速率最大的时间段是在t1~t2
C.四个时间段内生成C的量最多的是t1~t2
D.反应速率后来减慢主要是受反应物浓度变化的影响
答案
解析
√
7
1
2
3
4
5
6
解析 根据图像无法判断反应是放热反应还是吸热反应,A项错误;
斜率越大,反应速率越快,因此反应速率最大的时间段是在t1~t2,B项正确;
根据纵坐标数据可知四个时间段内生成C的量最多的是t1~t2,C项正确;
反应后阶段,反应物浓度减小,因此反应速率后来减慢主要是受反应物浓度变化的影响,D项正确。
7
7.某固定容积的2 L密闭容器中进行反应N2+3H2 2NH3。起始时加入的N2、H2、NH3均为2 mol,5 min后反应达到平衡,NH3的物质的量为3 mol,计算:
(1)这5 min内用N2来表示该反应的反应速率(请写出计算过程,下同)。
答案
答案 5 min内由NH3表示的该反应的反应速率
1
2
3
4
5
6
7
(2)求平衡时H2的物质的量浓度。
答案
1
2
3
4
5
6
7
起始/mol 2 2 2
平衡/mol 3
变化/mol Δn(H2) 3-2
平衡时n(H2)=(2-1.5) mol=0.5 mol
(3)平衡时容器的压强为初始时的多少倍?
答案
1
2
3
4
5
6
7
由(2)得Δn(N2)=0.5 mol,平衡时n(N2)=(2-0.5) mol=1.5 mol
平衡时n总2=(1.5+0.5+3) mol=5 mol
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
