2022-2023学年高一化学 人教版(2019)必修第二册 学案 7-3-2 乙酸 官能团与有机化合物的分类(含答案)
文档属性
| 名称 | 2022-2023学年高一化学 人教版(2019)必修第二册 学案 7-3-2 乙酸 官能团与有机化合物的分类(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 779.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-14 08:43:09 | ||
图片预览



文档简介
第二课时 乙酸 官能团与有机化合物的分类
[明确学习目标] [核心素养对接]
1.掌握乙酸的分子结构,了解乙酸的物理性质和化学性质。 2.了解酯化反应的原理和实质,认识乙酸乙酯。 3.知道根据官能团给有机物分类的方法。 1.通过对乙酸结构和性质的学习,培养学生宏观辨识与微观探析的能力。 2.通过学习乙酸与人们日常生活的关系,培养学生科学态度与社会责任。
课前篇·自主学习固基础
[知识梳理]
一、乙酸
1.组成和结构
2.物理性质
俗名 颜色 状态 气味 溶解性 挥发性
____ ____ ____ __________ ______________ ______
3.化学性质
(1)弱酸性
①乙酸在水中的电离方程式为____________________________,是一元弱酸,具有酸的通性。
②醋酸与碳酸酸性强弱的比较实验
(2)酯化反应
①概念:酸与醇反应生成________的反应。
②反应特点:酯化反应是________反应且比较________。
③乙酸与乙醇的酯化反应
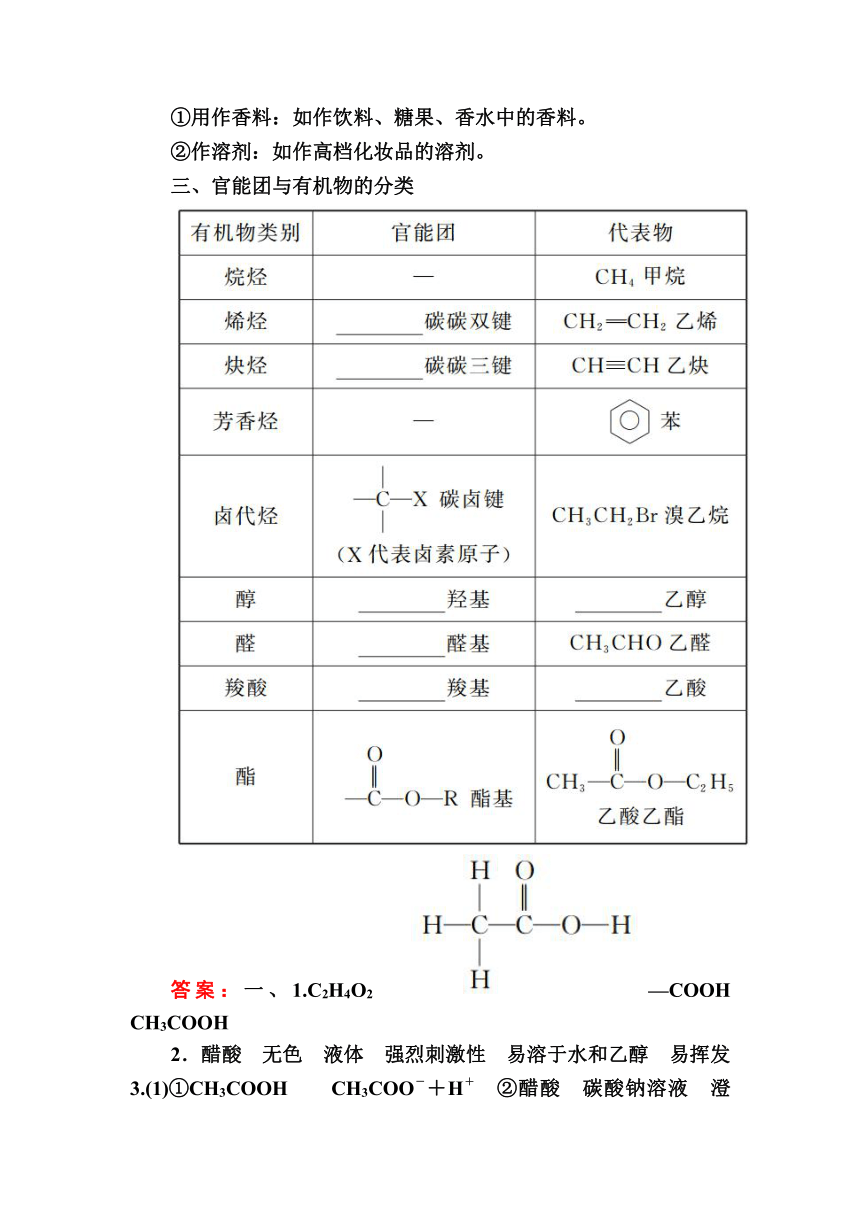
[实验7-6]
实验现象 a.饱和Na2CO3溶液的液面上有________________生成 b.能闻到________
化学方程式 ________________________________
反应机理 酸脱________、醇脱________
二、酯
(1)酯:羧酸分子羧基中的________被—OR取代后的一类有机物,乙酸乙酯是酯类物质的一种,其官能团为________( )。
(2)物理性质
低级酯密度比水________,易溶于有机溶剂,具有______气味。
(3)用途
①用作香料:如作饮料、糖果、香水中的香料。
②作溶剂:如作高档化妆品的溶剂。
三、官能团与有机物的分类
答案:一、1.C2H4O2 —COOH CH3COOH
2.醋酸 无色 液体 强烈刺激性 易溶于水和乙醇 易挥发 3.(1)①CH3COOHCH3COO-+H+ ②醋酸 碳酸钠溶液 澄清石灰水变浑浊 (2)①酯和水 ②可逆 缓慢 ③无色透明的油状液体 香味 CH3COOH+C2H5OHCH3COOC2H5+H2O 羟基 氢
二、—OH 酯基 小 芳香
[自我排查]
一、微判断
(1)乙酸分子中含4个H原子,故为四元酸( )
(2)可用紫色石蕊溶液鉴别乙醇和乙酸( )
(3)可用食醋除去水壶中的水垢(以CaCO3为主)( )
(4)制取乙酸乙酯时,适当增大乙醇的浓度,可使乙酸完全反应( )
答案:(1)× (2)√ (3)√ (4)×
二、尝试解答
1.用食醋可以清除水壶中的水垢(主要成分为CaCO3),利用这一事实能比较出醋酸与碳酸的酸性强弱吗?
__________________________
__________________________
提示:食醋除去水垢发生的化学反应方程式为2CH3COOH+CaCO3―→(CH3COO)2Ca+CO2↑+H2O。根据强酸制弱酸的原理可知醋酸的酸性强于碳酸。
2.实验室制得的乙酸乙酯中混有少量的乙酸和乙醇,并且含有少量的水。为获得较纯净的乙酸乙酯,应如何操作才能达到目的?
__________________________
__________________________
提示:将混合物加入碳酸钠饱和溶液中,振荡后静置,然后分液,便可获得较纯净的乙酸乙酯。
三、微训练
1.山西老陈醋素有“天下第一醋”的盛誉。食醋中含有乙酸,下列关于乙酸的说法中,错误的是( )
A.乙酸是具有强烈刺激性气味的无色液体,易溶于水和乙醇
B.乙酸的沸点比乙醇高
C.乙酸的酸性比碳酸的强,它是一元酸,能与碳酸盐反应
D.在发生酯化反应时,乙酸分子羧基中的氢原子与醇分子中的羟基结合生成水
答案:D
解析:酯化反应是酸脱羟基醇脱氢。
2.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离 ②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏 ③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 ④除去乙醇中少量的乙酸:加足量生石灰、蒸馏
A.①② B.②④ C.③④ D.②③
答案:B
解析:在光照条件下通入Cl2时乙烷和Cl2发生取代反应,①错;③中气体通入饱和碳酸钠溶液时CO2也和Na2CO3反应生成NaHCO3,③错。
3.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体
B.乙酸具有氧化性,能跟钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.温度低于16.6 ℃,乙酸就凝结成冰状晶体
答案:C
4.按照官能团可以给有机物进行分类,下列有机物类别划分正确的是( )
A.含有醛基,属于醛类物质
B.CH3CH2Br含有碳溴键,属于卤代烃
答案:B
5.正确书写下列几种官能团的名称:
答案:(1)碳碳双键 (2)碳溴键 (3)酯基
课堂篇·重点难点要突破
研习1 羟基中氢原子活泼性比较
[重点讲解]
乙酸、碳酸、水和乙醇中羟基氢原子的活泼性比较
(1)理论分析:乙酸、碳酸、水、乙醇的分子组成中,均含有羟基氢,它们有相似的性质,如易溶于水、能与活泼金属反应产生氢气等。但由于与羟基相连的原子或原子团的不同,它们也呈现不同的性质,其羟基氢原子的活泼性顺序为乙酸>碳酸>水>乙醇。
(2)实验验证
将4种物质分置于4支试管中,并编号①H—OH,
Ⅰ.实验过程
操作 现象 结论(—OH中氢原子活泼性顺序)
四种物质各取少量于试管中,各加入紫色石蕊溶液两滴 ③④变红,其他不变红 ③④>①②
在③④试管中,各加入少量碳酸钠溶液 ④中产生气体 ④>③
在①②中各加入少量金属钠 ①产生气体,反应迅速,②也产生气体,反应缓慢 ①>②
Ⅱ.实验结论
羟基氢的活泼性:乙醇<水<碳酸<乙酸。
[探究活动]
[实验]'探究乙酸的酸性
实验操作
实验现象 紫色石蕊 溶液变红 锌粒溶解, 有气泡产生 溶液红 色褪去 固体溶解, 有气泡产生
[问题探讨]
1.上述四个实验体现了乙酸的什么性质?用食醋浸泡有水垢(主要成分CaCO3)的水壶,可清除其中的水垢,写出反应的化学方程式。
提示:乙酸具有酸的通性;CaCO3+2CH3COOH―→(CH3COO)2Ca+H2O+CO2↑。
2.能否用NaHCO3溶液鉴别乙酸和乙醇?若能,写出反应的化学方程式。
提示:能;乙酸能与NaHCO3溶液反应产生CO2气体,乙醇与NaHCO3溶液不反应;NaHCO3+CH3COOH―→CH3COONa+H2O+CO2↑。
3.如何设计实验比较乙酸和碳酸的酸性强弱?
提示:利用酸性相对强的酸制取酸性相对弱的酸的原理,将乙酸滴入NaHCO3溶液中,然后将产生的气体通入饱和NaHCO3溶液中除去乙酸蒸气,最后将气体通入澄清石灰水,若石灰水变浑浊,则证明酸性:CH3COOH>H2CO3。实验装置如下图所示:
4.乙酸与乙醇的官能团相同吗?
提示:不相同;乙酸的官能团是羧基(—COOH),乙醇的官能团是羟基(—OH)。
[举一反三]
1.下列说法不正确的是( )
A.乙醇、乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
B.乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸
C.乙酸和乙醇生成乙酸乙酯的反应属于酸碱中和反应
D.乙酸分子中虽然有4个氢原子,但乙酸是一元酸
答案:C
2.在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的该有机物和足量的NaHCO3反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是( )
答案:A
解析:钠既能与羟基反应,又能与羧基反应,且2—OH~H2或2—COOH~H2,NaHCO3可与羧基反应,且—COOH~CO2;由题意知该有机物中既有羧基又有羟基,且羧基和羟基个数相等,故选A。
[规律方法]
—OH、—COOH在有气体生成的反应中的定量关系
(1)能与金属钠反应的有机物含有—OH或—COOH,反应关系为2Na~2—OH~H2或2Na~2—COOH~H2。
(2)Na2CO3、NaHCO3只能和—COOH反应产生CO2,物质的量的关系为Na2CO3~2—COOH~CO2,NaHCO3~—COOH~CO2。
研习2 酯化反应
[重点讲解]
1.酯
(2)物理性质
低级酯(如乙酸乙酯)密度比水小,不溶于水,易溶于有机溶剂,具有芳香气味。
(3)酯化反应与酯(以CH3COOC2H5为例)的水解反应的比较
酯化反应 酯的水解反应
反应关系 CH3COOH+C2H5OHCH3COOC2H5+H2O
催化剂 浓硫酸 稀硫酸或NaOH溶液
催化剂的 其他作用 吸水,提高CH3COOH和C2H5OH的转化率 NaOH能中和酯水解生成的CH3COOH,提高酯的水解率
加热方式 直接加热或水浴加热 水浴加热
反应类型 取代反应
(4)用途
①用作香料,如作饮料、香水等中的香料。
②用作溶剂,如作指甲油、胶水的溶剂。
2.酯化反应实验
(1)实验装置
(2)导气管末端未伸入液面以下的目的是为了防止倒吸。
(3)饱和Na2CO3溶液的作用
①与挥发出来的乙酸发生反应,生成可溶于水的乙酸钠。
②溶解挥发出来的乙醇。
③减小乙酸乙酯在水中的溶解度,使液体分层,便于得到酯。
(4)酯化反应实验中的四个注意问题
①注意防暴沸:反应试管中常加入几片碎瓷片或沸石防暴沸。
②注意浓硫酸的作用:催化剂、吸水剂。
③注意试剂的添加顺序:不能先加浓硫酸,以防止液体飞溅;通常的顺序是乙醇→浓硫酸→乙酸。
④注意酯的分离:对于生成的酯,通常用分液漏斗进行分液,将酯和饱和碳酸钠溶液分离。
(5)实验原理
①化学方程式
②反应实质:酸脱去羟基,醇脱去氢原子。
[探究活动]
[实验] 探究酯化反应
实验 装置
实验 步骤 在试管中先加入无水乙醇,然后慢慢加入浓硫酸和乙酸,再加入2~3块碎瓷片,连接实验装置;用酒精灯小心均匀地加热试管,将产生的气体经导管通到饱和Na2CO3溶液的液面上
实验 现象 ①饱和Na2CO3溶液液面上有透明油状液体生成; ②能闻到香味
[问题探讨]
1.实验过程中乙酸、乙醇、浓H2SO4在试管中的加入顺序是什么?加入碎瓷片的作用是什么?
提示:在试管中先加入乙醇,然后边振荡边慢慢加入浓硫酸和乙酸。碎瓷片的作用是防止暴沸。
2.反应中浓硫酸的作用是什么?饱和Na2CO3溶液的作用又是什么?
提示:浓H2SO4的作用是作催化剂和吸水剂;饱和Na2CO3溶液的作用是溶解乙醇,乙酸,便于闻酯的香味,降低乙酸乙酯的溶解度,减少乙酸乙酯的损失。
3.实验中为什么加热温度不能过高?如何对实验进行改进?(已知:乙酸乙酯的沸点为77 ℃)
提示:尽量减少反应物(乙酸、乙醇)的挥发,提高乙酸和乙醇的转化率及产品的纯度。对实验改进的方法是水浴加热。
4.试管b中的导管能否伸入到液面以下?为什么?实验结束后,如何从试管b中的液体中分离出乙酸乙酯?
提示:不能;原因是防止倒吸;将反应后的液体转移至分液漏斗中,用力振荡,待液体分层后,分离出上层液体即得乙酸乙酯。
[举一反三]
1.将0.5 mol乙醇(其中的氧用18O标记)在浓硫酸存在下与足量乙酸充分反应。下列叙述不正确的是( )
A.生成的乙酸乙酯中含有18O
B.生成的水分子中含有18O
C.可能生成44 g乙酸乙酯
D.不可能生成45 g乙酸乙酯
答案:B
解析:反应产物为CH3CO18OC2H5和H2O,且由于该反应为可逆反应,生成的乙酸乙酯小于0.5 mol,即CH3CO18OC2H5的质量小于45 g。
2.酯类物质广泛存在于香蕉、梨等水果中。某实验小组从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种化学式为C6H13OH的物质。以下说法中不正确的是( )
A.乙酸易溶于水
B.C6H13OH可与金属钠反应
C.实验小组分离出的酯可表示为C5H11COOC2H5
D.C6H13OH分子中含有羟基,乙酸分子中含有羧基
答案:C
解析:A.羧基属于亲水基团,因此乙酸易溶于水,故A正确;B.钠可以置换醇中羟基上的氢,故C6H13OH可与金属钠发生反应,故B正确;C.酯能在酸性条件下水解生成相应的酸和醇,可知用乙酸与C6H13OH脱去一分子的水即可得到酯CH3COOC6H13,故C错误;D.C6H13OH是醇,分子中含有羟基,乙酸是羧酸,分子中含有羧基,故D正确。
3.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的] 制取乙酸乙酯
[实验原理] 甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
(装置设计) 甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是__________________________。
[实验步骤]
(1)按丙同学设计的装置组装仪器,在试管中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸,再加上几片碎瓷片;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
[问题讨论]
a.步骤(1)安装好实验装置,加入样品前还应检查________;
b.写出试管①发生反应的化学方程式(注明反应条件)__________________________
__________________________;
c.试管②中饱和Na2CO3溶液的作用是__________________________;
________(填“能”或“不能”)换成NaOH溶液,原因__________________________
__________________________;
d.从试管②中分离出乙酸乙酯的实验操作是________。
答案:乙 能防止倒吸 (5)a.装置的气密性 b.CH3COOH+C2H5OHCH3COOC2H5+H2O
c.吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度,使其分层析出 不能 若用NaOH溶液,则NaOH会使生成的乙酸乙酯又彻底水解,导致实验失败 d.分液
解析:作为实验室制取乙酸乙酯的装置,导管与液面要有空隙,防止液体倒吸,故较合理的是乙。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是能防止倒吸。a.步骤(1)安装好实验装置,实验前即加入样品前,还应检查装置的气密性;b.试管①发生乙酸和乙醇的取代反应,反应可逆,化学方程式为CH3COOH+C2H5OHCH3COOC2H5+H2O;c.试管②中饱和Na2CO3溶液的作用是吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度,使其分层析出;不能换成NaOH溶液,因为若用NaOH溶液,会使生成的乙酸乙酯又彻底水解,导致实验失败;d.乙酸乙酯不溶于水,从试管②中分离出乙酸乙酯的实验操作是分液。
[规律方法]
酯化反应的理解
(1)酯化反应中,醇脱羟基上的H原子,羧酸脱—OH,含有1个—OH的醇的相对分子质量+含有1个—COOH的羧酸的相对分子质量=酯的相对分子质量+18。
(2)有多个—OH或多个—COOH存在的有机物若完全酯化时,需要的—COOH或—OH也对应增加。
演习篇·学业测试速达标
1.制取乙酸乙酯的装置正确的是( )
答案:A
解析:玻璃导管不能插入到饱和Na2CO3溶液液面以下,以防止倒吸;不能用NaOH溶液,应用饱和Na2CO3溶液。
2.(双选)实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊溶液1 mL,发现紫色石蕊溶液存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡试管)。下列有关该实验的描述中,不正确的是( )
A.制备的乙酸乙酯中混有乙酸和乙醇杂质
B.该实验中浓硫酸的作用是催化剂和脱水剂
C.饱和碳酸钠溶液的主要作用是降低乙酸乙酯的溶解度、吸收乙醇、中和乙酸
D.石蕊溶液层由上而下颜色分别是蓝、紫、红
答案:BD
解析:A正确,在乙酸乙酯挥发过程中,乙酸、乙醇也挥发;B错误,浓硫酸起催化剂和吸水剂的作用;C正确,饱和碳酸钠溶液的作用是吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度,有利于液体分层分离;D错误,由于乙酸乙酯密度小于水,溶液层由上到下为乙酸乙酯、石蕊、饱和碳酸钠溶液,乙酸乙酯中有乙酸使石蕊变红,碳酸钠水解显碱性使紫色石蕊溶液变蓝,从上到下颜色为红、紫、蓝。
3.下列有关酯的说法正确的是( )
A.酯是羧酸分子羧基中的—OH被—OR′取代后的产物,简写为RCOOR′
B.酯类物质广泛存在于自然界中,都是具有芳香气味的液体
C.酯类物质难溶于水,也难溶于有机溶剂
D.酯类物质属于化学产品,饮料、糖果和糕点中不能使用酯类香料
答案:A
解析:A.酯是羧酸分子羧基中的—OH被—OR′取代后的产物,可简写为RCOOR′,其中R和R′(不为H)可以相同,也可以不同,故A正确;B.低级酯(分子中含碳原子数少的酯)是具有芳香气味的液体。高级酯(分子中含碳原子数较多的酯)在通常状况下一般是固体,不一定具有芳香气味,故B错误,C.酯类物质都难溶于水而易溶于醇、乙醚等有机溶剂,故C错误;D.日常生活中的饮料、糖果和糕点等常使用酯类香料,故D错误。
4.山梨酸(结构简式如图所示)是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂,广泛应用于食品、饮料、烟草、农药、化妆品等行业。下列有关山梨酸的说法正确的是( )
A.分子式为C7H8O2
B.只能发生加成反应,不能发生取代反应
C.能使溴的四氯化碳溶液褪色,但不能使酸性高锰酸钾溶液褪色
D.其水溶液既能与碳酸钠反应,又能与钠反应
答案:D
解析:A项,根据山梨酸的结构简式可知其分子式为C6H8O2,错误;B项,甲基、羧基均能发生取代反应,错误;C项,碳碳双键既能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色,错误;D项,羧基能电离出氢离子,与碳酸钠、钠均能反应,正确。
5.乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸作原料分别制备乙酸乙酯(沸点77.2 ℃)。下列有关说法不正确的是( )
A.浓硫酸能加快酯化反应速率
B.不断蒸出酯,会降低其产率
C.装置b比装置a原料损失的少
D.可用分液的方法分离出乙酸乙酯
答案:B
解析:乙酸与乙醇在浓硫酸作用下加热发生酯化反应,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯的方向移动,故浓硫酸作催化剂、吸水剂,所以浓硫酸能加快酯化反应速率,A项正确;制备乙酸乙酯的反应为可逆反应,不断蒸出酯,有利于反应正向进行,会提高其产率,B项错误;乙醇、乙酸均易挥发,甲装置采取直接加热的方法,温度升高快,温度不易控制,装置b采用水浴加热的方法,受热均匀,相对于装置a原料损失的少,C项正确;分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液将挥发出来的乙酸转化为乙酸钠溶于水中,并溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,静置分层后分液即可得到乙酸乙酯,D项正确。
6.(双选)“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料。甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料。下列说法不正确的是( )
A.甲物质在一定条件下可以生成有机高分子化合物
B.1 mol乙物质可与2 mol钠完全反应生成2 mol氢气
C.甲、乙、丙物质都能够使溴的四氯化碳溶液褪色
D.丙可以使酸性高锰酸钾溶液褪色
答案:BC
解析:A.甲物质含有碳碳双键可以发生加聚反应生成有机高分子化合物,故A正确;B.乙物质含有两个羟基,1分子乙与Na反应生成1分子氢气,所以1 mol乙物质可与2 mol钠完全反应生成1 mol氢气,故B错误;C.甲、丙含有碳碳双键,可以与溴发生加成反应使溴的四氯化碳溶液褪色,乙不与溴的四氯化碳溶液反应,所以无法使其褪色,故C错误;D.丙含有碳碳双键,可以被酸性高锰酸钾溶液氧化,使其褪色,故D正确。
7.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。
回答下列问题:
(1)写出制取乙酸乙酯反应的化学方程式:__________________________
__________________________。
(2)浓硫酸的作用是:①________;②________。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止__________________________。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作
是__________________________。
(5)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是________,该过程中发生反应的化学方程式是__________________________。
答案:(1)
(2)催化作用 吸水作用 (3)倒吸
(4)用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,再分液
(5)乙酸乙酯中含有乙酸 CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O
[明确学习目标] [核心素养对接]
1.掌握乙酸的分子结构,了解乙酸的物理性质和化学性质。 2.了解酯化反应的原理和实质,认识乙酸乙酯。 3.知道根据官能团给有机物分类的方法。 1.通过对乙酸结构和性质的学习,培养学生宏观辨识与微观探析的能力。 2.通过学习乙酸与人们日常生活的关系,培养学生科学态度与社会责任。
课前篇·自主学习固基础
[知识梳理]
一、乙酸
1.组成和结构
2.物理性质
俗名 颜色 状态 气味 溶解性 挥发性
____ ____ ____ __________ ______________ ______
3.化学性质
(1)弱酸性
①乙酸在水中的电离方程式为____________________________,是一元弱酸,具有酸的通性。
②醋酸与碳酸酸性强弱的比较实验
(2)酯化反应
①概念:酸与醇反应生成________的反应。
②反应特点:酯化反应是________反应且比较________。
③乙酸与乙醇的酯化反应
[实验7-6]
实验现象 a.饱和Na2CO3溶液的液面上有________________生成 b.能闻到________
化学方程式 ________________________________
反应机理 酸脱________、醇脱________
二、酯
(1)酯:羧酸分子羧基中的________被—OR取代后的一类有机物,乙酸乙酯是酯类物质的一种,其官能团为________( )。
(2)物理性质
低级酯密度比水________,易溶于有机溶剂,具有______气味。
(3)用途
①用作香料:如作饮料、糖果、香水中的香料。
②作溶剂:如作高档化妆品的溶剂。
三、官能团与有机物的分类
答案:一、1.C2H4O2 —COOH CH3COOH
2.醋酸 无色 液体 强烈刺激性 易溶于水和乙醇 易挥发 3.(1)①CH3COOHCH3COO-+H+ ②醋酸 碳酸钠溶液 澄清石灰水变浑浊 (2)①酯和水 ②可逆 缓慢 ③无色透明的油状液体 香味 CH3COOH+C2H5OHCH3COOC2H5+H2O 羟基 氢
二、—OH 酯基 小 芳香
[自我排查]
一、微判断
(1)乙酸分子中含4个H原子,故为四元酸( )
(2)可用紫色石蕊溶液鉴别乙醇和乙酸( )
(3)可用食醋除去水壶中的水垢(以CaCO3为主)( )
(4)制取乙酸乙酯时,适当增大乙醇的浓度,可使乙酸完全反应( )
答案:(1)× (2)√ (3)√ (4)×
二、尝试解答
1.用食醋可以清除水壶中的水垢(主要成分为CaCO3),利用这一事实能比较出醋酸与碳酸的酸性强弱吗?
__________________________
__________________________
提示:食醋除去水垢发生的化学反应方程式为2CH3COOH+CaCO3―→(CH3COO)2Ca+CO2↑+H2O。根据强酸制弱酸的原理可知醋酸的酸性强于碳酸。
2.实验室制得的乙酸乙酯中混有少量的乙酸和乙醇,并且含有少量的水。为获得较纯净的乙酸乙酯,应如何操作才能达到目的?
__________________________
__________________________
提示:将混合物加入碳酸钠饱和溶液中,振荡后静置,然后分液,便可获得较纯净的乙酸乙酯。
三、微训练
1.山西老陈醋素有“天下第一醋”的盛誉。食醋中含有乙酸,下列关于乙酸的说法中,错误的是( )
A.乙酸是具有强烈刺激性气味的无色液体,易溶于水和乙醇
B.乙酸的沸点比乙醇高
C.乙酸的酸性比碳酸的强,它是一元酸,能与碳酸盐反应
D.在发生酯化反应时,乙酸分子羧基中的氢原子与醇分子中的羟基结合生成水
答案:D
解析:酯化反应是酸脱羟基醇脱氢。
2.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离 ②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏 ③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 ④除去乙醇中少量的乙酸:加足量生石灰、蒸馏
A.①② B.②④ C.③④ D.②③
答案:B
解析:在光照条件下通入Cl2时乙烷和Cl2发生取代反应,①错;③中气体通入饱和碳酸钠溶液时CO2也和Na2CO3反应生成NaHCO3,③错。
3.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体
B.乙酸具有氧化性,能跟钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.温度低于16.6 ℃,乙酸就凝结成冰状晶体
答案:C
4.按照官能团可以给有机物进行分类,下列有机物类别划分正确的是( )
A.含有醛基,属于醛类物质
B.CH3CH2Br含有碳溴键,属于卤代烃
答案:B
5.正确书写下列几种官能团的名称:
答案:(1)碳碳双键 (2)碳溴键 (3)酯基
课堂篇·重点难点要突破
研习1 羟基中氢原子活泼性比较
[重点讲解]
乙酸、碳酸、水和乙醇中羟基氢原子的活泼性比较
(1)理论分析:乙酸、碳酸、水、乙醇的分子组成中,均含有羟基氢,它们有相似的性质,如易溶于水、能与活泼金属反应产生氢气等。但由于与羟基相连的原子或原子团的不同,它们也呈现不同的性质,其羟基氢原子的活泼性顺序为乙酸>碳酸>水>乙醇。
(2)实验验证
将4种物质分置于4支试管中,并编号①H—OH,
Ⅰ.实验过程
操作 现象 结论(—OH中氢原子活泼性顺序)
四种物质各取少量于试管中,各加入紫色石蕊溶液两滴 ③④变红,其他不变红 ③④>①②
在③④试管中,各加入少量碳酸钠溶液 ④中产生气体 ④>③
在①②中各加入少量金属钠 ①产生气体,反应迅速,②也产生气体,反应缓慢 ①>②
Ⅱ.实验结论
羟基氢的活泼性:乙醇<水<碳酸<乙酸。
[探究活动]
[实验]'探究乙酸的酸性
实验操作
实验现象 紫色石蕊 溶液变红 锌粒溶解, 有气泡产生 溶液红 色褪去 固体溶解, 有气泡产生
[问题探讨]
1.上述四个实验体现了乙酸的什么性质?用食醋浸泡有水垢(主要成分CaCO3)的水壶,可清除其中的水垢,写出反应的化学方程式。
提示:乙酸具有酸的通性;CaCO3+2CH3COOH―→(CH3COO)2Ca+H2O+CO2↑。
2.能否用NaHCO3溶液鉴别乙酸和乙醇?若能,写出反应的化学方程式。
提示:能;乙酸能与NaHCO3溶液反应产生CO2气体,乙醇与NaHCO3溶液不反应;NaHCO3+CH3COOH―→CH3COONa+H2O+CO2↑。
3.如何设计实验比较乙酸和碳酸的酸性强弱?
提示:利用酸性相对强的酸制取酸性相对弱的酸的原理,将乙酸滴入NaHCO3溶液中,然后将产生的气体通入饱和NaHCO3溶液中除去乙酸蒸气,最后将气体通入澄清石灰水,若石灰水变浑浊,则证明酸性:CH3COOH>H2CO3。实验装置如下图所示:
4.乙酸与乙醇的官能团相同吗?
提示:不相同;乙酸的官能团是羧基(—COOH),乙醇的官能团是羟基(—OH)。
[举一反三]
1.下列说法不正确的是( )
A.乙醇、乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
B.乙酸能和碳酸钠反应生成二氧化碳气体,说明乙酸的酸性强于碳酸
C.乙酸和乙醇生成乙酸乙酯的反应属于酸碱中和反应
D.乙酸分子中虽然有4个氢原子,但乙酸是一元酸
答案:C
2.在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的该有机物和足量的NaHCO3反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是( )
答案:A
解析:钠既能与羟基反应,又能与羧基反应,且2—OH~H2或2—COOH~H2,NaHCO3可与羧基反应,且—COOH~CO2;由题意知该有机物中既有羧基又有羟基,且羧基和羟基个数相等,故选A。
[规律方法]
—OH、—COOH在有气体生成的反应中的定量关系
(1)能与金属钠反应的有机物含有—OH或—COOH,反应关系为2Na~2—OH~H2或2Na~2—COOH~H2。
(2)Na2CO3、NaHCO3只能和—COOH反应产生CO2,物质的量的关系为Na2CO3~2—COOH~CO2,NaHCO3~—COOH~CO2。
研习2 酯化反应
[重点讲解]
1.酯
(2)物理性质
低级酯(如乙酸乙酯)密度比水小,不溶于水,易溶于有机溶剂,具有芳香气味。
(3)酯化反应与酯(以CH3COOC2H5为例)的水解反应的比较
酯化反应 酯的水解反应
反应关系 CH3COOH+C2H5OHCH3COOC2H5+H2O
催化剂 浓硫酸 稀硫酸或NaOH溶液
催化剂的 其他作用 吸水,提高CH3COOH和C2H5OH的转化率 NaOH能中和酯水解生成的CH3COOH,提高酯的水解率
加热方式 直接加热或水浴加热 水浴加热
反应类型 取代反应
(4)用途
①用作香料,如作饮料、香水等中的香料。
②用作溶剂,如作指甲油、胶水的溶剂。
2.酯化反应实验
(1)实验装置
(2)导气管末端未伸入液面以下的目的是为了防止倒吸。
(3)饱和Na2CO3溶液的作用
①与挥发出来的乙酸发生反应,生成可溶于水的乙酸钠。
②溶解挥发出来的乙醇。
③减小乙酸乙酯在水中的溶解度,使液体分层,便于得到酯。
(4)酯化反应实验中的四个注意问题
①注意防暴沸:反应试管中常加入几片碎瓷片或沸石防暴沸。
②注意浓硫酸的作用:催化剂、吸水剂。
③注意试剂的添加顺序:不能先加浓硫酸,以防止液体飞溅;通常的顺序是乙醇→浓硫酸→乙酸。
④注意酯的分离:对于生成的酯,通常用分液漏斗进行分液,将酯和饱和碳酸钠溶液分离。
(5)实验原理
①化学方程式
②反应实质:酸脱去羟基,醇脱去氢原子。
[探究活动]
[实验] 探究酯化反应
实验 装置
实验 步骤 在试管中先加入无水乙醇,然后慢慢加入浓硫酸和乙酸,再加入2~3块碎瓷片,连接实验装置;用酒精灯小心均匀地加热试管,将产生的气体经导管通到饱和Na2CO3溶液的液面上
实验 现象 ①饱和Na2CO3溶液液面上有透明油状液体生成; ②能闻到香味
[问题探讨]
1.实验过程中乙酸、乙醇、浓H2SO4在试管中的加入顺序是什么?加入碎瓷片的作用是什么?
提示:在试管中先加入乙醇,然后边振荡边慢慢加入浓硫酸和乙酸。碎瓷片的作用是防止暴沸。
2.反应中浓硫酸的作用是什么?饱和Na2CO3溶液的作用又是什么?
提示:浓H2SO4的作用是作催化剂和吸水剂;饱和Na2CO3溶液的作用是溶解乙醇,乙酸,便于闻酯的香味,降低乙酸乙酯的溶解度,减少乙酸乙酯的损失。
3.实验中为什么加热温度不能过高?如何对实验进行改进?(已知:乙酸乙酯的沸点为77 ℃)
提示:尽量减少反应物(乙酸、乙醇)的挥发,提高乙酸和乙醇的转化率及产品的纯度。对实验改进的方法是水浴加热。
4.试管b中的导管能否伸入到液面以下?为什么?实验结束后,如何从试管b中的液体中分离出乙酸乙酯?
提示:不能;原因是防止倒吸;将反应后的液体转移至分液漏斗中,用力振荡,待液体分层后,分离出上层液体即得乙酸乙酯。
[举一反三]
1.将0.5 mol乙醇(其中的氧用18O标记)在浓硫酸存在下与足量乙酸充分反应。下列叙述不正确的是( )
A.生成的乙酸乙酯中含有18O
B.生成的水分子中含有18O
C.可能生成44 g乙酸乙酯
D.不可能生成45 g乙酸乙酯
答案:B
解析:反应产物为CH3CO18OC2H5和H2O,且由于该反应为可逆反应,生成的乙酸乙酯小于0.5 mol,即CH3CO18OC2H5的质量小于45 g。
2.酯类物质广泛存在于香蕉、梨等水果中。某实验小组从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种化学式为C6H13OH的物质。以下说法中不正确的是( )
A.乙酸易溶于水
B.C6H13OH可与金属钠反应
C.实验小组分离出的酯可表示为C5H11COOC2H5
D.C6H13OH分子中含有羟基,乙酸分子中含有羧基
答案:C
解析:A.羧基属于亲水基团,因此乙酸易溶于水,故A正确;B.钠可以置换醇中羟基上的氢,故C6H13OH可与金属钠发生反应,故B正确;C.酯能在酸性条件下水解生成相应的酸和醇,可知用乙酸与C6H13OH脱去一分子的水即可得到酯CH3COOC6H13,故C错误;D.C6H13OH是醇,分子中含有羟基,乙酸是羧酸,分子中含有羧基,故D正确。
3.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的] 制取乙酸乙酯
[实验原理] 甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
(装置设计) 甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是__________________________。
[实验步骤]
(1)按丙同学设计的装置组装仪器,在试管中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸,再加上几片碎瓷片;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
[问题讨论]
a.步骤(1)安装好实验装置,加入样品前还应检查________;
b.写出试管①发生反应的化学方程式(注明反应条件)__________________________
__________________________;
c.试管②中饱和Na2CO3溶液的作用是__________________________;
________(填“能”或“不能”)换成NaOH溶液,原因__________________________
__________________________;
d.从试管②中分离出乙酸乙酯的实验操作是________。
答案:乙 能防止倒吸 (5)a.装置的气密性 b.CH3COOH+C2H5OHCH3COOC2H5+H2O
c.吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度,使其分层析出 不能 若用NaOH溶液,则NaOH会使生成的乙酸乙酯又彻底水解,导致实验失败 d.分液
解析:作为实验室制取乙酸乙酯的装置,导管与液面要有空隙,防止液体倒吸,故较合理的是乙。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是能防止倒吸。a.步骤(1)安装好实验装置,实验前即加入样品前,还应检查装置的气密性;b.试管①发生乙酸和乙醇的取代反应,反应可逆,化学方程式为CH3COOH+C2H5OHCH3COOC2H5+H2O;c.试管②中饱和Na2CO3溶液的作用是吸收乙醇,除去乙酸,降低乙酸乙酯的溶解度,使其分层析出;不能换成NaOH溶液,因为若用NaOH溶液,会使生成的乙酸乙酯又彻底水解,导致实验失败;d.乙酸乙酯不溶于水,从试管②中分离出乙酸乙酯的实验操作是分液。
[规律方法]
酯化反应的理解
(1)酯化反应中,醇脱羟基上的H原子,羧酸脱—OH,含有1个—OH的醇的相对分子质量+含有1个—COOH的羧酸的相对分子质量=酯的相对分子质量+18。
(2)有多个—OH或多个—COOH存在的有机物若完全酯化时,需要的—COOH或—OH也对应增加。
演习篇·学业测试速达标
1.制取乙酸乙酯的装置正确的是( )
答案:A
解析:玻璃导管不能插入到饱和Na2CO3溶液液面以下,以防止倒吸;不能用NaOH溶液,应用饱和Na2CO3溶液。
2.(双选)实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊溶液1 mL,发现紫色石蕊溶液存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡试管)。下列有关该实验的描述中,不正确的是( )
A.制备的乙酸乙酯中混有乙酸和乙醇杂质
B.该实验中浓硫酸的作用是催化剂和脱水剂
C.饱和碳酸钠溶液的主要作用是降低乙酸乙酯的溶解度、吸收乙醇、中和乙酸
D.石蕊溶液层由上而下颜色分别是蓝、紫、红
答案:BD
解析:A正确,在乙酸乙酯挥发过程中,乙酸、乙醇也挥发;B错误,浓硫酸起催化剂和吸水剂的作用;C正确,饱和碳酸钠溶液的作用是吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度,有利于液体分层分离;D错误,由于乙酸乙酯密度小于水,溶液层由上到下为乙酸乙酯、石蕊、饱和碳酸钠溶液,乙酸乙酯中有乙酸使石蕊变红,碳酸钠水解显碱性使紫色石蕊溶液变蓝,从上到下颜色为红、紫、蓝。
3.下列有关酯的说法正确的是( )
A.酯是羧酸分子羧基中的—OH被—OR′取代后的产物,简写为RCOOR′
B.酯类物质广泛存在于自然界中,都是具有芳香气味的液体
C.酯类物质难溶于水,也难溶于有机溶剂
D.酯类物质属于化学产品,饮料、糖果和糕点中不能使用酯类香料
答案:A
解析:A.酯是羧酸分子羧基中的—OH被—OR′取代后的产物,可简写为RCOOR′,其中R和R′(不为H)可以相同,也可以不同,故A正确;B.低级酯(分子中含碳原子数少的酯)是具有芳香气味的液体。高级酯(分子中含碳原子数较多的酯)在通常状况下一般是固体,不一定具有芳香气味,故B错误,C.酯类物质都难溶于水而易溶于醇、乙醚等有机溶剂,故C错误;D.日常生活中的饮料、糖果和糕点等常使用酯类香料,故D错误。
4.山梨酸(结构简式如图所示)是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂,广泛应用于食品、饮料、烟草、农药、化妆品等行业。下列有关山梨酸的说法正确的是( )
A.分子式为C7H8O2
B.只能发生加成反应,不能发生取代反应
C.能使溴的四氯化碳溶液褪色,但不能使酸性高锰酸钾溶液褪色
D.其水溶液既能与碳酸钠反应,又能与钠反应
答案:D
解析:A项,根据山梨酸的结构简式可知其分子式为C6H8O2,错误;B项,甲基、羧基均能发生取代反应,错误;C项,碳碳双键既能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色,错误;D项,羧基能电离出氢离子,与碳酸钠、钠均能反应,正确。
5.乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸作原料分别制备乙酸乙酯(沸点77.2 ℃)。下列有关说法不正确的是( )
A.浓硫酸能加快酯化反应速率
B.不断蒸出酯,会降低其产率
C.装置b比装置a原料损失的少
D.可用分液的方法分离出乙酸乙酯
答案:B
解析:乙酸与乙醇在浓硫酸作用下加热发生酯化反应,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯的方向移动,故浓硫酸作催化剂、吸水剂,所以浓硫酸能加快酯化反应速率,A项正确;制备乙酸乙酯的反应为可逆反应,不断蒸出酯,有利于反应正向进行,会提高其产率,B项错误;乙醇、乙酸均易挥发,甲装置采取直接加热的方法,温度升高快,温度不易控制,装置b采用水浴加热的方法,受热均匀,相对于装置a原料损失的少,C项正确;分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液将挥发出来的乙酸转化为乙酸钠溶于水中,并溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,静置分层后分液即可得到乙酸乙酯,D项正确。
6.(双选)“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料。甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料。下列说法不正确的是( )
A.甲物质在一定条件下可以生成有机高分子化合物
B.1 mol乙物质可与2 mol钠完全反应生成2 mol氢气
C.甲、乙、丙物质都能够使溴的四氯化碳溶液褪色
D.丙可以使酸性高锰酸钾溶液褪色
答案:BC
解析:A.甲物质含有碳碳双键可以发生加聚反应生成有机高分子化合物,故A正确;B.乙物质含有两个羟基,1分子乙与Na反应生成1分子氢气,所以1 mol乙物质可与2 mol钠完全反应生成1 mol氢气,故B错误;C.甲、丙含有碳碳双键,可以与溴发生加成反应使溴的四氯化碳溶液褪色,乙不与溴的四氯化碳溶液反应,所以无法使其褪色,故C错误;D.丙含有碳碳双键,可以被酸性高锰酸钾溶液氧化,使其褪色,故D正确。
7.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。
回答下列问题:
(1)写出制取乙酸乙酯反应的化学方程式:__________________________
__________________________。
(2)浓硫酸的作用是:①________;②________。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止__________________________。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作
是__________________________。
(5)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是________,该过程中发生反应的化学方程式是__________________________。
答案:(1)
(2)催化作用 吸水作用 (3)倒吸
(4)用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,再分液
(5)乙酸乙酯中含有乙酸 CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
