4.1.1醇的结构和性质(含课件)(教学课件)(共28张PPT)——2022-2023学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 4.1.1醇的结构和性质(含课件)(教学课件)(共28张PPT)——2022-2023学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 68.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-14 09:45:26 | ||
图片预览



文档简介
(共28张PPT)
专题4 烃的含氧衍生物
第一单元 醇和酚
第一节 醇的结构和性质
1、了解乙醇的物理性质、结构和官能团
2、掌握乙醇的化学性质,能够正确书写反应的方程式
3、知道并能判断醇类物质,了解饱和一元醇的通式
4、了解醇类的分类及几种重要醇类物质
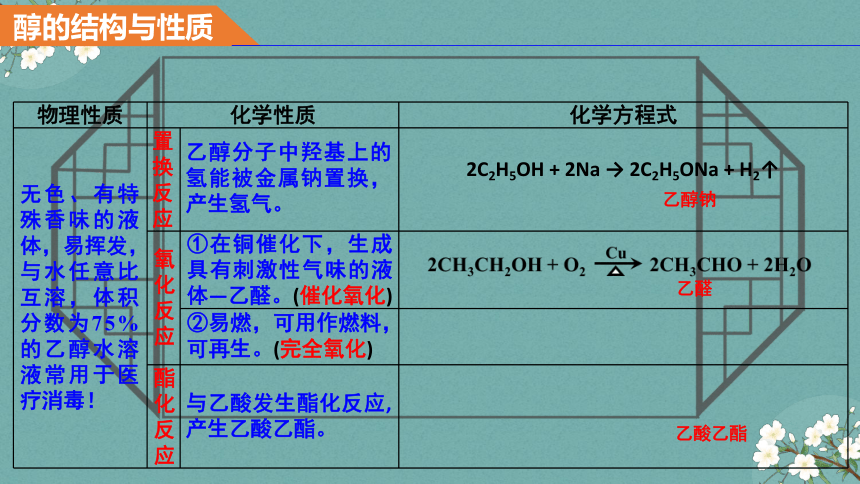
物理性质 化学性质 化学方程式
无色、有特殊香味的液体,易挥发,与水任意比互溶,体积分数为75%的乙醇水溶液常用于医疗消毒!
置换反应
氧化反应
酯化反应
乙醇分子中羟基上的氢能被金属钠置换,产生氢气。
①在铜催化下,生成具有刺激性气味的液体—乙醛。(催化氧化)
②易燃,可用作燃料,可再生。(完全氧化)
与乙酸发生酯化反应,产生乙酸乙酯。
2C2H5OH + 2Na → 2C2H5ONa + H2↑
乙醇钠
乙醛
乙酸乙酯
醇的结构与性质
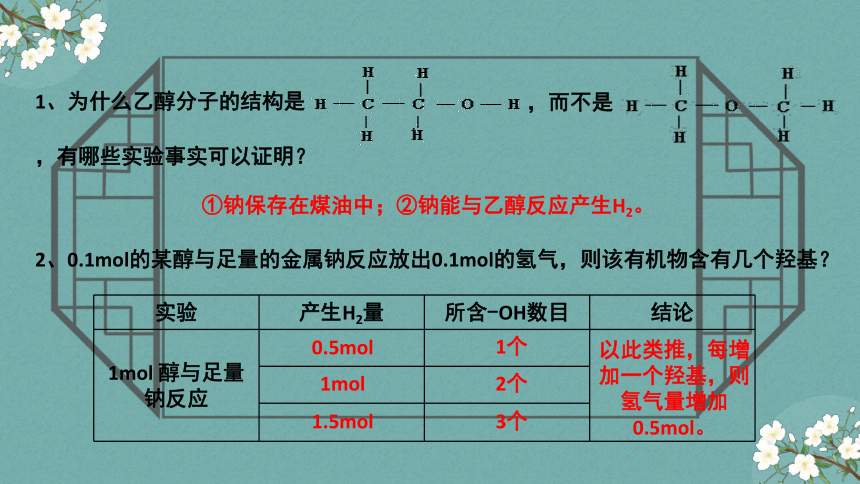
1、为什么乙醇分子的结构是
,而不是
,有哪些实验事实可以证明?
2、0.1mol的某醇与足量的金属钠反应放出0.1mol的氢气,则该有机物含有几个羟基?
实验 产生H2量 所含-OH数目 结论
1mol 醇与足量钠反应
0.5mol
1mol
1.5mol
以此类推,每增加一个羟基,则氢气量增加0.5mol。
1个
2个
3个
①钠保存在煤油中;②钠能与乙醇反应产生H2。
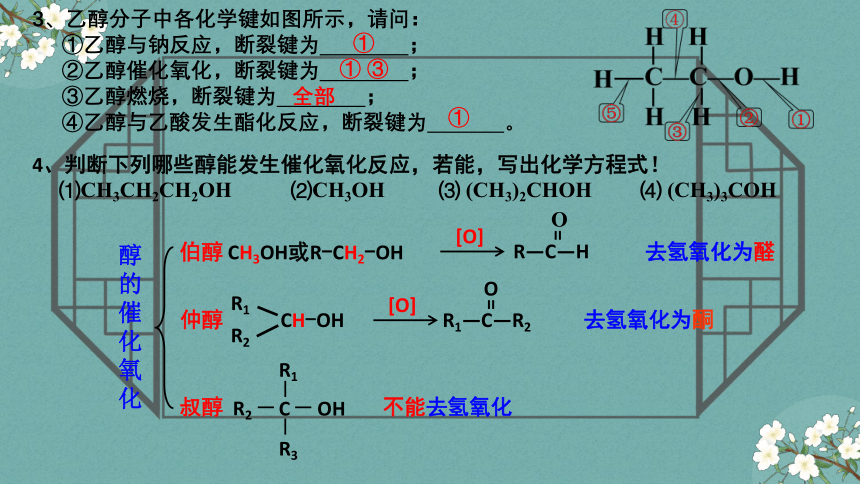
3、乙醇分子中各化学键如图所示,请问:
①乙醇与钠反应,断裂键为 ;
②乙醇催化氧化,断裂键为 ;
③乙醇燃烧,断裂键为 ;
④乙醇与乙酸发生酯化反应,断裂键为 。
①
① ③
全部
4、判断下列哪些醇能发生催化氧化反应,若能,写出化学方程式!
⑴CH3CH2CH2OH ⑵CH3OH ⑶ (CH3)2CHOH ⑷ (CH3)3COH
①
醇的催化氧化
[O]
O
=
R—C—H
伯醇 CH3OH或R-CH2-OH
去氢氧化为醛
CH-OH
R2
R1
O
=
R1—C—R2
去氢氧化为酮
仲醇
[O]
OH
R2
R1
R3
C
叔醇
不能去氢氧化
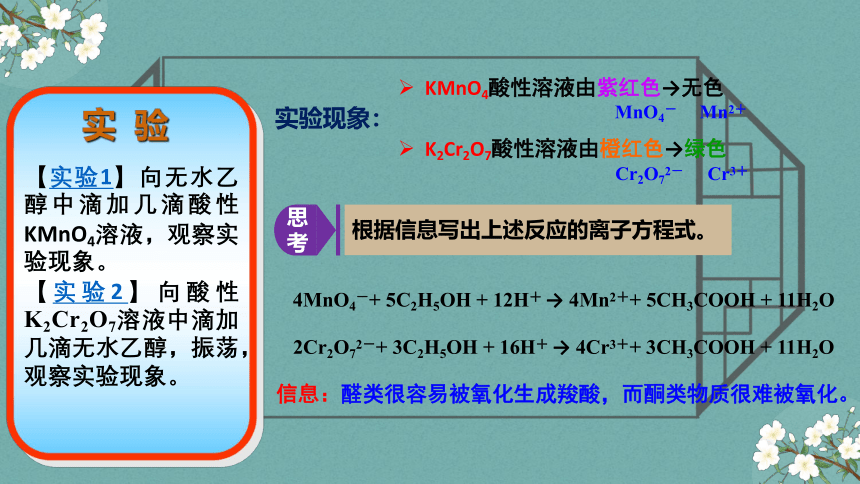
实 验
【实验1】向无水乙醇中滴加几滴酸性KMnO4溶液,观察实验现象。
【实验2】向酸性K2Cr2O7溶液中滴加几滴无水乙醇,振荡,观察实验现象。
实验现象:
思考
根据信息写出上述反应的离子方程式。
信息:醛类很容易被氧化生成羧酸,而酮类物质很难被氧化。
KMnO4酸性溶液由紫红色→无色
K2Cr2O7酸性溶液由橙红色→绿色
Cr2O72-
2Cr2O72-+ 3C2H5OH + 16H+ → 4Cr3++ 3CH3COOH + 11H2O
Cr3+
MnO4-
Mn2+
4MnO4-+ 5C2H5OH + 12H+ → 4Mn2++ 5CH3COOH + 11H2O
K2Cr2O7 溶液为橙红色, 遇到C2H5OH 后颜色变为绿色,据此,交警可让司机对填充了吸附有K2Cr2O7 的硅胶颗粒的装置吹气,若发现硅胶变色,则证明司机是酒后驾驶。
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4→2K2SO4 + 2Cr2(SO4)3 + 3CH3COOH + 11H2O
酒 精 测 试 仪
交警检测司机是否酒后驾驶的原理是:
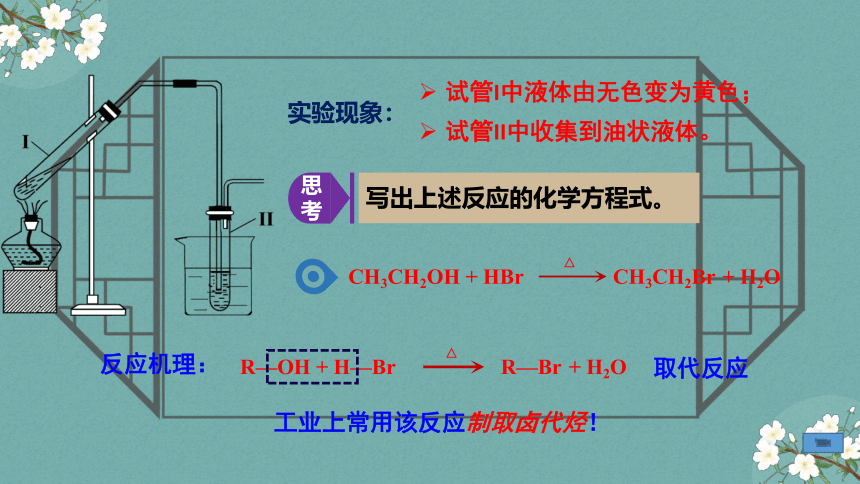
试管I中液体由无色变为黄色;
试管II中收集到油状液体。
CH3CH2OH + HBr
△
CH3CH2Br + H2O
取代反应
工业上常用该反应制取卤代烃!
实验现象:
思考
写出上述反应的化学方程式。
R—OH + H—Br
△
R—Br + H2O
反应机理:
为什么液体由无色变为黄色?
烧杯中的自来水起什么作用?
长导管除了导气之外,还有什么作用?
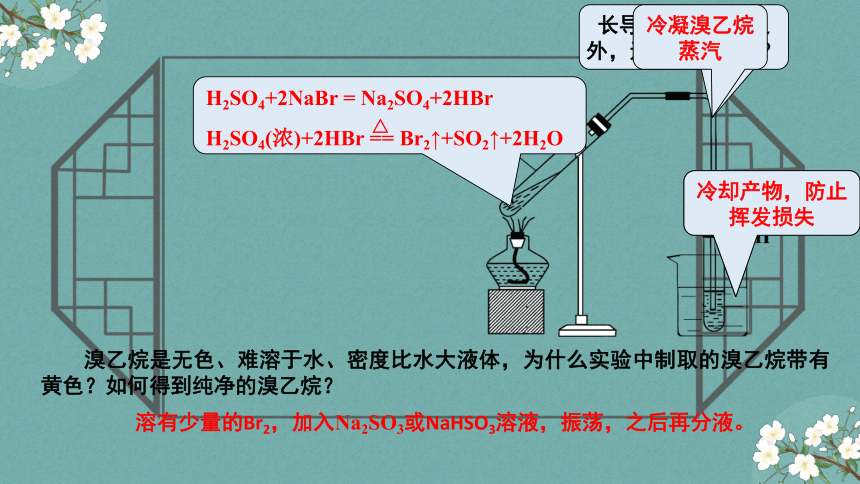
溴乙烷是无色、难溶于水、密度比水大液体,为什么实验中制取的溴乙烷带有黄色?如何得到纯净的溴乙烷?
溶有少量的Br2,加入Na2SO3或NaHSO3溶液,振荡,之后再分液。
H2SO4+2NaBr = Na2SO4+2HBr
H2SO4(浓)+2HBr == Br2↑+SO2↑+2H2O
冷却产物,防止挥发损失
冷凝溴乙烷蒸汽
△
液体变黑,产生气体,KMnO4溶液紫红色褪去。
实验现象:
思考
写出上述反应的化学方程式。
消去反应:在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
KOH溶液起到什么作用?
KMnO4溶液褪色说明什么?
为什么要使液体温度迅速升到170℃?
吸收SO2和乙醇,防止干扰实验。
证明有乙烯生成
浓硫酸有什么作用?为什么液体会变黑?
为了减少乙醚的产量。因为140℃时,乙醇分子间脱水生成乙醚。
C2H5OH
CH2=CH2 ↑ + H2O
浓H2SO4
170℃
副反应
脱水剂和催化剂;浓硫酸有脱水性,能使有机物碳化。
方程式
反应 机理
反应物结构特点
分子内脱水
分子间脱水
C2H5OH
CH2=CH2 ↑ + H2O
2C2H5OH
C2H5OC2H5 + H2O
浓H2SO4
170℃
浓H2SO4
140℃
CH2—CH2
OH
H
CH2=CH2
-H2O
(消去反应)
(取代反应)
1、分析下列有机反应的反应机理!
β碳上有氢
-H2O
2、根据醇发生消去反应的原理,判断:
⑴下列醇能发生消去反应的是 ,通过消去反应能生成三种烯烃的是 。
C、D
D
结论:醇的消去反应遵循“札依采夫规则”(氢少减氢)。
⑵经研究发现:虽然上述D项中的有机化合物发生消去反应时能生成三种烯烃,但是主要产物的结构简式如下所示,你能从中发现什么规律吗?
乙醇分子中各化学键如图所示,请问:
①乙醇与钠反应,断裂键为 ;
②乙醇催化氧化,断裂键为 ;
③乙醇燃烧,断裂键为 ;
④乙醇分子内脱水,断裂键为 ;
⑤乙醇分子间脱水,断裂键为 ;
⑥乙醇与氢卤酸反应,断裂键为 ;
⑦乙醇与乙酸发生酯化反应,断裂键为 。
①
① ③
全部
② ⑤
①或②
②
①
1、请判断下列哪些物质属于醇?哪些物质属于酚?并命名!
OH
2-甲基-1-丙醇
1,2-乙二醇
苯甲醇
CH2OH
OH
CH3
CH3—CH—CH2—OH
CH3
CH2—OH
CH2—OH
醇:羟基与烃基或苯环侧链上的碳原子相连
酚:羟基与苯环直接相连
苯酚
2-甲基苯酚
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
2、甲醇(CH3OH)、乙醇(C2H5OH)、1-丙醇(CH3CH2CH2OH)均为醇类物质,你能根据组成特点写出其通式吗?
羟基
的数目
烃基
是否饱和
一元醇:
二元醇:
三元醇:
CH2OH
CH2OH
CH3OH
C2H5OH
CH2OH
CHOH
CH2OH
乙二醇
丙三醇
饱和醇
CH3CH2OH
不饱和醇CH2=CHCH2OH
甲醇
乙醇
有两个或两个以上羟基的醇又称为多元醇。
醇的分类
醇的重要应用
一元醇——甲醇
甲醇(CH3OH):最简单的饱和一元醇,又称“木醇”或“木精”。是无色透明、易挥发的液体,易燃,有剧毒。
有机化工原料:用来制造甲醛、醋酸、氯甲烷、甲氨等多种有机产品,也是农药、医药的重要原料之一。
优质燃料:甲醇可作为一种新型清洁燃料,也可加入汽油掺烧。
甲醇对人体有强烈毒性,误饮4毫升以上就会出现中毒症状;超过10毫升即可因对视神经的永久破坏而导致失明;30毫升已能导致死亡。
甲醇的毒性
甲醇中毒可用乙醇解毒!
乙醇(C2H5OH):俗称 “酒精”,是无色透明、易挥发、有特殊气味的液体,易燃,与水任意比互溶,密度比水小。
乙醇用途广泛,是一种重要的有机化工原料。
醇的重要应用
一元醇——乙醇
醇的重要应用
二元醇—— 乙二醇
乙二醇是无色无臭、有甜味液体,能与水互溶。对动物有毒性,人类致死剂量约为1.6 g/kg,成人服食30毫升已有可能引起死亡。
用作溶剂、防冻剂以及合成涤纶的原料。
乙二醇 又名“甘醇”
最简单的二元醇
乙二醇的浓度不同时,冰点亦不同。当乙二醇的含量为60%时,冰点可降低至-48.3℃(极限)。在中国江南,一般采用质量分数为40 %的配比,而在寒冷的北方,需取质量分数50%左右的配比比较适宜。
醇的重要应用
三元醇—— 丙三醇
丙三醇 俗称“甘油”
丙三醇是无色、黏稠、有甜味、无毒的液体。吸湿性强,有护肤作用,是重要的化工原料,可用在制药工业、化妆品配制、有机合成等方面。
一种烈性炸药,也可用做心绞痛的缓解药物。
1.在下列物质中,分别加入金属钠,不能产生氢气的是( )
A.蒸馏水 B.无水酒精 C.苯 D.75%的酒精
2.把质量为m g的Cu丝灼烧变黑,立即放入下列物质中,使Cu丝变红,且质量仍为m g的是( )
A.稀H2SO4 B.C2H5OH C.稀HNO3 D.CH3COOH(aq)
3.乙醇分子中不同的化学键如右图所示,关于乙醇在各种不同反应中断键的说法不正确的是( )
A.和金属钠反应键①断裂
B.在Ag催化下和O2反应键①④断裂
C.和浓硫酸共热140℃时,键①或键②断裂,170℃时键②⑤断裂
D.和氢溴酸反应键①断裂
C
B
D
4.能证明乙醇分子中有一个羟基的是( )
A.乙醇完全燃烧生成二氧化碳和水 B.乙醇能与水以任意比混溶
C.0.1mol乙醇与足量钠反应只生成0.1g氢气 D.乙醇在铜催化下可被氧化
5.下列有关乙醇的物理性质的应用中不正确的是 ( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法
6.关于乙醇结构方面的说法中正确的是( )
A.乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
C
A
D
7.下列物质既能发生消去反应,又能氧化成醛的是( )
A、CH3CH2CH2OH B、(CH3)3CCH2OH
C、CH3CH(OH)CH3 D、 —CH2OH
8.某有机物6g与足量钠反应,生成0.05mol氢气,该有机物可能是( )
9.下列醇类发生消去反应可能生成两种烯烃的是( )
A. 1—丙醇 B. 2—丁醇 C. 2,2—二甲基丙醇 D. 3,3—二甲基—2—戊醇
10.现分别用一定量的乙醇、乙二醇、丙三醇与足量的钠反应,结果生成了等物质的量的氢气,则乙醇、乙二醇、丙三醇物质的量之比为( )
A.1:1:1 B.3:2:1 C.6:3:2 D.2:3:6
A
B
B
C
11.A、B、C、D四种有机物分子中碳原子数相同,A为气态,标况下的密度为1.16 g·L-1 ;B或D跟溴化氢反应都生成C ;D在浓硫酸存在下发生消去反应生成B 。
(1)A、B、C、D的结构简式分别是:
、 、 、 。
(2)写出下列反应的化学方程式
B→C
D→C
D→B
CH ≡ CH
CH2 = CH2
CH2=CH2 + HBr
CH3CH2OH + HBr
△
CH3CH2Br + H2O
C2H5OH
CH2=CH2 ↑+ H2O
浓H2SO4
170℃
催化剂
CH3CH2Br
CH3CH2Br
C2H5OH
专题4 烃的含氧衍生物
第一单元 醇和酚
第一节 醇的结构和性质
1、了解乙醇的物理性质、结构和官能团
2、掌握乙醇的化学性质,能够正确书写反应的方程式
3、知道并能判断醇类物质,了解饱和一元醇的通式
4、了解醇类的分类及几种重要醇类物质
物理性质 化学性质 化学方程式
无色、有特殊香味的液体,易挥发,与水任意比互溶,体积分数为75%的乙醇水溶液常用于医疗消毒!
置换反应
氧化反应
酯化反应
乙醇分子中羟基上的氢能被金属钠置换,产生氢气。
①在铜催化下,生成具有刺激性气味的液体—乙醛。(催化氧化)
②易燃,可用作燃料,可再生。(完全氧化)
与乙酸发生酯化反应,产生乙酸乙酯。
2C2H5OH + 2Na → 2C2H5ONa + H2↑
乙醇钠
乙醛
乙酸乙酯
醇的结构与性质
1、为什么乙醇分子的结构是
,而不是
,有哪些实验事实可以证明?
2、0.1mol的某醇与足量的金属钠反应放出0.1mol的氢气,则该有机物含有几个羟基?
实验 产生H2量 所含-OH数目 结论
1mol 醇与足量钠反应
0.5mol
1mol
1.5mol
以此类推,每增加一个羟基,则氢气量增加0.5mol。
1个
2个
3个
①钠保存在煤油中;②钠能与乙醇反应产生H2。
3、乙醇分子中各化学键如图所示,请问:
①乙醇与钠反应,断裂键为 ;
②乙醇催化氧化,断裂键为 ;
③乙醇燃烧,断裂键为 ;
④乙醇与乙酸发生酯化反应,断裂键为 。
①
① ③
全部
4、判断下列哪些醇能发生催化氧化反应,若能,写出化学方程式!
⑴CH3CH2CH2OH ⑵CH3OH ⑶ (CH3)2CHOH ⑷ (CH3)3COH
①
醇的催化氧化
[O]
O
=
R—C—H
伯醇 CH3OH或R-CH2-OH
去氢氧化为醛
CH-OH
R2
R1
O
=
R1—C—R2
去氢氧化为酮
仲醇
[O]
OH
R2
R1
R3
C
叔醇
不能去氢氧化
实 验
【实验1】向无水乙醇中滴加几滴酸性KMnO4溶液,观察实验现象。
【实验2】向酸性K2Cr2O7溶液中滴加几滴无水乙醇,振荡,观察实验现象。
实验现象:
思考
根据信息写出上述反应的离子方程式。
信息:醛类很容易被氧化生成羧酸,而酮类物质很难被氧化。
KMnO4酸性溶液由紫红色→无色
K2Cr2O7酸性溶液由橙红色→绿色
Cr2O72-
2Cr2O72-+ 3C2H5OH + 16H+ → 4Cr3++ 3CH3COOH + 11H2O
Cr3+
MnO4-
Mn2+
4MnO4-+ 5C2H5OH + 12H+ → 4Mn2++ 5CH3COOH + 11H2O
K2Cr2O7 溶液为橙红色, 遇到C2H5OH 后颜色变为绿色,据此,交警可让司机对填充了吸附有K2Cr2O7 的硅胶颗粒的装置吹气,若发现硅胶变色,则证明司机是酒后驾驶。
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4→2K2SO4 + 2Cr2(SO4)3 + 3CH3COOH + 11H2O
酒 精 测 试 仪
交警检测司机是否酒后驾驶的原理是:
试管I中液体由无色变为黄色;
试管II中收集到油状液体。
CH3CH2OH + HBr
△
CH3CH2Br + H2O
取代反应
工业上常用该反应制取卤代烃!
实验现象:
思考
写出上述反应的化学方程式。
R—OH + H—Br
△
R—Br + H2O
反应机理:
为什么液体由无色变为黄色?
烧杯中的自来水起什么作用?
长导管除了导气之外,还有什么作用?
溴乙烷是无色、难溶于水、密度比水大液体,为什么实验中制取的溴乙烷带有黄色?如何得到纯净的溴乙烷?
溶有少量的Br2,加入Na2SO3或NaHSO3溶液,振荡,之后再分液。
H2SO4+2NaBr = Na2SO4+2HBr
H2SO4(浓)+2HBr == Br2↑+SO2↑+2H2O
冷却产物,防止挥发损失
冷凝溴乙烷蒸汽
△
液体变黑,产生气体,KMnO4溶液紫红色褪去。
实验现象:
思考
写出上述反应的化学方程式。
消去反应:在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
KOH溶液起到什么作用?
KMnO4溶液褪色说明什么?
为什么要使液体温度迅速升到170℃?
吸收SO2和乙醇,防止干扰实验。
证明有乙烯生成
浓硫酸有什么作用?为什么液体会变黑?
为了减少乙醚的产量。因为140℃时,乙醇分子间脱水生成乙醚。
C2H5OH
CH2=CH2 ↑ + H2O
浓H2SO4
170℃
副反应
脱水剂和催化剂;浓硫酸有脱水性,能使有机物碳化。
方程式
反应 机理
反应物结构特点
分子内脱水
分子间脱水
C2H5OH
CH2=CH2 ↑ + H2O
2C2H5OH
C2H5OC2H5 + H2O
浓H2SO4
170℃
浓H2SO4
140℃
CH2—CH2
OH
H
CH2=CH2
-H2O
(消去反应)
(取代反应)
1、分析下列有机反应的反应机理!
β碳上有氢
-H2O
2、根据醇发生消去反应的原理,判断:
⑴下列醇能发生消去反应的是 ,通过消去反应能生成三种烯烃的是 。
C、D
D
结论:醇的消去反应遵循“札依采夫规则”(氢少减氢)。
⑵经研究发现:虽然上述D项中的有机化合物发生消去反应时能生成三种烯烃,但是主要产物的结构简式如下所示,你能从中发现什么规律吗?
乙醇分子中各化学键如图所示,请问:
①乙醇与钠反应,断裂键为 ;
②乙醇催化氧化,断裂键为 ;
③乙醇燃烧,断裂键为 ;
④乙醇分子内脱水,断裂键为 ;
⑤乙醇分子间脱水,断裂键为 ;
⑥乙醇与氢卤酸反应,断裂键为 ;
⑦乙醇与乙酸发生酯化反应,断裂键为 。
①
① ③
全部
② ⑤
①或②
②
①
1、请判断下列哪些物质属于醇?哪些物质属于酚?并命名!
OH
2-甲基-1-丙醇
1,2-乙二醇
苯甲醇
CH2OH
OH
CH3
CH3—CH—CH2—OH
CH3
CH2—OH
CH2—OH
醇:羟基与烃基或苯环侧链上的碳原子相连
酚:羟基与苯环直接相连
苯酚
2-甲基苯酚
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
2、甲醇(CH3OH)、乙醇(C2H5OH)、1-丙醇(CH3CH2CH2OH)均为醇类物质,你能根据组成特点写出其通式吗?
羟基
的数目
烃基
是否饱和
一元醇:
二元醇:
三元醇:
CH2OH
CH2OH
CH3OH
C2H5OH
CH2OH
CHOH
CH2OH
乙二醇
丙三醇
饱和醇
CH3CH2OH
不饱和醇CH2=CHCH2OH
甲醇
乙醇
有两个或两个以上羟基的醇又称为多元醇。
醇的分类
醇的重要应用
一元醇——甲醇
甲醇(CH3OH):最简单的饱和一元醇,又称“木醇”或“木精”。是无色透明、易挥发的液体,易燃,有剧毒。
有机化工原料:用来制造甲醛、醋酸、氯甲烷、甲氨等多种有机产品,也是农药、医药的重要原料之一。
优质燃料:甲醇可作为一种新型清洁燃料,也可加入汽油掺烧。
甲醇对人体有强烈毒性,误饮4毫升以上就会出现中毒症状;超过10毫升即可因对视神经的永久破坏而导致失明;30毫升已能导致死亡。
甲醇的毒性
甲醇中毒可用乙醇解毒!
乙醇(C2H5OH):俗称 “酒精”,是无色透明、易挥发、有特殊气味的液体,易燃,与水任意比互溶,密度比水小。
乙醇用途广泛,是一种重要的有机化工原料。
醇的重要应用
一元醇——乙醇
醇的重要应用
二元醇—— 乙二醇
乙二醇是无色无臭、有甜味液体,能与水互溶。对动物有毒性,人类致死剂量约为1.6 g/kg,成人服食30毫升已有可能引起死亡。
用作溶剂、防冻剂以及合成涤纶的原料。
乙二醇 又名“甘醇”
最简单的二元醇
乙二醇的浓度不同时,冰点亦不同。当乙二醇的含量为60%时,冰点可降低至-48.3℃(极限)。在中国江南,一般采用质量分数为40 %的配比,而在寒冷的北方,需取质量分数50%左右的配比比较适宜。
醇的重要应用
三元醇—— 丙三醇
丙三醇 俗称“甘油”
丙三醇是无色、黏稠、有甜味、无毒的液体。吸湿性强,有护肤作用,是重要的化工原料,可用在制药工业、化妆品配制、有机合成等方面。
一种烈性炸药,也可用做心绞痛的缓解药物。
1.在下列物质中,分别加入金属钠,不能产生氢气的是( )
A.蒸馏水 B.无水酒精 C.苯 D.75%的酒精
2.把质量为m g的Cu丝灼烧变黑,立即放入下列物质中,使Cu丝变红,且质量仍为m g的是( )
A.稀H2SO4 B.C2H5OH C.稀HNO3 D.CH3COOH(aq)
3.乙醇分子中不同的化学键如右图所示,关于乙醇在各种不同反应中断键的说法不正确的是( )
A.和金属钠反应键①断裂
B.在Ag催化下和O2反应键①④断裂
C.和浓硫酸共热140℃时,键①或键②断裂,170℃时键②⑤断裂
D.和氢溴酸反应键①断裂
C
B
D
4.能证明乙醇分子中有一个羟基的是( )
A.乙醇完全燃烧生成二氧化碳和水 B.乙醇能与水以任意比混溶
C.0.1mol乙醇与足量钠反应只生成0.1g氢气 D.乙醇在铜催化下可被氧化
5.下列有关乙醇的物理性质的应用中不正确的是 ( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法
6.关于乙醇结构方面的说法中正确的是( )
A.乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
C
A
D
7.下列物质既能发生消去反应,又能氧化成醛的是( )
A、CH3CH2CH2OH B、(CH3)3CCH2OH
C、CH3CH(OH)CH3 D、 —CH2OH
8.某有机物6g与足量钠反应,生成0.05mol氢气,该有机物可能是( )
9.下列醇类发生消去反应可能生成两种烯烃的是( )
A. 1—丙醇 B. 2—丁醇 C. 2,2—二甲基丙醇 D. 3,3—二甲基—2—戊醇
10.现分别用一定量的乙醇、乙二醇、丙三醇与足量的钠反应,结果生成了等物质的量的氢气,则乙醇、乙二醇、丙三醇物质的量之比为( )
A.1:1:1 B.3:2:1 C.6:3:2 D.2:3:6
A
B
B
C
11.A、B、C、D四种有机物分子中碳原子数相同,A为气态,标况下的密度为1.16 g·L-1 ;B或D跟溴化氢反应都生成C ;D在浓硫酸存在下发生消去反应生成B 。
(1)A、B、C、D的结构简式分别是:
、 、 、 。
(2)写出下列反应的化学方程式
B→C
D→C
D→B
CH ≡ CH
CH2 = CH2
CH2=CH2 + HBr
CH3CH2OH + HBr
△
CH3CH2Br + H2O
C2H5OH
CH2=CH2 ↑+ H2O
浓H2SO4
170℃
催化剂
CH3CH2Br
CH3CH2Br
C2H5OH
