4.2.2羧酸的性质(教学课件)(共17张PPT)——2022-2023学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 4.2.2羧酸的性质(教学课件)(共17张PPT)——2022-2023学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-14 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
4.2.2 羧酸的性质及应用
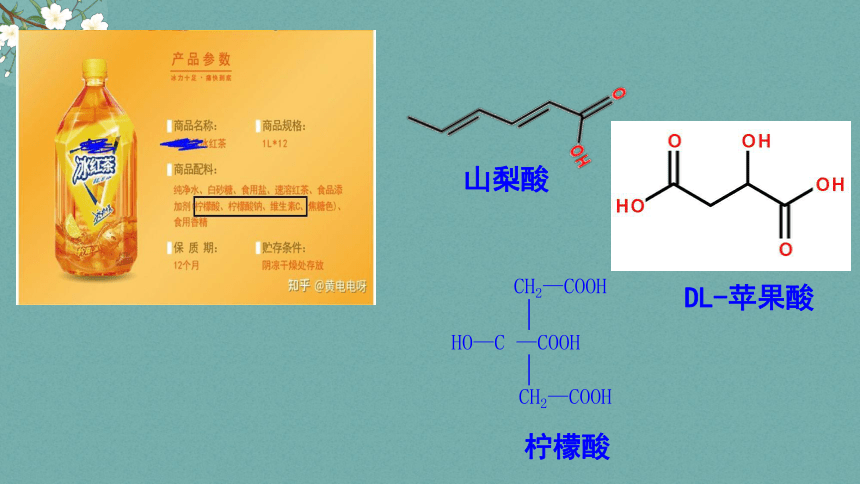
HO—C —COOH
CH2—COOH
CH2—COOH
柠檬酸
DL-苹果酸
山梨酸
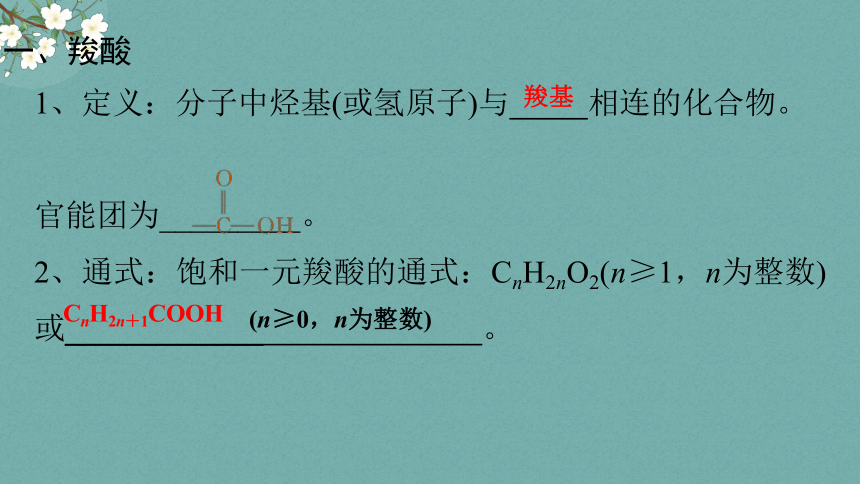
1、定义:分子中烃基(或氢原子)与 相连的化合物。
官能团为_________。
2、通式:饱和一元羧酸的通式:CnH2nO2(n≥1,n为整数)或_____________ 。
一、羧酸
羧基
CnH2n+1COOH
(n≥0,n为整数)
脂肪
软脂酸
C17H33COOH
亚油酸
芳香
C17H35COOH
固体--饱和
固体--饱和
液体--不饱和
液体--不饱和
(2)按分子中羧基的个数分类
一元羧酸:如乙酸( )
二元羧酸:如草酸(HOOC—COOH)
多元羧酸
CH3COOH
二、羧酸的物理性质
1、随着碳原子数的增多,溶解度下降
2、二元羧酸、芳香酸和高级酸常温下为固体
3、乙酸:无色液体,有强烈刺激性气味
易溶于水,易挥发、温度低于16.6℃时呈冰状晶体,
无水乙酸俗称冰醋酸。
二、羧酸的化学性质
①
②
③
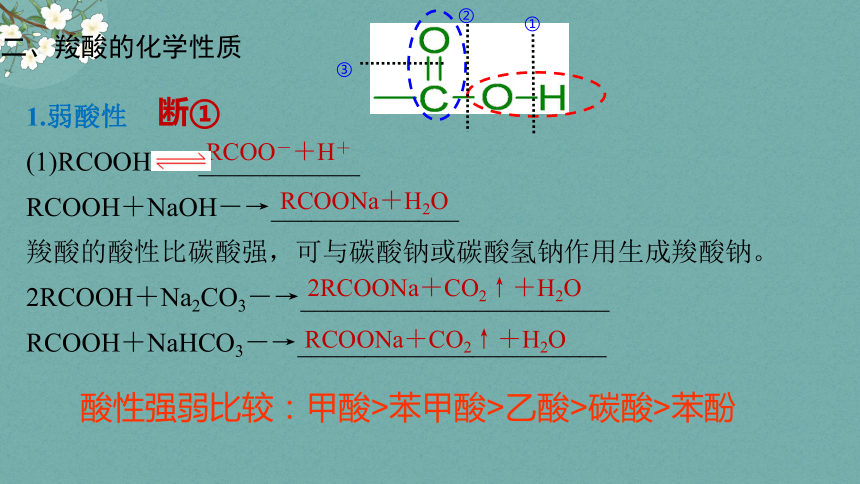
1.弱酸性
(1)RCOOH ____________
RCOOH+NaOH―→______________
羧酸的酸性比碳酸强,可与碳酸钠或碳酸氢钠作用生成羧酸钠。
2RCOOH+Na2CO3―→_______________________
RCOOH+NaHCO3―→_______________________
RCOONa+H2O
2RCOONa+CO2↑+H2O
RCOONa+CO2↑+H2O
RCOO-+H+
断①
酸性强弱比较:甲酸>苯甲酸>乙酸>碳酸>苯酚
代表物 结构简式 酸性 与钠反应 与NaOH反应 与Na2CO3反应 与NaHCO3反应
乙醇
苯酚
乙酸
CH3CH2OH
中性
能
不能
不能
不能
C6H5OH
比碳酸弱
能
能
能,不产
生CO2
不能
CH3COOH
比碳酸强
能
能
能
能
(1)链酯
若用18O标记乙醇,反应方程式为
2.酯化反应(取代反应)
酯化机理:酸脱羟基,醇脱氢
+C2H5-18OH
浓硫酸
△
O
CH3-C-OH
+H2O
O
CH3-C-18O-C2H5
(2)环酯
①二元酸和二元醇
HOCH2CH2CH2COOH +H2O
②一分子(两种官能团)
浓硫酸
△
③二分子
(3)聚酯
①二种二元分子
缩聚反应:有机化合物分子间脱去小分子获得高分子化合物的反应。
(3)聚酯
②一种分子
______________________________。
乳酸分子
课堂练习
D
2.将1 mol乙醇(其中羟基的氧用18O标记)在浓硫酸存在并加热的条件下与足量乙酸充分反应。下列叙述不正确的是
A.生成的乙酸乙酯中含有18O
B.生成的水分子中含有18O
C.可能生成45 g乙酸乙酯
D.不可能生成98 g乙酸乙酯
课堂练习
B
课堂练习
D
4.有机物A的结构简式为 ,据此回答下列问题:
(1)A的分子式为_________。
(2)A在NaOH溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,当有1 mol A发生反应时,最多消耗___ mol NaOH。
C12H14O5
2
课堂练习
4.2.2 羧酸的性质及应用
HO—C —COOH
CH2—COOH
CH2—COOH
柠檬酸
DL-苹果酸
山梨酸
1、定义:分子中烃基(或氢原子)与 相连的化合物。
官能团为_________。
2、通式:饱和一元羧酸的通式:CnH2nO2(n≥1,n为整数)或_____________ 。
一、羧酸
羧基
CnH2n+1COOH
(n≥0,n为整数)
脂肪
软脂酸
C17H33COOH
亚油酸
芳香
C17H35COOH
固体--饱和
固体--饱和
液体--不饱和
液体--不饱和
(2)按分子中羧基的个数分类
一元羧酸:如乙酸( )
二元羧酸:如草酸(HOOC—COOH)
多元羧酸
CH3COOH
二、羧酸的物理性质
1、随着碳原子数的增多,溶解度下降
2、二元羧酸、芳香酸和高级酸常温下为固体
3、乙酸:无色液体,有强烈刺激性气味
易溶于水,易挥发、温度低于16.6℃时呈冰状晶体,
无水乙酸俗称冰醋酸。
二、羧酸的化学性质
①
②
③
1.弱酸性
(1)RCOOH ____________
RCOOH+NaOH―→______________
羧酸的酸性比碳酸强,可与碳酸钠或碳酸氢钠作用生成羧酸钠。
2RCOOH+Na2CO3―→_______________________
RCOOH+NaHCO3―→_______________________
RCOONa+H2O
2RCOONa+CO2↑+H2O
RCOONa+CO2↑+H2O
RCOO-+H+
断①
酸性强弱比较:甲酸>苯甲酸>乙酸>碳酸>苯酚
代表物 结构简式 酸性 与钠反应 与NaOH反应 与Na2CO3反应 与NaHCO3反应
乙醇
苯酚
乙酸
CH3CH2OH
中性
能
不能
不能
不能
C6H5OH
比碳酸弱
能
能
能,不产
生CO2
不能
CH3COOH
比碳酸强
能
能
能
能
(1)链酯
若用18O标记乙醇,反应方程式为
2.酯化反应(取代反应)
酯化机理:酸脱羟基,醇脱氢
+C2H5-18OH
浓硫酸
△
O
CH3-C-OH
+H2O
O
CH3-C-18O-C2H5
(2)环酯
①二元酸和二元醇
HOCH2CH2CH2COOH +H2O
②一分子(两种官能团)
浓硫酸
△
③二分子
(3)聚酯
①二种二元分子
缩聚反应:有机化合物分子间脱去小分子获得高分子化合物的反应。
(3)聚酯
②一种分子
______________________________。
乳酸分子
课堂练习
D
2.将1 mol乙醇(其中羟基的氧用18O标记)在浓硫酸存在并加热的条件下与足量乙酸充分反应。下列叙述不正确的是
A.生成的乙酸乙酯中含有18O
B.生成的水分子中含有18O
C.可能生成45 g乙酸乙酯
D.不可能生成98 g乙酸乙酯
课堂练习
B
课堂练习
D
4.有机物A的结构简式为 ,据此回答下列问题:
(1)A的分子式为_________。
(2)A在NaOH溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,当有1 mol A发生反应时,最多消耗___ mol NaOH。
C12H14O5
2
课堂练习
