4.2第1课时 醛的性质和应用(含课件)(教学课件)(共19张PPT)——2022-2023学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 4.2第1课时 醛的性质和应用(含课件)(教学课件)(共19张PPT)——2022-2023学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 30.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-14 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
专题四 生活中常用的有机物
--烃的含氧衍生物
第二单元 醛 羧酸
第1课时 醛的性质和应用
教学目标
1,掌握乙醛的结构及乙醛的氧化反应和还原反应。
2,了解醛类和甲醛的性质和用途。
3,了解银氨溶液的配制方法
CnH2nO
2.饱和一元醛的通式:
1.概念:从结构上看,由烃基(或氢原子)跟醛基相连而成的化合物叫醛。
醛类
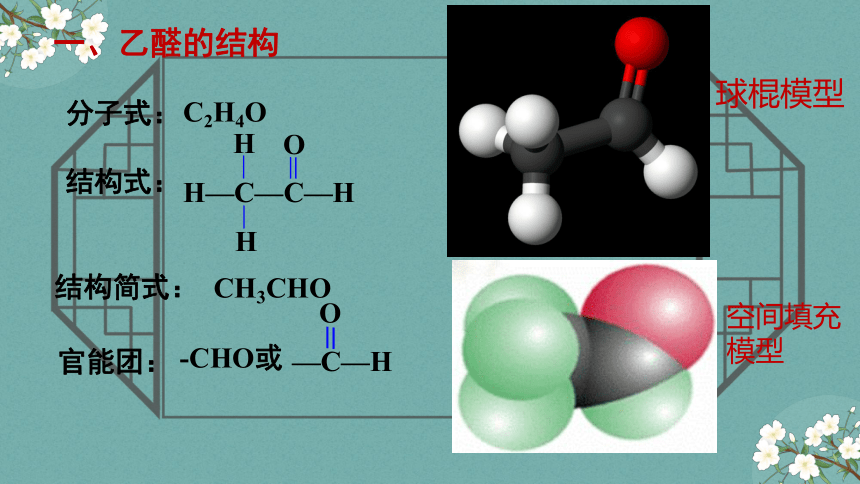
分子式:
结构式:
结构简式:
官能团:
C2H4O
CH3CHO
—C—H
O
一、乙醛的结构
-CHO或
H—C—C—H
H
H
O
球棍模型
空间填充模型
二、乙醛的物理性质
状态:无色液体
气味:有刺激性气味
密度:密度比水小
沸点:易挥发
溶解性:能跟水、乙醇、氯仿等互溶。
H—C—C—H
H
H
O
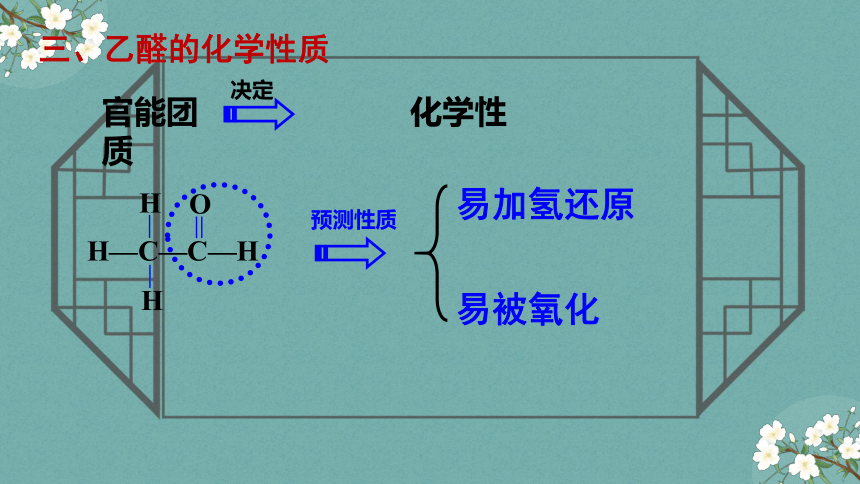
预测性质
易被氧化
易加氢还原
三、乙醛的化学性质
官能团 化学性质
决定
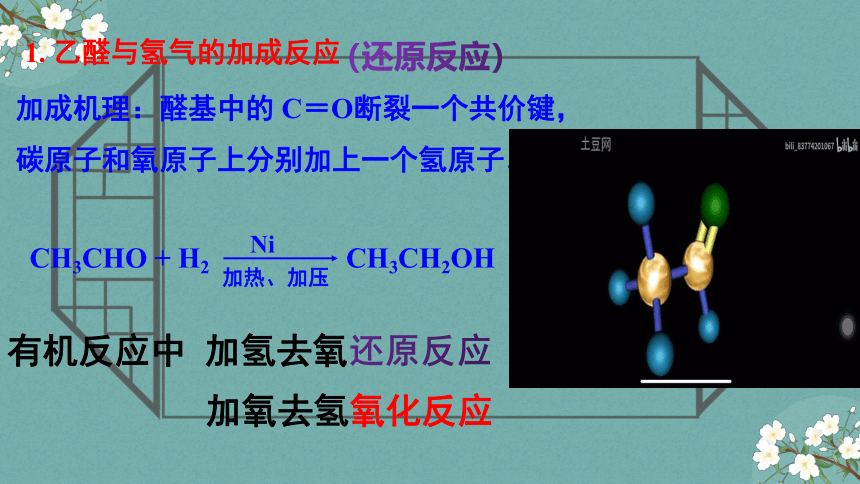
1. 乙醛与氢气的加成反应
CH3CHO + H2 CH3CH2OH
Ni
加热、加压
加成机理:醛基中的 C=O断裂一个共价键,
碳原子和氧原子上分别加上一个氢原子。
(还原反应)
有机反应中 加氢去氧还原反应
加氧去氢氧化反应
Ag+ + NH3·H2O ==AgOH↓+ NH4+
AgOH + 2NH3·H2O ==Ag(NH3)2OH + 2H2O
银氨溶液配制及反应方程式
2.氧化反应
(1)银镜反应——与银氨溶液的反应
CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O
水浴加热
此反应可以用于醛基的定性和定量检测
应用:工业上用来制瓶胆和镜子
注意:1mol醛基生成2molAg
实验步骤
现象:试管内壁有银层生成
1.试管要洁净(用碱溶液洗净)
2.水浴加热
实验注意事项:
3.试管内壁银镜的处理:
稀硝酸洗涤
5%NaOH
2%CuSO4
乙醛
现象:生成砖红色沉淀
CH3CHO+2Cu(OH)2+NaOH CH3COONa +Cu2O↓+3H2O
加热
应用:此反应用于醛基的检验和测定。
注意:1mol醛基→1mol Cu2O
(2)与新制氢氧化铜悬浊液的反应
实验注意事项:
条件:加热至沸腾
思考:这两个反应为什么必须在碱性环境下?
(3)催化氧化
2CH3-C-H + O2 2CH3-C-OH
催化剂
Δ
=
=
O O
(4)乙醛能被酸性KMnO4溶液或溴水氧化
思考:能使酸性KMnO4溶液或溴水褪色的有机物有哪些
CH3CH2OH
还原反应
得氢
得氧
氧化反应
与H2发生加成反应
在C-H之间插入O
O
CH3 C H
—
—
小结:
b.弱氧化剂:银氨溶液、
新制的Cu(OH)2
c.使酸性高锰酸钾溶液、溴水褪色
a.催化氧化
CH3 C
O
OH
—
—
化
第二部分,甲醛
一、甲醛的物理性质
最简单的醛,无色,易溶于水,有刺激性气味的气体,俗称蚁醛。
质量分数为35%~40%的甲醛水溶液(又称福尔马林)具有杀菌、防腐性能。
二.甲醛的分子结构
O
||
H—C—H
结构式:
分子式:
CH2O
结构简式:
HCHO
官能团:
-CHO
醛基
醛基
甲醛中有两个醛基
加热
三.甲醛的化学性质
HCHO+4Ag(NH3)2OH 4Ag↓+(NH4)2CO3+6NH3 +2H2O
水浴加热
(1)银镜反应
1mol甲醛最多可以还原得到多少摩尔Ag
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+ Na2CO3+ 6H2O
(2)甲醛与新制的氢氧化铜悬浊液反应。
(3)缩聚反应
定义:有机物分子间相互反应脱去小分子生成高分子的反应
三 酮类
1.官能团:
—C—
=
O
羰基
CnH2nO
2.饱和一元酮的通式:
丙酮
专题四 生活中常用的有机物
--烃的含氧衍生物
第二单元 醛 羧酸
第1课时 醛的性质和应用
教学目标
1,掌握乙醛的结构及乙醛的氧化反应和还原反应。
2,了解醛类和甲醛的性质和用途。
3,了解银氨溶液的配制方法
CnH2nO
2.饱和一元醛的通式:
1.概念:从结构上看,由烃基(或氢原子)跟醛基相连而成的化合物叫醛。
醛类
分子式:
结构式:
结构简式:
官能团:
C2H4O
CH3CHO
—C—H
O
一、乙醛的结构
-CHO或
H—C—C—H
H
H
O
球棍模型
空间填充模型
二、乙醛的物理性质
状态:无色液体
气味:有刺激性气味
密度:密度比水小
沸点:易挥发
溶解性:能跟水、乙醇、氯仿等互溶。
H—C—C—H
H
H
O
预测性质
易被氧化
易加氢还原
三、乙醛的化学性质
官能团 化学性质
决定
1. 乙醛与氢气的加成反应
CH3CHO + H2 CH3CH2OH
Ni
加热、加压
加成机理:醛基中的 C=O断裂一个共价键,
碳原子和氧原子上分别加上一个氢原子。
(还原反应)
有机反应中 加氢去氧还原反应
加氧去氢氧化反应
Ag+ + NH3·H2O ==AgOH↓+ NH4+
AgOH + 2NH3·H2O ==Ag(NH3)2OH + 2H2O
银氨溶液配制及反应方程式
2.氧化反应
(1)银镜反应——与银氨溶液的反应
CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O
水浴加热
此反应可以用于醛基的定性和定量检测
应用:工业上用来制瓶胆和镜子
注意:1mol醛基生成2molAg
实验步骤
现象:试管内壁有银层生成
1.试管要洁净(用碱溶液洗净)
2.水浴加热
实验注意事项:
3.试管内壁银镜的处理:
稀硝酸洗涤
5%NaOH
2%CuSO4
乙醛
现象:生成砖红色沉淀
CH3CHO+2Cu(OH)2+NaOH CH3COONa +Cu2O↓+3H2O
加热
应用:此反应用于醛基的检验和测定。
注意:1mol醛基→1mol Cu2O
(2)与新制氢氧化铜悬浊液的反应
实验注意事项:
条件:加热至沸腾
思考:这两个反应为什么必须在碱性环境下?
(3)催化氧化
2CH3-C-H + O2 2CH3-C-OH
催化剂
Δ
=
=
O O
(4)乙醛能被酸性KMnO4溶液或溴水氧化
思考:能使酸性KMnO4溶液或溴水褪色的有机物有哪些
CH3CH2OH
还原反应
得氢
得氧
氧化反应
与H2发生加成反应
在C-H之间插入O
O
CH3 C H
—
—
小结:
b.弱氧化剂:银氨溶液、
新制的Cu(OH)2
c.使酸性高锰酸钾溶液、溴水褪色
a.催化氧化
CH3 C
O
OH
—
—
化
第二部分,甲醛
一、甲醛的物理性质
最简单的醛,无色,易溶于水,有刺激性气味的气体,俗称蚁醛。
质量分数为35%~40%的甲醛水溶液(又称福尔马林)具有杀菌、防腐性能。
二.甲醛的分子结构
O
||
H—C—H
结构式:
分子式:
CH2O
结构简式:
HCHO
官能团:
-CHO
醛基
醛基
甲醛中有两个醛基
加热
三.甲醛的化学性质
HCHO+4Ag(NH3)2OH 4Ag↓+(NH4)2CO3+6NH3 +2H2O
水浴加热
(1)银镜反应
1mol甲醛最多可以还原得到多少摩尔Ag
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+ Na2CO3+ 6H2O
(2)甲醛与新制的氢氧化铜悬浊液反应。
(3)缩聚反应
定义:有机物分子间相互反应脱去小分子生成高分子的反应
三 酮类
1.官能团:
—C—
=
O
羰基
CnH2nO
2.饱和一元酮的通式:
丙酮
