2.1共价键 课时作业(含解析)
文档属性
| 名称 | 2.1共价键 课时作业(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 526.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-15 00:00:00 | ||
图片预览



文档简介
2.1共价键 课时作业
一、单选题
1.在特定催化剂条件下,可除去废气中的氮氧化物,总反应为,设为阿伏加德罗常数的值,下列说法错误的是
A.所含中子数为
B.生成标准状况下,转移的电子数为
C.该反应中消耗还原剂,生成的键的个数为
D.装有的集气瓶中含有的分子数小于
2.下列叙述正确的是
A.与的结构相似,分子中σ键与π键的数目之比为1:1
B.CO与的结构相似,CO分子中σ键与π键的数目之比为2:1
C.共价化合物中含有σ键,离子化合物中也含有σ键
D.已知反应,若该反应中有断裂,则形成的π键的数目为
3.中美学者携手发现了全硼富勒烯团簇。团簇的结构酷似中国的红灯笼(如图所示)。该材料可用于组装分子器件,在储氢储锂、半导体、超导、绿色催化等领域具有重要的应用前景。下列有关说法正确的是( )
A.与石墨烯的结构相同,二者互为同素异形体
B.含有原子
C.中既含极性键,又含非极性键
D.和同主族,在反应中都只能形成简单阳离子
4.原子数目相等和电子数目相等的微粒叫等电子体,下列各组微粒中属于等电子体的是
A.CH4、NH3 B.S2-、Cl-
C.CO2、HCl D.OH-、
5.下列说法中,错误的是
A.氧原子有两个未成对电子,因而能形成2个共价键
B.氧原子可以形成H2O、H2O2,也可能形成H3O
C.已知 H2O2的分子结构是,在H2O2中只有σ键没有π键
D.已知 N2的分子结构是NN,在N2中有1个σ键和2个π键
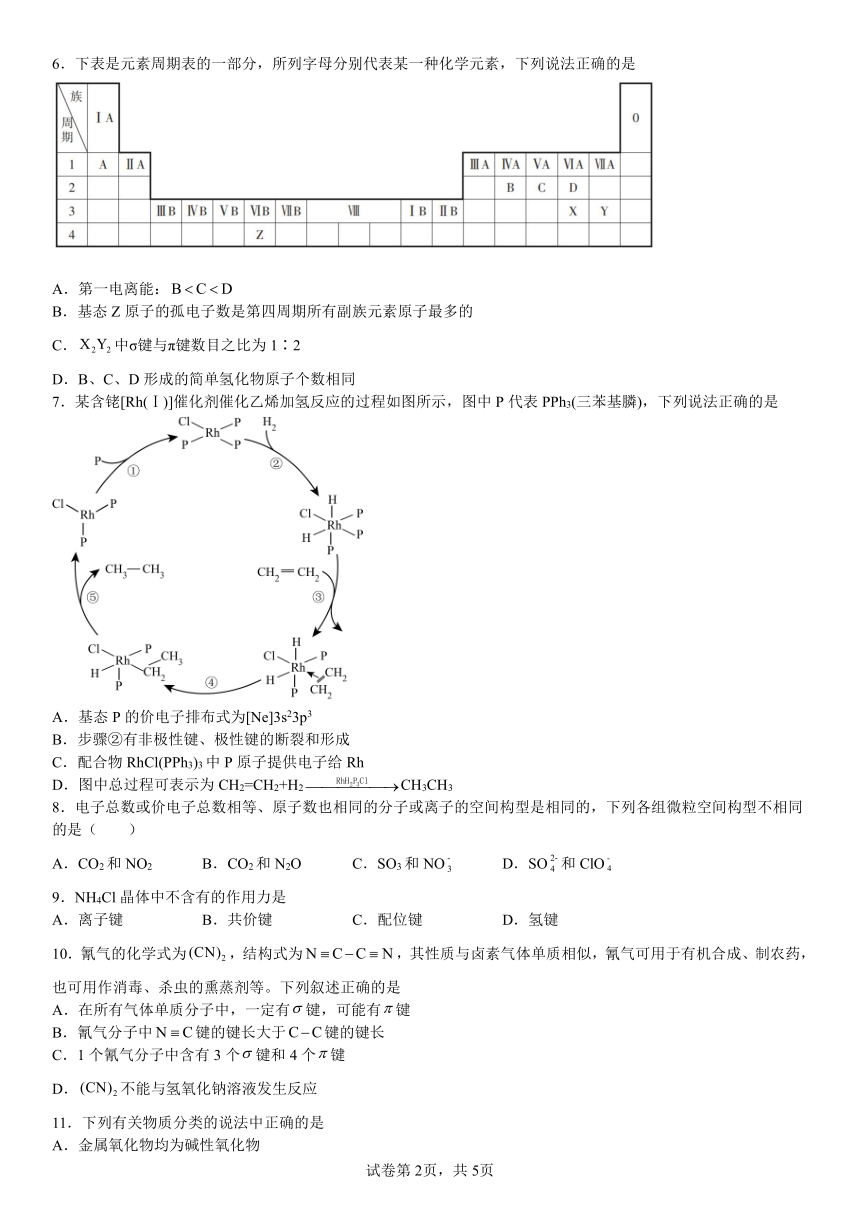
6.下表是元素周期表的一部分,所列字母分别代表某一种化学元素,下列说法正确的是
A.第一电离能:
B.基态Z原子的孤电子数是第四周期所有副族元素原子最多的
C.中σ键与π键数目之比为1∶2
D.B、C、D形成的简单氢化物原子个数相同
7.某含铑[Rh(Ⅰ)]催化剂催化乙烯加氢反应的过程如图所示,图中P代表PPh3(三苯基膦),下列说法正确的是
A.基态P的价电子排布式为[Ne]3s23p3
B.步骤②有非极性键、极性键的断裂和形成
C.配合物RhCl(PPh3)3中P原子提供电子给Rh
D.图中总过程可表示为CH2=CH2+H2CH3CH3
8.电子总数或价电子总数相等、原子数也相同的分子或离子的空间构型是相同的,下列各组微粒空间构型不相同的是( )
A.CO2和NO2 B.CO2和N2O C.SO3和NO D.SO和ClO
9.NH4Cl晶体中不含有的作用力是
A.离子键 B.共价键 C.配位键 D.氢键
10.氰气的化学式为,结构式为,其性质与卤素气体单质相似,氰气可用于有机合成、制农药,也可用作消毒、杀虫的熏蒸剂等。下列叙述正确的是
A.在所有气体单质分子中,一定有键,可能有键
B.氰气分子中键的键长大于键的键长
C.1个氰气分子中含有3个键和4个键
D.不能与氢氧化钠溶液发生反应
11.下列有关物质分类的说法中正确的是
A.金属氧化物均为碱性氧化物
B.非金属氧化物不一定是酸性氧化物
C.溶于水能电离出H+的化合物都是酸
D.由非金属元素组成的化合物一定共价化合物
12.氰化物剧毒,工业上采用将废水中的氧化成无毒物质,反应为。下列有关说法正确的是
A.该反应涉及两种共价化合物 B.中子数为19的氯原子为
C.的电子式为 D.中含离子键和共价键
13.下列说法错误的是
A.由非金属元素形成的单质中一定存在非极性键
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.由非金属元素形成的化合物中可能存在离子键
14.下列说法正确的是
A.键和键比例为7:1
B.某元素气态基态原子的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+
C.共价键的键长越短,形成的共价键键能就一定越大
D.1个S原子最多只能与2个H原子结合形成分子,是由共价键的饱和性决定的
15.关于键长、键能和键角的说法中不正确的是
A.键角是描述分子立体结构的重要参数 B.键长的大小与成键原子的半径有关
C.多原子分子的键角一定,表明共价键具有方向性 D.键能越大,键长就越长,共价化合物也就越稳定
二、填空题
16.某有机物分子的结构简式为,该分子中有_______个σ键,_______个π键,_______(填“有”或“没有”)非极性键。根据共价键的类型和极性可推测该物质可发生_______反应和_______反应,与钠反应的剧烈程度比水与钠反应的剧烈程度_______。原因是CH2=CHCOOH中中的氢氧键受酮羰基影响,极性更强,更易断裂。
17.查阅教材附录中键长和键能的数据,将、、、四种气态氢化物按稳定性由强到弱排序并说明原因____。
三、实验题
18.碱金属元素和卤族元素广泛存在,用化学用语回答下列问题。
(1)氢氟酸可以用来雕刻玻璃。用电子式表示氟化氢的形成过程__________。
(2)过氧化钠可以用于潜水艇中氧气的来源,其与二氧化碳反应的化学方程式是_____。
(3)次氯酸钠溶液(pH>7)和溴化钠溶液混合,可以作为角膜塑形镜的除蛋白液。二者混合后,溶液变成淡黄色,该反应的离子方程式是_____________________。
(4)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。组装该电池必须在无水条件下进行,原因是_____________(用化学方程式表示)。
(5)关于碱金属和卤族元素,下列说法一定正确的是____________。
A.从上到下,单质密度依次增大 B.从上到下,单质熔沸点依次升高
C.从上到下,原子半径依次增大 D.单质都可以与水反应
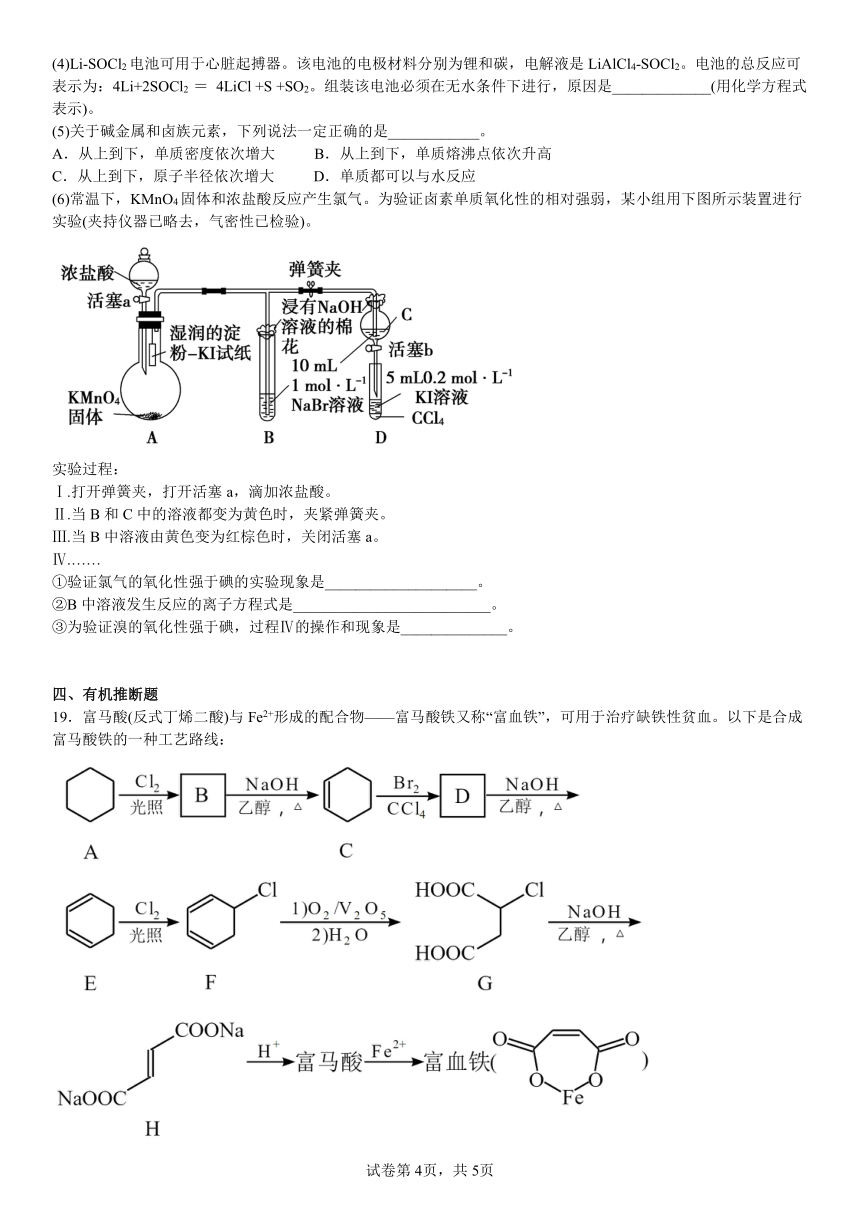
(6)常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
①验证氯气的氧化性强于碘的实验现象是____________________。
②B中溶液发生反应的离子方程式是__________________________。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________。
四、有机推断题
19.富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
回答下列问题:
(1)由A生成B的反应类型为___,反应的化学方程式为:___。
(2)由D生成E的反应类型为___,反应的化学方程式为:__。
(3)检验富血铁中是否含有Fe3+的实验所用的试剂是___。富血铁中存在的化学键有___。
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
(4)富马酸为二元羧酸,富马酸的同分异构体中,同为二元羧酸的还有___,___(写出结构简式,考虑立体异构)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.1个分子含有17个中子,则所含中子数为,A正确;
B.该反应中、、中的化合价变化分别为-3→0、+2→0、+4→0,所以生成标准状况下(即)时,转移的电子数为,B正确;
C.由反应的各物质中元素化合价变化情况可知,作还原剂,该反应中消耗还原剂,生成氮气、水,键个数为,C错误;
D.,则装有(即)的集气瓶中含有的分子数小于,D正确;
故选C。
2.C
【详解】A.由与的结构相似,可推断出的结构简式为,其分子中含有6个σ键和3个π键,所以σ键与π键的数目之比为2:1,A项错误;
B.CO与的结构相似,则CO的结构式为,σ键与π键的数目之比为1:2,B项错误;
C.中的和都是共价单键,属于可键,中存在共价单键,是可键,C项正确;
D.分子中含有4个,若该反应中有断裂,则生成,形成π键的数目是,D项错误。
故选:C。
3.B
【详解】A. 与石墨烯是不同元素形成的单质,不互为同素异形体,A项错误;
B. 的物质的量为,含有原子,B项正确;
C. 中没有极性键,只含有非极性键,C项错误;
D. 可形成,可形成,D项错误;
答案选B。
4.B
【详解】A.CH4和NH3电子数分别为6+1×4=10,7+1×3=10,原子数目不相等,故A错误;
B.S2-和Cl-电子数分别为16+2=18,17+1=18,原子数目相等,故B正确;
C.CO2和HCl电子数分别为6+8×2=22,1+17=18,原子数目不相等,故C错误;
D.OH-和电子数分别为8+1+1=10,7+1×2+1=10,原子数目不相等,故D错误;
故选B。
5.B
【详解】A.氧原子有两个未成对电子,其余4个电子形成2对,还缺少两个电子达到8电子稳定结构,因而能形成2个共价键,A正确;
B.根据共价键的饱和性可知,氧原子最多形成2个共价键,所以不存在H3O分子,B错误;
C.根据H2O2的分子结构可知,其分子中均为单键,没有双键或三键,即在H2O2中只有σ键没有π键,C正确;
D.N2的分子结构是NN,形成氮氮三键,三键中有1个σ键和2个π键,D正确;
综上所述答案为B。
6.B
【分析】由元素在周期表中的位置可知,A为H,B为C,C为N,D为O,X为S,Y为Cl,Z为Cr,据此解答。
【详解】A.同周期主族元素随着原子序数增大,第一电离能呈增大的趋势,但第ⅡA族和第ⅤA族反常,所以第一电离能:C>D>B,故A错误;
B.基态Cr原子核外电子排布式为1s22s22p63s23p63d54s1,因此孤电子数是第四周期所有副族元素原子最多的,故B正确;
C.为S2Cl2,结构式为Cl-S-S-Cl,分子中不存在π键,故C错误;
D.B、C、D形成的简单氢化物分别为CH4、NH3、H2O,原子总数不一样,故D错误;
故选B。
7.D
【详解】A.P的原子序数为15,基态P原子最外层有5个电子,价电子排布式为3s23p3,A项错误;
B.步骤②中H2中存在H-H非极性共价键,H-H键的断裂,生成Rh-H极性共价键,则步骤②中有非极性共价键断裂,极性共价键生成,B项错误;
C.配合物RhCl(PPh3)3中P原子形成三对共价键,Cl原子形成一对共价键,则P原子和Cl原子提供电子给Rh,C项错误;
D.铑[Rh(Ⅰ)]催化剂催化乙烯加氢反应的过程总反应为CH2=CH2+H2CH3CH3,D项正确;
答案选D。
8.A
【详解】A.CO2和NO2的价电子总数分别为16、17个,不相等,故空间构型不同,A正确;
B.CO2和N2O价电子总数分别为4+26=16、25+6=16,均为16个,原子数均为3个,故空间构型相同,B正确;
C.SO3和NO价电子总数分别为46=24、5+36+1=24,均为24个,原子数均为4个,故空间构型相同,C正确;
D.SO和ClO价电子总数分别为6+46+2=32、7+46+1=32,均为32个,原子数均为5个,故空间构型相同,D正确;
答案选A。
9.D
【详解】NH4Cl是由与Cl-通过离子键结合形成的离子晶体,在阳离子中含有共价键和配位键,故NH4Cl晶体中含有的作用力是离子键、共价键、配位键,而不存在氢键,故合理选项是D。
10.C
【详解】A.稀有气体为单原子分子,不存在化学键,A错误;
B.成键原子半径越小,键长越短,氮原子半径小于碳原子半径,故键比键的键长短,B错误;
C.单键为σ键、三键为1个σ键和2个π键,氰气的结构式为,1个氰气分子中含有3个σ键和4个π键,C正确;
D.卤素单质能与氢氧化钠溶液反应,氰气性质与卤素气体单质相似,则氰气能与氢氧化钠溶液反应,D错误;
答案选C。
11.B
【分析】
【详解】A.碱性氧化物都是金属氧化物,但金属氧化物不一定是碱性氧化物,如Al2O3属于两性氧化物,故错误;
B.非金属氧化物不一定是酸性氧化物,如CO和NO2等不属于酸性氧化物,故正确;
C.能电离出H+的不一定是酸,如NaHSO4,酸是电离出的阳离子全部是H+的化合物,故错误;
D.由非金属元素组成的化合物不一定共价化合物,如铵盐,所有铵盐都是离子化合物,故错误。
故选B。
12.D
【详解】A.该反应中只有水是共价化合物,故A错误;
B.中子数为19的氯原子表示为,故B错误;
C.是离子化合物,电子式为,故C错误;
D.是离子化合物,含离子键和共价键,故D正确;
选D。
13.A
【详解】A. 由非金属元素形成的单质中不一定存在化学键,如稀有气体等,故A错误;
B. 只含有共价键的化合物是共价化合物,所以在共价化合物中一定含有共价键,故B正确;
C. 含有离子键的化合物一定是离子化合物,故C正确;
D. 由非金属元素形成的化合物中可能存在离子键,如NH4Cl等,故D正确;
答案选A。
14.D
【详解】A.单键为键,双键为1个键、1个键,结构中共有16个单键、2个双键,即18个键、2个键,键和键比例为9:1,A错误;
B.该元素第三电离能剧增,最外层应有2个电子,表现为+2价,当它与氯气反应时可能生成的阳离子是X2+,B错误;
C.原子间共用电子对数目相同的共价键,键长越短、键能越大,如氮氮三键的键长小于碳碳三键的键长,氮氮三键的键能大于碳碳三键的键能,氮氮三键的键长大于O-H键的键长,但氮氮三键的键能大于O-H键的键能,C错误;
D.硫原子最外层有6个电子,有2个未成对电子,1个S原子最多只能与2个H原子结合形成分子,是由共价键的饱和性决定的,D正确;
答案选D。
15.D
【详解】A.键角是分子中两个共价键之间的夹角,是描述分子立体结构的重要参数,故A正确;
B.影响键长的因素有:参与成键的原子半径、成键原子的周围环境,与成键原子的半径和成键数目有关,故B正确;
C.多原子分子的键角一定,表明共价键具有方向性,故C正确;
D.键能越大,键长越短,共价化合物越稳定,故D错误。
故选D。
16. 8 2 有 加成 取代 大
【解析】略
17.HF> H2O> NH3 > PH3
【详解】查阅教材附录中键长和键能的数据可知,H-F键长为0.092nm,键能为565kJ/mol,O-H键长为0.101nm,键能为467 kJ/mol,N-H的键长为0.101nm,键能为391 kJ/mol,P-H的键长为0.142nm,键能为320 kJ/mol,氢化物的稳定性取决于共价键的键能大小,键能越大,物质的稳定性越强,共价键的键能取决于共价键的键长,键长越长,键能越小,键长越短,键能越大,同周期,从左向右原子半径逐渐减下,同主族,从上到下原子半径逐渐增大,故稳定性为:HF> H2O> NH3 > PH3。
18. 2Na2O2+2CO2=2Na2CO3+O2 ClO-+2Br-+H2O=Cl-+Br2+2OH- 2Li+2H2O=2LiOH+H2↑ CD A中湿润的淀粉碘化钾试纸变蓝 Cl2+2Br-=Br2+2Cl- 打开活塞b,C中溶液滴入试管D中,关闭活塞b,取下试管D,振荡、静置,若溶液分层,且下层溶液变为紫红色,则证明溴的氧化性强于碘
【分析】(1)HF为共价化合物,按照电子式表示物质形成过程的要求进行书写;
(2)从过氧化钠的性质入手即可;
(3)次氯酸钠具有强氧化性,能将溴化钠氧化,从而书写出离子方程式;
(4)Li属于碱金属,从这个角度进行分析;
(5)从同主族从上到下性质的相似性和递变性角度进行分析;
(6)实验目的是验证是卤素单质氧化性的相对较弱,反应原理是Cl2+2Br-=2Cl-+Br2、Br2+2I-=I2+2Br-、Cl2+2I-=2Cl-+I2,然后具体分析;
【详解】(1)HF为共价化合物,其结构式为H-F,因此用电子式表示氟化氢形成的过程为;
(2)过氧化钠能与CO2发生反应生成Na2CO3和O2,反应方程式为2Na2O2+2CO2=2Na2CO3+O2;
(3)次氯酸钠与溴化钠混合,溶液变为淡黄色,说明有溴单质生成,利用次氯酸钠具有强氧化性,将Br-氧化成Br2,离子方程式为2Br-+ClO-+H2O=Cl-+Br2+2OH-;
(4)Li属于碱金属,易与水发生反应,反应的方程式为2Li+2H2O=2LiOH+H2↑,因此Li-SOCl2电池必须在无水条件下进行;
(5)A. 碱金属从上到下,密度呈增大的趋势,但K的密度比Na小,故A错误;
B. 碱金属从上到下,单质熔沸点逐渐降低,故B错误;
C. 同主族从上到下,电子层数增多,原子半径依次增大,故C正确;
D. 碱金属、卤族元素都能水发生反应,故D正确;
答案:CD;
(6)①圆底烧瓶中产生的Cl2与A中的KI发生反应:Cl2+2I-=2Cl-+I2,淀粉与碘单质变蓝,即A中湿润的淀粉碘化钾试纸变蓝,说明氯气的氧化性强于碘;
②氯气的氧化性强于Br2,将Cl2通入NaBr溶液中,B中发生反应的离子方程式为Cl2+2Br-=2Cl-+Br2;
③验证Br2的氧化性强于碘,利用的原理是Br2+2I-=I2+2Br-;根据实验过程II、III,说明C中不含Cl2,则过程Ⅳ的操作和现象是打开活塞b,C中溶液滴入试管D中,关闭活塞b,取下试管D,振荡、静置,若溶液分层,且下层溶液变为紫红色,则证明溴的氧化性强于碘。
【点睛】用电子式表示物质的形成过程,首先判断形成的物质是离子化合物还是共价化合物,然后按离子化合物、共价化合物形成过程的书写要点书写。
19. 取代反应 +Cl2+HCl 消去反应 +2NaOH+2NaBr+2H2O KSCN溶液或苯酚溶液 BCEF
【分析】环己烷与氯气发生取代反应生成B,B在氢氧化钠的醇溶液中发生消去反应生成环己烯,可知B是一氯环己烷,环己烯和溴的四氯化碳溶液发生加成反应生成D,D是1,2-二氯环己烷;酸化得到富马酸,富马酸的结构简式是。
【详解】(1)环己烷与氯气在光照条件下发生取代反应生成,反应类型为取代反应,反应的化学方程式为+Cl2+HCl;
(2)D是 ,在氢氧化钠的醇溶液中发生消去反应生成,反应类型为消去反应,反应的化学方程式为+2NaOH+2NaBr+2H2O;
(3) Fe3+遇KSCN溶液变红色,苯酚与Fe3+发生显色反应,检验富血铁中是否含有Fe3+所用的试剂是KSCN溶液或苯酚溶液。Fe2+和反应生成 ,可知富血铁是离子化合物,存在的化学键有离子键、共价键 、σ键、π键,选ABEF;
(4) 为二元羧酸,富马酸的同分异构体中,同为二元羧酸的还有,。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.在特定催化剂条件下,可除去废气中的氮氧化物,总反应为,设为阿伏加德罗常数的值,下列说法错误的是
A.所含中子数为
B.生成标准状况下,转移的电子数为
C.该反应中消耗还原剂,生成的键的个数为
D.装有的集气瓶中含有的分子数小于
2.下列叙述正确的是
A.与的结构相似,分子中σ键与π键的数目之比为1:1
B.CO与的结构相似,CO分子中σ键与π键的数目之比为2:1
C.共价化合物中含有σ键,离子化合物中也含有σ键
D.已知反应,若该反应中有断裂,则形成的π键的数目为
3.中美学者携手发现了全硼富勒烯团簇。团簇的结构酷似中国的红灯笼(如图所示)。该材料可用于组装分子器件,在储氢储锂、半导体、超导、绿色催化等领域具有重要的应用前景。下列有关说法正确的是( )
A.与石墨烯的结构相同,二者互为同素异形体
B.含有原子
C.中既含极性键,又含非极性键
D.和同主族,在反应中都只能形成简单阳离子
4.原子数目相等和电子数目相等的微粒叫等电子体,下列各组微粒中属于等电子体的是
A.CH4、NH3 B.S2-、Cl-
C.CO2、HCl D.OH-、
5.下列说法中,错误的是
A.氧原子有两个未成对电子,因而能形成2个共价键
B.氧原子可以形成H2O、H2O2,也可能形成H3O
C.已知 H2O2的分子结构是,在H2O2中只有σ键没有π键
D.已知 N2的分子结构是NN,在N2中有1个σ键和2个π键
6.下表是元素周期表的一部分,所列字母分别代表某一种化学元素,下列说法正确的是
A.第一电离能:
B.基态Z原子的孤电子数是第四周期所有副族元素原子最多的
C.中σ键与π键数目之比为1∶2
D.B、C、D形成的简单氢化物原子个数相同
7.某含铑[Rh(Ⅰ)]催化剂催化乙烯加氢反应的过程如图所示,图中P代表PPh3(三苯基膦),下列说法正确的是
A.基态P的价电子排布式为[Ne]3s23p3
B.步骤②有非极性键、极性键的断裂和形成
C.配合物RhCl(PPh3)3中P原子提供电子给Rh
D.图中总过程可表示为CH2=CH2+H2CH3CH3
8.电子总数或价电子总数相等、原子数也相同的分子或离子的空间构型是相同的,下列各组微粒空间构型不相同的是( )
A.CO2和NO2 B.CO2和N2O C.SO3和NO D.SO和ClO
9.NH4Cl晶体中不含有的作用力是
A.离子键 B.共价键 C.配位键 D.氢键
10.氰气的化学式为,结构式为,其性质与卤素气体单质相似,氰气可用于有机合成、制农药,也可用作消毒、杀虫的熏蒸剂等。下列叙述正确的是
A.在所有气体单质分子中,一定有键,可能有键
B.氰气分子中键的键长大于键的键长
C.1个氰气分子中含有3个键和4个键
D.不能与氢氧化钠溶液发生反应
11.下列有关物质分类的说法中正确的是
A.金属氧化物均为碱性氧化物
B.非金属氧化物不一定是酸性氧化物
C.溶于水能电离出H+的化合物都是酸
D.由非金属元素组成的化合物一定共价化合物
12.氰化物剧毒,工业上采用将废水中的氧化成无毒物质,反应为。下列有关说法正确的是
A.该反应涉及两种共价化合物 B.中子数为19的氯原子为
C.的电子式为 D.中含离子键和共价键
13.下列说法错误的是
A.由非金属元素形成的单质中一定存在非极性键
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.由非金属元素形成的化合物中可能存在离子键
14.下列说法正确的是
A.键和键比例为7:1
B.某元素气态基态原子的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+
C.共价键的键长越短,形成的共价键键能就一定越大
D.1个S原子最多只能与2个H原子结合形成分子,是由共价键的饱和性决定的
15.关于键长、键能和键角的说法中不正确的是
A.键角是描述分子立体结构的重要参数 B.键长的大小与成键原子的半径有关
C.多原子分子的键角一定,表明共价键具有方向性 D.键能越大,键长就越长,共价化合物也就越稳定
二、填空题
16.某有机物分子的结构简式为,该分子中有_______个σ键,_______个π键,_______(填“有”或“没有”)非极性键。根据共价键的类型和极性可推测该物质可发生_______反应和_______反应,与钠反应的剧烈程度比水与钠反应的剧烈程度_______。原因是CH2=CHCOOH中中的氢氧键受酮羰基影响,极性更强,更易断裂。
17.查阅教材附录中键长和键能的数据,将、、、四种气态氢化物按稳定性由强到弱排序并说明原因____。
三、实验题
18.碱金属元素和卤族元素广泛存在,用化学用语回答下列问题。
(1)氢氟酸可以用来雕刻玻璃。用电子式表示氟化氢的形成过程__________。
(2)过氧化钠可以用于潜水艇中氧气的来源,其与二氧化碳反应的化学方程式是_____。
(3)次氯酸钠溶液(pH>7)和溴化钠溶液混合,可以作为角膜塑形镜的除蛋白液。二者混合后,溶液变成淡黄色,该反应的离子方程式是_____________________。
(4)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。组装该电池必须在无水条件下进行,原因是_____________(用化学方程式表示)。
(5)关于碱金属和卤族元素,下列说法一定正确的是____________。
A.从上到下,单质密度依次增大 B.从上到下,单质熔沸点依次升高
C.从上到下,原子半径依次增大 D.单质都可以与水反应
(6)常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
①验证氯气的氧化性强于碘的实验现象是____________________。
②B中溶液发生反应的离子方程式是__________________________。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________。
四、有机推断题
19.富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
回答下列问题:
(1)由A生成B的反应类型为___,反应的化学方程式为:___。
(2)由D生成E的反应类型为___,反应的化学方程式为:__。
(3)检验富血铁中是否含有Fe3+的实验所用的试剂是___。富血铁中存在的化学键有___。
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
(4)富马酸为二元羧酸,富马酸的同分异构体中,同为二元羧酸的还有___,___(写出结构简式,考虑立体异构)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.1个分子含有17个中子,则所含中子数为,A正确;
B.该反应中、、中的化合价变化分别为-3→0、+2→0、+4→0,所以生成标准状况下(即)时,转移的电子数为,B正确;
C.由反应的各物质中元素化合价变化情况可知,作还原剂,该反应中消耗还原剂,生成氮气、水,键个数为,C错误;
D.,则装有(即)的集气瓶中含有的分子数小于,D正确;
故选C。
2.C
【详解】A.由与的结构相似,可推断出的结构简式为,其分子中含有6个σ键和3个π键,所以σ键与π键的数目之比为2:1,A项错误;
B.CO与的结构相似,则CO的结构式为,σ键与π键的数目之比为1:2,B项错误;
C.中的和都是共价单键,属于可键,中存在共价单键,是可键,C项正确;
D.分子中含有4个,若该反应中有断裂,则生成,形成π键的数目是,D项错误。
故选:C。
3.B
【详解】A. 与石墨烯是不同元素形成的单质,不互为同素异形体,A项错误;
B. 的物质的量为,含有原子,B项正确;
C. 中没有极性键,只含有非极性键,C项错误;
D. 可形成,可形成,D项错误;
答案选B。
4.B
【详解】A.CH4和NH3电子数分别为6+1×4=10,7+1×3=10,原子数目不相等,故A错误;
B.S2-和Cl-电子数分别为16+2=18,17+1=18,原子数目相等,故B正确;
C.CO2和HCl电子数分别为6+8×2=22,1+17=18,原子数目不相等,故C错误;
D.OH-和电子数分别为8+1+1=10,7+1×2+1=10,原子数目不相等,故D错误;
故选B。
5.B
【详解】A.氧原子有两个未成对电子,其余4个电子形成2对,还缺少两个电子达到8电子稳定结构,因而能形成2个共价键,A正确;
B.根据共价键的饱和性可知,氧原子最多形成2个共价键,所以不存在H3O分子,B错误;
C.根据H2O2的分子结构可知,其分子中均为单键,没有双键或三键,即在H2O2中只有σ键没有π键,C正确;
D.N2的分子结构是NN,形成氮氮三键,三键中有1个σ键和2个π键,D正确;
综上所述答案为B。
6.B
【分析】由元素在周期表中的位置可知,A为H,B为C,C为N,D为O,X为S,Y为Cl,Z为Cr,据此解答。
【详解】A.同周期主族元素随着原子序数增大,第一电离能呈增大的趋势,但第ⅡA族和第ⅤA族反常,所以第一电离能:C>D>B,故A错误;
B.基态Cr原子核外电子排布式为1s22s22p63s23p63d54s1,因此孤电子数是第四周期所有副族元素原子最多的,故B正确;
C.为S2Cl2,结构式为Cl-S-S-Cl,分子中不存在π键,故C错误;
D.B、C、D形成的简单氢化物分别为CH4、NH3、H2O,原子总数不一样,故D错误;
故选B。
7.D
【详解】A.P的原子序数为15,基态P原子最外层有5个电子,价电子排布式为3s23p3,A项错误;
B.步骤②中H2中存在H-H非极性共价键,H-H键的断裂,生成Rh-H极性共价键,则步骤②中有非极性共价键断裂,极性共价键生成,B项错误;
C.配合物RhCl(PPh3)3中P原子形成三对共价键,Cl原子形成一对共价键,则P原子和Cl原子提供电子给Rh,C项错误;
D.铑[Rh(Ⅰ)]催化剂催化乙烯加氢反应的过程总反应为CH2=CH2+H2CH3CH3,D项正确;
答案选D。
8.A
【详解】A.CO2和NO2的价电子总数分别为16、17个,不相等,故空间构型不同,A正确;
B.CO2和N2O价电子总数分别为4+26=16、25+6=16,均为16个,原子数均为3个,故空间构型相同,B正确;
C.SO3和NO价电子总数分别为46=24、5+36+1=24,均为24个,原子数均为4个,故空间构型相同,C正确;
D.SO和ClO价电子总数分别为6+46+2=32、7+46+1=32,均为32个,原子数均为5个,故空间构型相同,D正确;
答案选A。
9.D
【详解】NH4Cl是由与Cl-通过离子键结合形成的离子晶体,在阳离子中含有共价键和配位键,故NH4Cl晶体中含有的作用力是离子键、共价键、配位键,而不存在氢键,故合理选项是D。
10.C
【详解】A.稀有气体为单原子分子,不存在化学键,A错误;
B.成键原子半径越小,键长越短,氮原子半径小于碳原子半径,故键比键的键长短,B错误;
C.单键为σ键、三键为1个σ键和2个π键,氰气的结构式为,1个氰气分子中含有3个σ键和4个π键,C正确;
D.卤素单质能与氢氧化钠溶液反应,氰气性质与卤素气体单质相似,则氰气能与氢氧化钠溶液反应,D错误;
答案选C。
11.B
【分析】
【详解】A.碱性氧化物都是金属氧化物,但金属氧化物不一定是碱性氧化物,如Al2O3属于两性氧化物,故错误;
B.非金属氧化物不一定是酸性氧化物,如CO和NO2等不属于酸性氧化物,故正确;
C.能电离出H+的不一定是酸,如NaHSO4,酸是电离出的阳离子全部是H+的化合物,故错误;
D.由非金属元素组成的化合物不一定共价化合物,如铵盐,所有铵盐都是离子化合物,故错误。
故选B。
12.D
【详解】A.该反应中只有水是共价化合物,故A错误;
B.中子数为19的氯原子表示为,故B错误;
C.是离子化合物,电子式为,故C错误;
D.是离子化合物,含离子键和共价键,故D正确;
选D。
13.A
【详解】A. 由非金属元素形成的单质中不一定存在化学键,如稀有气体等,故A错误;
B. 只含有共价键的化合物是共价化合物,所以在共价化合物中一定含有共价键,故B正确;
C. 含有离子键的化合物一定是离子化合物,故C正确;
D. 由非金属元素形成的化合物中可能存在离子键,如NH4Cl等,故D正确;
答案选A。
14.D
【详解】A.单键为键,双键为1个键、1个键,结构中共有16个单键、2个双键,即18个键、2个键,键和键比例为9:1,A错误;
B.该元素第三电离能剧增,最外层应有2个电子,表现为+2价,当它与氯气反应时可能生成的阳离子是X2+,B错误;
C.原子间共用电子对数目相同的共价键,键长越短、键能越大,如氮氮三键的键长小于碳碳三键的键长,氮氮三键的键能大于碳碳三键的键能,氮氮三键的键长大于O-H键的键长,但氮氮三键的键能大于O-H键的键能,C错误;
D.硫原子最外层有6个电子,有2个未成对电子,1个S原子最多只能与2个H原子结合形成分子,是由共价键的饱和性决定的,D正确;
答案选D。
15.D
【详解】A.键角是分子中两个共价键之间的夹角,是描述分子立体结构的重要参数,故A正确;
B.影响键长的因素有:参与成键的原子半径、成键原子的周围环境,与成键原子的半径和成键数目有关,故B正确;
C.多原子分子的键角一定,表明共价键具有方向性,故C正确;
D.键能越大,键长越短,共价化合物越稳定,故D错误。
故选D。
16. 8 2 有 加成 取代 大
【解析】略
17.HF> H2O> NH3 > PH3
【详解】查阅教材附录中键长和键能的数据可知,H-F键长为0.092nm,键能为565kJ/mol,O-H键长为0.101nm,键能为467 kJ/mol,N-H的键长为0.101nm,键能为391 kJ/mol,P-H的键长为0.142nm,键能为320 kJ/mol,氢化物的稳定性取决于共价键的键能大小,键能越大,物质的稳定性越强,共价键的键能取决于共价键的键长,键长越长,键能越小,键长越短,键能越大,同周期,从左向右原子半径逐渐减下,同主族,从上到下原子半径逐渐增大,故稳定性为:HF> H2O> NH3 > PH3。
18. 2Na2O2+2CO2=2Na2CO3+O2 ClO-+2Br-+H2O=Cl-+Br2+2OH- 2Li+2H2O=2LiOH+H2↑ CD A中湿润的淀粉碘化钾试纸变蓝 Cl2+2Br-=Br2+2Cl- 打开活塞b,C中溶液滴入试管D中,关闭活塞b,取下试管D,振荡、静置,若溶液分层,且下层溶液变为紫红色,则证明溴的氧化性强于碘
【分析】(1)HF为共价化合物,按照电子式表示物质形成过程的要求进行书写;
(2)从过氧化钠的性质入手即可;
(3)次氯酸钠具有强氧化性,能将溴化钠氧化,从而书写出离子方程式;
(4)Li属于碱金属,从这个角度进行分析;
(5)从同主族从上到下性质的相似性和递变性角度进行分析;
(6)实验目的是验证是卤素单质氧化性的相对较弱,反应原理是Cl2+2Br-=2Cl-+Br2、Br2+2I-=I2+2Br-、Cl2+2I-=2Cl-+I2,然后具体分析;
【详解】(1)HF为共价化合物,其结构式为H-F,因此用电子式表示氟化氢形成的过程为;
(2)过氧化钠能与CO2发生反应生成Na2CO3和O2,反应方程式为2Na2O2+2CO2=2Na2CO3+O2;
(3)次氯酸钠与溴化钠混合,溶液变为淡黄色,说明有溴单质生成,利用次氯酸钠具有强氧化性,将Br-氧化成Br2,离子方程式为2Br-+ClO-+H2O=Cl-+Br2+2OH-;
(4)Li属于碱金属,易与水发生反应,反应的方程式为2Li+2H2O=2LiOH+H2↑,因此Li-SOCl2电池必须在无水条件下进行;
(5)A. 碱金属从上到下,密度呈增大的趋势,但K的密度比Na小,故A错误;
B. 碱金属从上到下,单质熔沸点逐渐降低,故B错误;
C. 同主族从上到下,电子层数增多,原子半径依次增大,故C正确;
D. 碱金属、卤族元素都能水发生反应,故D正确;
答案:CD;
(6)①圆底烧瓶中产生的Cl2与A中的KI发生反应:Cl2+2I-=2Cl-+I2,淀粉与碘单质变蓝,即A中湿润的淀粉碘化钾试纸变蓝,说明氯气的氧化性强于碘;
②氯气的氧化性强于Br2,将Cl2通入NaBr溶液中,B中发生反应的离子方程式为Cl2+2Br-=2Cl-+Br2;
③验证Br2的氧化性强于碘,利用的原理是Br2+2I-=I2+2Br-;根据实验过程II、III,说明C中不含Cl2,则过程Ⅳ的操作和现象是打开活塞b,C中溶液滴入试管D中,关闭活塞b,取下试管D,振荡、静置,若溶液分层,且下层溶液变为紫红色,则证明溴的氧化性强于碘。
【点睛】用电子式表示物质的形成过程,首先判断形成的物质是离子化合物还是共价化合物,然后按离子化合物、共价化合物形成过程的书写要点书写。
19. 取代反应 +Cl2+HCl 消去反应 +2NaOH+2NaBr+2H2O KSCN溶液或苯酚溶液 BCEF
【分析】环己烷与氯气发生取代反应生成B,B在氢氧化钠的醇溶液中发生消去反应生成环己烯,可知B是一氯环己烷,环己烯和溴的四氯化碳溶液发生加成反应生成D,D是1,2-二氯环己烷;酸化得到富马酸,富马酸的结构简式是。
【详解】(1)环己烷与氯气在光照条件下发生取代反应生成,反应类型为取代反应,反应的化学方程式为+Cl2+HCl;
(2)D是 ,在氢氧化钠的醇溶液中发生消去反应生成,反应类型为消去反应,反应的化学方程式为+2NaOH+2NaBr+2H2O;
(3) Fe3+遇KSCN溶液变红色,苯酚与Fe3+发生显色反应,检验富血铁中是否含有Fe3+所用的试剂是KSCN溶液或苯酚溶液。Fe2+和反应生成 ,可知富血铁是离子化合物,存在的化学键有离子键、共价键 、σ键、π键,选ABEF;
(4) 为二元羧酸,富马酸的同分异构体中,同为二元羧酸的还有,。
答案第1页,共2页
答案第1页,共2页
