3.2分子晶体与共计晶体 课时作业(含答案)
文档属性
| 名称 | 3.2分子晶体与共计晶体 课时作业(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 345.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-15 00:00:00 | ||
图片预览


文档简介
3.2分子晶体与共计晶体 课时作业
一、单选题
1.二茂铁[(C5H5)2Fe]是由一个二价铁离子和2个环戊二烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域。已知:二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等溶剂。下列说法正确的是( )
A.二茂铁属于离子晶体
B.在二茂铁结构中,C5H与Fe2+之间形成的化学键类型是离子键
C.已知:环戊二烯的结构式为: ,则其中碳环上有2个π键和5个σ键
D.二价铁离子的基态电子排布式为:[Ar]3d44s2
2.氮氧化铝(AlON)是一种透明高硬度防弹材料,硬度为石英玻璃的 4 倍,可耐 120 摄氏度的高温。下列描述错误的是( )
A.AlON 和石英的化学键类型相同 B.AlON 和石英晶体类型相同
C.AlON 和 NaCl 的化学键类型不同 D.AlON 和 NaCl 晶体类型相同
3.我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法不正确的是
A.氮化硼晶体有较高的熔沸点
B.该晶体具有良好的导电性
C.该晶胞中含有4个B原子,4个N原子
D.N原子周围等距且最近的N原子数为12
4.下列说法正确的是
A.构成共价晶体的原子的半径越大,晶体的硬度越大
B.施加电场时,液晶分子垂直于电场方向排列
C.冰融化时,分子中氢氧键发生断裂
D.液晶分子在特定方向排列比较整齐,但不稳定
5.类比推理是化学中常用的思维方法。下列推理正确的是
A.干冰(CO2)是分子晶体,推测SiO2,也是分于晶体
B.SiH4的沸点高于CH4,推测H2Se的沸点高于H2S
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成Fel3
D.NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4,加热可制HBr
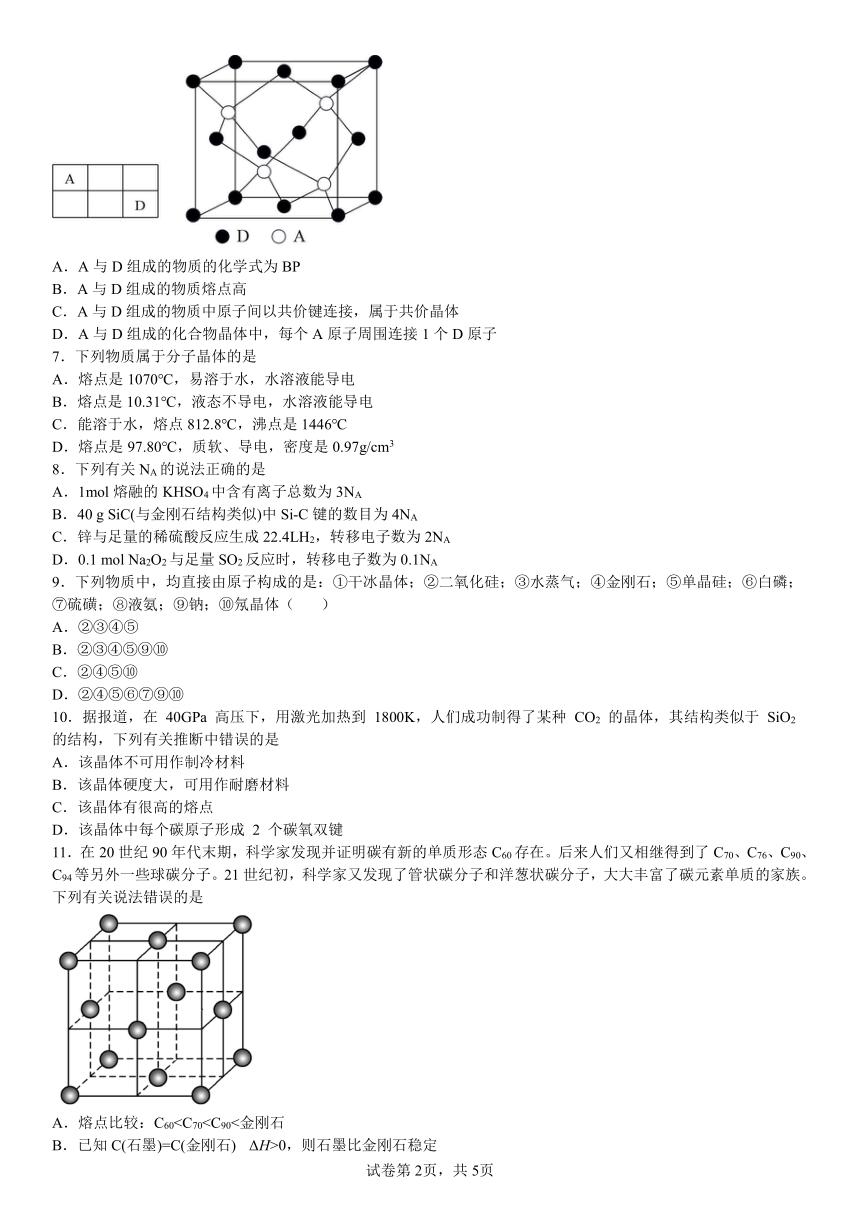
6.已知A、D两种短周期元素在元素周期表中的相对位置如表,其中D的原子序数是A的原子序数的3倍。A与D组成的物质是一种超硬耐磨涂层材料,如图为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构。下列有关说法错误的是
A.A与D组成的物质的化学式为BP
B.A与D组成的物质熔点高
C.A与D组成的物质中原子间以共价键连接,属于共价晶体
D.A与D组成的化合物晶体中,每个A原子周围连接1个D原子
7.下列物质属于分子晶体的是
A.熔点是1070℃,易溶于水,水溶液能导电
B.熔点是10.31℃,液态不导电,水溶液能导电
C.能溶于水,熔点812.8℃,沸点是1446℃
D.熔点是97.80℃,质软、导电,密度是0.97g/cm3
8.下列有关NA的说法正确的是
A.1mol熔融的KHSO4中含有离子总数为3NA
B.40 g SiC(与金刚石结构类似)中Si-C键的数目为4NA
C.锌与足量的稀硫酸反应生成22.4LH2,转移电子数为2NA
D.0.1 mol Na2O2与足量SO2反应时,转移电子数为0.1NA
9.下列物质中,均直接由原子构成的是:①干冰晶体;②二氧化硅;③水蒸气;④金刚石;⑤单晶硅;⑥白磷;⑦硫磺;⑧液氨;⑨钠;⑩氖晶体( )
A.②③④⑤
B.②③④⑤⑨⑩
C.②④⑤⑩
D.②④⑤⑥⑦⑨⑩
10.据报道,在 40GPa 高压下,用激光加热到 1800K,人们成功制得了某种 CO2 的晶体,其结构类似于 SiO2的结构,下列有关推断中错误的是
A.该晶体不可用作制冷材料
B.该晶体硬度大,可用作耐磨材料
C.该晶体有很高的熔点
D.该晶体中每个碳原子形成 2 个碳氧双键
11.在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
A.熔点比较:C60B.已知C(石墨)=C(金刚石) ΔH>0,则石墨比金刚石稳定
C.C60晶体结构如图所示,每个C60分子周围与它最近且等距离的C60分子有10个
D.金刚石、C60、C70、管状碳和洋葱状碳一定条件下都能燃烧
12.下列化学用语正确的是
A.的结构式为
B.二氧化硅分子式:
C.甲醛的电子式
D.含10个中子的氧原子表示为
13.SiC 和Si 的结构相似,是最有前景的半导体材料之一,下列说法正确的是
A.碳和硅原子最外层电子的轨道表示式完全相同
B.2py是碳原子核外能量最高的电子亚层
C.硅原子核外电子共占用 5 个轨道
D.都属于原子晶体,熔点SiC>Si
14.2022年北京冬奥会的成功举办离不开各种科技力量的支持。下列说法错误的是
A.滑冰场上的冰中水分子的热稳定性高于甲烷
B.用于跨临界直冷技术制冰的二氧化碳是非极性分子
C.颁奖礼服内胆中添加的石墨烯(部分结构如图)是分子晶体
D.闭幕式的水上烟火与原子核外电子发生跃迁有关
15.氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是()
A.六方相氮化硼与石墨一样可以导电
B.立方相氮化硼含有σ键和π键,所以硬度大
C.两种晶体均为分子晶体
D.六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为平面三角形
二、填空题
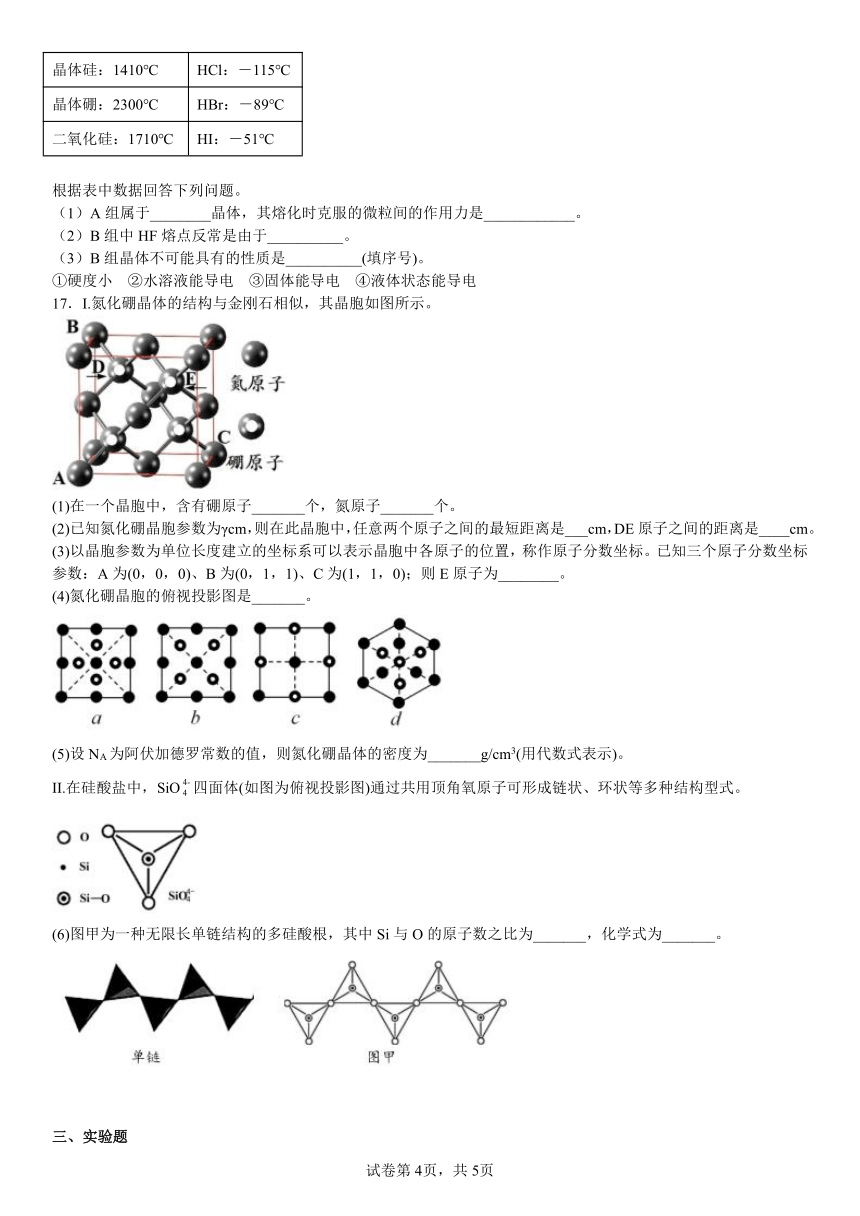
16.现有两组物质的熔点数据如表所示:
A组 B组
金刚石:3550℃ HF:-83℃
晶体硅:1410℃ HCl:-115℃
晶体硼:2300℃ HBr:-89℃
二氧化硅:1710℃ HI:-51℃
根据表中数据回答下列问题。
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是____________。
(2)B组中HF熔点反常是由于__________。
(3)B组晶体不可能具有的性质是__________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④液体状态能导电
17.I.氮化硼晶体的结构与金刚石相似,其晶胞如图所示。
(1)在一个晶胞中,含有硼原子_______个,氮原子_______个。
(2)已知氮化硼晶胞参数为γcm,则在此晶胞中,任意两个原子之间的最短距离是___cm,DE原子之间的距离是____cm。
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则E原子为________。
(4)氮化硼晶胞的俯视投影图是_______。
(5)设NA为阿伏加德罗常数的值,则氮化硼晶体的密度为_______g/cm3(用代数式表示)。
II.在硅酸盐中,SiO四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构型式。
(6)图甲为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为_______,化学式为_______。
三、实验题
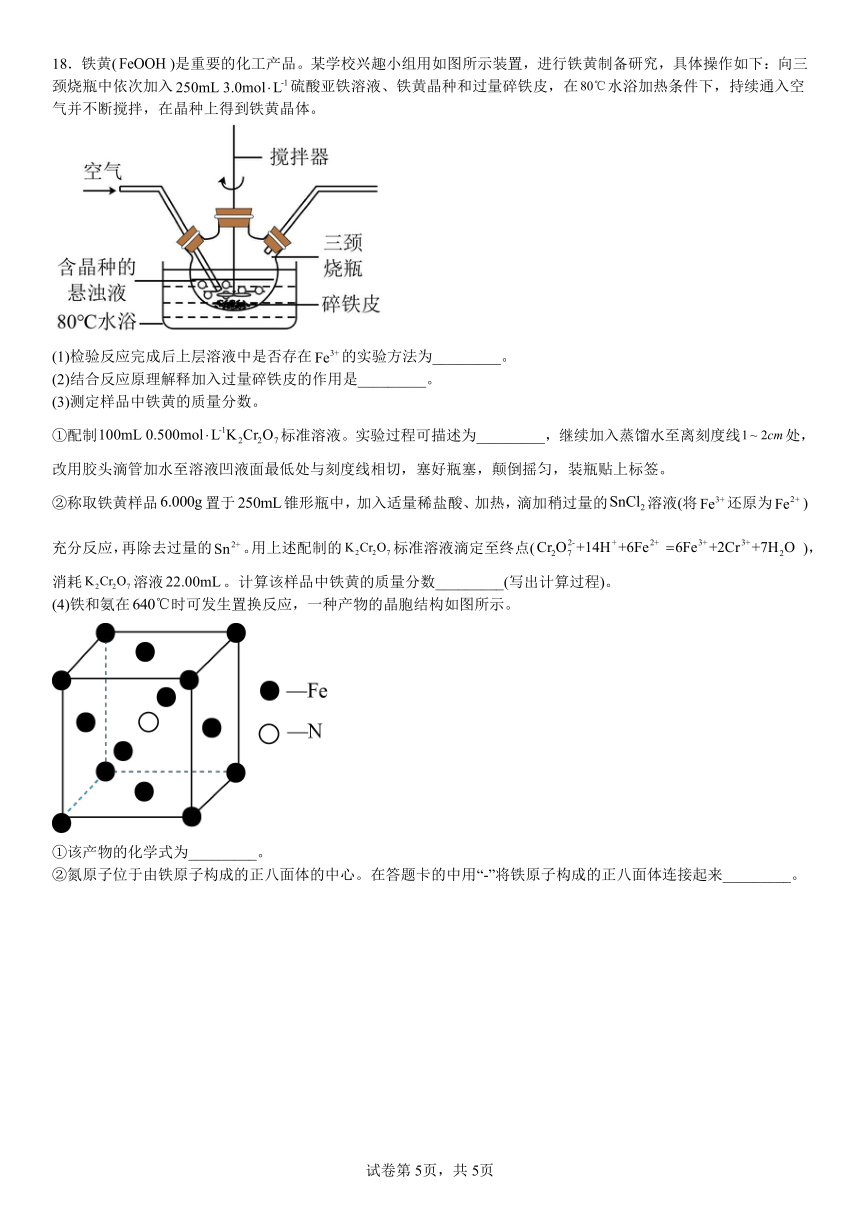
18.铁黄()是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
(1)检验反应完成后上层溶液中是否存在的实验方法为_________。
(2)结合反应原理解释加入过量碎铁皮的作用是_________。
(3)测定样品中铁黄的质量分数。
①配制标准溶液。实验过程可描述为_________,继续加入蒸馏水至离刻度线处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
②称取铁黄样品置于锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的溶液(将还原为)充分反应,再除去过量的。用上述配制的标准溶液滴定至终点(),消耗溶液。计算该样品中铁黄的质量分数_________(写出计算过程)。
(4)铁和氨在时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为_________。
②氮原子位于由铁原子构成的正八面体的中心。在答题卡的中用“-”将铁原子构成的正八面体连接起来_________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由题干可知,二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等溶剂,二茂铁属于分子晶体,A错误;
B.在二茂铁结构中,C5H与Fe2+之间形成的化学键类型是配位键,B错误;
C.由环戊二烯的结构式可知分子结构中碳环上由3个单键即3个σ键,2个双键即2个 σ键和2个π键,故其中碳环上有2个π键和5个σ键,C正确;
D.二价铁离子的基态电子排布式为:[Ar]3d6,D错误;
故答案为:C。
2.D
【分析】氮氧化铝(AlON)属原子晶体,石英(SiO2)属于原子晶体,Al2O3属于离子晶体,结合选项来解答。
【详解】A.二者均属于原子晶体,均只含有共价键,故A正确;
B.根据分析,二者均属于原子晶体,故B正确;
C.AlON属于原子晶体,只含有共价键,而Al2O3属于离子晶体,只含有离子键,故C正确;
D.AlON属于原子晶体,而Al2O3属于离子晶体,晶体类型不同,故D错误;
答案选D。
【点睛】根据物质的熔点,硬度,可以推测出物质具有原子晶体的性质。
3.B
【详解】A.氮化硼晶体为原子晶体,原子晶体具有较高的熔沸点,A正确;
B.该晶体结构中无自由移动的电子,不具有导电性,B错误;
C.由图可知,该晶胞含4个N原子,B原子位于晶胞的顶点和面心上,故B原子的数量为8×+6×=4个,C正确;
D.由晶胞示意图,1个N原子与4个B原子成键,1个B原子可以和3个N原子成键,这些N原子距中心N原子等距离且最近,总数为12个,D正确;
答案选B。
4.D
【详解】A.共价晶体中成键原子的原子半径越小,键长越短,共价键越强,晶体的硬度越大,故A错误;
B.液晶的显示原理为施加电场时,液晶分子沿电场方向排列,故B错误;
C.冰为分子晶体,冰融化时,破坏分子间的氢键,但分子中的氢氧键不发生断裂,故C错误;
D.液晶是介于液态与结晶态之间的一种物质状态,液晶像液体一样可以流动,又具有某些晶体结构特征的一类物质,所以液晶分子在特定方向排列比较整齐,但不稳定,故D正确;
故选D。
5.B
【详解】A.SiO2熔沸点高,属于原子晶体,故A错误;
B.SiH4、CH4、H2Se、H2S形成的均是分子晶体,且均不能形成氢键,因此根据SiH4的沸点高于CH4,可推测H2Se的沸点高于H2S,故B正确;
C.因I2的氧化性较弱,碘单质与铁反应生成的是FeI2,故C错误;
D.浓硫酸氧化性很强,能够将NaBr氧化为Br2,不能用该方法制取HBr,故D错误;
故选B。
6.D
【分析】设A的原子序数为a,已知A、D两种短周期元素在元素周期表中的相对位置如表,则D的原子序数为a+10,其中D的原子序数是A的原子序数的3倍,则a+10=3a,a=5,则A为B元素、 D为P元素, 已知A与D组成的物质是一种超硬耐磨涂层材料,如图为其晶体结构中最小的重复结构单元,该结构单元中B原子处于内部、含有4个B原子,P原子属于顶点与面心上,则按均摊法含有P原子数目为,故化学式为BP, 晶体中每个B与3个P形成常规的3个共价键B-P外,P原子有1对孤电子对、B有空轨道,形成了一个配位键,故每个原子最外层均满足8电子稳定结构,则:晶体BP中原子间以共价键连接,是一种超硬耐磨涂层材料,属于共价晶体。
【详解】A. 据分析,A与D组成的物质的化学式为BP,A正确;
B.据分析,A与D组成的物质熔点高,B正确;
C.据分析,A与D组成的物质中原子间以共价键连接,属于共价晶体,C正确;
D.由图知,A与D组成的化合物晶体中,每个A原子周围连接4个D原子,D不正确;
答案选D。
7.B
【详解】分子间通过分子间作用力(范德华力)结合的晶体叫做分子晶体。例如:所有的非金属氢化物,大多数的非金属氧化物(H2O),绝大多数的共价化合物,少数盐(如AlCl3)。
分子晶体的熔沸点较低,一般有挥发性,在蒸发、沸腾等情况下会破坏分子间作用力,其硬度小,导电性差
A.熔点是1070℃太高,不可能是分子晶体,另外水溶液能导电也可以是离子晶体,故A错误;
B.熔点是10.31℃,液态不导电说明是共价键或者没有化学键,但是水溶液能导电说明共价键断裂,由此确定是分子晶体,故B正确;
C.能溶于水有可能是分子晶体,但是熔点812.8℃,沸点是1446℃太高,不是分子晶体,故C错误;
D.熔点是97.80℃,质软、导电的物质不可能是分子晶体,故D错误。
故答案为B
8.B
【详解】A.熔融的KHSO4电离方程式为KHSO4=K++,则1mol熔融的KHSO4中含有离子总数为2NA,A错误;
B.SiC晶体中,1个C原子周围有4个Si-C键,40g SiC的物质的量为1mol,含有1mol C原子,故40g SiC中Si-C键的数目为4NA,B正确;
C.题中未说明H2所处的状态,故无法计算22.4L H2的物质的量,也就无法计算转移电子数目,C错误;
D.Na2O2与SO2反应的化学方程式为Na2O2+SO2=Na2SO4,则0.1mol Na2O2参加反应,转移电子数为0.2NA,D错误;
故选B。
9.C
【详解】①干冰晶体属于分子晶体,是由分子构成的;②二氧化硅属于原子晶体,是由硅原子和氧原子直接构成;③水蒸气是分子晶体,是由分子构成的;④金刚石属于原子晶体,是由碳原子直接构成;⑤单晶硅属于原子晶体,是由硅原子直接构成;⑥白磷属于分子晶体,是由分子构成的;⑦硫磺属于分子晶体,是由分子构成的;⑧液氨中存在氨气分子,是由分子构成的;⑨钠属于金属晶体,由金属阳离子和自由电子构成;⑩氖晶体中只含有氖原子,直接由原子构成的,故C正确。
【点睛】原子晶体和稀有气体分子直接由原子构成,分子晶体由分子构成(稀有气体是单原子分子),离子晶体由阴阳离子构成,金属晶体由金属阳离子和自由电子构成。
10.D
【分析】其结构类似于 SiO2的结构,说明此CO2 晶体属于原子晶体。
【详解】A. 原子晶体CO2有很高的沸点,不易汽化,不可用作制冷剂,故A正确;
B. 原子晶体硬度大,所以原子晶体CO2的硬度大,可用作耐磨材料,故B正确;
C. 原子晶体具有很高的熔点、沸点,故原子晶体CO2有很高的熔点、沸点,故C正确;
D. 原子晶体CO2的结构类似SiO2,碳原子和氧原子应为单键,1个C原子形成4个C O键,故D错误;
答案选D。
11.C
【详解】A.分子晶体的相对分子质量越大,分子间作用力越大,熔点就越高,故熔点比较: C60<C70<C90 ,故A正确;
B. 石墨转变为金刚石吸收能量,则石墨能量低,所以石墨比金刚石稳定,故B正确;
C.以晶胞顶点上的C60为例,与之距离最近的分子在经过该点的面的面心上,这样的面有12个,所以这样的分子也有12个,故C错误;
D. C60 、 C70 、管状碳和洋葱状碳都是碳的单质,都能与 O2 发生反应,生成碳的氧化物,故D正确;
故选C。
12.A
【详解】A.结构式是指用一根“-”表示一对共用电子的式子,故的结构式为,A正确;
B.二氧化硅是原子(或共价)晶体,故二氧化硅不存在分子式,其化学式为,B错误;
C.甲醛分子中O最外层为8电子稳定结构,C错误;
D.质量数等于质子数加中子数,故含10个中子的氧原子表示为,D错误;
故答案为:A。
13.D
【详解】A.原子状态不同时,如基态碳原子和激发态的硅原子最外层电子的轨道表示式不相同,A错误;
B.2px、2py、2pz三个轨道的能量相同,2p才是碳原子核外能量最高的电子亚层,B错误;
C.硅原子的核外电子排布式为1s22s22p63s23p2,s有1个轨道,p有3个轨道,根据电子排布规律可知,其核外电子共占用8个轨道,C错误;
D.SiC 和Si均属于原子晶体,由于原子半径C<Si,因此键长:C—Si<Si—Si,则键能:C—Si>Si—Si,因此熔点SiC>Si,D正确;
答案选D。
14.C
【详解】A. 周期表中同主族从下到上,同周期从左到右,元素的非金属性增强,元素的氢化物稳定性增强,滑冰场上的冰中水分子的热稳定性高于甲烷,故A正确;
B. 用于跨临界直冷技术制冰的二氧化碳是直线形分子,结构对称,是非极性分子,故B正确;
C. 颁奖礼服内胆中添加的石墨烯(部分结构如图)有分子晶体性质,能导电,有金属晶体的性质,又有共价晶体的结构特点,属于混合晶体,故C错误;
D. 烟火是原子核外电子发生跃迁,由高能级跃迁到低能级时,释放的能量以光的形式呈现出来的,闭幕式的水上烟火与原子核外电子发生跃迁有关,故D正确;
故选C。
15.D
【详解】A、六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,该物质的层状结构中不存在自由移动的电子,所以不导电,故A错误;
B、该化合物中含有σ键不存在π键,故B错误;
C、立方相氮化硼为原子晶体,故C错误;
D、一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,所以构成的空间构型为平面三角形,故D正确。
16. 原子 共价键 HF分子间能形成氢键,熔化时需要消耗的能量更多 ③④
【详解】(1)A组熔点很高,应是原子晶体,原子晶体熔化时破坏的是共价键;
(2)B组是分子晶体,且结构相似,一般是相对分子质量越大,熔点越高;
HF的相对分子质量最小但熔点比HCl高,出现反常的原因是HF分子间存在氢键,HF熔化时除了破坏分子间作用力,还要破坏氢键,所需能量更高,因而熔点更高;
(3)分子晶体在固态和熔化状态都不导电,③④符合题意,故答案为:③④。
17. 4 4 b 1:3 或
【分析】结合晶胞示意图、确定原子的相对位置关系、进行计算;用均摊法计算晶胞密度、硅酸盐的化学式;
【详解】I(1)硼原子位于晶胞内,氮原子位于顶点和面心,则在一个晶胞中,含有硼原子4个,个。
(2)已知氮化硼晶胞参数为γcm,则在此晶胞中,任意两个原子之间的最短距离为N与B之间,最短距离为晶胞体对角线的,则是cm,DE原子即晶体中两个距离最近的B原子,二者之间的距离为晶胞的棱长的,即是cm。
(3)已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则由E原子的位置知,E的原子分数坐标为。
(4)由晶胞示意图知,氮化硼晶胞的俯视投影图是b。
(5)1个氮化硼晶胞内含有的氮原子和硼原子均为4个,则晶胞的质量为,氮化硼晶胞参数为γcm,则晶胞体积为,晶胞密度即晶体的密度为。
II(6)观察图可知,每个四面体通过两个氧原子与其他四面体连接形成链状结构,所以每个四面体中的硅原子数是1,氧原子数是,即Si与O的原子数之比为1:3;化学式为或。
18.(1)取少量上层清液,滴加2~3滴溶液,若存在,可观察到溶液变成血红色
(2)既能消除反应产生的,同时又能额外提供,实现硫酸亚铁的循环利用
(3) 用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中 97.9%
(4)
【详解】(1)检验反应完成后上层溶液中是否存在,取反应完后上层清液,滴加2~3滴溶液,若溶液变为红色,说明存在,若溶液不变红则不存在;
(2)该发生化学反应为,加入碎铁皮能消除反应产生的生成,生成的又能额外提供,实现硫酸亚铁的循环利用;
(3)①配制溶液的一般过程包括计算、称量、溶解、冷却转移、洗涤、定容、摇匀装瓶;配制标准溶液。,用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中;
②根据方程式可知反应的关系式为,,该样品中铁黄的质量分数;
(4)①Fe原子位于顶点和面心,晶胞中Fe原子数为,N原子位于体心,晶胞中含有1个N原子,原子数之比为Fe:N=4:1,该产物的化学式为
②氮原子位于由铁原子构成的正八面体的中心。铁原子构成的正八面体为:;
答案第1页,共2页
答案第1页,共2页
一、单选题
1.二茂铁[(C5H5)2Fe]是由一个二价铁离子和2个环戊二烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域。已知:二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等溶剂。下列说法正确的是( )
A.二茂铁属于离子晶体
B.在二茂铁结构中,C5H与Fe2+之间形成的化学键类型是离子键
C.已知:环戊二烯的结构式为: ,则其中碳环上有2个π键和5个σ键
D.二价铁离子的基态电子排布式为:[Ar]3d44s2
2.氮氧化铝(AlON)是一种透明高硬度防弹材料,硬度为石英玻璃的 4 倍,可耐 120 摄氏度的高温。下列描述错误的是( )
A.AlON 和石英的化学键类型相同 B.AlON 和石英晶体类型相同
C.AlON 和 NaCl 的化学键类型不同 D.AlON 和 NaCl 晶体类型相同
3.我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法不正确的是
A.氮化硼晶体有较高的熔沸点
B.该晶体具有良好的导电性
C.该晶胞中含有4个B原子,4个N原子
D.N原子周围等距且最近的N原子数为12
4.下列说法正确的是
A.构成共价晶体的原子的半径越大,晶体的硬度越大
B.施加电场时,液晶分子垂直于电场方向排列
C.冰融化时,分子中氢氧键发生断裂
D.液晶分子在特定方向排列比较整齐,但不稳定
5.类比推理是化学中常用的思维方法。下列推理正确的是
A.干冰(CO2)是分子晶体,推测SiO2,也是分于晶体
B.SiH4的沸点高于CH4,推测H2Se的沸点高于H2S
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成Fel3
D.NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4,加热可制HBr
6.已知A、D两种短周期元素在元素周期表中的相对位置如表,其中D的原子序数是A的原子序数的3倍。A与D组成的物质是一种超硬耐磨涂层材料,如图为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构。下列有关说法错误的是
A.A与D组成的物质的化学式为BP
B.A与D组成的物质熔点高
C.A与D组成的物质中原子间以共价键连接,属于共价晶体
D.A与D组成的化合物晶体中,每个A原子周围连接1个D原子
7.下列物质属于分子晶体的是
A.熔点是1070℃,易溶于水,水溶液能导电
B.熔点是10.31℃,液态不导电,水溶液能导电
C.能溶于水,熔点812.8℃,沸点是1446℃
D.熔点是97.80℃,质软、导电,密度是0.97g/cm3
8.下列有关NA的说法正确的是
A.1mol熔融的KHSO4中含有离子总数为3NA
B.40 g SiC(与金刚石结构类似)中Si-C键的数目为4NA
C.锌与足量的稀硫酸反应生成22.4LH2,转移电子数为2NA
D.0.1 mol Na2O2与足量SO2反应时,转移电子数为0.1NA
9.下列物质中,均直接由原子构成的是:①干冰晶体;②二氧化硅;③水蒸气;④金刚石;⑤单晶硅;⑥白磷;⑦硫磺;⑧液氨;⑨钠;⑩氖晶体( )
A.②③④⑤
B.②③④⑤⑨⑩
C.②④⑤⑩
D.②④⑤⑥⑦⑨⑩
10.据报道,在 40GPa 高压下,用激光加热到 1800K,人们成功制得了某种 CO2 的晶体,其结构类似于 SiO2的结构,下列有关推断中错误的是
A.该晶体不可用作制冷材料
B.该晶体硬度大,可用作耐磨材料
C.该晶体有很高的熔点
D.该晶体中每个碳原子形成 2 个碳氧双键
11.在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
A.熔点比较:C60
C.C60晶体结构如图所示,每个C60分子周围与它最近且等距离的C60分子有10个
D.金刚石、C60、C70、管状碳和洋葱状碳一定条件下都能燃烧
12.下列化学用语正确的是
A.的结构式为
B.二氧化硅分子式:
C.甲醛的电子式
D.含10个中子的氧原子表示为
13.SiC 和Si 的结构相似,是最有前景的半导体材料之一,下列说法正确的是
A.碳和硅原子最外层电子的轨道表示式完全相同
B.2py是碳原子核外能量最高的电子亚层
C.硅原子核外电子共占用 5 个轨道
D.都属于原子晶体,熔点SiC>Si
14.2022年北京冬奥会的成功举办离不开各种科技力量的支持。下列说法错误的是
A.滑冰场上的冰中水分子的热稳定性高于甲烷
B.用于跨临界直冷技术制冰的二氧化碳是非极性分子
C.颁奖礼服内胆中添加的石墨烯(部分结构如图)是分子晶体
D.闭幕式的水上烟火与原子核外电子发生跃迁有关
15.氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是()
A.六方相氮化硼与石墨一样可以导电
B.立方相氮化硼含有σ键和π键,所以硬度大
C.两种晶体均为分子晶体
D.六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为平面三角形
二、填空题
16.现有两组物质的熔点数据如表所示:
A组 B组
金刚石:3550℃ HF:-83℃
晶体硅:1410℃ HCl:-115℃
晶体硼:2300℃ HBr:-89℃
二氧化硅:1710℃ HI:-51℃
根据表中数据回答下列问题。
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是____________。
(2)B组中HF熔点反常是由于__________。
(3)B组晶体不可能具有的性质是__________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④液体状态能导电
17.I.氮化硼晶体的结构与金刚石相似,其晶胞如图所示。
(1)在一个晶胞中,含有硼原子_______个,氮原子_______个。
(2)已知氮化硼晶胞参数为γcm,则在此晶胞中,任意两个原子之间的最短距离是___cm,DE原子之间的距离是____cm。
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则E原子为________。
(4)氮化硼晶胞的俯视投影图是_______。
(5)设NA为阿伏加德罗常数的值,则氮化硼晶体的密度为_______g/cm3(用代数式表示)。
II.在硅酸盐中,SiO四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构型式。
(6)图甲为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为_______,化学式为_______。
三、实验题
18.铁黄()是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
(1)检验反应完成后上层溶液中是否存在的实验方法为_________。
(2)结合反应原理解释加入过量碎铁皮的作用是_________。
(3)测定样品中铁黄的质量分数。
①配制标准溶液。实验过程可描述为_________,继续加入蒸馏水至离刻度线处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
②称取铁黄样品置于锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的溶液(将还原为)充分反应,再除去过量的。用上述配制的标准溶液滴定至终点(),消耗溶液。计算该样品中铁黄的质量分数_________(写出计算过程)。
(4)铁和氨在时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为_________。
②氮原子位于由铁原子构成的正八面体的中心。在答题卡的中用“-”将铁原子构成的正八面体连接起来_________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.由题干可知,二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等溶剂,二茂铁属于分子晶体,A错误;
B.在二茂铁结构中,C5H与Fe2+之间形成的化学键类型是配位键,B错误;
C.由环戊二烯的结构式可知分子结构中碳环上由3个单键即3个σ键,2个双键即2个 σ键和2个π键,故其中碳环上有2个π键和5个σ键,C正确;
D.二价铁离子的基态电子排布式为:[Ar]3d6,D错误;
故答案为:C。
2.D
【分析】氮氧化铝(AlON)属原子晶体,石英(SiO2)属于原子晶体,Al2O3属于离子晶体,结合选项来解答。
【详解】A.二者均属于原子晶体,均只含有共价键,故A正确;
B.根据分析,二者均属于原子晶体,故B正确;
C.AlON属于原子晶体,只含有共价键,而Al2O3属于离子晶体,只含有离子键,故C正确;
D.AlON属于原子晶体,而Al2O3属于离子晶体,晶体类型不同,故D错误;
答案选D。
【点睛】根据物质的熔点,硬度,可以推测出物质具有原子晶体的性质。
3.B
【详解】A.氮化硼晶体为原子晶体,原子晶体具有较高的熔沸点,A正确;
B.该晶体结构中无自由移动的电子,不具有导电性,B错误;
C.由图可知,该晶胞含4个N原子,B原子位于晶胞的顶点和面心上,故B原子的数量为8×+6×=4个,C正确;
D.由晶胞示意图,1个N原子与4个B原子成键,1个B原子可以和3个N原子成键,这些N原子距中心N原子等距离且最近,总数为12个,D正确;
答案选B。
4.D
【详解】A.共价晶体中成键原子的原子半径越小,键长越短,共价键越强,晶体的硬度越大,故A错误;
B.液晶的显示原理为施加电场时,液晶分子沿电场方向排列,故B错误;
C.冰为分子晶体,冰融化时,破坏分子间的氢键,但分子中的氢氧键不发生断裂,故C错误;
D.液晶是介于液态与结晶态之间的一种物质状态,液晶像液体一样可以流动,又具有某些晶体结构特征的一类物质,所以液晶分子在特定方向排列比较整齐,但不稳定,故D正确;
故选D。
5.B
【详解】A.SiO2熔沸点高,属于原子晶体,故A错误;
B.SiH4、CH4、H2Se、H2S形成的均是分子晶体,且均不能形成氢键,因此根据SiH4的沸点高于CH4,可推测H2Se的沸点高于H2S,故B正确;
C.因I2的氧化性较弱,碘单质与铁反应生成的是FeI2,故C错误;
D.浓硫酸氧化性很强,能够将NaBr氧化为Br2,不能用该方法制取HBr,故D错误;
故选B。
6.D
【分析】设A的原子序数为a,已知A、D两种短周期元素在元素周期表中的相对位置如表,则D的原子序数为a+10,其中D的原子序数是A的原子序数的3倍,则a+10=3a,a=5,则A为B元素、 D为P元素, 已知A与D组成的物质是一种超硬耐磨涂层材料,如图为其晶体结构中最小的重复结构单元,该结构单元中B原子处于内部、含有4个B原子,P原子属于顶点与面心上,则按均摊法含有P原子数目为,故化学式为BP, 晶体中每个B与3个P形成常规的3个共价键B-P外,P原子有1对孤电子对、B有空轨道,形成了一个配位键,故每个原子最外层均满足8电子稳定结构,则:晶体BP中原子间以共价键连接,是一种超硬耐磨涂层材料,属于共价晶体。
【详解】A. 据分析,A与D组成的物质的化学式为BP,A正确;
B.据分析,A与D组成的物质熔点高,B正确;
C.据分析,A与D组成的物质中原子间以共价键连接,属于共价晶体,C正确;
D.由图知,A与D组成的化合物晶体中,每个A原子周围连接4个D原子,D不正确;
答案选D。
7.B
【详解】分子间通过分子间作用力(范德华力)结合的晶体叫做分子晶体。例如:所有的非金属氢化物,大多数的非金属氧化物(H2O),绝大多数的共价化合物,少数盐(如AlCl3)。
分子晶体的熔沸点较低,一般有挥发性,在蒸发、沸腾等情况下会破坏分子间作用力,其硬度小,导电性差
A.熔点是1070℃太高,不可能是分子晶体,另外水溶液能导电也可以是离子晶体,故A错误;
B.熔点是10.31℃,液态不导电说明是共价键或者没有化学键,但是水溶液能导电说明共价键断裂,由此确定是分子晶体,故B正确;
C.能溶于水有可能是分子晶体,但是熔点812.8℃,沸点是1446℃太高,不是分子晶体,故C错误;
D.熔点是97.80℃,质软、导电的物质不可能是分子晶体,故D错误。
故答案为B
8.B
【详解】A.熔融的KHSO4电离方程式为KHSO4=K++,则1mol熔融的KHSO4中含有离子总数为2NA,A错误;
B.SiC晶体中,1个C原子周围有4个Si-C键,40g SiC的物质的量为1mol,含有1mol C原子,故40g SiC中Si-C键的数目为4NA,B正确;
C.题中未说明H2所处的状态,故无法计算22.4L H2的物质的量,也就无法计算转移电子数目,C错误;
D.Na2O2与SO2反应的化学方程式为Na2O2+SO2=Na2SO4,则0.1mol Na2O2参加反应,转移电子数为0.2NA,D错误;
故选B。
9.C
【详解】①干冰晶体属于分子晶体,是由分子构成的;②二氧化硅属于原子晶体,是由硅原子和氧原子直接构成;③水蒸气是分子晶体,是由分子构成的;④金刚石属于原子晶体,是由碳原子直接构成;⑤单晶硅属于原子晶体,是由硅原子直接构成;⑥白磷属于分子晶体,是由分子构成的;⑦硫磺属于分子晶体,是由分子构成的;⑧液氨中存在氨气分子,是由分子构成的;⑨钠属于金属晶体,由金属阳离子和自由电子构成;⑩氖晶体中只含有氖原子,直接由原子构成的,故C正确。
【点睛】原子晶体和稀有气体分子直接由原子构成,分子晶体由分子构成(稀有气体是单原子分子),离子晶体由阴阳离子构成,金属晶体由金属阳离子和自由电子构成。
10.D
【分析】其结构类似于 SiO2的结构,说明此CO2 晶体属于原子晶体。
【详解】A. 原子晶体CO2有很高的沸点,不易汽化,不可用作制冷剂,故A正确;
B. 原子晶体硬度大,所以原子晶体CO2的硬度大,可用作耐磨材料,故B正确;
C. 原子晶体具有很高的熔点、沸点,故原子晶体CO2有很高的熔点、沸点,故C正确;
D. 原子晶体CO2的结构类似SiO2,碳原子和氧原子应为单键,1个C原子形成4个C O键,故D错误;
答案选D。
11.C
【详解】A.分子晶体的相对分子质量越大,分子间作用力越大,熔点就越高,故熔点比较: C60<C70<C90 ,故A正确;
B. 石墨转变为金刚石吸收能量,则石墨能量低,所以石墨比金刚石稳定,故B正确;
C.以晶胞顶点上的C60为例,与之距离最近的分子在经过该点的面的面心上,这样的面有12个,所以这样的分子也有12个,故C错误;
D. C60 、 C70 、管状碳和洋葱状碳都是碳的单质,都能与 O2 发生反应,生成碳的氧化物,故D正确;
故选C。
12.A
【详解】A.结构式是指用一根“-”表示一对共用电子的式子,故的结构式为,A正确;
B.二氧化硅是原子(或共价)晶体,故二氧化硅不存在分子式,其化学式为,B错误;
C.甲醛分子中O最外层为8电子稳定结构,C错误;
D.质量数等于质子数加中子数,故含10个中子的氧原子表示为,D错误;
故答案为:A。
13.D
【详解】A.原子状态不同时,如基态碳原子和激发态的硅原子最外层电子的轨道表示式不相同,A错误;
B.2px、2py、2pz三个轨道的能量相同,2p才是碳原子核外能量最高的电子亚层,B错误;
C.硅原子的核外电子排布式为1s22s22p63s23p2,s有1个轨道,p有3个轨道,根据电子排布规律可知,其核外电子共占用8个轨道,C错误;
D.SiC 和Si均属于原子晶体,由于原子半径C<Si,因此键长:C—Si<Si—Si,则键能:C—Si>Si—Si,因此熔点SiC>Si,D正确;
答案选D。
14.C
【详解】A. 周期表中同主族从下到上,同周期从左到右,元素的非金属性增强,元素的氢化物稳定性增强,滑冰场上的冰中水分子的热稳定性高于甲烷,故A正确;
B. 用于跨临界直冷技术制冰的二氧化碳是直线形分子,结构对称,是非极性分子,故B正确;
C. 颁奖礼服内胆中添加的石墨烯(部分结构如图)有分子晶体性质,能导电,有金属晶体的性质,又有共价晶体的结构特点,属于混合晶体,故C错误;
D. 烟火是原子核外电子发生跃迁,由高能级跃迁到低能级时,释放的能量以光的形式呈现出来的,闭幕式的水上烟火与原子核外电子发生跃迁有关,故D正确;
故选C。
15.D
【详解】A、六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,该物质的层状结构中不存在自由移动的电子,所以不导电,故A错误;
B、该化合物中含有σ键不存在π键,故B错误;
C、立方相氮化硼为原子晶体,故C错误;
D、一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,所以构成的空间构型为平面三角形,故D正确。
16. 原子 共价键 HF分子间能形成氢键,熔化时需要消耗的能量更多 ③④
【详解】(1)A组熔点很高,应是原子晶体,原子晶体熔化时破坏的是共价键;
(2)B组是分子晶体,且结构相似,一般是相对分子质量越大,熔点越高;
HF的相对分子质量最小但熔点比HCl高,出现反常的原因是HF分子间存在氢键,HF熔化时除了破坏分子间作用力,还要破坏氢键,所需能量更高,因而熔点更高;
(3)分子晶体在固态和熔化状态都不导电,③④符合题意,故答案为:③④。
17. 4 4 b 1:3 或
【分析】结合晶胞示意图、确定原子的相对位置关系、进行计算;用均摊法计算晶胞密度、硅酸盐的化学式;
【详解】I(1)硼原子位于晶胞内,氮原子位于顶点和面心,则在一个晶胞中,含有硼原子4个,个。
(2)已知氮化硼晶胞参数为γcm,则在此晶胞中,任意两个原子之间的最短距离为N与B之间,最短距离为晶胞体对角线的,则是cm,DE原子即晶体中两个距离最近的B原子,二者之间的距离为晶胞的棱长的,即是cm。
(3)已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则由E原子的位置知,E的原子分数坐标为。
(4)由晶胞示意图知,氮化硼晶胞的俯视投影图是b。
(5)1个氮化硼晶胞内含有的氮原子和硼原子均为4个,则晶胞的质量为,氮化硼晶胞参数为γcm,则晶胞体积为,晶胞密度即晶体的密度为。
II(6)观察图可知,每个四面体通过两个氧原子与其他四面体连接形成链状结构,所以每个四面体中的硅原子数是1,氧原子数是,即Si与O的原子数之比为1:3;化学式为或。
18.(1)取少量上层清液,滴加2~3滴溶液,若存在,可观察到溶液变成血红色
(2)既能消除反应产生的,同时又能额外提供,实现硫酸亚铁的循环利用
(3) 用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中 97.9%
(4)
【详解】(1)检验反应完成后上层溶液中是否存在,取反应完后上层清液,滴加2~3滴溶液,若溶液变为红色,说明存在,若溶液不变红则不存在;
(2)该发生化学反应为,加入碎铁皮能消除反应产生的生成,生成的又能额外提供,实现硫酸亚铁的循环利用;
(3)①配制溶液的一般过程包括计算、称量、溶解、冷却转移、洗涤、定容、摇匀装瓶;配制标准溶液。,用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中;
②根据方程式可知反应的关系式为,,该样品中铁黄的质量分数;
(4)①Fe原子位于顶点和面心,晶胞中Fe原子数为,N原子位于体心,晶胞中含有1个N原子,原子数之比为Fe:N=4:1,该产物的化学式为
②氮原子位于由铁原子构成的正八面体的中心。铁原子构成的正八面体为:;
答案第1页,共2页
答案第1页,共2页
