3.2.1醇(教学课件)(共23张PPT)—2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.2.1醇(教学课件)(共23张PPT)—2022-2023学年高二化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-14 00:00:00 | ||
图片预览







文档简介
(共23张PPT)
第三章 烃的衍生物
第二节 醇 酚
第1课时 醇
1、了解醇的典型代表物的组成、结构特点及物理性质。
2、以乙醇为例掌握醇的主要化学性质。
3、了解实验室制取乙烯的注意事项。
课程目标
教学重点
醇的典型代表物的组成和结构特点。
教学难点
醇的化学性质。
01
醇的分类
组成与物理性质
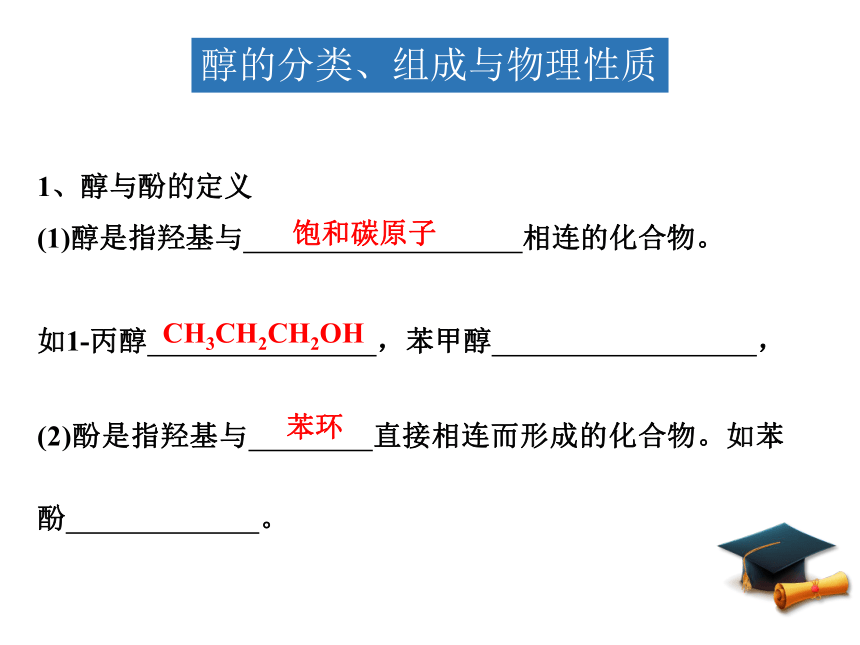
醇的分类、组成与物理性质
1、醇与酚的定义
(1)醇是指羟基与 相连的化合物。
如1 丙醇 ,苯甲醇 ,
饱和碳原子
CH3CH2CH2OH
(2)酚是指羟基与 直接相连而形成的化合物。如苯酚 。
苯环
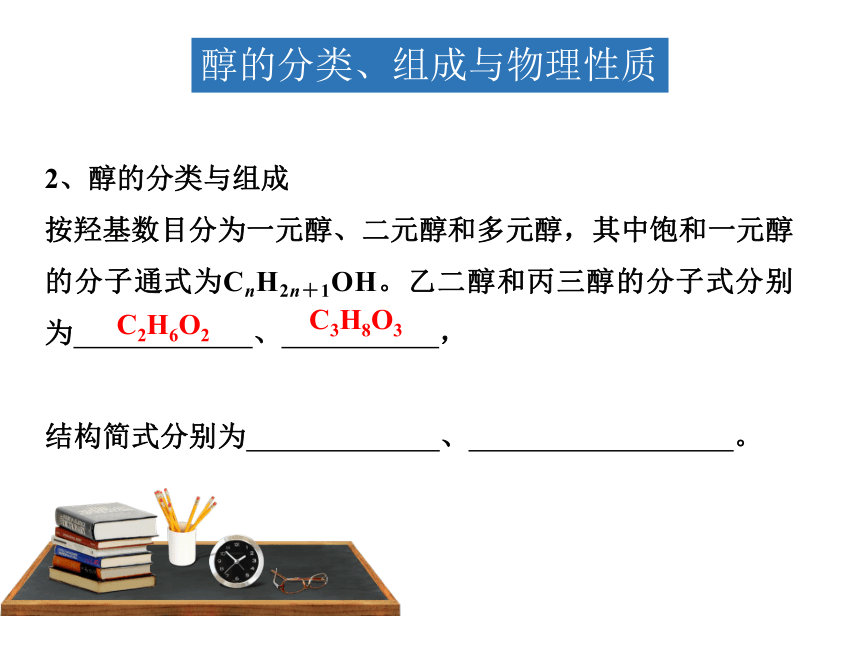
醇的分类、组成与物理性质
2、醇的分类与组成
按羟基数目分为一元醇、二元醇和多元醇,其中饱和一元醇的分子通式为CnH2n+1OH。乙二醇和丙三醇的分子式分别为 、 ,
结构简式分别为 、 。
C3H8O3
C2H6O2
醇的分类、组成与物理性质
3、醇的物理性质
(1)甲醇、乙二醇与丙三醇(又叫甘油)及应用
甲醇(CH3OH)是无色、具有 性的液体, 溶于水,沸点为65 ℃。甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,也可作为车用燃料。乙二醇和丙三醇都是 色、黏稠的液体,都 溶于水和乙醇,是重要的化工原料。
挥发
易
无
易
醇的分类、组成与物理性质
(2)溶解性:①醇在水中的溶解度随着分子中碳原子数的增加而 ,原因是极性的—OH在分子中所占的比例逐渐减少。羟基越多,溶解度越大。
②醇的溶解度 含有相同碳原子数烃类的溶解度,原因是醇分子中的羟基属于极性基团且能与水形成 。
降低
大于
氢键
醇的分类、组成与物理性质
(3)熔沸点:
①随分子中碳原子数的增多,熔沸点逐渐升高。
②醇的沸点远远 于相对分子质量相近的烃、卤代烃等的沸点,原因是醇分子之间形成了 (醇分子中羟基的氧原子与另一醇分子中羟基的氢原子间存在着 )。
高
氢键
氢键
02
醇的
化学性质
醇的化学性质
醇的化学性质主要由 官能团决定。在醇分子中由于氧原子吸引电子能力比氢原子和碳原子强,使O—H和C—O的电子对都向氧原子偏移,使O—H和C—O易断裂,即 。
羟基
1、置换反应
与活泼金属(如Na)发生置换反应,其反应方程式为
_____________________________________,反应时乙醇分子断裂的化学键为 。
2、取代反应
(1)酯化反应:与乙酸发生反应的方程式为
_____________________________________________。
O—H
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
醇的化学性质
(2)与氢卤酸反应
与HBr反应的化学方程式为_____________________________,反应时,乙醇分子断裂的键为 。
(3)分子间脱水生成醚
乙醇在浓硫酸作用下加热至140 ℃时,生成乙醚,方程式为 。
C—O
醇的化学性质
①乙醚是一种无色、易 的液体,沸点34.5 ℃,有特殊气味,具有 作用。乙醚 于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
②醚的官能团叫 ,表示为 ,醚的结构可用 表示,R、R′都是 ,可以相同也可以不同。
挥发
麻醉
微溶
醚键
R—O—R′
烃基
知识拓展
【实验3-2】
a. 如图所示,在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL;
b. 放入几片碎瓷片,以避免混合液在受热时暴沸;
c. 加热混合液,使液体温度迅速升到170℃;
d. 将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
酸性KMnO4溶液
NaOH溶液
溴的四氯化碳溶液
混合液
碎瓷片
温度计
【实验装置】
醇的化学性质
醇的化学性质
1、试剂的作用
试剂 作用
浓硫酸
氢氧化钠 溶液
溴的CCl4溶液
酸性高锰酸钾溶液
碎瓷片
催化剂和脱水剂
吸收二氧化硫和乙醇(都与酸性高锰酸钾溶液反应,SO2能与溴的CCl4溶液反应)
验证乙烯的不饱和性
验证乙烯的还原性
防止暴沸
醇的化学性质
2、现象、原因及结论
现象 原因及结论
烧瓶中液体 逐渐变黑
溴的CCl4溶液 褪色
酸性高锰酸钾 溶液褪色
浓硫酸与乙醇作用生成碳单质
乙烯与溴单质发生加成反应
乙烯被酸性高锰酸钾氧化
3、消去反应
乙醇在浓硫酸的作用下,加热至 时生成乙烯,反应方程式为
,浓硫酸的作用是________________。反应时乙醇分子断的键是 与 。
C—O
170℃
催化剂和脱水剂
C—H
醇的化学性质
醇的化学性质
4、氧化反应
①燃烧: .
(淡蓝色火焰)
应用:实验室里也常用乙醇作为燃料,乙醇也可用作内燃机的燃料。
②催化氧化:
C2H5OH+3O2 2CO2+3H2O
乙醇被酸性重铬酸钾溶液氧化的过程为
溶液由橙红色变为绿色
K2Cr2O7(H+):橙色→绿色(检验酒驾)
KMnO4(H+):紫色→无色——直接被氧化成乙酸
若加入酸性KMnO4溶液
③被强氧化剂氧化:
CH3CH2OH
CH3CHO
CH3COOH
氧化
醇的化学性质
氧化
④有机反应中的氧化、还原反应
有机物分子中 氢原子或 氧原子的反应叫氧化反应。如乙醇在氧化剂的作用下失去氢原子转化为乙醛,乙醛在氧化剂的作用下加入氧原子转化为乙酸。
有机物分子中 氢原子或 氧原子的反应叫还原反应。如烯烃与H2的加成反应,也属于还原反应。
失去
加入
加入
失去
醇的化学性质
卤代烃、醇的消去反应的比较
相同点:二者在结构条件上要求是相同的,即官能团(—OH或—X)所在碳原子的邻位碳原子上必须有氢原子才可发生消去反应,生成不饱和有机化合物。例如:
归纳总结
不同点:二者在反应条件上要求有明显区别,卤代烃发生消去反应的条件是碱性环境下的醇溶液且需加热,而醇发生消去反应的条件是有浓硫酸存在,并加热至一定温度。例如:
归纳总结
教学课件
感谢观看
第三章 烃的衍生物
第二节 醇 酚
第1课时 醇
1、了解醇的典型代表物的组成、结构特点及物理性质。
2、以乙醇为例掌握醇的主要化学性质。
3、了解实验室制取乙烯的注意事项。
课程目标
教学重点
醇的典型代表物的组成和结构特点。
教学难点
醇的化学性质。
01
醇的分类
组成与物理性质
醇的分类、组成与物理性质
1、醇与酚的定义
(1)醇是指羟基与 相连的化合物。
如1 丙醇 ,苯甲醇 ,
饱和碳原子
CH3CH2CH2OH
(2)酚是指羟基与 直接相连而形成的化合物。如苯酚 。
苯环
醇的分类、组成与物理性质
2、醇的分类与组成
按羟基数目分为一元醇、二元醇和多元醇,其中饱和一元醇的分子通式为CnH2n+1OH。乙二醇和丙三醇的分子式分别为 、 ,
结构简式分别为 、 。
C3H8O3
C2H6O2
醇的分类、组成与物理性质
3、醇的物理性质
(1)甲醇、乙二醇与丙三醇(又叫甘油)及应用
甲醇(CH3OH)是无色、具有 性的液体, 溶于水,沸点为65 ℃。甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,也可作为车用燃料。乙二醇和丙三醇都是 色、黏稠的液体,都 溶于水和乙醇,是重要的化工原料。
挥发
易
无
易
醇的分类、组成与物理性质
(2)溶解性:①醇在水中的溶解度随着分子中碳原子数的增加而 ,原因是极性的—OH在分子中所占的比例逐渐减少。羟基越多,溶解度越大。
②醇的溶解度 含有相同碳原子数烃类的溶解度,原因是醇分子中的羟基属于极性基团且能与水形成 。
降低
大于
氢键
醇的分类、组成与物理性质
(3)熔沸点:
①随分子中碳原子数的增多,熔沸点逐渐升高。
②醇的沸点远远 于相对分子质量相近的烃、卤代烃等的沸点,原因是醇分子之间形成了 (醇分子中羟基的氧原子与另一醇分子中羟基的氢原子间存在着 )。
高
氢键
氢键
02
醇的
化学性质
醇的化学性质
醇的化学性质主要由 官能团决定。在醇分子中由于氧原子吸引电子能力比氢原子和碳原子强,使O—H和C—O的电子对都向氧原子偏移,使O—H和C—O易断裂,即 。
羟基
1、置换反应
与活泼金属(如Na)发生置换反应,其反应方程式为
_____________________________________,反应时乙醇分子断裂的化学键为 。
2、取代反应
(1)酯化反应:与乙酸发生反应的方程式为
_____________________________________________。
O—H
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
醇的化学性质
(2)与氢卤酸反应
与HBr反应的化学方程式为_____________________________,反应时,乙醇分子断裂的键为 。
(3)分子间脱水生成醚
乙醇在浓硫酸作用下加热至140 ℃时,生成乙醚,方程式为 。
C—O
醇的化学性质
①乙醚是一种无色、易 的液体,沸点34.5 ℃,有特殊气味,具有 作用。乙醚 于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
②醚的官能团叫 ,表示为 ,醚的结构可用 表示,R、R′都是 ,可以相同也可以不同。
挥发
麻醉
微溶
醚键
R—O—R′
烃基
知识拓展
【实验3-2】
a. 如图所示,在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL;
b. 放入几片碎瓷片,以避免混合液在受热时暴沸;
c. 加热混合液,使液体温度迅速升到170℃;
d. 将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
酸性KMnO4溶液
NaOH溶液
溴的四氯化碳溶液
混合液
碎瓷片
温度计
【实验装置】
醇的化学性质
醇的化学性质
1、试剂的作用
试剂 作用
浓硫酸
氢氧化钠 溶液
溴的CCl4溶液
酸性高锰酸钾溶液
碎瓷片
催化剂和脱水剂
吸收二氧化硫和乙醇(都与酸性高锰酸钾溶液反应,SO2能与溴的CCl4溶液反应)
验证乙烯的不饱和性
验证乙烯的还原性
防止暴沸
醇的化学性质
2、现象、原因及结论
现象 原因及结论
烧瓶中液体 逐渐变黑
溴的CCl4溶液 褪色
酸性高锰酸钾 溶液褪色
浓硫酸与乙醇作用生成碳单质
乙烯与溴单质发生加成反应
乙烯被酸性高锰酸钾氧化
3、消去反应
乙醇在浓硫酸的作用下,加热至 时生成乙烯,反应方程式为
,浓硫酸的作用是________________。反应时乙醇分子断的键是 与 。
C—O
170℃
催化剂和脱水剂
C—H
醇的化学性质
醇的化学性质
4、氧化反应
①燃烧: .
(淡蓝色火焰)
应用:实验室里也常用乙醇作为燃料,乙醇也可用作内燃机的燃料。
②催化氧化:
C2H5OH+3O2 2CO2+3H2O
乙醇被酸性重铬酸钾溶液氧化的过程为
溶液由橙红色变为绿色
K2Cr2O7(H+):橙色→绿色(检验酒驾)
KMnO4(H+):紫色→无色——直接被氧化成乙酸
若加入酸性KMnO4溶液
③被强氧化剂氧化:
CH3CH2OH
CH3CHO
CH3COOH
氧化
醇的化学性质
氧化
④有机反应中的氧化、还原反应
有机物分子中 氢原子或 氧原子的反应叫氧化反应。如乙醇在氧化剂的作用下失去氢原子转化为乙醛,乙醛在氧化剂的作用下加入氧原子转化为乙酸。
有机物分子中 氢原子或 氧原子的反应叫还原反应。如烯烃与H2的加成反应,也属于还原反应。
失去
加入
加入
失去
醇的化学性质
卤代烃、醇的消去反应的比较
相同点:二者在结构条件上要求是相同的,即官能团(—OH或—X)所在碳原子的邻位碳原子上必须有氢原子才可发生消去反应,生成不饱和有机化合物。例如:
归纳总结
不同点:二者在反应条件上要求有明显区别,卤代烃发生消去反应的条件是碱性环境下的醇溶液且需加热,而醇发生消去反应的条件是有浓硫酸存在,并加热至一定温度。例如:
归纳总结
教学课件
感谢观看
