3.3 醛 酮(教学课件)(共18张PPT)-2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.3 醛 酮(教学课件)(共18张PPT)-2022-2023学年高二化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-15 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
第三章 烃的衍生物
第三节 醛 酮
学习目标
1. 能够通过对乙醛的学习,明确醛
基的组成、结构和性质
2. 了解醛、酮在结构上的区别及醛
基的检验
醛
1.醛的定义与通式
(1)定义:由 与 相连而构成的化合物,其官能团的结构简式为 ,简写为 。
(2)通式:饱和一元醛的通式为 。
烃基(或氢原子)
醛基
—CHO
CnH2nO
乙醛
(1)结构:分子式为 ,结构式为 ,简写为_________,乙醛的核磁共振氢谱有 组峰,峰面积比为 。
2
(2)物理性质
乙醛是无色、具有 的液体,密度比水的 ,沸点20.8 ℃,易挥发,易燃烧,能与水、乙醇等 。
C2H4O
CH3CHO
3:1
刺激性气味
小
互溶
(3)化学性质
加成反应:
①催化加氢又称为还原反应
化学方程式为 。
②与HCN加成
化学方程式为 。
氧化反应:
①银镜反应【实验3-7】
实验操作
实验现象 A中现象: 。
D中现象:试管内壁出现一层 。
化学方程式 A中:AgNO3 + NH3·H2O = AgOH↓(白色) + NH4NO3;
AgOH + 2NH3·H2O = [Ag(NH3)2]OH + 2H2O。
C中: 。
应用 。
先产生白色沉淀后变澄清
光亮的银镜
检验醛基
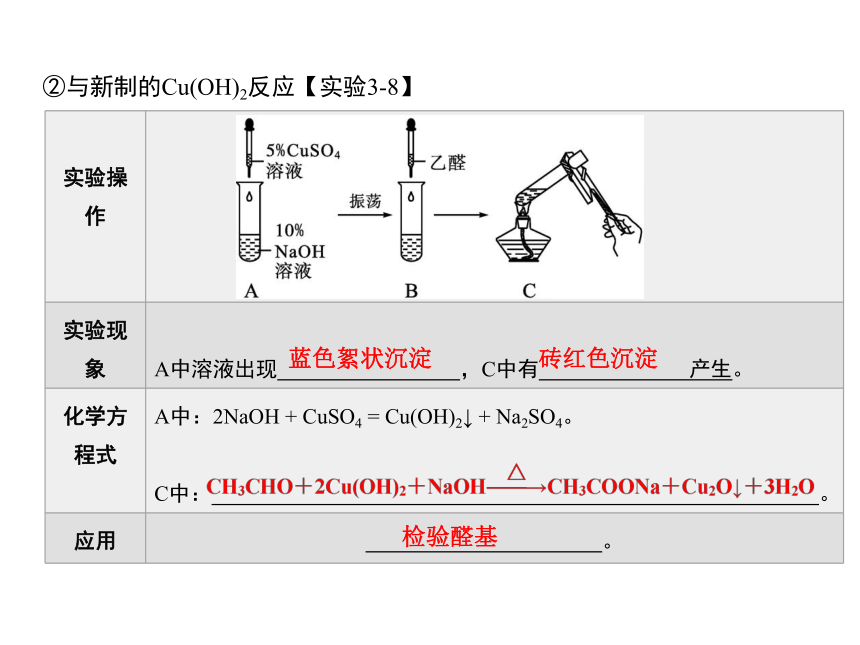
②与新制的Cu(OH)2反应【实验3-8】
实验操作
实验现象
A中溶液出现 ,C中有 产生。
化学方程式 A中:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4。
C中: 。
应用 。
蓝色絮状沉淀
砖红色沉淀
检验醛基
已知银氨溶液和新制的氢氧化铜属于弱氧化剂,思考乙醛能不能使酸性高锰酸钾溶液褪色
酸性高锰酸钾溶液属于强氧化剂,故乙醛能使酸性高锰酸钾溶液褪色。
③催化氧化
乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸,反应的化学方程式为2CH3CHO+O2 2CH3COOH。
④燃烧反应
化学方程式为2CH3CHO+5O2 4CO2+4H2O。
常见的醛
名称 甲醛 苯甲醛
结构简式 HCHO
俗称 蚁醛 苦杏仁油
物理性质 颜色 无色 无色
气味 强烈刺激性气味 苦杏仁气味
状态 气体 液体
溶解性 易溶于水 —
用途 合成多种有机化合物;福尔马林(甲醛水溶液)可用于消毒和制作生物标本 制造染料、香料及药物的重要原料
化学性质 与乙醛相似,可以被还原为醇,氧化为酸,可以发生银镜反应,能与氰化氢加成
肉桂醛
苯甲醛
酮
1.酮的定义和结构特点
2.丙酮
饱和一元醛的通式为CnH2nO(n≥1),饱和一元酮的通式为CnH2nO(n≥3),那么分子中含相同碳原子数的饱和一元醛与饱和一元酮有什么关系
分子中含相同碳原子数的饱和一元醛与饱和一元酮的分子式相同,结构不同,互为同分异构体。
酮是重要的有机溶剂和化工原料。例如,丙酮可用作化学纤维、钢瓶储存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
总结
1.醛类的两个特征反应及—CHO的检验
特征反应 银镜反应 与新制的Cu(OH)2
反应
现象 产生光亮的银镜 产生砖红色沉淀
注意 事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2要随用随配,不可久置。
(2)配制新制的Cu(OH)2时,所用NaOH溶液必须过量
总结
2.含醛基物质中碳碳双键的检验方法
官能团 醛基 碳碳双键
加入酸性KMnO4溶液 褪色 褪色
加入溴水 褪色 褪色
加入银氨溶液 产生银镜 不反应
加入新制的Cu(OH)2 产生砖红色沉淀 不反应
感谢观看
Thank you for watching
第三章 烃的衍生物
第三节 醛 酮
学习目标
1. 能够通过对乙醛的学习,明确醛
基的组成、结构和性质
2. 了解醛、酮在结构上的区别及醛
基的检验
醛
1.醛的定义与通式
(1)定义:由 与 相连而构成的化合物,其官能团的结构简式为 ,简写为 。
(2)通式:饱和一元醛的通式为 。
烃基(或氢原子)
醛基
—CHO
CnH2nO
乙醛
(1)结构:分子式为 ,结构式为 ,简写为_________,乙醛的核磁共振氢谱有 组峰,峰面积比为 。
2
(2)物理性质
乙醛是无色、具有 的液体,密度比水的 ,沸点20.8 ℃,易挥发,易燃烧,能与水、乙醇等 。
C2H4O
CH3CHO
3:1
刺激性气味
小
互溶
(3)化学性质
加成反应:
①催化加氢又称为还原反应
化学方程式为 。
②与HCN加成
化学方程式为 。
氧化反应:
①银镜反应【实验3-7】
实验操作
实验现象 A中现象: 。
D中现象:试管内壁出现一层 。
化学方程式 A中:AgNO3 + NH3·H2O = AgOH↓(白色) + NH4NO3;
AgOH + 2NH3·H2O = [Ag(NH3)2]OH + 2H2O。
C中: 。
应用 。
先产生白色沉淀后变澄清
光亮的银镜
检验醛基
②与新制的Cu(OH)2反应【实验3-8】
实验操作
实验现象
A中溶液出现 ,C中有 产生。
化学方程式 A中:2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4。
C中: 。
应用 。
蓝色絮状沉淀
砖红色沉淀
检验醛基
已知银氨溶液和新制的氢氧化铜属于弱氧化剂,思考乙醛能不能使酸性高锰酸钾溶液褪色
酸性高锰酸钾溶液属于强氧化剂,故乙醛能使酸性高锰酸钾溶液褪色。
③催化氧化
乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸,反应的化学方程式为2CH3CHO+O2 2CH3COOH。
④燃烧反应
化学方程式为2CH3CHO+5O2 4CO2+4H2O。
常见的醛
名称 甲醛 苯甲醛
结构简式 HCHO
俗称 蚁醛 苦杏仁油
物理性质 颜色 无色 无色
气味 强烈刺激性气味 苦杏仁气味
状态 气体 液体
溶解性 易溶于水 —
用途 合成多种有机化合物;福尔马林(甲醛水溶液)可用于消毒和制作生物标本 制造染料、香料及药物的重要原料
化学性质 与乙醛相似,可以被还原为醇,氧化为酸,可以发生银镜反应,能与氰化氢加成
肉桂醛
苯甲醛
酮
1.酮的定义和结构特点
2.丙酮
饱和一元醛的通式为CnH2nO(n≥1),饱和一元酮的通式为CnH2nO(n≥3),那么分子中含相同碳原子数的饱和一元醛与饱和一元酮有什么关系
分子中含相同碳原子数的饱和一元醛与饱和一元酮的分子式相同,结构不同,互为同分异构体。
酮是重要的有机溶剂和化工原料。例如,丙酮可用作化学纤维、钢瓶储存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
总结
1.醛类的两个特征反应及—CHO的检验
特征反应 银镜反应 与新制的Cu(OH)2
反应
现象 产生光亮的银镜 产生砖红色沉淀
注意 事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2要随用随配,不可久置。
(2)配制新制的Cu(OH)2时,所用NaOH溶液必须过量
总结
2.含醛基物质中碳碳双键的检验方法
官能团 醛基 碳碳双键
加入酸性KMnO4溶液 褪色 褪色
加入溴水 褪色 褪色
加入银氨溶液 产生银镜 不反应
加入新制的Cu(OH)2 产生砖红色沉淀 不反应
感谢观看
Thank you for watching
